地衣芽孢杆菌B38 对产气荚膜梭菌的抑菌性能研究
■ 杨梦瀚 苗华彪,2 宋婧楠 赵香帅 陈紫娴 吴 倩,2 黄遵锡,2*
(1.云南师范大学生命科学学院,云南昆明 650500;2.生物能源持续开发利用教育部工程研究中心,云南昆明 650500)
产气荚膜梭菌(Clostridium perfringers,CP)是一种革兰氏阳性厌氧菌,在自然界中广泛存在,包括土壤、水源、粪便以及健康的人和动物的胃肠道,但同时也是人和动物肠道中的主要致病菌之一[1]。已知CP可以产生约20种毒素,根据其产生的4种主要毒素α毒素(CPA)、β毒素(CPB)、ε毒素(ETX)和T 毒素(ITX)可以将CP 分为A~E 五种类型[2]。当宿主自身抵抗力下降或是外界环境条件恶劣,都会使CP大量增殖,产生大量毒素,对宿主造成严重危害,甚至死亡[3-4]。CP也是目前已知繁殖速度最快的微生物之一,在液体硫乙醇酸盐(FTG)培养基中43 ℃条件下培养,增殖一代仅需8~12 min[5],这种快速增殖的特性导致畜禽从感染到死亡的过程非常迅速且难以发现。近几年来,由CP 导致的疾病严重危害着全球畜禽业的发展,造成了严重的经济损失[6]。随着欧盟以及我国禁止在饲料中添加抗生素,CP 导致的畜禽疾病已呈上升趋势,因此寻找抗生素替代品,预防CP 导致的危害,已迫在眉睫。
益生菌是动物肠道中的有益菌,可以通过帮助动物肠道进行消化、增强免疫系统功能以及促进肠道菌群的平衡来维持肠道的健康[7]。同时,益生菌的特点是安全、无污染、不会产生抗药性,已成为抗生素的理想替代品。地衣芽孢杆菌(Bacillus licheniformis,BL)作为一种通过GRAS(Generally Recognized as Safe)认证的细菌,因其安全性和优良的耐受性受到广泛关注,且已有多种试验研究表明,在饲料和饮水中添加BL 可以显著提高肉鸡的生长性能,并能够降低肉鸡感染CP 导致的死亡率[8-10]。BL 可以产生多种抗菌物质[11-14],对多种食源性以及腐败细菌有抑菌活性。虽然CP 的体外抑制作用研究已有不少,但是有关BL代谢产物对CP 体外抑制的研究却较少。生物能源持续开发利用教育部工程研究中心通过对48 株芽孢杆菌的筛选,得到了一株对CP 具有优良抗菌性质的芽孢杆菌,该芽孢杆菌为地衣芽孢杆菌,其代谢产物具有优良耐受性质,为新型替抗产品的开发研究提供了基础。
1 材料和方法
1.1 试验材料和仪器
1.1.1 菌株
CP:分离自胀气死亡的怀孕母猪胃部。
益生菌:48 株芽孢杆菌,编号B1~B48,均为本实验室前期保存,不同芽孢杆菌的种类如下所示:
枯草芽孢杆菌B1、B2、B3、B5、B6、B7、B8、B9、B10、B11、B12、B14、B15、B16、B17、B19、B20、B21、B22、B23、B24、B26、B28、B29、B30、B31、B32、B33、B34、B35。
地衣芽孢杆菌B25、B27、B36、B37、B38、B39、B40、B41、B42、B43。
纳豆芽孢杆菌B44、B45、B46、B47、B48。
解淀粉芽孢杆菌B4、B13、B18。
指示菌:见表1所示。

表1 不同指示菌的来源及其培养条件
1.1.2 培养基
LB 液体培养基:胰蛋白胨10 g,酵母膏5 g,氯化钠10 g,双蒸水1 000 mL,121 ℃高压灭菌30 min。
TG 液体培养基:胰酪蛋白胨15 g,酵母浸粉5 g,L-胱氨酸0.5 g,巯基乙酸钠0.5 g,氯化钠2.5 g,葡萄糖5.5 g,双蒸水1 000 mL,121 ℃高压灭菌15 min。
强化梭菌增殖(RCM)固体培养基:蛋白胨10 g,牛肉粉1 g,酵母粉3 g,葡萄糖5 g,可溶性淀粉1 g,氯化钠5 g,乙酸钠3 g,L-半胱氨酸盐酸盐0.5 g,琼脂15 g,121 ℃高压灭菌20 min。
MRS固体培养基:蛋白胨10 g,牛肉浸粉5 g,酵母浸粉4 g,葡萄糖20 g,乙酸钠5 g,磷酸氢二钾2 g,柠檬酸三铵2 g,硫酸镁0.2 g,硫酸锰0.05 g,吐温-80 1 mL,琼脂15 g,双蒸水1 000 mL,121 ℃高压灭菌15 min。
1.1.3 试验试剂
胃蛋白酶、胰蛋白酶、蛋白酶K、过氧化氢酶购自上海源叶生物科技有限公司;硫酸铵:(纯度≥99%)购自广东光华科技股份有限公司。
1.1.4 仪器设备
分析天平和pH 仪(美国梅特勒托利多);高速冷冻离心机(德国艾本德);厌氧工作站DG250(英国Don Whitley Scientific);菌落分析系统ProtoCol 3(英国Synbiosis);冷冻干燥机(丹麦Labogene);水浴锅(德国哈克);恒温培养箱(上海一恒科学仪器有限公司);超净工作台(苏州安泰空气技术有限公司);高压蒸汽灭菌锅(天正集团有限公司)。
1.2 方法
1.2.1 B38的筛选过程
参考贾丽艳[15]的筛选流程,并根据实际操作环境优化。
初次筛选采用单层牛津杯法,以CP 为指示菌,测定48 株芽孢杆菌发酵上清液对其抑菌活性。将甘油保种的48 株芽孢杆菌以0.1%接种量接种至5 mL LB试管中,37 ℃、180 r/min 培养24 h,而后13 000 r/min离心5 min,收集上清液,放于-20 ℃备用。将甘油保种的CP 以1%接种量接种至5 mL TG 试管中,置于厌氧培养箱静置培养12 h。而后13 000 r/min 收集菌体,用无菌生理盐水将OD600调整为0.6,取200 μL 涂布于RCM 培养基,将牛津杯垂直放置于培养基表面,在杯中加入100 μL 离心后的发酵上清液,置于厌氧培养箱中(厌氧条件为80% N2+10% H2+10% CO2),37 ℃培养12 h,并用菌落分析系统ProtoCol 3 测量抑菌圈直径(下文测量抑菌圈直径均采用该仪器),用抑菌圈直径表示抑菌活性。
复筛采用打孔法,以CP 为指示菌,对初次筛选抑菌圈直径大于15 mm 的芽孢杆菌进行第二次筛选。预先将无菌牛津杯放置于无菌培养皿中,孔径为7.8 mm,而后将灭菌后的RCM 培养基倒入培养皿中,每皿约25 mL,冷却后保存在4 ℃备用。将培养12 h的CP 离心收集沉淀,调整菌液浓度为0.5 麦氏比浊度(约1.5×108CFU/mL),取200 μL 涂布于预先准备好的平板中,而后加入100 μL 芽孢杆菌上清液,每个芽孢杆菌的抑菌试验均重复3 次,每次试验3 个孔,37 ℃培养12 h,测量抑菌圈直径大小。
1.2.2 抑菌性能最佳菌株最小抑菌效价的测定
为测试上述筛选试验中抑菌效果最好的菌株的最小抑菌效价,采用二倍稀释法,用无菌纯化水将B38发酵上清液进行2倍稀释,以未稀释原液为对照,分别进行抑菌试验。B38 发酵上清液的最小抑菌效价参考细菌素的活性单位(AU),定义为出现明显抑菌圈的最高稀释倍数的倒数,单位用AU/mL表示。
1.2.3 B38抑菌物质生成曲线
将过夜培养的B38 以1%接种量接种至200 mL LB 液体培养基,每隔2 h 取样一次,13 000 r/min 离心5 min 收集上清液,取100 μL 上清液,以CP 为指示菌进行抑菌试验,置于厌氧培养箱中37 ℃培养12 h,测量其抑菌圈直径,以抑菌圈的直径大小表示抑菌物质生成的量。
1.2.4 B38对不同指示菌的抑菌情况
指示菌的种类及培养条件见表1。指示菌培养结束后离心收集菌体,用无菌生理盐水重新悬浮菌体,稀释至0.5 麦氏比浊度,采用打孔法测定B38 对不同指示菌的抑菌活性。
1.2.5 B38代谢产物的蛋白酶和过氧化氢酶耐受情况
在1 mL 发酵上清液中加入预先配制好的胃蛋白酶、胰蛋白酶、蛋白酶K 和过氧化氢酶溶液,使其终浓度都为5 mg/mL,其中胃蛋白酶组上清液预先使用5 mol/L 的HCl 调pH 至2,其余试验组pH 均不作处理(pH=8.5),以未加酶组为对照,置于37 ℃水浴3 h,探究蛋白酶和过氧化氢酶对B38代谢产物的影响。
1.2.6 B38代谢产物的温度耐受情况
吸取B38 发酵上清液1 mL 于EP 管中,分别在40、50、60、70、80、90、100 ℃耐受30 min,121 ℃高压耐受30 min,以37 ℃耐受30 min 为对照,而后冷却至室温。处理后,分别吸取100 μL 进行抑菌试验,探究温度对B38代谢产物的影响。
1.2.7 B38代谢产物的pH耐受情况
用5 mol/L 的HCl 和5 mol/L 的NaOH 将其上清液pH 分别调至2~12,置于37 ℃水浴处理3 h,而后冷却至室温,将pH 调节至原液(pH=8.5),以未作处理耐受3 h为对照,探究pH对B38代谢产物的影响。
1.2.8 B38代谢产物中抑菌物质的粗提取
采用硫酸铵分级沉淀的方法提取上清液中的抑菌物质[16]。将预先准备好的发酵上清液按每份100 mL的量添加至烧杯中,将称量好的硫酸铵缓慢加入烧杯,使其终浓度分别为30%、40%、50%、60%、70%、80%,并用玻璃棒不断搅拌,使其充分溶解,整个过程保持在4 ℃。然后将烧杯转移至4 ℃,静置24 h,待沉淀以后,4 ℃、6 000 r/min 离心30 min,将沉淀用1 mL无菌双蒸水溶解,同时取离心后的上清液,分别进行抑菌试验,确定最佳的沉淀浓度。
1.2.9 最小抑菌浓度的测定
按照1.2.7 中的方法,采用最佳沉淀浓度获得抗菌粗提取物,而后进行冷冻干燥,待干燥后,将样品放于-20 ℃保存。采用二倍稀释法,配制200、100、50、25、12.5、6.25、3.125 mg/mL的抗菌粗品溶液,取100 μL,以CP 为指示菌进行抑菌试验,观察抑菌效果,确定样品的最小抑菌浓度。
1.2.10 软件及统计学分析
抑菌圈直径的测量使用的软件是ProtoCOL 3,数据库版本为1.0.59;数据分析使用的软件是GraphPad Prism,版本为8.0.2。
2 结果与分析
2.1 B38的筛选过程
2.1.1 对CP具有抑制作用的芽孢杆菌的初次筛选
采用单层牛津杯法,对48 株芽孢杆菌发酵上清液进行筛选,共得到了22 株对CP 具有抑制效果的芽孢杆菌,这些菌株对CP 的抑制效果见图1。由图1 可知,不同芽孢杆菌之间抑菌效果存在较大差异,因此在复筛试验中,以抑菌圈直径>15 mm 为敏感区划分,选取13株抑菌圈直径>15 mm的芽孢杆菌进行试验。

图1 对CP具有较强抑菌活性的芽孢杆菌菌株
2.1.2 对CP具有抑制作用的芽孢杆菌的复筛
对于2.1.1 中选取的13 株芽孢杆菌,采用打孔法对CP 进行抑制,最终得到了一株对CP 具有很强抑制作用的芽孢杆菌B38,和其他菌株相比具有显著差异。复筛结果见图2,B38 对CP 的抑菌圈直径为(31.14±0.90)mm,该芽孢杆菌为地衣芽孢杆菌。

图2 对CP有较强活性的芽孢杆菌菌株的复筛
由表2 可知,不同稀释倍数的发酵上清液之间存在显著差异,B38 发酵上清液具有抑菌效果的最大稀释倍数是64 倍,此稀释倍数下B38 发酵上清液对CP的抑菌圈直径为(10.51±0.97)mm,故B38 对CP 的最小抑菌效价为64 AU/mL。

表2 B38发酵上清液不同稀释倍数的抑菌效果(mm)
2.2 B38发酵上清液的最小抑菌效价
由表2 可知,B38 发酵上清液具有抑菌效果的最大稀释倍数是64 倍,此稀释倍数下,B38 发酵上清液对CP 的抑菌圈直径为(10.51±0.97)mm,故B38 对CP的最小抑菌效价为68 AU/mL。
2.3 B38抑菌物质生成曲线
由图3 可知,0~<6 h,B38 发酵上清液对CP 无抑制效果,无抑菌物质生成;6~<12 h,发酵上清液的抑菌活性呈指数增长,此时发酵上清液中的抑菌物质增长速率最大;12~<24 h,虽然抑菌活性逐步增加,但是增加不明显;在当发酵时间达到24 h 时,抑菌圈的直径已经不再继续增大,随着时间的增长有略微下降的趋势,与12 h 相比具有显著差异,表明在24 h 时,B38 的发酵上清液抑菌活性最大,后续试验中对该菌的培养时间均为24 h。
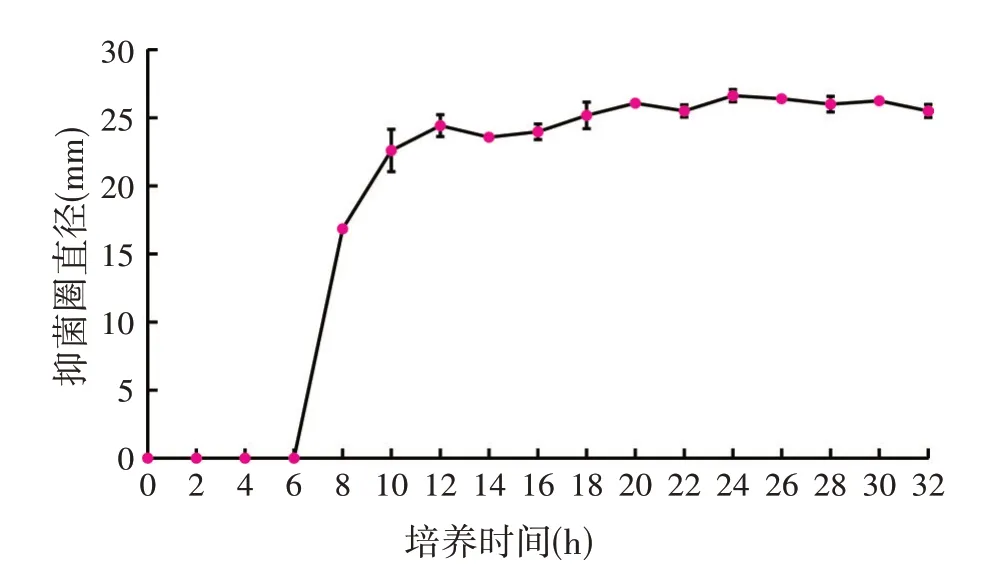
图3 B38发酵上清液抑菌物质的生成和时间的关系
2.4 B38对不同指示菌的抑制效果。
由表3可知,B38对其中8株革兰氏阳性菌均有抑菌效果,但是对4株革兰氏阴性菌均无抑菌效果。B38对革兰氏阳性菌的抑菌情况较好,尤其是对两株CP、金黄色葡萄球菌和厌氧消化链球菌,其抑菌圈直径均达到25 mm以上。对粪肠球菌、屎肠球菌、藤黄微球菌等抑菌效果稍弱。而对革兰氏阴性菌(如大肠杆菌、大肠杆菌K88和K99、铜绿假单胞菌)均无抑制效果。

表3 B38对不同指示菌的抑菌效果
2.5 B38代谢产物的蛋白酶和过氧化氢酶耐受情况
由图4 可知,经酸化的胃蛋白酶处理后,抑菌活性保持在93.79%;经胰蛋白酶处理后,抑菌活性保持在90.11%;经蛋白酶K 处理后,抑菌活性基本保持不变,表明B38 代谢产物具有优良的抗蛋白酶能力,尤其是对蛋白酶K,同时也证明了该抑菌物质作为饲料添加剂时,经过动物的胃和肠道,不会被胃蛋白酶和胰蛋白酶分解,使其能够在胃和肠道中发挥功能。而经过氧化氢酶处理后,抑菌活性保持在87.78%,表明B38代谢产物中的主要抑菌物质并非过氧化氢。

图4 B38发酵上清液中的抑菌物质对蛋白酶和过氧化氢酶的耐受情况
2.6 B38代谢产物的温度耐受情况
由图5 可知,B38 发酵上清液在37~100 ℃下耐受30 min,其抑菌活性基本保持稳定,在121 ℃高压处理30 min,其抑菌活性仍保持81.91%,表明B38 的代谢产物对温度具有非常强的耐受能力,可以满足饲料生产中高温制粒的要求。
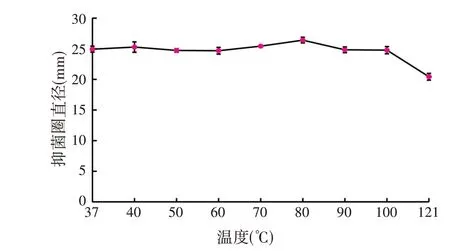
图5 B38发酵上清液中抑菌物质的温度耐受情况
2.7 B38代谢产物的pH耐受情况
由图6 可知,该菌发酵上清液在pH 7~9 之间,和对照组(pH=8.5)相比,活性基本保持不变,随着pH 的降低,抑菌活性也在降低,但是降低的趋势不明显,当pH=2 时,剩余抑菌活性为83.17%;但是当pH 上升到10 时,抑菌活性有明显下降,当pH 为12 时,剩余抑菌活性为71.29%,表明B38的代谢产物对酸性有较强的耐受能力,但是对碱性的耐受较弱。综上可知,B38发酵上清液中的抑菌物质在pH 为7~9 时抑菌活性最大,在pH=2 时,抑菌活性虽然有所损失,但是仍能保持83.17%的抑菌效果。

图6 B38发酵上清液中抑菌物质的pH耐受情况
2.8 B38代谢产物中抑菌物质的粗提取
由图7 可知,当硫酸铵浓度为30%时上清液的抑菌活性最大,随着硫酸铵浓度的升高,上清液的抑菌活性不断降低,当硫酸铵浓度达到80%时上清液完全失去抑菌活性;同时,当硫酸铵浓度为30%时沉淀无抑菌活性,随着硫酸铵浓度升高,沉淀的抑菌活性越来越大,当硫酸铵浓度为80%时抑菌活性最大,表明上清液中的抑菌物质可以被80%的硫酸铵完全沉淀。

图7 硫酸铵沉淀提取B38发酵产生物质抑菌活性
2.9 最小抑菌浓度的测定
通过80%硫酸铵沉淀得到抗菌粗品,并测定其MIC,结果见表4,质量浓度为200 mg/mL的抗菌粗品抑菌圈直径为(24.81±0.75)mm,当质量浓度为3.125 mg/mL时,无抑菌圈产生,表明其MIC值为6.25 mg/mL。

表4 硫酸铵沉淀提取的抗菌粗品的最小抑菌浓度(MIC)
3 讨论
3.1 CP的体外抑制研究
由CP 导致的鸡坏死性肠炎(NE)、断奶仔猪腹泻、育肥猪和母猪胀气死亡问题一直是困扰全世界养殖业的难题之一。虽然在饲料中添加抗生素可以改善该问题,但是在饲料中过度使用抗生素会导致CP产生耐药性以及抗生素残留等问题,因此许多国家已禁止在饲料中添加抗生素[17]。益生菌能够改善宿主肠道微生物菌群平衡,对宿主产生有益影响,已有多种研究表明益生菌可以在体外对CP 有抑菌效果。李洁萍等[18]在CP的压力下对5株乳酸杆菌进行筛选,得到了两株乳酸杆菌S1 和H2,其发酵菌液对CP 体外抑制效果达16.12 mm 和18.15 mm,但是其发酵代谢产物的碱耐受能力均较差。王宏浩等[19]对7 株益生菌进行筛选,得到了3 株对CP 有抑制作用的菌株,分别为凝结芽孢杆菌、枯草芽孢杆菌、丁酸梭菌,对这3 株菌的进一步研究表明,62.5 mg/g 的酸化凝结芽孢杆菌和枯草芽孢杆菌发酵液、31.25 mg/g 的酸化丁酸梭菌发酵液均可完全抑制CP 的生长。Barbosa 等[20]在肉鸡肠道中分离出多种芽孢杆菌,其抑菌试验表明,地衣芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌等对CP 具有抑菌效果,但是抑菌效果存在差异,枯草芽孢杆菌的抑菌效果要优于BL 和短小芽孢杆菌。全爽等[21]对一株土壤源BL 的研究发现,该菌发酵上清液对CP 表现一定的抑菌作用;并且和金黄色葡萄球菌的混合培养表明,该菌可以完全抑制金黄色葡萄球菌的生长。
3.2 BL 作为饲料添加剂的研究进展
BL 是一种兼性厌氧菌,因其能够形成耐热和耐酸的芽孢,已广泛作为各种动物饲料的益生菌添加剂[7]。Alexopoulos 等[22]的研究表明,在每吨日粮添加400 g BioPlus 2B(含有枯草芽孢杆菌和BL活性孢子),可有效降低断奶仔猪的发病率和病死率,且能提高育肥猪的生长性能,与对照组相比,猪的体重、饲料转化率和胴体质量显著提高。Knap 等[23]的研究表明,和15 g/t的维吉尼亚霉素相比,在日粮中添加1.6×107~8×107CFU/g的BL孢子在饲料转化率提升和体重增加上没有显著差异,但能显著降低肉鸡感染CP导致的病死率。Musa等[24]研究表明,与5 mg/kg的恩拉霉素相比,含有2×109CFU/g枯草芽孢杆菌B21或2×109CFU/g的地衣芽孢杆菌B26 的日粮能够降低由CP 导致的肉鸡死亡,且能改善鸡的肠道健康和生长性能。除了BL的孢子体外,Hung等[25]证明了4.5 g/kg的BL发酵产品可降低断奶仔猪的腹泻发生率并调节粪便微生物群落。
3.3 BL的抗菌物质研究进展
BL能够产生多种抗菌物质,研究最多的是地衣素(lichenysin)和表面蛋白(surfactin)。大多数BL都能产生地衣素[26]。地衣素是BL的次级代谢产物,在有氧和无氧的条件下均能够产生。地衣素具有两亲性质,可以与生物膜上磷脂的极性基团和疏水基团相互作用,增加其流动性,诱导生物膜成孔[27]。这种性质使地衣素具有较强的抗菌、抗生物膜性质。但是最近的一项研究表明地衣素可能会对细胞产生毒害作用,16.6 μg/mL的地衣素浓度可使Caco-2细胞活性降低一半,16.8 μg/mL可使猪回肠细胞活性降低一半[28]。表面蛋白和地衣素在结构上高度类似,二者的唯一区别是表面蛋白肽环的1号位是L-Glu,而地衣素的是L-Gln[29]。表面蛋白能够抑制多种革兰氏阳性菌如单增李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌等,但是对革兰氏阴性菌很少起作用[30]。除此之外,Horng等[31]的研究首次证明,表面蛋白还能够抑制猪痢疾短螺旋体和CP,枯草芽孢杆菌产生的表面蛋白对猪痢疾短螺旋体的抑制效果要好于BL,而BL产生的表面蛋白对CP的抑制效果要好于BL。该研究表明,BL中对CP有抑制效果的物质可能是表面蛋白介导的,但是该物质是如何对CP进行抑制的仍需探究。至于本研究中得到的B38,其代谢产物中究竟是哪种抗菌物质在起作用,还需后续研究。
4 结论
本研究获得了一株对CP 具有良好抑菌活性的菌株B38,对多种革兰氏阳性菌(如CP、金黄色葡萄球菌、厌氧消化链球菌、屎肠球菌、粪肠球菌、藤黄微球菌等)表现出很强的抑菌活性。B38 发酵上清液的最小抑菌效价为64 AU/mL,对胃蛋白酶、胰蛋白酶、蛋白酶K 不敏感,具有良好的耐pH 和耐热性,可以被80%的硫酸铵完全沉淀,沉淀得到的抗菌粗品MIC 为6.25 mg/mL。B38 代谢产物具有优良的耐受性,可以运用于工业生产,为新型替抗产品的开发提供基础。

