二化螟味觉受体基因鉴定、克隆与表达模式分析
黄玉萱,沈忱,鞠佳菲,杨磊,罗光华,方继朝
二化螟味觉受体基因鉴定、克隆与表达模式分析
黄玉萱1,2,沈忱1,2,鞠佳菲2,杨磊1,2,罗光华1,2,方继朝1,2
1南京农业大学植物保护学院,南京 210095;2江苏省农业科学院植物保护研究所/江苏省食品质量安全重点实验室(省部共建国家重点实验室培育基地),南京 210014
【背景】二化螟()是我国水稻上的重要害虫之一,味觉受体(gustatory receptor,GR)基因在昆虫取食、产卵等过程中发挥重要作用。【目的】基于组学数据鉴定并克隆二化螟GR基因序列,明确其在不同发育阶段和成虫不同组织中的表达特性,为后续深入研究二化螟GR基因的功能打下基础。【方法】结合二化螟转录组数据和其他昆虫的GR基因序列,通过多重序列比对,鉴定二化螟GR基因。利用RT-PCR方法克隆获得二化螟GR基因的完整开放阅读框(open reading frame,ORF)序列,运用生物信息学分析工具对二化螟GR基因编码的氨基酸序列进行分子生物学特征、结构域等分析;基于最大似然法构建二化螟GR基因蛋白序列与其他昆虫GR基因的系统进化树;利用实时荧光定量PCR(RT-qPCR)方法分析GR基因在二化螟不同发育阶段(1—6龄幼虫和雌、雄成虫)和成虫不同组织(雌、雄成虫的触角、头、翅、腹、足)中的表达模式。【结果】鉴定并克隆得到5个二化螟GR基因,分别命名为—,ORF长度为1 122—1 428 bp,编码氨基酸序列长度为373—475 aa,其中、、具有7个跨膜结构域,、具有8个跨膜结构域。系统进化分析显示,、与黑腹果蝇及小菜蛾、亲缘关系较近,属于CO2受体家族;与黑腹果蝇及家蚕、亲缘关系较近,属于果糖/肌醇受体家族;、与黑腹果蝇及家蚕—亲缘关系较近,属于糖受体家族。发育期表达谱分析表明,二化螟5个GR基因在不同发育时期均有表达,其中、均在雄成虫中高表达,在1龄幼虫和雄成虫中表达量最高,在成虫中高表达,在4龄幼虫中表达量最高;组织表达谱分析表明,5个GR基因在雌、雄成虫的各组织均有表达,其中、在成虫头部表达量高,—在成虫触角部位高表达。【结论】鉴定克隆的5个二化螟GR基因均具有昆虫味觉受体基因的典型特征,且在成虫触角或头部高表达,推测这5个基因可能与二化螟识别和适应寄主植物有关。
二化螟;味觉受体;基因鉴定;序列分析;表达谱
0 引言
【研究意义】二化螟()可危害多种寄主植物,包括水稻、茭白、玉米等作物,是我国主要水稻害虫之一,以幼虫钻蛀组织取食危害,严重威胁我国的粮食安全[1]。水稻各生长时期均可见不同发育阶段的二化螟,初孵幼虫主要是在叶鞘内集中蛀食造成枯鞘,3龄以后钻进茎秆暴食,导致水稻出现枯心、白穗、虫伤株等症状[2]。目前对二化螟的防治主要依靠化学药剂,化学防治虽效果直接、见效快,但对农田生态环境构成一定危害,且导致二化螟抗药性持续增强[3-4]。二化螟危害寄主植物依赖于其化学感受系统,目前对于二化螟嗅觉感受系统在选择寄主和虫害诱导挥发物介导的“植物-植食性昆虫-天敌”三级营养关系研究已取得重要进展[5],但关于二化螟的味觉感受分子机制尚未有明确报道。对二化螟味觉系统在选择寄主植物过程中的感受机制和作用模式的阐释,可为二化螟田间防治提供潜在的分子靶标。【前人研究进展】昆虫在选择寄主植物的过程中一般通过化学感受系统发挥作用,昆虫的化学感受过程包括昆虫的嗅觉感受和味觉感受。寄主植物挥发物可以对二化螟产生引诱作用[6],虫害诱导水稻挥发物也能调控二化螟雌成虫的产卵行为[7],表明二化螟在对寄主植物选择和定位过程中嗅觉系统发挥重要作用。对寄主植物进行定位后,二化螟通过咀嚼寄主植物的组织从而吸收植物的可溶性成分和次级代谢物质,获得其生长发育所需要的营养物质,或是感受寄主植物部位组织确定产卵位置从而繁衍后代,在这个过程中,二化螟的味觉感受系统发挥了重要作用。昆虫的味觉感受系统负责识别甜味物质、苦味物质和氨基酸等非挥发性化合物而区分营养物质和躲避有害物质,在昆虫的取食、交配和产卵等生命活动中发挥着极为重要的作用[8]。昆虫味觉感受需要各级器官、神经元参与,直至诱导昆虫产生行为。昆虫味觉感受器中,位于味觉神经元树突上的味觉受体(gustatory receptor,GR)接收到化学刺激后将其转化为电信号,以脉冲的形式传递到中枢神经系统,从而调控昆虫的行为[9]。昆虫的味觉感受器主要分布于口器和触角,在前足、翅缘和雌虫产卵器等部位也有分布。鳞翅目昆虫幼虫的味觉器主要位于头部的口器中[10-11],以栓锥形感器为主。栓锥形感器包括4个味觉神经元和1个机械神经元,均参与感知味觉和其他相关反应[12]。昆虫味觉受体属于G蛋白偶联受体家族,结构上具有7个跨膜结构域[13],根据其配体选择性和序列聚类分析,GR基因被分为4类:糖受体、CO2受体、苦味受体和其他受体[14-15]。味觉受体首先在黑腹果蝇()中被鉴定[16],随着基因组和转录组测序技术以及生物信息学的快速发展,家蚕()[17]、黑脉金斑蝶()[18]、红带袖蝶()[19]、小菜蛾()[20]、斜纹夜蛾()[21]、黏虫()[22]、甜菜夜蛾()[23]等鳞翅目昆虫的味觉受体也得到鉴定。【本研究切入点】目前,对于二化螟的寄主植物适应机制研究主要集中于依赖于嗅觉感受系统的挥发物介导的互作上,而对于其味觉感受机制关注较少,阐释二化螟味觉系统在寄主植物适应机制中的作用可为其田间防治提供理论基础和分子靶标。【拟解决的关键问题】基于转录组和基因组数据,鉴定并克隆二化螟GR基因完整ORF序列,进而明确二化螟GR基因序列结构特征和时空表达谱,为后续二化螟味觉受体的功能研究提供依据。
1 材料与方法
试验于2021—2022年在江苏省农业科学院植物保护研究所完成。
1.1 供试昆虫与样品收集
二化螟为室内利用人工饲料[24]连续传代饲养多年的品系。养殖温度为(28±1)℃,相对湿度≥80%,光周期为16 h﹕8 h(L﹕D)。依次收集不同发育阶段的试虫样品,包括二化螟1龄幼虫80头、2龄幼虫60头、3龄幼虫40头、4龄幼虫20头、5龄幼虫5头、6龄幼虫5头、雄成虫5头、雌成虫5头,同时收集成虫不同组织样品,包括雌、雄成虫(各200头)的触角、头部、翅、前足、中后足、腹部。以上每份样品各收集3份,作为3次生物学重复。收集好的样品迅速置于含有500 μL Trizol的1.5 mL EP管中,用液氮冷冻后置于-80 ℃冰箱中保存。
1.2 二化螟GR候选基因的鉴定
以实验室前期二化螟转录组数据(GEO accession number:GSE179532)结合NCBI在线数据库基因组(GenBank assembly accession:GCA_004000445.1)建立二化螟本地数据库。以家蚕、红带袖蝶、小菜蛾和黑脉金斑蝶的GR序列为参考序列,运用TBtools软件在本地数据库中以tblastn和blastp方法搜索相似度最高的序列。将上述得到的序列整合,使用NCBI在线数据库(Non-Redundant Protein Database)人工注释校正,删除错误匹配或匹配度较低的序列。
1.3 二化螟总RNA提取、cDNA合成
使用Ambion Trizol Reagent(玉博生物科技有限公司,上海)提取二化螟各发育时期和成虫不同组织样品的总RNA,利用Trans2K DNA Marker(全式金生物技术有限公司,北京)和琼脂糖凝胶电泳检测RNA浓度和质量。分别使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit和PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(宝日医生物技术有限公司,北京)试剂盒按照说明书步骤合成cDNA,前者合成的1st strand cDNA用于基因克隆,后者用于实时荧光定量PCR分析。
1.4 引物设计
对鉴定得到的5个二化螟GR基因(—)进行克隆和定量检测分析,利用Primer Premier 5.0软件设计基因克隆引物和定量引物(表1)。在实时荧光定量PCR试验中,选择作为内参基因[25],上述引物均由生工生物工程(上海)股份有限公司合成。
1.5 基因克隆
按照表1设计的引物,利用RT-PCR技术扩增—的ORF全长序列,使用Premix TaqTM(TaKaRa TaqTMVersion 2.0 plus dye)(宝日医生物技术有限公司,北京)试剂按照说明书配置PCR反应体系(50 μL):Premix Taq(TaKaRa Taq Version 2.0 plus dye)25 μL,cDNA模板2 μL,正反向引物(20 μmol·L-1)各1 μL,灭菌水21 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55—60 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。利用琼脂糖凝胶电泳和Trans2K DNA Marker(全式金生物技术有限公司,北京)验证产物长度并使用OMEGA Gel Extraction Kit(索莱宝生物科技有限公司,上海)回收目的片段,用T3 Cloning Kit(全式金生物技术有限公司,北京)将回收产物连接至-T3克隆载体并转化到1-T1感受态细胞(全式金生物技术有限公司,北京)中,于含有100 mg·mL-1Amp的LB固体培养基中培养12—16 h,随机挑选出6个经蓝白斑筛选后的阳性克隆在含有100 mg·mL-1Amp的LB液体培养基中37 ℃过夜培养,经菌液PCR验证后,将阳性菌液送生工生物工程(上海)股份有限公司进行双向测序。
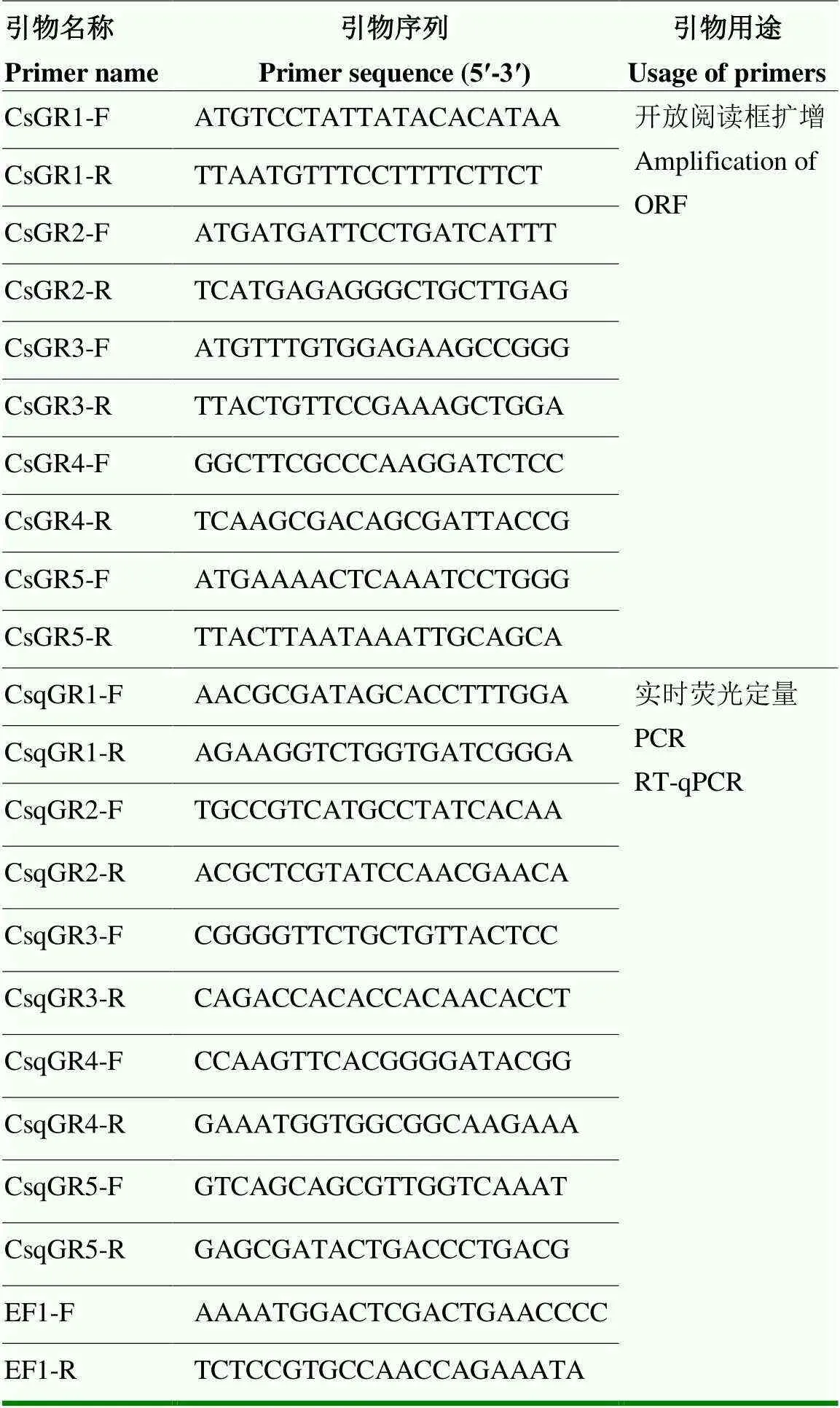
表1 引物序列
1.6 序列分析
测序结果利用DNAMAN软件进行序列比对。使用ExPASy(https://web.expasy.org/compute_pi/)和TMHMM 2.0在线软件预测二化螟GR基因的蛋白分子量、理论等电点和跨膜结构域(transmembrane domain,TMD)等蛋白信息。应用BLAST(https://blast. ncbi.nlm.nih.gov/Blast.cgi)和DNAMAN软件对二化螟GR基因进行序列比对。
根据家蚕、小菜蛾、果蝇已发表的味觉受体基因序列和克隆得到的二化螟味觉受体基因进行系统发育分析,MAFFT 7.221用于味觉受体基因蛋白序列的比对,Gblocks 0.91b提取味觉受体基因多序列比对结果的保守位点,ProtTest 3.4选择最优氨基酸替代模型(AIC分值),RAxML 8.1.24构建系统发育树,执行快速Bootstrap分析并搜索最佳得分的ML树,自举1 000次。建树模型为PROTCATJTTX。Fig Tree v 1.4.0和iTOL(https://itol.embl.de/)在线软件用于树的编辑和可视化。
1.7 实时荧光定量PCR
使用TB Green® Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒(宝日医生物技术有限公司,北京)进行实时荧光定量PCR反应,检测二化螟GR基因在不同发育时期和成虫不同组织中的表达情况,按照说明书步骤配置反应体系(20 μL):TB Green Premix Ex Taq II 10 μL,正反向引物(10 μmol·L-1)各0.8 μL,DNA模板2 μL,灭菌水6.4 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40个循环;60—95 ℃记录熔解曲线。每个试验样品设计3个技术重复,采用2-∆∆CT方法分析基因相对表达量。
1.8 数据分析
采用DPS数据处理软件对实时荧光定量PCR结果进行单因素方差分析(One-way ANOVA),选用Duncan新复极差法作多重比较,对二化螟GR基因表达量作差异显著性分析。
2 结果
2.1 二化螟GR候选基因的鉴定与序列分析
初步鉴定得到30个二化螟味觉受体候选基因,其中有5个味觉受体基因包含完整的7—8个跨膜结构域,经预测均具有完整的开放阅读框(ORF),符合昆虫味觉受体特征,命名为—,用于后续研究。利用RT-PCR技术克隆得到这5个GR基因的完整ORF序列(图1),ORF分别为1 428、1 302、1 317、1 122、1 269 bp,分别编码475、433、438、373、422个氨基酸(表2),预测蛋白分子量分别为54.05、49.64、48.91、41.29和48.92 kDa,等电点分别为8.75、7.51、9.28、7.09和9.31(表3)。利用TMHMM 2.0预测结构域发现,、和具有7个跨膜结构域,和具有8个跨膜结构域(表2、图2—图6),且蛋白的N端均位于细胞膜内,C端位于细胞膜外。
在NCBI数据库中,利用blastp对—的氨基酸序列搜索同源GR序列,发现5个GR基因与多种鳞翅目昆虫的GR序列具有高度相似性。与亚洲玉米螟()GR24-like(XP_028179334.1)、黄野螟()(UVB79173.1)的序列相似度分别高达80.62%、80.67%;与粉纹夜蛾()GR22-like(XP_026735279.1)、疆夜蛾()(QHB15304.1)的序列相似度分别高达86.95%、86.01%;与棉红铃虫()GR43a-like(XP_049878938.1)序列相似度为31.45%;与桃蛀螟()(ARO76475.1)序列相似性为69.53%,与黄野螟(UVB79175.1)序列相似度高达73.70%;与亚洲玉米螟GR64f-like(XP_028178841.1)序列相似度为66.91%(表2、图2—图6)。

图1 二化螟GR基因的PCR产物电泳分析

表2 二化螟GR跨膜结构域预测和BLAST最佳比对结果

表3 二化螟GR蛋白理化性质分析
吸收率以mol-1cm-1为单位,在水中测量(280 nm),假设所有的Cys残基形成胱氨酸
Absorptivity in units of mol-1cm-1at 280 nm measured in water, assuming all pairs of Cys residues form cystines

OfurGR24-like:亚洲玉米螟O. furnacalis (XP_028179334.1);HvitGR3:黄野螟H. vitessoides (UVB79173.1);McinGR24:庆网蛱蝶Melitaea cinxia (XP_045454518.1);ZcesGR24:菊黄花粉蝶Zerene cesonia (XP_038207281.1);PintGR24:印度谷螟Plodia interpunctella (XP_053615595.1);HkahGR24:海波斯莫科马属蛾Hyposmocoma kahamanoa (XP_026332325.1)
二化螟GR基因与黑腹果蝇、家蚕和小菜蛾GR基因氨基酸序列构建系统进化树,结果显示、分别与小菜蛾、聚为一支,且、、、、也包含在此进化分支内,属于CO2受体家族;与和、以及一些小菜蛾的味觉受体基因聚为一支,该分支属于果糖/肌醇受体家族;与属于糖受体家族,与其他昆虫的糖受体基因聚为一支(图7)。
2.2 二化螟GR基因的表达谱
实时荧光定量PCR结果显示,在二化螟不同发育时期,在雄成虫中相对表达量最高,其次是2龄幼虫阶段,其他发育阶段均处于较低表达水平;在1龄幼虫和雄成虫中相对表达量最高,2龄幼虫阶段其次,并且均显著高于其他发育阶段;在雌、雄成虫中表达量最高,其次是1龄幼虫阶段,其他发育阶段表达量均较低;在雄成虫中高表达,显著高于其他发育阶段;在4龄幼虫中相对表达量最高,在3龄幼虫中表达量最低(图8)。

OfurGR64f-like:亚洲玉米螟O. furnacalis (XP_028178841.1);SlitGR5a:斜纹夜蛾S. litura (XP_022818462.1);SfruGR5a:草地贪夜蛾S. frugiperda (XP_035430548.1);GmelGR 64f-like:大蜡螟Galleria mellonella (XP_052753721.1);CcroGR64f-like:红点豆粉蝶Colias croceus (XP_045503615.1);HzeaGR5a:棉铃虫H. zea (XP_047036862.1)
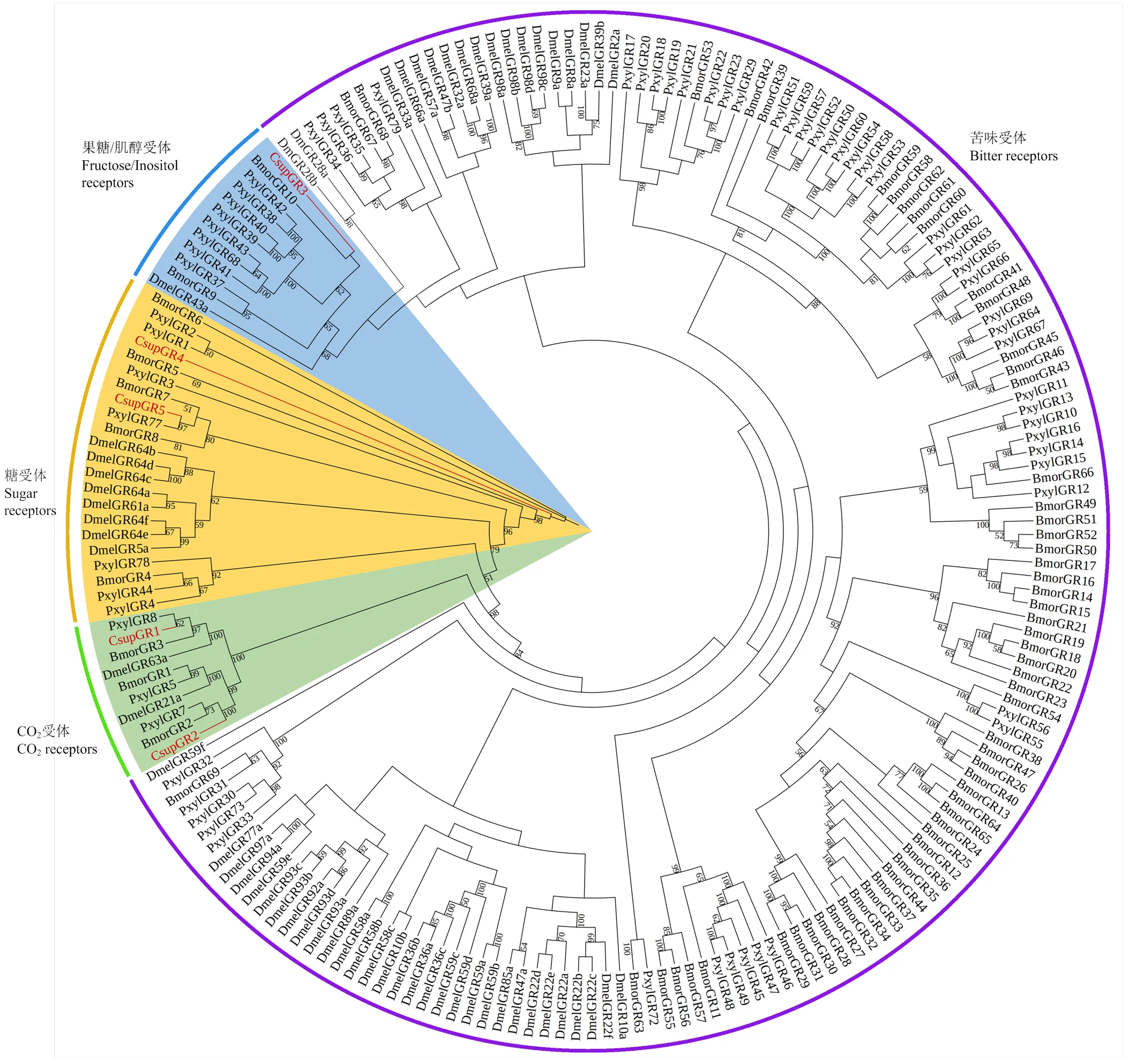
Csup:二化螟C. suppressalis;Dmel:黑腹果蝇D. melanogaster;Bmor:家蚕B. mori;Pxyl:小菜蛾P. xylostella。氨基酸序列和基因登录号来源于黑腹果蝇[16]、家蚕[17]、小菜蛾[26]GR基因的研究结果The amino acid sequence and gene accession number were derived from the research results of GR genes in D. melanogaster[16], B. mori[17]and P. xylostella[26]
在二化螟雌、雄成虫不同组织中,、、均在触角或头部高表达,其中在雌、雄成虫头部表达量显著高于触角部分,而、在雌、雄成虫触角中的表达量显著高于其他组织;在雌、雄成虫的触角中表达量最高,在前足和中后足的表达量也显著高于其他组织;在头部和前足中表达量较高且在雌成虫中表达量显著高于雄成虫,其他组织中的表达量均较低(图9)。

1st:1龄幼虫1st instar larvae;2nd:2龄幼虫2nd instar larvae;3rd:3龄幼虫3rd instar larvae;4th:4龄幼虫4th instar larvae;5th:5龄幼虫5th instar larvae;6th:6龄幼虫6th instar larvae;M:雄成虫Male adult;F:雌成虫Female adult
不同样品进行3次生物学重复,图中数据为平均值±标准误,柱上不同字母表示表达量差异显著(<0.05,one-way ANOVA)。图9同Different samples were subjected to three biological replicates, relative expression levels are indicated as mean±SEM, the different letters above each bar indicate significant differences (<0.05, one-way ANOVA). The same as below
图8 GR基因在二化螟不同发育时期的mRNA相对表达量
Fig. 8 Relative expression levels of GR mRNA at different developmental stages in
3 讨论
3.1 二化螟GR基因的鉴定与分析
目前味觉受体得到鉴定的昆虫中,在黑腹果蝇[13,16]、赤拟谷盗()[27]、家蚕[17]、斜纹夜蛾[21]中分别鉴定到68、341、69、30个味觉受体;在小菜蛾[26]转录组数据中鉴定得到67个味觉受体基因;在黑脉金斑蝶[18]、红带袖蝶[19]中分别鉴定到47、73个味觉受体基因;在黏虫[22]转录组中鉴定到16个味觉受体。根据前人的报道,一般认为昆虫的GR基因越多,其选择的寄主范围会越广。在西方蜜蜂()中只鉴定到10个GR基因,可能是因为长期取食花粉和花蜜导致蜜蜂味觉受体基因发生进化,花蜜中的主要成分为水和糖分,不包含危害昆虫的有毒物质,因此西方蜜蜂并不需要很多味觉受体来参与寄主的识别过程[28]。本研究鉴定并克隆得到5个二化螟味觉受体基因,相比于其他鳞翅目昆虫数量偏少,推测可能还存在其他的味觉受体基因。此外,相比于昆虫的其他受体基因,味觉受体基因的表达水平整体偏低,难以检测,这可能是没有鉴定得到更多味觉受体基因的原因。本研究利用RT-PCR成功克隆得到二化螟5个GR基因的完整ORF序列,这些味觉受体基因均包含7—8个跨膜结构域。
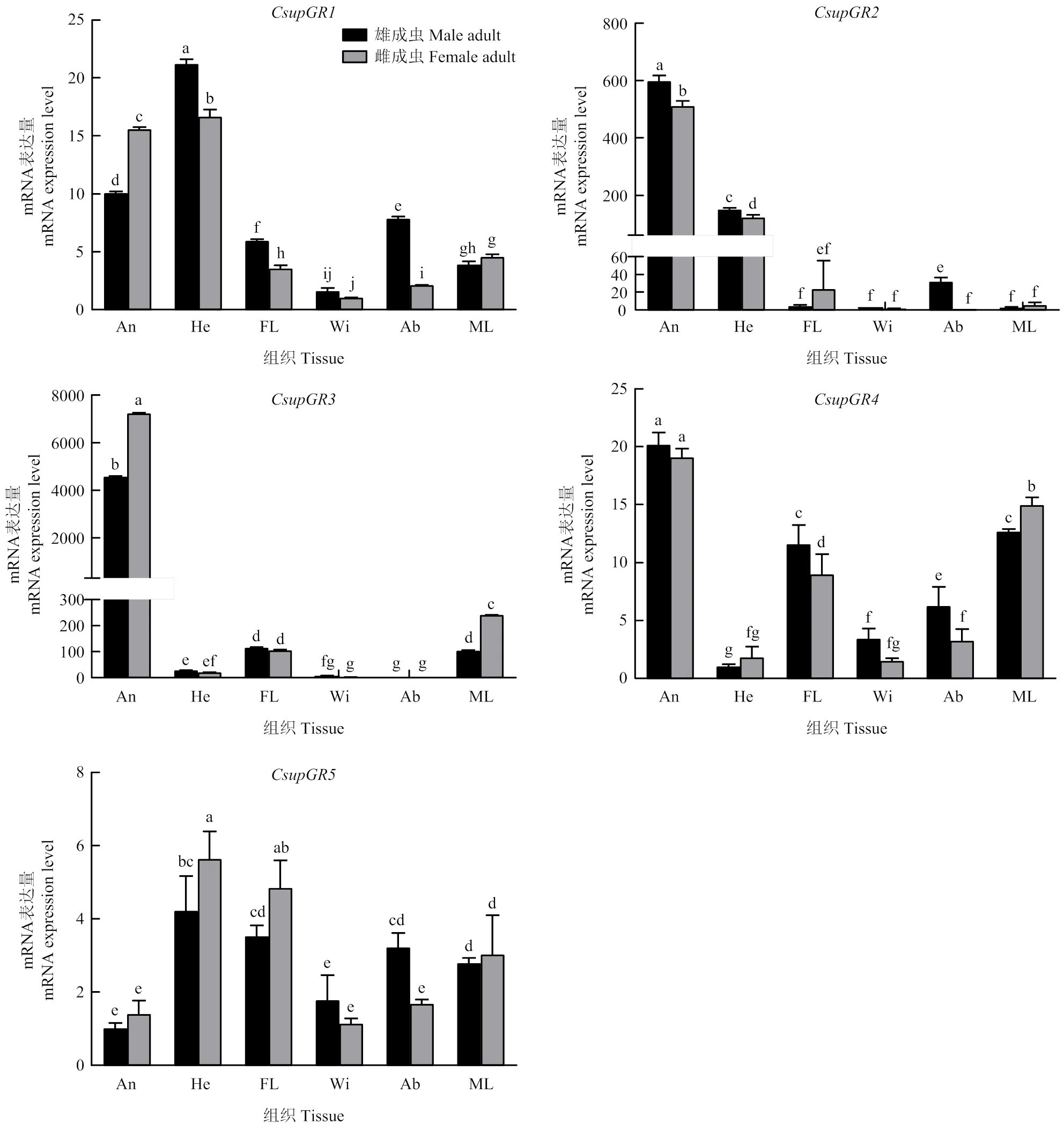
An:触角Antenna;He:头Head;FL:前足Foreleg;Wi:翅Wing;Ab:腹部Abdomen;ML:中后足Middle leg and hindleg
系统发育分析发现,、分别与、聚为一支。已有研究表明在感受CO2的神经元上与共表达,并且只有在这两个基因共同表达的情况下,才能够识别CO2并作出反应[29];、、也被认定为家蚕CO2受体基因[17],因此推测二化螟、也行使识别CO2的功能。与黑腹果蝇和家蚕、受体基因聚为一支。GR43a家族是一类保守程度相对较高的果糖受体,在黑腹果蝇中发挥识别果糖的功能[30],在家蚕[30-31]、小菜蛾[32]、斜纹夜蛾[33]和棉铃虫[34]等鳞翅目昆虫中有所报道;黑腹果蝇大脑中的GR43a-like受体作为血淋巴果糖的营养感受器,可以促进饥饿果蝇取食、抑制饱腹果蝇取食[35];家蚕果糖受体表达细胞与假定的神经肽Fl表达细胞在脑中共定位,参与促进取食行为[36];对肌醇和表肌醇有特异性反应[37],因此推测二化螟也有类似功能。、与、聚为一支。研究表明能识别myo-肌醇及epi-肌醇,且配体浓度越高,其敏感性越强[38];除了味觉受体的功能外还具有化学传感器的作用,例如用于调节幼虫的肠道运动、生理条件和取食行为[31],推测和也具有相应的功能。对于二化螟这些GR基因的具体功能有待于进一步研究。
3.2 二化螟5个GR基因的表达特征
昆虫的味觉受体在选择和趋避寄主植物过程中发挥着重要作用,研究昆虫味觉受体在不同发育时期和不同组织中的表达情况有助于推测味觉受体发挥的功能。前人研究表明,鳞翅目昆虫的GR基因不仅在幼虫各个时期有表达,而且在成虫不同组织中也均有分布,包括口器、触角、翅边缘和足等,参与诱导昆虫的行为[39-42]。
对成虫GR基因的组织表达谱进行分析发现,、、在触角部位高表达,这可能与成虫感知寄主植物表面物质有关,例如棉铃虫成虫触角末端具有对D-果糖敏感的味觉受体[34];蔗糖和果糖能够刺激棉铃虫触角从而引起喙管伸长反应和吸食行为[40]。、在头部表达量显著高于其他部位,这是因为昆虫的喙也分布了一定数量的栓锥感器用于感知外界物质,有研究表明棉铃虫的喙上大约有90个栓锥形感器发挥味觉感受功能,可感知蔗糖、果糖和葡萄糖且敏感性强[40];中华蜜蜂()口器中的味觉生物传感器能够稳定且可靠地在最佳浓度区间内辨别不同品质的蜂蜜[43]。在足上也有较高表达量,可能与产卵和感知化合物有关,有研究者发现在凤尾蝶()产卵过程中,雌蝶前肢中的味觉受体可以识别辛弗林从而有选择性地将卵产于单一科或少数科植物中[8];黑腹果蝇的足和翅边缘也可以识别碳水化合物、氨基酸和苦味物质[44]。
GR基因在幼虫阶段也有表达,可能与取食、发育等有关。、、在幼虫1龄期表达量较高,这可能是因为昆虫幼虫中存在识别寄主植物特异次生代谢物质的味觉敏感神经元,例如柑橘大实蝇()的大多数GR基因在1龄和2龄幼虫中高表达,尤其在2龄幼虫口器中高表达,通过感知橙皮苷和柚皮苷对柑橘大实蝇幼虫的生长具有促进作用[45];大菜粉蝶()和菜粉蝶()幼虫口器上的中栓锥感器和侧栓锥感器中均具有1个芥子油苷特异受体神经元,烟草天蛾幼虫具有对茄科寄主植物次生物质紫花茄皂苷敏感的味觉神经元,这些味觉受体神经元的敏感性决定昆虫是否接受寄主或取食[46]。在4、5龄幼虫中也有较高表达,可能与幼虫取食选择有关,研究表明草地贪夜蛾口器中的中栓锥感器和侧栓锥感器内的味觉受体神经元对取食激食素和抑制剂敏感,为其取食选择行为奠定了味觉基础[47];5龄棉铃虫幼虫侧栓锥感受器中具有对印楝素和棉酚敏感的味觉神经元,将这两种物质视为取食抑制素[48];在棉铃虫幼虫前肠中高表达,能够特异性识别D-半乳糖、D-果糖和D-麦芽糖[49],且能在饱腹条件下抑制取食从而调控取食行为[42]。
二化螟GR基因的具体功能需要后期利用电生理技术来确定这些基因所识别的配体,并结合RNAi技术和CRISPR基因编辑技术加以验证。
4 结论
利用生物信息学方法鉴定得到5个二化螟味觉受体基因。、、和在成虫期高表达;和在成虫头部表达量较高;、和在成虫触角表达量高。所克隆的5个GR基因可能与二化螟识别和适应寄主植物有关。
[1] MAO K K, LI W H, LIAO X, LIU C Y, QIN Y, REN Z J, QIN X Y, WAN H, SHENG F, LI J H. Dynamics of insecticide resistance in different geographical populations of(Lepidoptera: Crambidae) in China 2016-2018. Journal of Economic Entomology, 2019, 112(4): 1866-1874.
[2] 胡君, 陈文明, 张真真, 郑雪松, 靳建超, 苏建亚, 高聪芬, 沈晋良. 长江流域稻区二化螟抗药性监测. 中国水稻科学, 2010, 24(5): 509-515.
HU J, CHEN W M, ZHANG Z Z, ZHENG X S, JIN J C, SU J Y, GAO C F, SHEN J L. Insecticide resistance monitoring ofin the drainage area of the Yangtze River, China. Chinese Journal of Rice Science, 2010, 24(5): 509-515. (in Chinese)
[3] LU Y, ZHENG X, LU Z. Application of vetiver grass: Poaceae (L.) as a trap plant for rice stem borer: Crambidae (Walker) in the paddy fields. Journal of Integrative Agriculture, 2019, 18(4): 797-804.
[4] ZHAO X, XU X, WANG X G, YIN Y, LI M Y, WU Y Q, LIU Y H, CHENG Q H, GONG C W, SHEN L T. Mechanisms for multiple resistances in field populations of rice stem borer,(Lepidoptera: Crambidae) from Sichuan Province, China. Pesticide Biochemistry and Physiology, 2021, 171: 104720.
[5] 姚诚诚, 杜立啸, 李云河. 虫害诱导植物信息化合物介导的植物间交流及机制. 植物保护, 2021, 47(6): 1-10.
YAO C C, DU L X, LI Y H. Plant-to-plant communications medicated by herbivore-induced plant volatiles and the mechanisms. Plant Protection, 2021, 47(6): 1-10. (in Chinese)
[6] 王广利, 付小刚, 韩晓霞, 张宇瑶, 魏洪义. 二化螟雌蛾对香根草挥发物的EAG和行为反应. 应用昆虫学报, 2016, 53(1): 148-156.
WANG G L, FU X G, HAN X X, ZHANG Y Y, WEI H Y. EAG and behavioral responses offemales to plant volatiles from. Chinese Journal of Applied Entomology, 2016, 53(1): 148-156. (in Chinese)
[7] HU X Y, SU S L, LIU Q S, JIAO Y Y, PENG Y F, LI Y H, TURLINGS T C J. Caterpillar-induced rice volatiles provide enemy-free space for the offspring of the brown planthopper. eLife, 2020, 9: e55421.
[8] OZAKI K, RYUDA M, YAMADA A, UTOGUCHI A, ISHIMOTO H, CALAS D, MARION-POLL F, TANIMURA T, YOSHIKAWA H. A gustatory receptor involved in host plant recognition for oviposition of a swallowtail butterfly. Nature Communications, 2011, 2: 542.
[9] SCHOONHOVEN L M, VAN LOON J J A. An inventory of taste in caterpillars: Each species its own key. Acta Zoologica Academiae Scientiarum Hungaricae, 2002, 48(Suppl. 1): 215-263.
[10] ZHANG Z J, ZHANG S S, NIU B L, JI D F, LIU X J, LI M W, BAI H, PALLI S R, WANG C Z, TAN A J. A determining factor for insect feeding preference in the silkworm,. Plos Biology, 2019, 17(2): e3000162.
[11] YANG J, GUO H, JIANG N J, TANG R, LI G C, HUANG L Q, VAN LOON J J A, WANG C Z. Identification of a gustatory receptor tuned to sinigrin in the cabbage butterfly. Plos Genetics, 2021, 17(7): e1009527.
[12] SINGH R N. Neurobiology of the gustatory systems ofand some terrestrial insects. Microscopy Research and Technique, 1997, 39(6): 547-563.
[13] CLYNE P J, WARR C G, CARLSON J R. Candidate taste receptors in. Science, 2000, 287(5459): 1830-1834.
[14] AGNIHOTRI A R, ROY A A, JOSHI R S. Gustatory receptors in Lepidoptera: chemosensation and beyond. Insect Molecular Biology, 2016, 25(5): 519-529.
[15] SANCHEZ-GRACIA A, VIEIRA F G, ROZAS J. Molecular evolution of the major chemosensory gene families in insects. Heredity, 2009, 103(3): 208-216.
[16] ROBERTSON H M, WARR C G, CARLSON J R. Molecular evolution of the insect chemoreceptor gene superfamily in. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(Suppl. 2): 14537-14542.
[17] GUO H, CHENG T, CHEN Z, JIANG L, GUO Y, LIU J, LI S, TANIAI K, ASAOKA K, KADONO-OKUDA K,. Expression map of a complete set of gustatory receptor genes in chemosensory organs of. Insect Biochemistry and Molecular Biology, 2017, 82: 74-82.
[18] ZHAN S, MERLIN C, BOORE J L, REPPERT S M. The monarch butterfly genome yields insights into long-distance migration. Cell, 2011, 147(5): 1171-1185.
[19] BRISCOE A D, MACIAS-MUÑOZ A, KOZAK K M, WALTERS J R, YUAN F, JAMIE G A, MARTIN S H, DASMAHAPATRA K K, FERGUSON L C, MALLET J, JACQUIN-JOLY E, JIGGINS C D. Female behaviour drives expression and evolution of gustatory receptors in butterflies. PLOS Genetics, 2013, 9(7): e1003620.
[20] YOU M, YUE Z, HE W, YANG X, YANG G, XIE M, ZHAN D, BAXTER S W, VASSEUR L, GURR G M,. A heterozygous moth genome provides insights into herbivory and detoxification. Nature Genetics, 2013, 45(2): 220-225.
[21] LI L L, XU J W, YAO W C, YANG H H, DEWER Y, ZHANG F, ZHU X Y, ZHANG Y N. Chemosensory genes in the head oflarvae. Bulletin of Entomological Research, 2021, 111(4): 454-463.
[22] DU L X, ZHAO X C, LIANG X Z, GAO X W, LIU Y, WANG G R. Identification of candidate chemosensory genes inby transcriptomic analysis. Bmc Genomics, 2018, 19: 518.
[23] ZHANG Y N, QIAN J L, XU J W, ZHU X Y, LI M Y, XU X X, LIU C X, XUE T, SUN L. Identification of chemosensory genes based on the transcriptomic analysis of six different chemosensory organs in. Frontiers in Physiology, 2018, 9: 432.
[24] 罗智心, 姚静, 张茹, 罗光华, 方继朝. 二化螟36 d标准化饲养技术与管理体系. 江苏农业科学, 2021, 49(24): 100-109.
LUO Z X, YAO J, ZHANG R, LUO G H, FANG J C. A 36-days standardized mass rearing technique and management system for rice stem borer,(Lepidoptera: Crambidae). Jiangsu Agricultural Sciences, 2021, 49(24): 100-109. (in Chinese)
[25] HE F J, LU M X, DU Y Z. Selection and evaluation of reference genes for qRT-PCR analysis of different developmental stages in. Journal of Asia-Pacific Entomology, 2021, 24(4): 1228-1234.
[26] YANG K, GONG X L, LI G C, HUANG L Q, NING C, WANG C Z. A gustatory receptor tuned to the steroid plant hormone brassinolide in(Lepidoptera: Plutellidae). eLife, 2020, 9: e64114.
[27] ABDEL-LATIEF M. A family of chemoreceptors in(Tenebrionidae: Coleoptera). Plos One, 2007, 2(12): e1319.
[28] ROBERTSON H M, WANNER K W. The chemoreceptor superfamily in the honey bee,: Expansion of the odorant, but not gustatory, receptor family. Genome Research, 2006, 16(11): 1395-1403.
[29] JONES W D, CAYIRLIOGLU P, KADOW I G, VOSSHALL L B. Two chemosensory receptors together mediate carbon dioxide detection in. Nature, 2007, 445(7123): 86-90.
[30] SATO K, TANAKA K, TOUHARA K. Sugar-regulated cation channel formed by an insect gustatory receptor. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(28): 11680-11685.
[31] MANG D, SHU M, ENDO H, YOSHIZAWA Y, NAGATA S, KIKUTA S, SATO R. Expression of a sugar clade gustatory receptor,, in the oral sensory organs, midgut, and central nervous system of larvae of the silkworm. Insect Biochemistry and Molecular Biology, 2016, 70: 85-98.
[32] LIU X L, SUN S J, HOU W, ZHANG J, YAN Q, DONG S L. Functional characterization of two spliced variants of fructose gustatory receptor in the diamondback moth,. Pesticide Biochemistry and Physiology, 2020, 164: 7-13.
[33] LIU X L, YAN Q, YANG Y L, HOU W, MIAO C L, PENG Y C, DONG S L. A gustatory receptor Gr8 tunes specifically to D-fructose in the common cutworm. Insects, 2019, 10(9): 272.
[34] JIANG X J, NING C, GUO H, JIA Y Y, HUANG L Q, QU M J, WANG C Z. A gustatory receptor tuned to D-fructose in antennal sensilla chaetica of. Insect Biochemistry and Molecular Biology, 2015, 60: 39-46.
[35] MIYAMOTO T, SLONE J, SONG X, AMREIN H. A fructose receptor functions as a nutrient sensor in thebrain. Cell, 2012, 151(5): 1113-1125.
[36] MANG D, SHU M, TANAKA S, NAGATA S, TAKADA T, ENDO H, KIKUTA S, TABUNOKI H, IWABUCHI K, SATO R. Expression of the fructose receptorand its involvement in the promotion of feeding, suggested by its co-expression with neuropeptide F1 in. Insect Biochemistry and Molecular Biology, 2016, 75: 58-69.
[37] KIKUTA S, ENDO H, TOMITA N, TAKADA T, MORITA C, ASAOKA K, SATO R. Characterization of a ligand-gated cation channel based on an inositol receptor in the silkworm,. Insect Biochemistry and Molecular Biology, 2016, 74: 12-20.
[38] ZHANG H J, ANDERSON A R, TROWELL S C, LUO A R, XIANG Z H, XIA Q Y. Topological and functional characterization of an insect gustatory receptor. PLoS ONE, 2011, 6(8): e24111.
[39] POPESCU A, COUTON L, ALMAAS T J, ROSPARS J P, WRIGHT G A, MARION-POLL F, ANTON S. Function and central projections of gustatory receptor neurons on the antenna of the noctuid moth. Journal of Comparative Physiology A, 2013, 199(5): 403-416.
[40] 贾岩岩. 雌性棉铃虫触角刺形感器和喙管栓锥感器的味觉感受特性[D]. 合肥: 安徽大学, 2016.
JIA Y Y. Gustatory characteristics of sensilla chaetica in antennae and sensilla styloconica in proboscis of female(Hübner) (Lepidoptera: Noctuidae)[D]. Hefei: Anhui University, 2016. (in Chinese)
[41] Montell C. A taste of thegustatory receptors. Current Opinion in Neurobiology, 2009, 19(4): 345-353.
[42] AI D, DONG C, YANG B, YU C, WANG G. A fructose receptor gene influences development and feed intake in. Insect Science, 2022, 29(4): 993-1005.
[43] 张军飞, 杨雪梅, 孙惠, 张楠, 安传远, 吴帆, 李红亮. 基于循环伏安法的蜜蜂组织传感器对蜂蜜品质的鉴别. 中国食品学报, 2022, 22(6): 307-314.
ZHANG J F, YANG X M, SUN H, ZHANG N, AN C Y, WU F, LI H L. Identification of honey quality with bee tissue sensor based on cyclic voltammetry. Journal of Chinese Institute of Food Science and Technology, 2022, 22(6): 307-314. (in Chinese)
[44] AMREIN H, THORNE N. Gustatory perception and behavior in. Current Biology, 2005, 15(17): R673-R684.
[45] ZHANG G, CAO S, GUO T, WANG H, QI X, REN X, NIU C. Identification and expression profiles of gustatory receptor genes inlarvae (Diptera: Tephritidae): Role ofin larval growth. Insect Science, 2022, 29(5): 1240-1250.
[46] Del Campo M L, Miles C I, Schroeder F C, Mueller C, Booker R, Renwick J A. Host recognition by the tobacco hornworm is mediated by a host plant compound. Nature, 2001, 411(6834): 186-189.
[47] 侯文华, 孙龙龙, 马英, 孙惠婉, 张佳佳, 白润娥, 赵新成, 汤清波. 草地贪夜蛾幼虫对四种刺激物质的味觉感受和取食选择. 昆虫学报, 2020, 63(5): 545-557.
HOU W H, SUN L L, MA Y, SUN H W, ZHANG J J, BAI R E, ZHAO X C, TANG Q B. Gustatory perception and feeding preference of(Lepidoptera: Noctuidae) larvae to four stimuli. Acta Entomologica Sinica, 2020, 63(5): 545-557. (in Chinese)
[48] 周东升, 龙九妹. 棉铃虫5龄幼虫对棉酚和印楝素的味觉适应性行为研究. 南方农业学报, 2013, 44(4): 590-593.
ZHOU D S, LONG J M. Taste adaptability to azadirachtin and gossypol in fifth instar larvae of. Journal of Southern Agriculture, 2013, 44(4): 590-593. (in Chinese)
[49] XU W, ZHANG H J, ANDERSON A. A sugar gustatory receptor identified from the foregut of cotton bollworm. Journal of Chemical Ecology, 2012, 38(12): 1513-1520.
Identification, cloning and expression profiles of gustatory receptor genes in
HUANG YuXuan1,2, SHEN Chen1,2, JU JiaFei2, YANG Lei1,2, LUO GuangHua1,2, FANG JiChao1,2
1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences/Jiangsu Key Laboratory for Food and Safety (State Key Laboratory Cultivation Base of Ministry of Science and Technology), Nanjing 210014
【Background】The rice striped stem borer,, is one of the important rice pests in China. The gustatory receptors (GRs) play important roles in insect feeding, oviposition, and so on.【Objective】Based on transcriptomic and genomic data, the gustatory receptor gene sequences ofwere identified and cloned in this study. Then, their expression characteristics at different developmental stages and in different tissues of adults were clarified. These results will lay a foundation for further study on the function of gustatory receptor genes in.【Method】Combined with the transcriptome data ofand the GR sequences of other insects, the GR genes inwere identified by multiple sequence alignment. The complete open reading frame (ORF) sequences of the GR genes inwere cloned by RT-PCR, and the molecular biological characteristics and domains of the amino acid sequences encoded by the GR genes inwere analyzed by bioinformatics analysis tools. The phylogenetic tree of GR gene protein sequences ofand other insect GR genes was constructed based on the maximum likelihood method. The expression patterns of GR genes at different developmental stages (1-6 instar larvae, female and male adults) and in different adult tissues (antennae, head, wing, abdomen and leg) ofwere determined by real-time quantitative PCR (RT-qPCR).【Result】Five gustatory receptor genes were identified and named as-. The complete ORFs of these GR genes were between 1 122 and 1 428 bp in length, encoding 373-475 amino acids. Among them,,,had seven transmembrane domains,,had eight transmembrane domains. Phylogenetic analysis showed thatandwere closely related toin,and, belonging to the CO2receptor family.was closely related toin,and, belonging to the fructose/inositol receptor family.andwere closely related toand-in, belonging to the sugar receptor family. The expression profile analysis showed that the five GR genes were all expressed at different developmental stages in. Among them,andwere highly expressed in male adults,had the highest expression level in the 1st instar larvae and male adults,was highly expressed in adults,andhad the highest expression level in the 4th instar larvae. Tissue expression profile analysis showed that these five GR genes were expressed in all tissues of male and female adults.andwere highly expressed in the head of adults, and-were highly expressed in the antennae of adults.【Conclusion】The five GR genes ofidentified in this study have the typical characteristics of insect gustatory receptors and are highly expressed in the antennae or heads of adults. It is speculated that these five genes may be related to the recognitionand adaptation ofto host plants.
; gustatory receptor (GR); gene identification; sequence analysis; expression profile

10.3864/j.issn.0578-1752.2023.13.006
2023-03-28;
2023-05-04
国家水稻产业技术体系(CARS-01)、国家自然科学基金(31672024)、江苏省农业科技自主创新资金(CX(20)1004)
黄玉萱,E-mail:xuan19980712@outlook.com。通信作者罗光华,E-mail:luogh_cn@163.com。通信作者方继朝,E-mail:fangjc126@126.com
(责任编辑 岳梅)

