乳酸菌发酵天麻口服液工艺优化
陈来凤,倪琳钰,邓成林,罗亚楠,李海燕,丰贵江,林秋叶
(云南农业大学食品科学技术学院,云南昆明 650201)
天麻(Gastrodia elata)是被子植物纲天麻属兰科草本植物干燥块茎[1],是我国传统名贵中药材,其性辛、温、无毒,富含天麻素、香荚兰素、多糖、氨基酸及微量元素[2]。天麻也是云贵川高原特有的药食同源中药材,拥有悠久的应用历史。《神农本草经》云天麻为上品,“久服益气力,长阴,肥健,轻身,增年”[3];《药性本草》言天麻能“治语多恍惚,善惊失志”[4];《珍珠囊》记载天麻“治风虚眩晕头痛”,故名定风草;清代名医张志聪称赞天麻“功同五芝,力倍五参,为仙家服食上品”。研究发现,天麻中主要含有酚类、苷类、有机酸、甾醇类和多糖类等化合物,主要活性化学成分为天麻素(对羟基苯甲醇1β-D 葡萄吡喃糖苷),也是含量最高的有效单体成分[2,5]。现代药理研究和临床应用表明,天麻具有提高免疫力、镇静止痛、提高耐缺氧力、改善记忆、降血压、抗炎等多种药理作用,对血管性神经性头痛[6]、脑震荡后遗症等有显著疗效[7]。天麻活性化合物天麻素具有多种生理功能,包括镇静催眠[8]、抗惊厥[9]、抗焦虑抑郁[10]、抗炎镇痛[11]、抗氧化[12]、增强记忆和抗衰老[13]、抗病毒和抗肿瘤作用[14],还具有保护神经、调节循环系统[15−16]等功效。
2018 年国家卫健委批准天麻作为食药物质试生产,其保健作用及特有的药理特性成为食品领域药食同源研究的热点[17]。目前,有关天麻的研究主要集中在贮藏工艺研究[18]、化学成分分析[19]和药理药效探索[20]等基础研究方面,新型天麻食品饮料研究鲜见报道。乳酸菌是一类能利用可发酵碳水化合物生成乳酸的一类无芽孢、革兰染色阳性细菌的总称,广泛存在于人体内,具有促进营养物质消化吸收、调节肠道菌群、提高机体免疫力等多种益生功能[21−22]。近年来研究表明,乳酸菌发酵剂可以改善药食同源中药材的口感,又能够提升中药材的生物学功效,正日益受到关注[23]。应用乳酸菌发酵天麻,不仅保留天麻原有功能性成分和活性乳酸菌,发酵过程中还可能产生具有生物学活性的功能性代谢产物,从而增加天麻的保健功能[24]。
植物乳植杆菌属于同型乳酸菌,普遍存在于泡菜、酱油和发酵肉制品等传统发酵食品中[25],植物乳植杆菌位于我国《可用于食品的菌种名单》[26]之列,可以作为安全菌株添加于食品中。本研究以天麻为研究对象,采用复合酶法处理天麻,利用课题组自主筛选、在天麻酶解液中生长良好的植物乳植杆菌STDA6 作为发酵菌剂,在单因素实验基础上,通过正交试验设计,研发乳酸菌发酵天麻口服液。研究结果可为深入开发天麻及药食同源药材提供理论依据。
1 材料与方法
1.1 材料与仪器
植物乳植杆菌STDA6 来源于课题组自主分离,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.20878;天麻 购买于云南省昆明市新螺蛳湾国际商贸城中药材市场;MRS 培养基、马铃薯葡萄糖琼脂培养基(PDA)、结晶紫中性红胆盐琼脂培养基(VRBA)广东环凯微生物科技有限公司;胰蛋白胨 北京兰杰柯科技有限公司;牛肉膏 北京索莱宝科技有限公司;琼脂 广州赛国生物科技有限公司;氯化钠 天津市风船化学试剂科技有限公司;硫酸锰 大连美仑生物技术有限公司;液体石蜡 成都市科隆化学品有限公司;丁二酸钠 大连美仑生物技术有限公司;硼酸 西陇化工股份有限公司;苯酚 天津市化学试剂一厂;磷酸氢二钾 广东光华科技股份有限公司,均为分析纯;α-淀粉酶(30000 U/g)、果胶酶(40000 U/g)、纤维素酶(100000 U/g)山东隆科特酶制剂有限公司;单宁酶(300 U/g)南宁庞博生物工程有限公司;碳酸氢钠 南京甘汁园糖业有限公司;柠檬酸 潍坊英轩实业有限公司;蔗糖 昆明多悦多工贸有限公司,均为食品级;试验用水为纯化水。
BSA224S 精密分析天平 赛多利斯科学仪器(北京)有限公司;EPED-E2-20TH 超纯水仪 南京易普易达科技发展有限公司;DW-86L388J 医用低温保存箱 青岛海尔生物医疗股份有限公司;Vorte-5 涡旋混合器 江苏海门市麒麟医用仪器厂;UV-5100 紫外分光光度计 上海元析仪器有限公司;Sorvall ST 16R 高速冷冻离心机 赛默飞世尔科技(中国)有限公司;LDZX-50L 立式压力蒸汽灭菌器上海申安医疗器械厂;SW-CJ-1FD 洁净工作台 苏州安泰空气技术有限公司,DHP-9162 电热恒温培养箱 上海一恒科学仪器有限公司;FE28 pH 计 梅特勒-托利多仪器(上海)有限公司;DHG-9240A 电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;HH-6高精度数显恒温水浴锅 上海力辰邦西仪器科技有限公司。
1.2 实验方法
1.2.1 乳酸菌发酵天麻口服液生产工艺流程 参考文献[27]的方法,乳酸菌发酵天麻口服液生产工艺流程如图1。
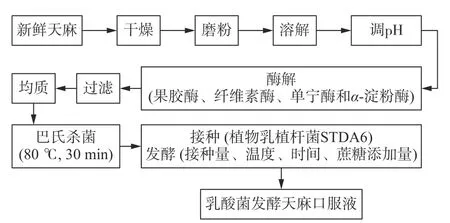
图1 乳酸菌发酵天麻口服液生产工艺流程Fig.1 Processing technology of fermented G.elata oral liquid with lactic acid bacteria
1.2.2 天麻发酵基液的制备
1.2.2.1 酶解单因素实验 参考文献[27]的方法,以5.0 g 天麻粉为基准,料液比1:8(g/mL)、单酶添加量0.3%、pH5.0、酶解温度50 ℃和酶解时间180 min为基准条件,以酶解率为指标,进行单因素实验,优化果胶酶、纤维素酶、单宁酶和ɑ-淀粉酶酶解工艺。
果胶酶酶解天麻单因素实验:分别考察料液比[1:7、1:8、1:9、1:10、1:11(g/mL)]、果胶酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)、pH(4.0、4.5、5.0、5.5、6.0)、酶解温度(40、45、50、55、60 ℃)和酶解时间(90、120、150、180、210 min)对天麻酶解率的影响。
纤维素酶酶解天麻单因素实验:分别考察料液比[1:6、1:7、1:8、1:9、1:10(g/mL)]、纤维素酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)、pH(4.0、4.5、5.0、5.5、6.0)、酶解温度(40、45、50、55、60 ℃)和酶解时间(90、120、150、180、210 min)对天麻酶解率的影响。
单宁酶酶解天麻单因素实验:分别考察料液比[1:7、1:8、1:9、1:10、1:11(g/mL)]、单宁酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)、pH(4.0、4.5、5.0、5.5、6.0)、酶解温度(50、55、60、65、70 ℃)和酶解时间(60、90、120、150、180 min)对天麻酶解率的影响。
ɑ-淀粉酶酶解天麻单因素实验:分别考察料液比[1:7、1:8、1:9、1:10、1:11(g/mL)]、ɑ-淀粉酶添加量(0.2%、0.3%、0.4%、0.5%、0.6%)、pH(3.0、3.5、4.0、4.5、5.0)、酶解温度(35、40、45、50、55 ℃)和酶解时间(90、120、150、180、210 min)对天麻酶解率的影响。
1.2.2.2 正交试验确定复合酶酶解天麻最佳工艺条件 参考文献[27−29]的方法,复合酶选用等比例混合酶(果胶酶:纤维素酶:单宁酶:α-淀粉酶=1:1:1:1)对天麻进行酶解反应,结合单因素实验结果,选取对酶解率影响较大的4 个因素,采用 Design Expert软件设计L9(34)正交试验方案,进行正交试验,优化天麻酶解条件,酶解正交因素水平见表1。

表1 正交试验因素水平设计Table 1 Factors and levels design of orthogonal test
1.2.2.3 酶解率的确定 参照叶朋飞等[27]方法,称取天麻粉样品(5 g)进行酶解,酶解液5000 r/min,离心10 min,沉淀80 ℃干燥3 h 后称重(m2),根据如下公式计算酶解条件下酶解率:
式中:m1:天麻样品质量,g ;m2:残渣的质量,g ;9.67:未添加酶处理天麻的酶解率。
1.2.3 乳酸菌发酵天麻口服液的工艺优化
1.2.3.1 植物乳植杆菌STDA6 发酵天麻口服液单因素实验 确定天麻酶解条件后,以乳酸菌接种量1×105CFU/mL、蔗糖添加量8%、发酵温度37 ℃和发酵时间16 h 为基准条件,以感官评分为评价指标,分别考察乳酸菌接种量(1×103、1×104、1×105、1×106、1×107CFU/mL)、发酵温度(33、35、37、39、41 ℃)、发酵时间(8、12、16、20、24 h)和蔗糖添加量(6%、7%、8%、9%、10%)对发酵天麻口服液的影响。
1.2.3.2 植物乳植杆菌STDA6 发酵天麻口服液正交试验 结合单因素实验结果,选择乳酸菌接种量、发酵温度、发酵时间和蔗糖添加量四因素,采用Design Expert 软件设计L9(34)正交试验方案,进行正交试验,优化乳酸菌发酵天麻的最优条件,正交因素水平见表2。

表2 正交试验因素水平设计Table 2 Factors and levels design of orthogonal test
1.2.4 感官评定标准 由10 名经过培训的食品专业研究生组成感官评定小组,从颜色与外观、香气、滋味与口感及组织形态四个方面对乳酸菌发酵天麻口服液进行感官评分,评定标准见表3。

表3 乳酸菌发酵天麻口服液感官评分标准Table 3 Sensory scoring criteria for fermented G.elata oral liquid with lactic acid bacteria
1.2.5 乳酸菌发酵天麻口服液质量指标测定
1.2.5.1 pH 测定 应用pH 计测定天麻口服液pH。
1.2.5.2 微生物指标测定 按GB/T 31326-2014 相关标准的要求检测[30];菌落总数参照GB 4789.2-2016 进行测定[31];大肠菌群参照GB 4789.3-2016 进行测定[32];霉菌和酵母菌参照GB 4789.15-2016 进行测定[33];金黄色葡萄球菌参照GB 4789.10-2016进行测定[34];沙门氏菌参照GB4789.4-2016 进行测定[35];乳酸菌总数参照GB 4789.35-2016 进行测定[36]。
1.3 数据处理
所有实验进行3 次重复,采用SPSS 19.0 软件统计处理数据,使用GraphPad Prism 8.0 软件对实验数据进行统计与制图,采用One-way ANOVA 进行方差分析和Duncan 多重比较进行各数据之间的显著性分析。P<0.05 表示各组数据之间的差异具有统计学意义。
2 结果与分析
2.1 天麻酶解工艺的确定
2.1.1 天麻酶解单因素实验结果 果胶酶较佳酶解条件如图2 所示:料液比(g:mL)1:10、加酶量0.2%、pH4.5、50 ℃酶解180 min。
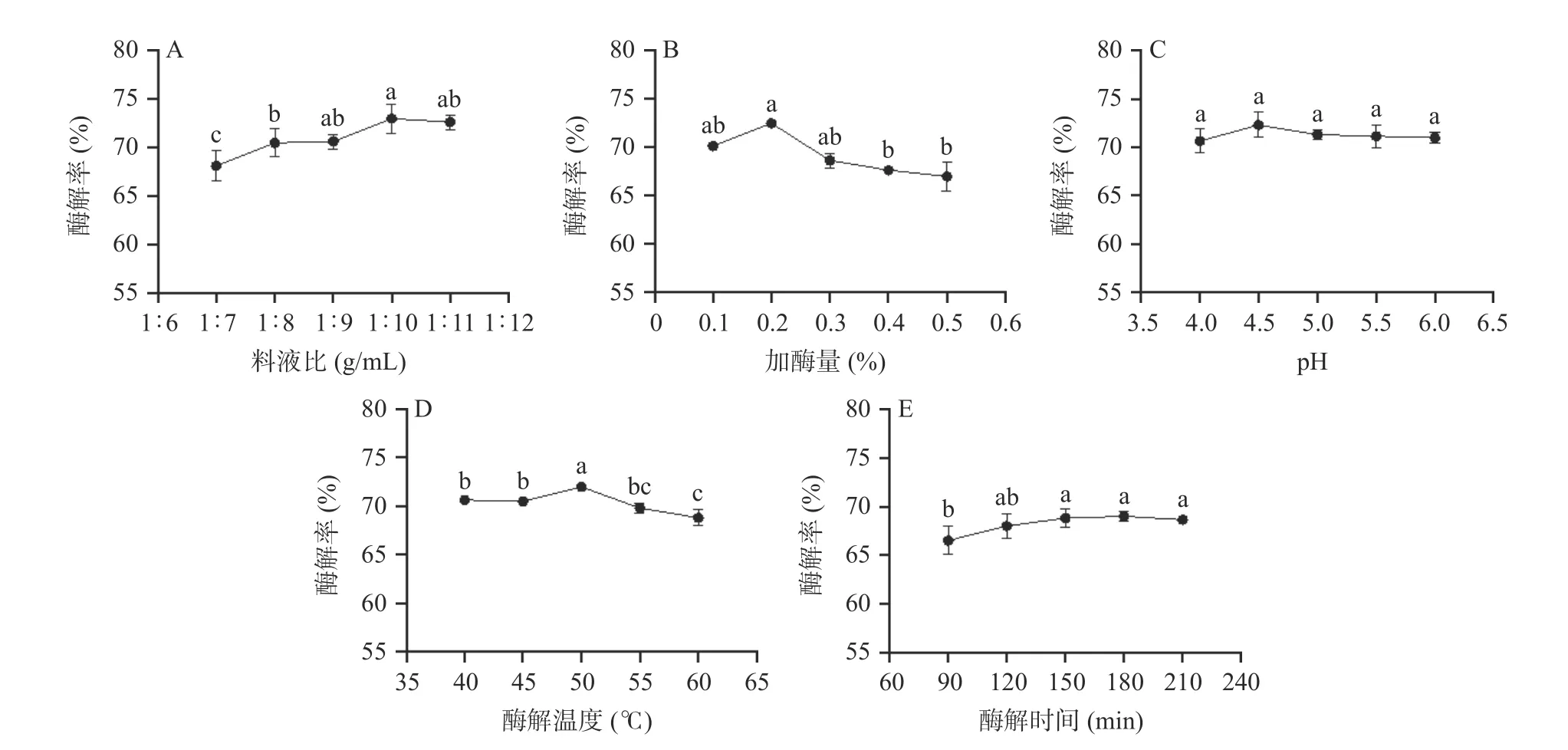
图2 果胶酶酶解天麻单因素实验结果Fig.2 Results of single factor experiment on pectinase enzymatic hydrolysis of G.elata
纤维素酶较佳酶解条件如图3 所示:料液比(g:mL)1:9、加酶量0.4%、pH5.0、50 ℃酶解180 min。

图3 纤维素酶酶解天麻单因素实验结果Fig.3 Results of single factor experiment on cellulase enzymatic hydrolysis of G.elata
单宁酶较佳酶解条件如图4 所示:料液比(g:mL)1:8、加酶量0.3%、pH4.5、60 ℃酶解150 min。
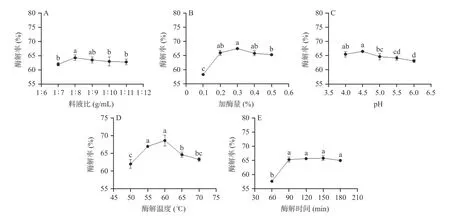
图4 单宁酶酶解天麻单因素实验结果Fig.4 Results of single factor experiment on tannase enzymatic hydrolysis of G.elata
α-淀粉酶较佳酶解条件如图5 所示:料液比(g:mL)1:10、加酶量0.5%、pH4.0、40 ℃酶解150 min。

图5 α-淀粉酶酶解天麻单因素实验结果Fig.5 Results of single factor experiment on α-amylase enzymatic hydrolysis of G.elata
由上述单因素实验结果可知,在天麻中分别加入果胶酶、纤维素酶、单宁酶和α-淀粉酶,随着料液比、加酶量、pH、酶解温度和酶解时间增加,酶解率总体呈现先上升后下降的趋势。随着料液比的增加,酶解率先增后减,分析结果可能是溶剂体积小时,溶液浓度过大,流动性差,酶与底物接触不充分,致使酶解不完全;溶剂体积大时,溶液稀释,底物浓度降低,影响了反应的进行[37]。随着单酶量的增加,酶解效率提高,酶量继续增加,酶过剩则会导致溶液体系黏度增加,进而限制酶解效率[38]。随着pH 升高,酶活性逐渐增强,酶解率提高,pH 继续升高酶活性可能受到抑制,酶解率降低。随着酶解温度升高,酶活性逐渐增强,酶解率提高,温度继续升高,酶的稳定性降低,导致酶活性下降,酶解率也随之降低[39]。在一定时间范围内,随着酶解时间延长,酶解率增加,酶解时间继续延长,酶解率趋于稳定,分析原因可能是酶解后期底物基本被酶解完全[40]。果胶酶、纤维素酶的较佳酶解时间为180 min,单宁酶和α-淀粉酶的较佳酶解时间为150 min,综合考虑后选择固定酶解时间为180 min。杨培青[41]蓝莓果渣酵素制备工艺的研究也得出了相似的结果。根据单因素实验结果,果胶酶、纤维素酶、单宁酶和α-淀粉酶的较佳料液比分别是1:10、1:9、1:8 和1:10,较佳酶添加量是0.2%、0.4%、0.3%和0.5%,较佳pH 分别是4.5、5.0、4.5 和4.0,较佳温度分别是50、50、60 和40 ℃。综合考虑,选择不同考察因素中相同的最优条件作为正交试验的中心点,即确定料液比1:9、1:10、1:11,复合酶添加量0.3%、0.4%、0.5%,pH4.0、4.5、5.0,酶解温度40、50、60 ℃作为正交因素考察水平。
2.1.2 正交试验确定复合酶酶解天麻最佳工艺条件
根据单因素实验结果,确定料液比(A)、复合酶添加量(B)、酶解pH(C)和酶解温度(D)4 个因素,进行4 因素3 水平的正交试验,正交试验结果见表4。
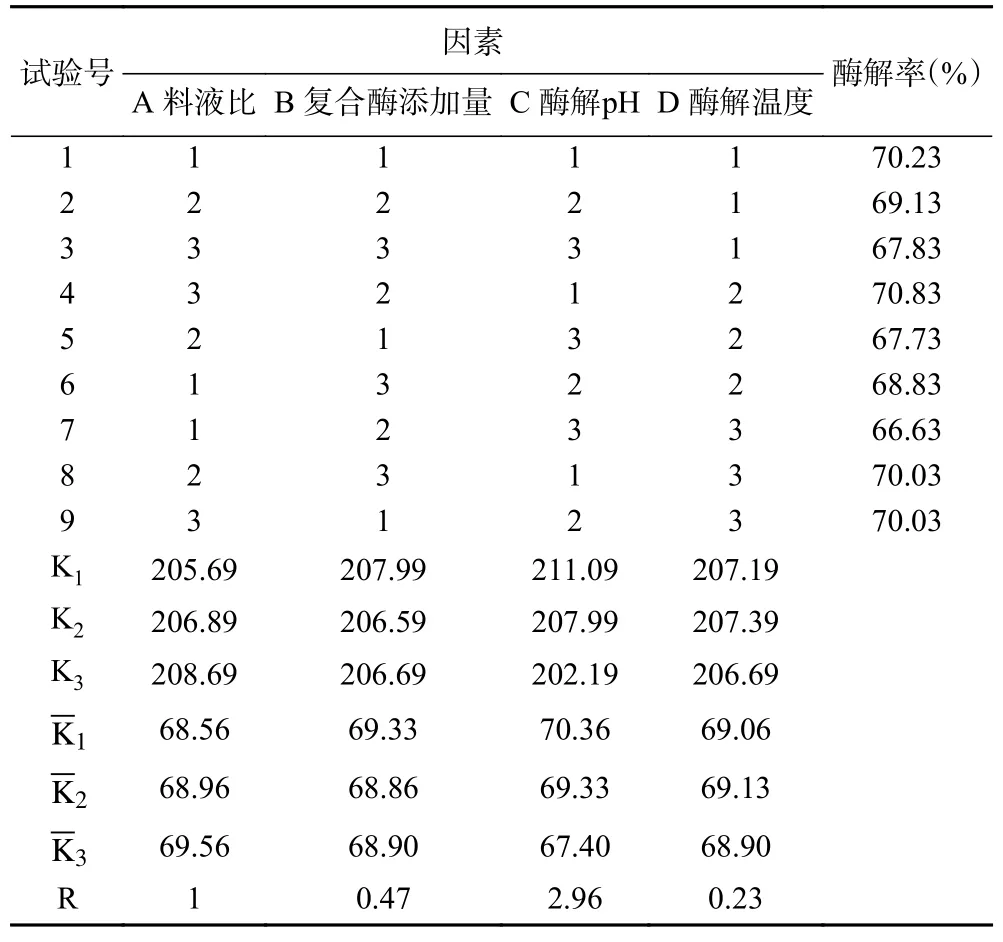
表4 正交试验结果(酶解率)Table 4 Results of orthogonal experiments (enzymolysis rate)
根据各因素显著水平,结合R 值大小可以判断影响天麻酶解率的主次因素关系为C>A>B>D,即酶解pH>料液比>复合酶添加量>酶解温度。根据K 值,得出理论最佳酶解工艺组合为A3B1C1D2,即料液比1:11、复合酶添加量0.3%、pH4.0、酶解温度50 ℃。在正交试验表中组合A3B2C1D2酶解率最高。将正交试验中由直观分析所得的酶解工艺理论最优和实际最优进行验证实验,结果显示A3B2C1D2(70.93)酶解率高于A3B1C1D2(70.53)。结果与别蒙等[42]和孟然等[43]研究一致,分析可能是因为因素的水平间具有交互作用导致[44]。故选择最佳酶解工艺为料液比1:11、复合酶添加量0.4%、pH4.0、酶解温度50 ℃。由表5 中方差分析结果可知,料液比(A)和pH(C)对酶解率影响显著,因素影响大小顺序与表4 极差分析结果一致,表明正交试验数据可靠。

表5 正交试验方差分析(酶解率)Table 5 Anova of orthogonal experiments (enzymolysis rate)
2.2 乳酸菌发酵天麻口服液工艺优化
2.2.1 乳酸菌发酵天麻口服液单因素实验结果 通过单因素实验确定了植物乳植杆菌STDA6 发酵天麻口服液的工艺条件,结果如图6 所示。随着乳酸菌接种量的增加,天麻口服液的感官评分呈现先上升后下降的趋势,分析原因是在一定浓度范围内,增加乳酸菌接种量,对天麻口服液的口感香味方面产生了积极的影响,导致感官评分上升,当接种量达到1×106CFU/mL 时,感官评分达到最大值。随着接种量继续增加,感官评分降低,分析原因可能是接种量过多导致天麻口服液口感偏酸、接受度低[45],这与郑聪等[46]研究余甘子圣女果复合饮料发酵工艺的乳酸菌添加量结果相似,因此确定接种量1×105、1×106、1×107CFU/mL 作为正交因素考察水平。发酵温度对天麻口服液感官评分影响结果显示,随发酵温度升高,感官评分先升高后降低,当发酵温度为35 ℃时感官评分达到最高,分析原因可能是温度会影响乳酸菌的生长的速率和产物形成,当发酵温度为35 ℃时,乳酸菌活性最高,发酵效果最好,天麻口服液口感和滋味最好;温度高于35 ℃时,乳酸菌活性也会随温度升高而下降,发酵效果也随之降低[47]。郗恩光[48]对香蕉金针菇发酵饮料工艺优化研究也得出了相似的结果,因此确定发酵温度33、35、37 ℃作为正交因素考察水平。发酵时间对天麻口服液感官评分影响结果显示,随发酵时间延长,感官评分先升高后降低,分析原因可能是发酵时间太短,发酵风味不明显,发酵时间太长时,乳酸菌增长迅速,使饮料酸涩,口感较差[49],与汪云阳等[50]研究一致。因此确定发酵时间12、16、20 h 作为正交因素考察水平。蔗糖添加量对天麻口服液感官评分影响结果显示,随蔗糖添加量增加,感官评分先升高后降低,蔗糖添加量过少或过多时,口感偏酸或偏甜;当蔗糖添加量为9%时,天麻口服液口感适中,感官评分达到最高,因此确定蔗糖添加量8%、9%、10%作为正交因素考察水平。

图6 植物乳植杆菌发酵天麻口服液工艺单因素实验结果Fig.6 Single factor experiment results of processing of G.elata oral liquid fermented with L.plantarum
2.2.2 乳酸菌发酵天麻口服液正交试验结果 根据单因素的实验结果,确定植物乳植杆菌接种量(A)、发酵时间(B)、发酵温度(C)和蔗糖添加量(D)4 个因素,进行4 因素3 水平的正交试验,正交试验结果见表6。根据各因素显著水平,结合R 值大小可以判断影响乳酸菌发酵天麻口服液感官评价的主次因素关系为A>B>D>C,即接种量>发酵时间>蔗糖添加量>发酵温度。根据K 值,得出最佳工艺组合为A1B1C3D3,即接种量1×105CFU/mL,发酵时间12 h,发酵温度37 ℃,蔗糖添加量10%。在正交试验表中感官评价得分最高的组合为A3B1C2D3,即接种量为1×107CFU/mL,发酵时间12 h,发酵温度为35 ℃,蔗糖添加量为10%。将正交试验中由直观分析所得的发酵工艺理论最优和实际最优进行验证实验,结果显示理论最优A1B1C3D3感官评分88.33,高于实际最优A3B1C2D3感官评分85.60。故确定最佳发酵工艺为接种量1×105CFU/mL,发酵时间12 h,发酵温度37 ℃,蔗糖添加量10%。由表7 中方差分析可知,接种量(A)、发酵时间(B)和蔗糖添加量(D)3 个因素对感官评分影响显著,因素影响大小顺序与表6极差分析结果一致,表明正交试验数据可靠。

表6 正交试验结果(感官评分)Table 6 Results of orthogonal experiments (sensory score)
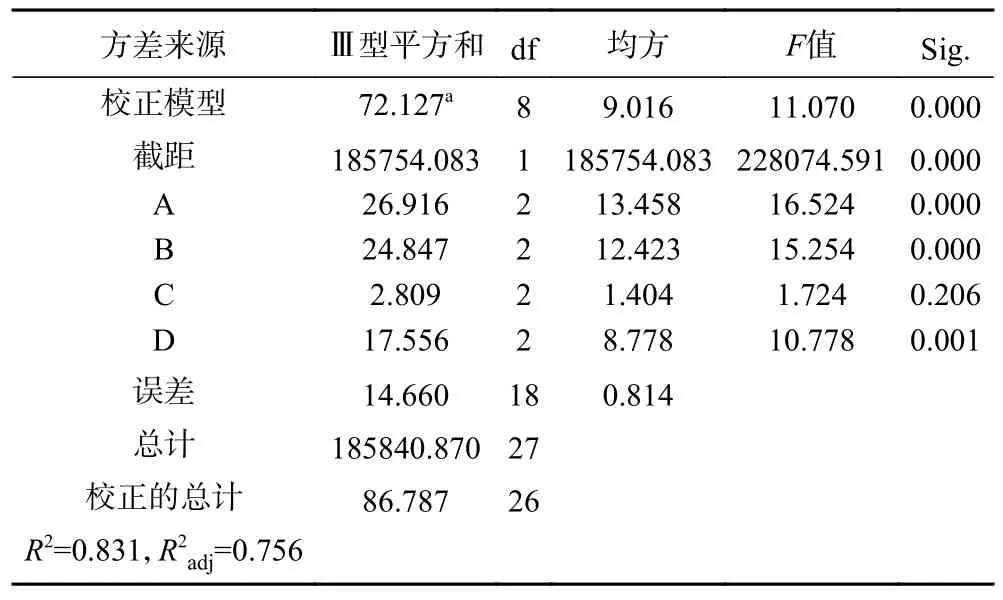
表7 正交试验方差分析(感官评分)Table 7 Anova of orthogonal experiments (sensory score)
2.3 乳酸菌发酵天麻口服液质量指标检测结果
实验测得乳酸菌发酵天麻口服液pH 为3.5,乳酸菌活菌数2×108CFU/mL,微生物指标:菌落总数<10 CFU/mL,大肠菌群、霉菌和酵母菌、金黄色葡萄球菌、沙门氏菌均未检出,符合GB/T 31326-2014《植物饮料》的相关标准。
3 讨论
纤维素和果胶是植物细胞壁的主要成分,前人研究发现纤维素酶和果胶酶能够破坏植物细胞壁的完整性[51]。另有研究表明天麻中含有大量酚类物质[2],食用时会有苦涩味。单宁酶在清除植物果实和皮衣中的苦涩味和改善食品原料的适口性方面具有良好的效果,同时可以提高游离氨基酸的得率[52]。天麻中支链淀粉的含量高达90%[53],α-淀粉酶对支链淀粉的酶解速率高于直链淀粉,支链淀粉平均链长更长的淀粉结构更利于经α-淀粉酶酶解[54]。因此,应用α-淀粉酶可以将天麻中的支链淀粉降解为麦芽糖和少量葡萄糖,水溶性增强[55]。目前酶解技术主要应用于提取天麻多糖,而在乳酸菌发酵前酶解天麻的研究鲜见报道。因此,基于多种酶复合使用可有效提升原料利用效率、利于发酵性物质溶出和改善风味的优势。赵敏等[56]制备天麻酵素研究中,采用热水搅拌和加纤维素酶的方法处理天麻原料。朱苗等[57]和李刚凤等[58]制备天麻复合植物饮料中,均采用85 ℃浸提20 min 制备天麻浸提液。与上述文献相比,本文采用酶法一步处理,具有工艺简单和节省能源的优势。以天麻单独为基质的发酵产品主要集中在多菌种复配酵素中,乳酸菌发酵天麻产品鲜见报道。已有研究证实植物乳植杆菌在石斛[59]、薏苡仁[60]、葛根[61]等药食同源药材中繁殖性能良好,可能是因为植物乳植杆菌能够耐受和代谢多酚类物质,有学者提出植物乳植杆菌通过对酚类物质的代谢也可能具有维护细胞能量平衡的作用[62]。此外,在纤维素酶和淀粉酶的作用下,天麻中的纤维素和淀粉分解产生的可发酵性糖可被植物乳植杆菌利用进行生长繁殖[63],进一步提高了植物乳植杆菌的发酵性能。本研究发现发酵时间是影响乳酸菌发酵天麻感官品质的主要因素,与范俊华等[64]结果一致。推测随着发酵时间的变化产生的酯类和醛类物质可能对乳酸菌发酵天麻口服液的风味品质形成发挥了重要作用[65],酶解与乳酸菌协同发酵可能有助于酯类等香气物质的产生而促进不良风味物质的转化[66]。在未来研究中,将对乳酸菌发酵天麻口服液的风味物质及功能性进行深入研究,为其产品应用提供理论支持。
4 结论
本文采用单因素实验和正交试验设计,确定了复合酶果胶酶、纤维素酶、单宁酶和ɑ-淀粉酶酶解天麻最佳工艺条件。本研究以自主分离的植物乳植杆菌STDA6 为接种菌剂,乳酸菌发酵天麻口服液的最佳工艺条件为:接种量1×105CFU/mL,发酵时间12 h,发酵温度37 ℃,蔗糖添加量10%,口感具有天麻的特征风味,酸甜比例适中,发酵酸味浓厚且柔和,细腻滑爽,植物乳植杆菌STDA6 活菌数平均值为2×108CFU/mL,pH3.5。与发酵0 h 的活菌数相比,植物乳植杆菌的数量增加了3.3 log CFU/mL,表明其在天麻酶解液中具有优良的增殖活性。

