纳米结构脂质载体制备及在功能食品中的应用研究进展
史凡,杨 红
(首都医科大学燕京医学院,北京 101300)
随着现代生活水平的提高,社会公众更加注重食品和疾病预防之间的关系,能够延缓慢性疾病发生的新型功能性食品越来越受欢迎。功能食品是除基本营养价值外还提供更多对健康有益处的食品[1]。如果单纯降低饮食中的脂肪,可能会导致脂溶性营养素缺乏,如人体必需的脂肪酸、类胡萝卜素、植物甾醇、脂溶性维生素等,因此有必要将这些生物活性化合物作为功能食品补充进人体[2]。传统载体系统由于稳定性差、易泄漏、粒子易发生沉降聚集、有机溶剂残留或不适合工业化生产等问题[3],在食品领域应用尚存在一定限制,但纳米结构脂质载体具有较高的载药量和包封率[4],可较好地解决类似问题。
纳米结构脂质载体(Nanostructured lipid carriers,NLCs)是在固体脂质纳米粒(Solid lipid nanoparticles,SLNs)的基础上发展起来的一种新型载体,采用混合脂质代替了SLNs 中的固体脂质作为载体,将常温下为液态的脂质加入到固态脂质中[5],晶体的混乱度增加,其承载药物的空间增大,使载体形成含纳米隔室的特殊脂质骨架[6]。系列研究表明,NLCs 对营养成分和生物活性物质的包裹和运载具有明显的优势,包括保护敏感的生物活性物质免受外界因素影响,解决水溶性低、生物相容性差等问题[7],增强稳定性而延长储存期限,改善在肠道的通透性并优化其生物利用度等[8]。
目前,国内外在食品方面对NLCs 的研究相对较少。本文系统梳理了NLCs 的结构特征、制备方法,及其在功能食品中作为一种新型传递系统的应用现状,可为NLCs 在功能食品中的进一步研究提供理论依据。
1 纳米结构脂质载体的结构特征
NLCs 采用固液混合脂质作为载体,不同比例的固液脂质,制备的NLCs 结构不同[9]。相比于SLNs,NLCs 由于其不完整结晶与无定形状态,更有利于活性成分的包载。NLCs 包载活性成分的结构主要分3 类[10],即缺陷型(Imperfect type)、无定型(Amorphous type)和复合型(Multiple type),如图1 所示。缺陷型NLCs 通过加入不同类型的脂质分子,打破了分子间紧密的排列,破坏高度有序的结晶结构,从而形成较大的空间容纳生物活性成分,提高溶解度,增加载药量。通常少量液态油与固体脂质相混合制备的NLCs 为此种类型[11]。无定形型NLCs 在制备过程中,会加入冷却过程中不产生结晶结构的特殊脂质如肉豆蔻酸酯等,长时间维持固体的无定形状态,避免了脂质重结晶而导致活性物质泄露,可通过差示扫描量热仪验证纳米粒是否结晶[12]。复合型NLCs 的固体脂质中包含了十分微小的液态油纳米隔室,是由固体脂质混合大量的液体油而制成的,这种结构可显著提高生物活性成分在纳米粒子中的溶解度[13]。生物活性物质在纳米载体中的分布能显著影响释放效果[14],即NLCs 的结构与环境不同,生物活性物质在纳米粒子中的分布不同,纳米粒子与角质层中类脂间的相互作用不同,生物活性物质的靶部位也就不同,进而对吸收产生不同的影响。
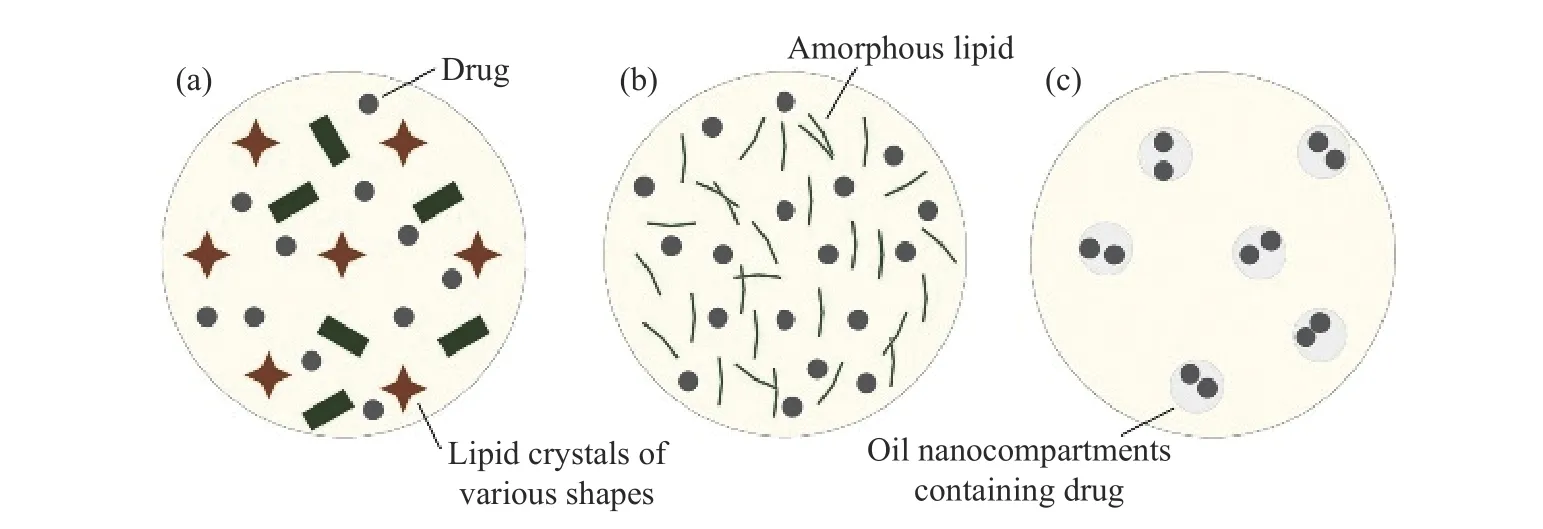
图1 NLCs 类型Fig.1 NLCs types
2 纳米结构脂质载体的制备方法
NLCs 的制备方法与SLNs 相似,主要包括热或冷高压均质法、溶剂扩散法、溶剂蒸发法、溶剂注入/溶剂置换法、微乳法、乳化超声法、薄膜接触器法、相转化技术、超临界流体技术等[15−16]。但是,这些方法大多都有缺点,例如热高压均质法在均质化过程中无法避免温度升高,不适用于对热敏感的药物[17],溶剂扩散法、溶剂蒸发法和溶剂注入/溶剂置换法存在有机溶剂残留导致毒性问题等[18],使NLCs 在食品工业中的应用复杂化。在实际工业生产和研究中,通常根据活性物质、载体基质的性质以及所需的加工参数,选择合适的制备NLCs 的方法。表1 全面总结了各种方法的操作流程和主要优缺点。
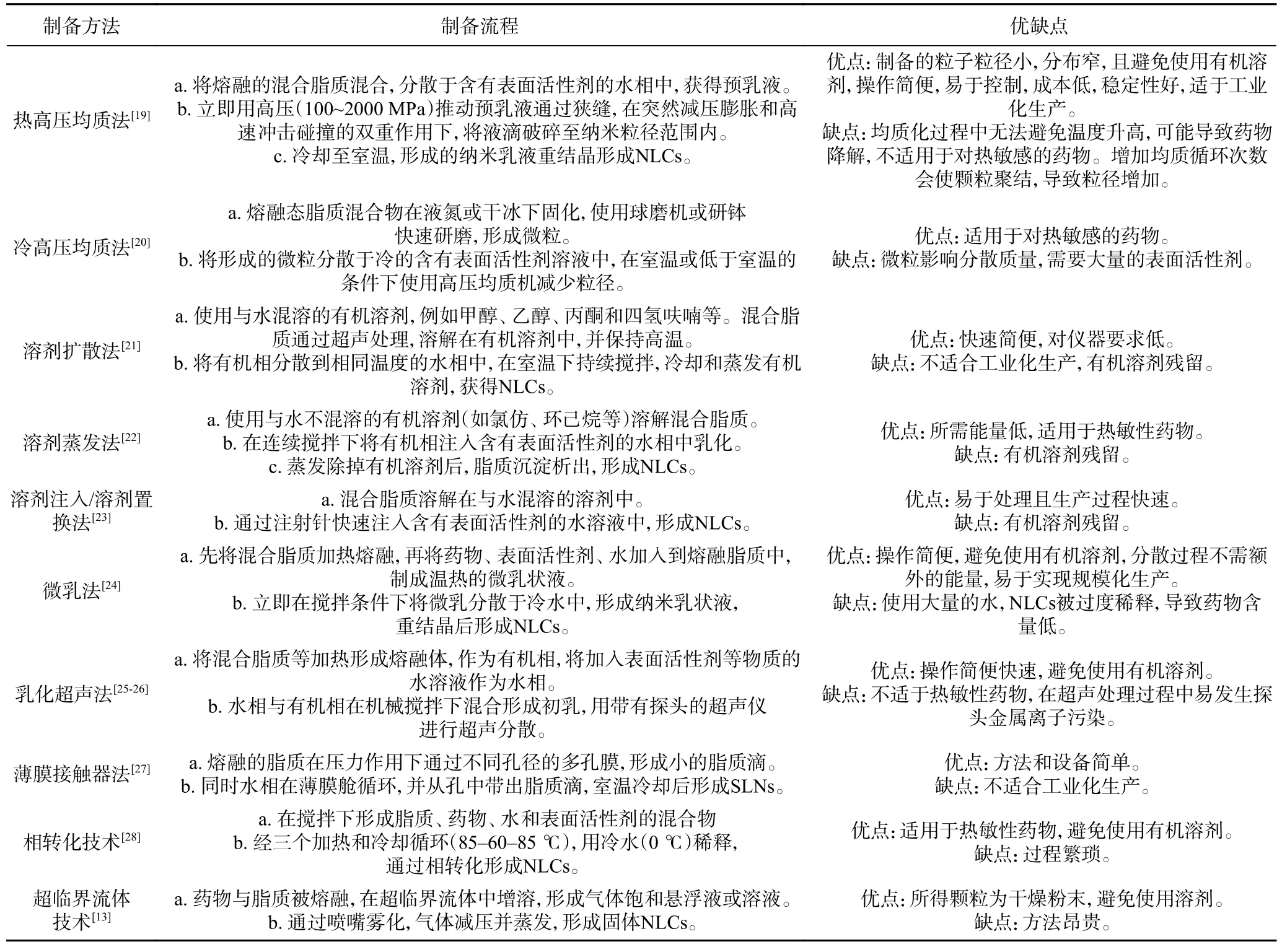
表1 NLCs 的制备方法Table 1 Methods for the production of NLCs
3 纳米结构脂质载体在功能食品中的应用
由于生物活性物质的一些理化性质,如水溶性低,化学稳定性差,高熔点或生物利用度低,难以直接掺入食品中,需要合适的载体系统包裹。NLCs 特别适用于将亲脂性活性物质包载入食品和饮料中,在人体胃肠道消化过程中起到保护、增溶、缓控释以及提高生物利用度的作用[29]。
3.1 必需脂肪酸
ω-3 脂肪酸是主要的必需脂肪酸,在人类饮食中有益于保持大脑和心血管健康,在调节脂质代谢、减轻炎症反应、降低自身免疫性疾病及癌症风险等方面发挥重要的作用[30],主要包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。ω-3 脂肪酸不能被人体合成,必须从食物中摄取,但由于其易于氧化降解,易变质且产生不良气味,限制了其在功能性食品的应用[31],因此需要选择合适的封装方式,保护它们免受氧化降解,掩盖不良气味。磷虾油中富含长链ω-3多不饱和脂肪酸,Zhu 等[32]使用棕榈油硬脂作为固体脂质,卵磷脂作为表面活性剂,制备了含有高含量磷虾油的NLCs,包封率高达96%。研究结果显示,载体化的磷虾油暴露于紫外线后受光的氧化减弱,物理和化学稳定性提高,克服了将磷虾油用于功能性饮料等食品的局限性。另外有研究发现,同时包载两种或多种双亲性物质,更有助于提高NLCs 的稳定性,Shahparast 等[33]选取了富含ω-3 脂肪酸的鱼油和α-生育酚两种活性物质作为包埋对象,采用熔融后乳化超声法制备出二者共包封的NLCs,研究显示载体化的α-生育酚具有更好的抗氧化活性,有效延缓了ω-3 脂肪酸的氧化。
3.2 类胡萝卜素
类胡萝卜素是一类种类繁多、具有多种功能的天然色素,含丰富类胡萝卜素的食品和饮料可以减少某些慢性疾病的发生[34]。但是,由于类胡萝卜素较高的疏水性,在人体消化环境中溶解度差,容易析出结晶,降低了机体对它的吸收[35],在很大程度上限制了类胡萝卜素在功能食品领域的应用[36]。研究发现,构建合适的纳米载体可有效改善类胡萝卜素的生物利用度并起到缓释作用,Rohmah 等[37]采用热高压均质法制备了载有β-胡萝卜素的NLCs。通过体外胃肠消化模型发现,NLCs 增强了β-胡萝卜素的生物利用度和抗氧化活性,可用于递送β-胡萝卜素等亲脂生物活性物质至饮料食品中。Shu 等[38]采用超高压均质法,由鼠李糖脂作乳化剂制备了载有叶黄素的NLCs,包封率可达94.73%。在体外胃肠消化研究中,NLCs 中叶黄素的释放率在3 h 时为50.87%±1.72%,表现出较好的稳定性,并持续释放叶黄素,相比游离叶黄素的生物利用度(5.29%±0.70%),载体化的叶黄素生物利用度可达到23.01%±0.62%。
3.3 植物甾醇
植物甾醇是一种存在于植物中的天然活性物质,因其与胆固醇有着极为相似的结构,可通过抑制饮食中胆固醇的吸收进而降低人体内总胆固醇和低密度脂蛋白的含量,被认为是治疗和预防高血脂症的最佳天然物质[39]。但由于植物甾醇不溶于水,熔点高,且加入食品过程中易氧化[40],不易在食品中应用。研究发现,构建合适的纳米载体可增加植物甾醇的水溶性,提高其稳定性,Valeria 等[41]以高油酸葵花籽油、全氢化菜籽油和克拉姆贝油为原料,采用高压均质法制备植物甾醇NLCs。在60 d 的稳定性研究中,植物甾醇NLCs 的粒径变化范围为148.23~342.10 nm,多分散指数变化范围为0.275~0.481,Zeta电位变化范围为−22.27~−29.70 mV,表现出较好的物理稳定性。怀其彤等[42]通过高压均质法采用核桃油为液体脂质制备用于封装、保护植物甾醇NLCs,物理稳定性试验结果发现植物甾醇和核桃油复配的NLCs 在4 ℃下储藏28 d 稳定性良好,使用时可以在5~100 倍之间进行稀释,具有良好的稀释稳定性,且添加2%的蔗糖可以提高冻干稳定性。
3.4 脂溶性维生素
脂溶性维生素主要包括维生素A、D、E、K 4种[43],与人类的健康密切相关[44],但水溶性差且容易被氧化破坏,口服生物利用度较低[45],因此通过纳米制剂技术将其封装稳定化,具有重要的意义。Akram等[46]通过热均质法制备了载有维生素A 棕榈酸酯的NLCs。以Preciol 作为固体脂质,辛基辛酸酯为液相脂质,泊洛沙姆作为表面活性剂,制备的NLCs包封率为98.5%,能够在25 ℃下稳定保存两个月,提高了维生素A 在水溶液中的分散性与稳定性。Sung 等[47]使用油酸和单硬脂酸甘油酯通过热高压均质化成功地制备了载有维生素D3的NLCs。稳定性实验(20 d)显示维生素D3NLCs 仍具有较高的包封率(85.6%),说明载体化的维生素D3均匀分散在脂质基质中,在贮藏过程保持稳定未发生絮凝或沉降。模拟胃肠道消化实验中,维生素D3NLCs 在模拟胃液中能够保持稳定,在模拟肠液中消化8 h 后维生素D3可释放90%以上,显示出维生素D3NLCs的缓控释效果。
3.5 多酚类化合物
多酚类化合物是一类复杂的具有多个酚羟基的次级代谢产物,是植物体内非常重要的生物活性化合物[48],具有很强的抗氧化性、抑菌性、抗癌性、抗炎性及抗肥胖作用[49],且对调节血糖血脂均具有较高的生理活性[50]。但由于不稳定性与亲脂性[51],限制了多酚类化合物的广泛应用。Izza 等[52]研究了多酚(白藜芦醇、山奈酚和槲皮素)载入NLCs 的稳定性和抗氧化活性,制备的样品粒径和分布均适合口服递送系统应用,且保存2 个月后表现出良好的稳定性。通过测定对自由基的清除能力,发现与游离多酚相比,载体化多酚的抗氧化活性明显提高。Huang等[53]通过高压均质技术将槲皮素和亚麻籽油共同包载于NLCs 中,研究表明槲皮素在由亚麻籽油和表面活性剂组成的亲水性基质中的溶解度提高了至少1300 倍,在25 ℃下可稳定存储3 个月以上,同时亚麻籽油的添加也改善了槲皮素的体外抗氧化活性。
3.6 其他营养素
除以上生物活性化合物外,仍有大量研究证明NLCs 在功能食品中的广泛应用,例如使用由棕榈酸十六烷基酯和椰子油制备的NLCs 作为载体可以提高辅酶Q10 对皮肤的抗炎活性[54]。用可可脂和橄榄油制备的豆蔻精油NLCs,能够提高豆蔻精油的物理化学稳定性及抗菌活性等[55]。采用椰子中碳甘油三脂制备的姜黄素NLCs,改善水溶性,提高生物利用度和储存稳定性[56]。
4 结论与展望
总而言之,NLCs 作为一种新型传递系统,在功能食品的应用具有明显优势,包括保护包埋在内的生物活性物质,抵抗外界因素干扰,控制释放,以及提高生物利用度等。除此之外,NLCs 也具备一些其他传统剂型无法替代的优势:a.制备材料可选自FDA 和/或EMA 批准的食品级表面活性剂和脂质,具有较好的生物相容性和可降解性,不会对人体造成毒害作用[57]。b.制备过程中可以喷雾干燥或冻干,避免发生沉降及分层现象,增加稳定性延长储存期限。c.在释放调节方面更具有灵活性,适用于与定时或定位有关的快速释放、持续释放、延迟释放和定位释放等。由于NLCs 在包封营养成分和生物活性物质上凸显的优势,使越来越多的研究者意识到在功能食品领域,NLCs 巨大的应用潜力和发展前景。
然而NLCs 在功能食品中的研究还处于一个相对初级的发展阶段,在理论和应用方面都需要进行更深入的研究,例如:a.与掺入食品的相容性,对其外观、风味、质地和保质期没有不利影响。b.在选材方面必须仔细选择和优化固体脂质,去除或减少不利于人类健康的饱和脂肪酸、胆固醇等食品成分。c.NLCs 应用到功能性食品,食品原材料制备成纳米级别时,相应的物理和化学性质以及在胃肠道中的传递过程也会有所改变,因此对其安全性的研究也是后续需要完善解决的问题。d.NLCs 的产业化效果不理想,目前只有高压均质法可以大批量生产,其他制备方法还只是停留在实验室水平,无法实现从基础研究到产业化的顺利转化,因此更加简便高效的制备方法仍需进一步探索。
随着食品工业领域更多相关研究的开展,相信NLCs 在功能食品中将会得到更加广泛的应用。

