艾叶多糖明胶微球的制备及其体外释放性能
王云鹏,张晓苗,谢卫红,张 毅,
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068;2.发酵工程教育部重点实验室,湖北武汉 430068)
艾叶为菊科草本植物艾蒿(Artemisia argyiLevl.et Vant.)的干燥叶,临床用于温经止血、宫冷不孕等[1]。艾蒿的资源分布是主要在北温带地区,特别是亚洲、欧洲和北美[2]。艾叶在我国分布也十分广泛,主要分布于湖北、河南、湖南、安徽、山东、河北等地[3]。目前从艾叶中发现多种天然成分,包括精油、黄酮、酚酸及多糖[4−8]。艾叶多糖是艾叶的主要功能活性成分之一,并被证实具有多种药理功效,包括抗氧化[9]、调节免疫[10−11]、降血糖[12]、抗肿瘤[13−14]等药理作用,具有极大的开发潜力。但艾叶多糖易吸收水分,从而导致潮解、流动性降低等变化限制了其应用[15]。因此可通过将其微囊化,改善其粉体学性质,提高稳定性和生物利用度,拓展艾叶多糖的应用。
多糖的微囊化已得到了广泛的应用。钟诚等[16]以海藻酸钙作为壁材包埋枸杞多糖,利用静电液滴法制备出枸杞多糖凝胶微球,发现与单独的枸杞多糖相比,经包埋后的枸杞多糖对骨质疏松小鼠起到更好的治疗作用,延缓枸杞多糖在胃肠道的时间,提高了生物利用度,进而提高药效。Niu 等[17]以麦芽糖糊精和乳清蛋白为壁材包埋银耳多糖,利用喷雾干燥法制备了银耳多糖微囊,不但改善了银耳多糖的吸湿性和结块情况,提高了其稳定性,而且未影响其治疗糖尿病的功效。
明胶是由胶原部分水解而得到的一类蛋白质,大多用于缓释载体材料[18]。以明胶为载体的微球剂的制备,可提高药物的稳定性并且具有缓释作用,具有很好的应用前景[19]。本课题组研究表明,从艾叶中提取的多糖具有良好的抗氧化活性,具有抑制α-葡萄糖苷酶和α-淀粉酶的活性[20]。目前,国内外未见以明胶作为包材将艾叶多糖微囊化的相关研究。基于此,本研究以乳化-化学交联固化法将艾叶多糖制成明胶微球,以期提高其稳定性,开发成具有缓释作用,肠溶性良好,生物利用度高的新产品。利用响应面分析法优化制备工艺,表征其结构,验证其缓释性能,为艾叶多糖调节血糖功能产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
干燥艾叶 湖北蕲阳河蕲艾科技有限公司;DEAE 纤维素-52 柱层析,上海源叶生物科技有限公司;明胶 分析纯,天津市科密欧化学试剂有限公司;蒽酮 分析纯,上海麦克林生化科技有限公司;三氯乙酸 分析纯,上海源叶生物科技有限公司;span85 分析纯,上海旭硕生物科技有限公司;液体石蜡、无水乙醇(均为分析纯)、25%戊二醛(生化试剂)国药集团化学试剂有限公司。
R-1001VN 旋转蒸发仪 郑州长城科工贸有限公司;F-020S 超声仪 深圳福洋科技集团有限公司;EPOCH 超微量分光光度计 美国伯腾仪器有限公司;JSM-6390LV 扫描电子显微镜 日本电子株式会社;Mastersizer3000 激光粒度仪 英国马尔文仪器有限公司;RC806D 溶出仪 天津天大天发科技有限公司。
1.2 实验方法
1.2.1 艾叶总多糖提取工艺 称取一定量的艾叶,以1∶30(g/mL)的质量比加入去离子水,搅拌后置于4 ℃冰箱内12 h,以使水溶性成分更充分的溶出。然后将混合物超声30 min,功率为200 W。水浴80 ℃加热2 h,经纱布粗滤后再抽滤,收集滤液进行旋蒸浓缩得到粗提物,加入4 倍体积的无水乙醇,4 ℃醇沉12 h 后6000 r/min 离心10 min 取沉淀,用少量去离子水溶解沉淀,再加入等体积的10%三氯乙酸脱蛋白,离心后取上清液再醇沉后用2000 Da 透析袋透析36 h,冷冻干燥后得到艾叶总多糖[20]。
1.2.2 艾叶多糖的分离纯化 称取一定量的艾叶总多糖在去离子水中溶解,用0.45 μm 微孔滤膜过滤,采用DEAE 纤维素-52 层析柱(200×10 mm)分离纯化,分别用去离子水、0.1、0.3 和0.5 mol/L 的NaCl溶液逐级洗脱,流速为1.0 mL/min[21]。纯化样品经浓缩后用2000 Da 透析袋透析48 h 并冻干。四种组分命名为AAP1、AAP2、AAP3、AAP4。实验室前期研究表明AAP4 相较于其他组分对α-葡萄糖苷酶和α-淀粉酶抑制活性较好[20],所以选择AAP4 作为包封对象。
1.2.3 艾叶多糖(AAP4)-明胶微球的制备 釆用乳化交联法制备微球[22],即称取一定量的明胶溶于适量去离子水中,加入艾叶多糖溶液充分混匀制成水相溶液并加热至60 ℃充分混匀。滴加少量span85 于液体石蜡中制成油相,转速900 r/min 的条件下,将水相加到油相中,30 min 充分乳化后冷却至4 ℃以下搅拌,加入1%戊二醛固化2 h 后离心,用乙醇洗涤沉淀残留的液体石蜡和交联剂,60 ℃恒温干燥即得微球。以上方法可加入等量去离子水代替多糖样品作为实验的空白对照。
1.2.4 单因素实验
1.2.4.1 多糖浓度对微球包封率及载药量的影响 称取4 份1.00 g 明胶,分别溶于10 mL 水中使其质量分数为10%,再分别加入10、50、100、150、200 mg艾叶多糖,使多糖浓度分别为1、5、10、15、20 mg/mL,并搅拌均匀制成水相。在液体石蜡中加入1.4%的乳化剂制成油相,以4:1 的油水比混合两相。依据1.2.3 工艺固化洗涤后,考察微球的包封率和载药量的变化。
1.2.4.2 明胶质量分数对微球包封率及载药量的影响 称取0.8、1.0、1.2、1.4 g 的明胶分别溶于10 mL的去离子水中,使其质量分数为8%、10%、12%、14%。并加入100 mg 艾叶多糖使其浓度为10 mg/mL。在液体石蜡中加入乳化剂浓度为1.4%,依据1.2.3 的工艺,按照油水比为4:1 的比例进行油相水相的混合、交联固化、洗涤后,考察微球的包封率和载药量的变化。
1.2.4.3 油水比对微球包封率及载药量的影响 固定10%明胶和10 mg/mL 的艾叶多糖,60 ℃下混合制成水相。液体石蜡中加1.4% span85 制成油相并按照油水比2:1、3:1、4:1、5:1 的比例混合,依据1.2.3 的工艺固化洗涤后,考察油水比对制备微球的包封率和载药量的影响。
1.2.4.4 乳化剂浓度对微球包封率及载药量的影响 固定10%明胶和10 mg/mL 的艾叶多糖,60 ℃下混合制成水相。液体石蜡中分别加入0.8%、1.0%、1.2%、1.4% span85 制成油相、按照油水比4:1 的比例混合,依据1.2.3 的工艺固化洗涤后,考察乳化剂浓度对微球包封率和载药量的影响。
1.2.5 响应面试验 依据单因素实验,以包封率、载药量为响应值,选择影响较为显著的三个因素,即多糖浓度、明胶质量分数、油水比。采用Box-Behnken响应面优化制备工艺[23]。因素与水平设计见表1。
1.2.6 包封率与载药量测定 称取100 mg 艾叶多糖-明胶微球,加入10 mL 去离子水超声60 min,90 ℃加热回流5 h,取上清液用0.22 μm 微孔滤膜过滤,利用蒽酮-硫酸法[24]测定多糖含量,绘制标准曲线,拟合标准曲线为y=3.71806x+0.00827,R2=0.9962,求出艾叶多糖含量,为消除干扰,以空白微球做对照,利用公式计算多糖含量、包封率和载药量,其公式如下:
式中:C 为标曲计算多糖浓度,mg/mL;V 为溶解多糖溶剂体积,mL;m 为称取多糖质量,mg;C1为标曲计算微球中多糖浓度,mg/mL;V1为分散微球溶剂体积,mL;n 为检测微球中多糖含量时稀释倍数;m1为称取微球中多糖的理论质量,mg;m2为称取微球质量,mg。
1.2.7 艾叶多糖明胶微球表征
1.2.7.1 微球形貌观察 取适量微球,加入无水乙醇超声分散10 min。吸取适量混悬液在硅片上,挥干后进行喷金处理后扫描电镜观察,加速电压为15 kV。
1.2.7.2 微球粒径测定 取少量微球加入无水乙醇超声10 min 分散均匀,使用激光粒度分析仪进行粒径测定明胶微球平均粒径和粒度分布,折射率为1.38,温度25 ℃。
1.2.8 体外释放度测定 依据2020 版《中国药典》进行溶出度与释放度测定[25]。称取适量艾叶多糖明胶微球,以pH2.5 和pH7.4 磷酸盐缓冲液为释药介质,在37 ℃,转速100 r/min 条件下进行体外释放度实验。在0.5~12 h 内取样。釆用蒽酮-硫酸法测定不同时间多糖的含量。
1.2.9 微球释放多糖对α-葡萄糖苷酶和α-淀粉酶活性的抑制效果 称取30 mg 微球,参照1.2.8 方法,分别取释放上清液过0.45 μm 的微孔滤膜。参照文献[26−27]的方法测定释放的艾叶多糖对α-葡萄糖苷酶和α-淀粉酶的抑制率,并以1.5 mg/mL 的艾叶多糖作为对照组。
1.3 数据处理
平行实验均重复3 次,采用Excel 和IBM SPSS Statistics 26 进行数据处理,采用Origin 2019b 和Design-Expert 13 进行数据处理及绘图。
2 结果与分析
2.1 艾叶多糖层析柱分离效果
用DEAE 纤维素-52 色谱柱纯化多糖,NaCl 溶液浓度梯度(0~0.5 mol/L)洗脱粗多糖。如图1 所示,观察到4 个峰,表明成功分离了4 个不同的组分。
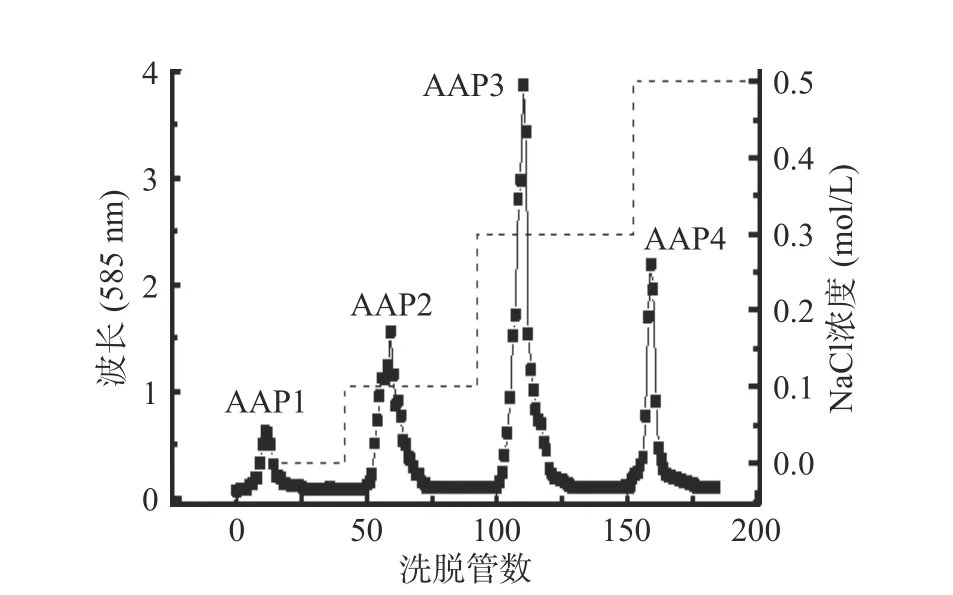
图1 艾叶多糖DEAE-52 纤维柱色谱图Fig.1 The DEAE-52 cellulose column chromatograms of Artemisia argyi polysaccharide
2.2 艾叶多糖明胶微球制备工艺单因素实验结果
2.2.1 多糖浓度对微球包封率及载药量的影响 由图2 可知,1~15 mg/mL 时包封率和载药量逐渐增加。当多糖浓度达到15 mg/mL 时,微球的包封率和载药量达到了最高分别为64.14%和9.56%。当在20 mg/mL 时,包封率出现下降,载药量保持升高,分别为60.33%和12.06%。而在15 和20 mg/mL 时包封率已无显著性差异(P>0.05),这是由于当多糖浓度达到一定浓度时,多糖的量相对于明胶过量,明胶包覆能力有限,使得包封率下降[28]。选择多糖浓度5、10、15 mg/mL作为响应面考察水平。
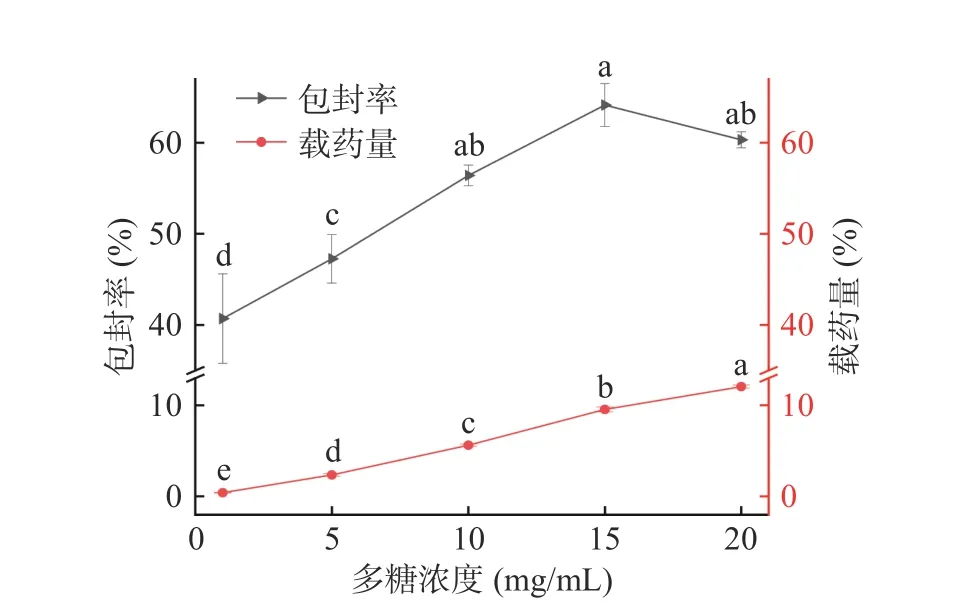
图2 多糖浓度对微球包封率、载药量的影响Fig.2 Effect of polysaccharide concentration on encapsulation efficiency and drug loading of microspheres
2.2.2 明胶质量分数对微球包封率及载药量的影响 由图3 可知,当明胶质量分数为8%时,微球的包封率和载药量分别为39.33%和4.92%。随着明胶质量分数增大,包封率和载药量呈现先升高后降低的趋势。当明胶质量分数达到10%时,微球的包封率和载药量分别为56.41%和5.64%。当质量分数达到12%时出现下降,且包封率已无显著性差异(P>0.05),与14%有显著性差异(P<0.05)。原因可能是明胶质量分数过高,使粘度增大导致微球球形变差,进而微球的包封率和载药量下降[29]。明胶质量分数的变化对工艺中微球的成形有较大程度的影响,由于在8%时包封率与载药量过于偏低,因此选择10%、12%、14%作为响应面考察水平。
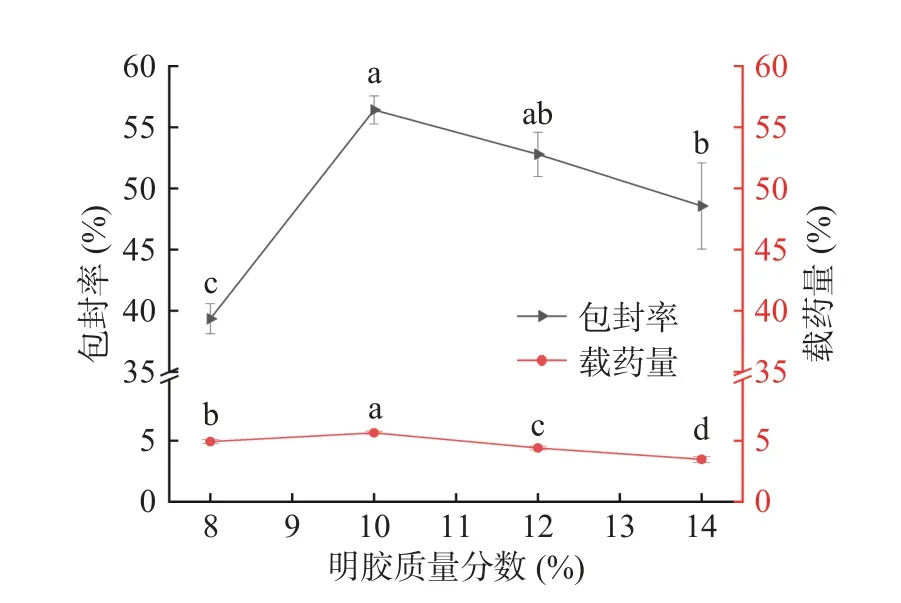
图3 明胶质量分数对微球包封率、载药量的影响Fig.3 Effect of gelatin mass fraction on encapsulation efficiency and drug loading of microspheres
2.2.3 油水比对微球包封率及载药量的影响 如图4所示,随着油水比值的增加,包封率和载药量逐渐上升。当油水比为2:1 时,微球的包封率和载药量分别为45.76%和3.74%。当油水比为4:1 时达到最大值,包封率和载药量分别为56.41%和5.64%。当油水比达到5:1 时,包封率和载药量显著下降(P<0.05)。原因可能是油相体积越大,乳滴分散情况越充分,油相较多时导致样品未能与明胶结合使包封率和载药量降低[30]。选择油水比3:1、4:1、5:1 作为响应面考察水平。
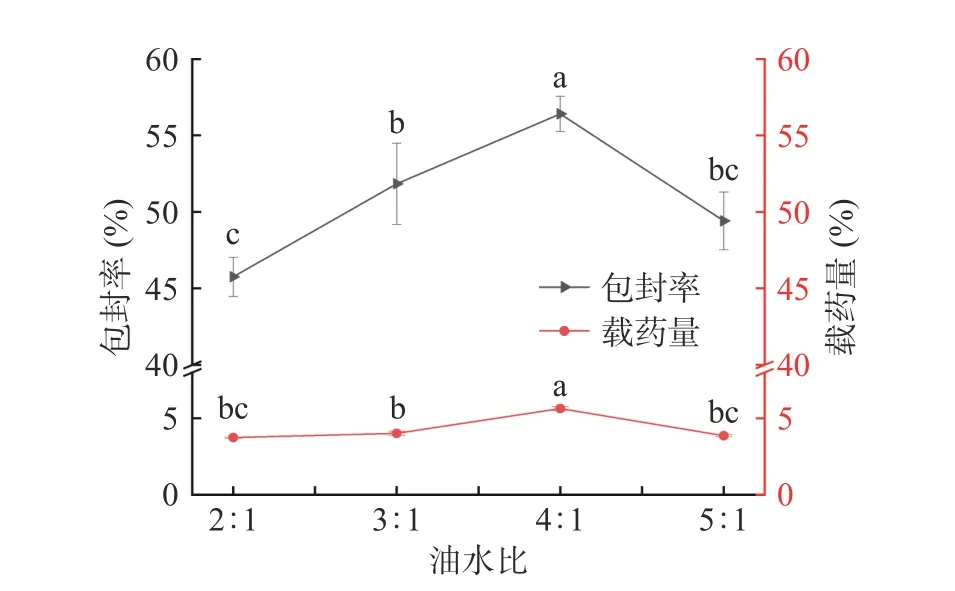
图4 油水比对微球包封率、载药量的影响Fig.4 Effect of oil-water ratio on encapsulation efficiency and drug loading of microspheres
2.2.4 乳化剂浓度对微球包封率及载药量的影响 如图5 所示,当乳化剂浓度为0.8%时微球的包封率和载药量分别为49.18%和4.92%。随着乳化剂浓度的增高,包封率与载药量逐渐增加。当浓度为1.2%时达到极值,包封率和载药量分别为58.12%和5.81%,随后包封率随浓度增加而下降。推测乳剂用量过高会增大药物在外水相中的溶解度[29],导致包封率下降。当乳化剂用量少时,乳液体系形成的界面膜不饱和,导致乳液体系不稳定,包封率降低。确定其最佳浓度为1.2%。由于乳化剂浓度的影响的显著性小于其他因素,所以不作为响应面试验的考察因素。
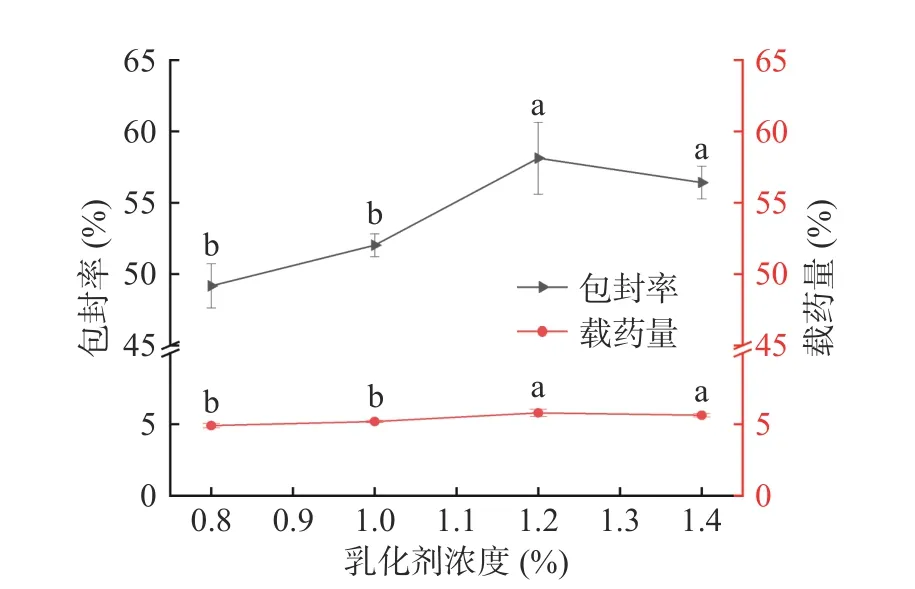
图5 乳化剂浓度对微球包封率、载药量的影响Fig.5 Effect of emulsifier concentration on encapsulation efficiency and drug loading of microspheres
2.3 响应面试验结果分析
根据单因素实验结果,选取对艾叶多糖明胶微球性质影响较为显著的3 个因素即多糖浓度、明胶质量分数、油水比。利用软件Design-Expert 13 对选取的3 个因素进行分析。试验的设计及结果见表2。并以表2 建立回归模型拟合得的回归方程为:
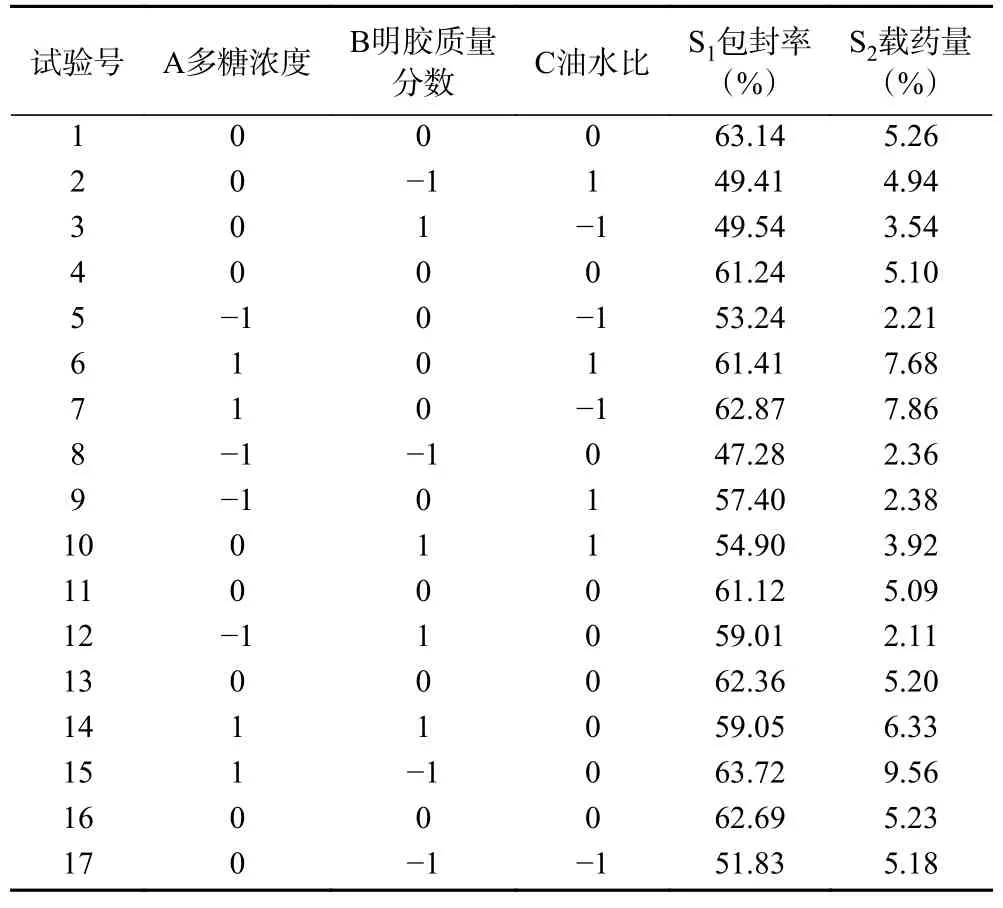
表2 响应面因素设计及结果Table 2 Experimental design and results for response surface analysis
S1=−257.355+5.811A+37.31625B+28.745C−0.41AB−0.281AC+0.9725BC+0.0493A2−1.51937B2−4.6125C2(R2=0.9316,P<0.0001)
S2=−20.4245+1.30265A+2.22175B+2.6125C−0.0745AB−0.0175AC+0.0775BC+0.0113A2−0.090437 B2−0.41925C2(R2=0.9981,P<0.0001)
由表3、表4 可知,两个拟合方程中一次项中A(多糖浓度)、B(明胶质量分数)均为极显著因素(P<0.01),C(油水比)为不显著因素(P>0.05);二次项中S1(包封率)拟合方程A2为显著(P<0.05)、B2和C2为极显著(P<0.01),S2(载药量)拟合方程A2、B2和C2均为极显著(P<0.01);S1和S2中AB 交互作用均为极显著(P<0.01)。S1中BC 交互作用极显著(P<0.01)、AC 交互作用显著(P<0.05),S2中AC 和BC 交互作用不显著(P>0.05)。S1、S2方差分析表中的模型P<0.0001,失拟项P值分别为0.4165 和0.0520,皆大于0.05,不显著,说明模型拟合度较好。由表中回归系数显著性检验结果可知,对S1和S2的影响大小顺序如下:多糖浓度、明胶质量分数、油水比。
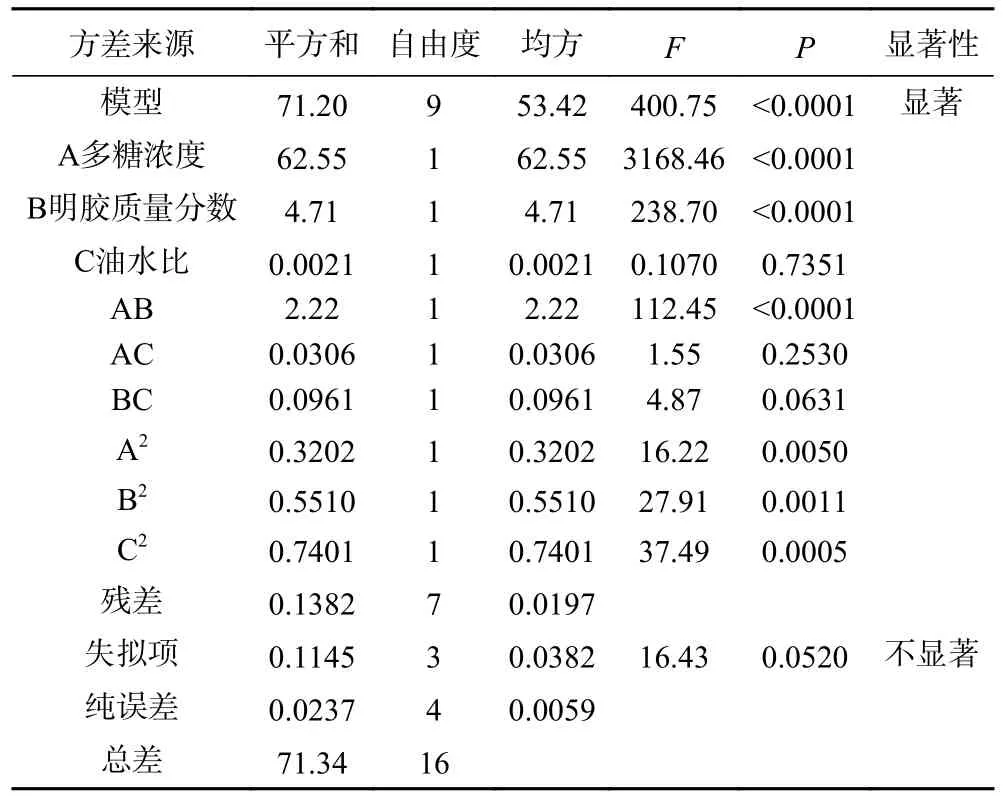
表4 载药量回归模型方差分析结果Table 4 Results of variance analysis of drug loading regression model
通过Design-Expert13 软件利用包封率和载药量为响应值得出各个因素交互作用的三维响应面图(图6)。如图6a 所示,当固定油水比时,随着多糖浓度的升高响应值出现逐渐升高的趋势,随着明胶质量分数的升高响应值呈先上升后下降的趋势,从等高线可知多糖浓度的影响最大。图6b 显示,当明胶质量分数固定时,随着多糖浓度的升高响应值出现逐渐升高的趋势,随着油水比的升高响应值呈先上升后下降的趋势,从等高线上可以看出多糖浓度相比油水比对总评值的影响高。图6c 显示,当多糖浓度固定时,随着明胶质量分数和油水比升高响应值呈先升高后下降的趋势,但从等高线上可以看出明胶质量分数相比油水比对响应值的影响更高。因此对响应值影响最高的是多糖浓度,其次是明胶质量分数,油水比的影响相对不显著,这与回归方程显著性检验结果相同。通过软件模拟,最终筛选出的最优处方为:艾叶多糖浓度15 mg/mL、明胶质量分数10.20%、油水比3.77:1;考虑到实际情况,将油水比修改为3.8:1,其余因素按最优处方制备艾叶多糖明胶微球,按照最佳工艺重复3 次实验,结果显示包封率和载药量分别为63.80%和9.38%。包封率和载药量的预测值分别为63.67%和9.50%,预测定值相比误差均小于0.05,表明模型具有较好的预测能力。
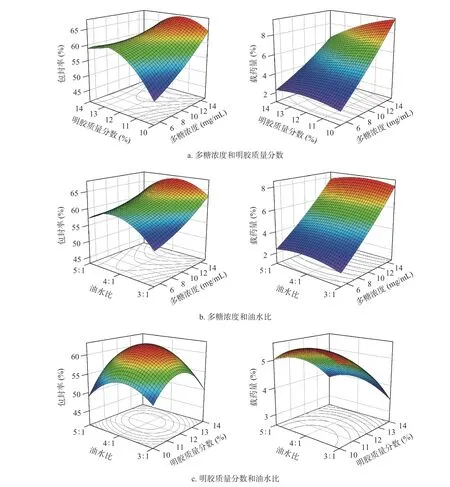
图6 各因素交互作用响应面图Fig.6 Response surface diagram of interaction of various factors
2.4 微球形态观察与粒径测定
依据最优的制备工艺制备的艾叶多糖微球为棕黄色粉末。由图7 所示,微球形态圆整,表面相对光滑。图8 为微球粒径分布图,微球平均粒径为59.593 μm,跨距(span)为1.755,粒径跨度较小。相比于费文玲等[31]制备的绿原酸明胶微球粒径为36 μm 较大,其搅拌速度为1220 r/min,可能是由于本实验转速过低引起的粒径较大[32]。

图7 艾叶多糖明胶微球扫描电镜图Fig.7 Scanning electron microscopy of Artemisia argyi polysaccharide gelatin microspheres
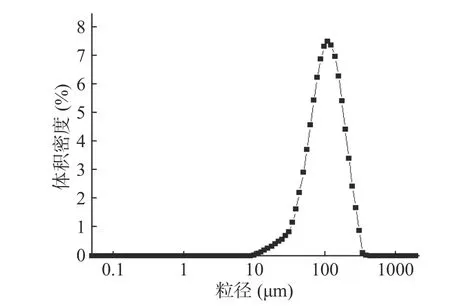
图8 粒径分布图Fig.8 Particle size distribution map
2.5 体外释放实验
由表5、表6 可知,在零级、一级、Higuchi 模型拟合中,艾叶多糖明胶微球的释放与一级动力学模型拟合度高。累积释药曲线如图9 所示,艾叶多糖-明胶微球在酸性条件下(pH2.5)释放较缓;在酸性条件下艾叶多糖明胶微球0.5 h 药物释放达30%以下,4 h 后药物释放达60%以上,而在pH7.4 条件下0.5 h药物释在40%左右,4 h 后药物释放达80%以上,即明胶微球对艾叶多糖具有一定的缓释作用并具有良好肠溶性。
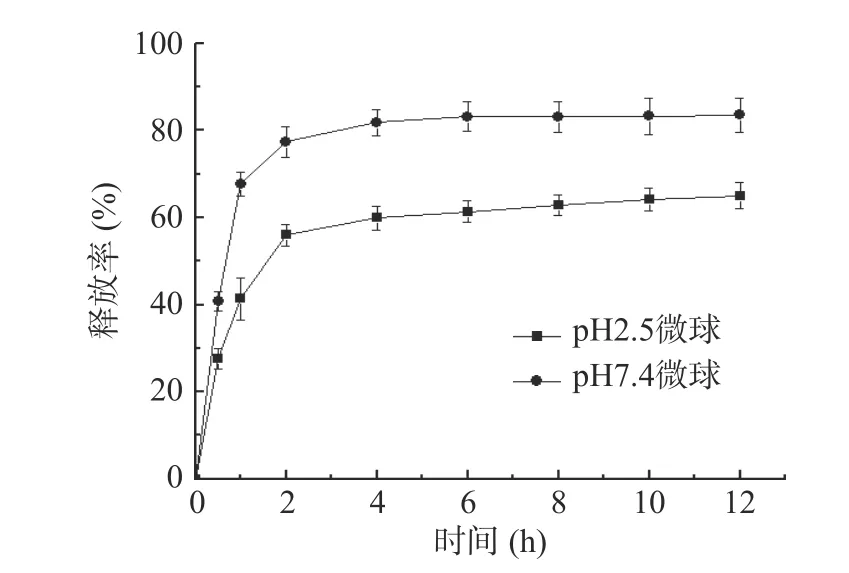
图9 艾叶多糖明胶微球体外释药曲线Fig.9 In vitro drug release curve of Artemisia argyi polysaccharide gelatin microspheres

表5 在pH2.5 释放介质中释药曲线拟合结果Table 5 Release curve fitting results in pH2.5 release medium

表6 在pH7.4 释放介质中释药曲线拟合结果Table 6 Release curve fitting results in pH7.4 release medium
2.6 α-葡萄糖苷酶和α-淀粉酶活性抑制实验结果
由图10 可知,在pH7.4 中释放介质中抑制活性要高于在pH2.5 的释放介质中。这可能是由于在pH7.4 的释放介质中释放的多糖含量更高[33],这可以进一步说明艾叶多糖明胶微球具有一定的肠溶性。同时取pH7.4 的释放上清液,测其最终多糖释放含量约为1.5 mg/mL。单独称取1.5 mg/mL 的艾叶多糖作为对照,在pH7.4 释放介质中,微球释放多糖对α-葡萄糖苷酶和α-淀粉酶的抑制率分别为31.31%和17.15%,多糖对两种酶抑制率分别为34.13%和18.05%,抑制活性无显著性差异(P>0.05)。说明艾叶多糖被明胶包覆后不会影响其活性。
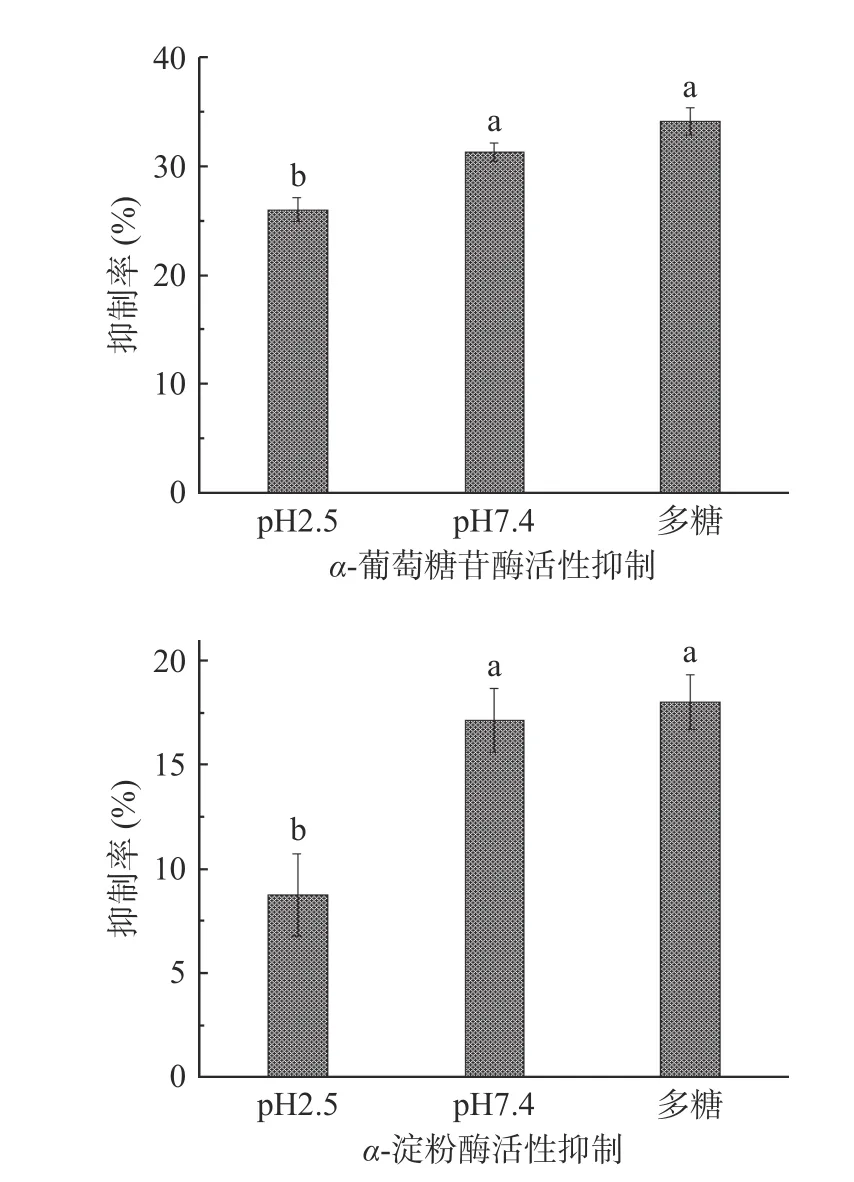
图10 α-葡萄糖苷酶和α-淀粉酶活性抑制实验结果Fig.10 Experimental results of α-glucosidase and α-amylase activity inhibition
3 结论
通过DEAE-52 纤维素分离得到的4 种多糖组分(AAP1、AAP2、AAP3、AAP4),以AAP4 作为包封对象。利用明胶为载体,结合乳化-化学交联法制备艾叶多糖明胶微球,采用单因素与响应面分析法进行工艺优化,利用扫描电镜和粒度仪对微球进行了初步表征并进行了释放度的测定。得到艾叶多糖明胶微球的最佳制备工艺:艾叶多糖浓度为15 mg/mL、油水比为3.8:1、乳化剂浓度为1.2%、明胶质量分数为10.20%,其包封率和载药量分别为63.80%和9.38%。并且球表面形态显示微球光滑圆整,平均粒径为59.593 μm。体外释放度结果表明在pH 为2.5和7.4 的释放介质中12 h 累积释放率约为60%和80%,即艾叶多糖明胶微球具有较好缓释作用与肠溶性。通过α-葡萄糖苷酶和α-淀粉酶活性抑制实验发现,在pH7.4 释放介质中其与单一艾叶多糖抑制活性相比无显著性差异。
综上所述,本研究为艾叶多糖调节降血糖相关功能食品开发奠定了理论基础。但目前还有些许问题尚未解决,微球粒径较大,可能是由于乳化过程中的搅拌速度太低引起的,需要通过后续实验探究搅拌速度对制备工艺的影响。且关于微球的表征只停留在初步,需要通过红外光谱、差示扫描热量分析、X 射线衍射等手段,对微球的结构和热稳定性进行进一步的探究。

