玉米麸皮阿拉伯木聚糖提取工艺优化及其凝胶特性研究
肖宇,张 涛,陈爱君,续晓琪, ,李 莎,孙桂莲,李克文,徐 虹
(1.南京工业大学食品与轻工学院,江苏南京 211816;2.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏南京 210023;3.保龄宝生物科技有限公司,山东德州 251200)
玉米是重要的粮食作物,也是饲料、酿造、淀粉、生物制药等行业关键的原材料,在农业生产和国民经济中占有重要的地位[1]。玉米麸皮是湿法加工生产淀粉或糖浆的重要副产物,主要用作低价饲料,经济价值被严重低估,每年约有数亿吨的玉米麸皮产生[2]。利用废弃玉米麸皮生产高附加值和营养价值的产品,具有重要的研究价值和应用前景。
玉米麸皮中膳食纤维含量约为60%~70%,主要成分为阿拉伯木聚糖(Arabinoxylan,AX)[3−4]。结构上来看(如图1),AX 由β-D-吡喃木糖残基(Xylp)形成线性骨架,α-L-阿拉伯呋喃糖(Araf)组成的侧链通过C(O)-2、C(O)-3 或C(O)-2,3 键连接到主链[5],少量阿魏酸(Ferulic acid,FA)通过酯键连接到Araf 的C(O)-5 位[6−7]。现已证实,AX 可以抑制机体胆固醇的升高,降低血糖,作为益生元促进肠道有益菌的增殖等[8]。除了具备良好的生理活性外,AX 可在化学氧化剂以及酶(如漆酶、过氧化氢酶)作用下,耦合交联形成稳定凝胶。例如,漆酶交联制成的AX 凝胶具有蜂巢结构,将B.longum等益生菌截留在三维网状结构中,形成益生菌的包埋体[9]。

图1 玉米麸皮结构示意图Fig.1 Schematic diagram of structure of maize bran
AX 的分子量、活性基团等结构特征会影响其生理活性、凝胶特性,进而影响AX 的应用[10]。AX 常用的提取方法为碱法,但提取条件不同会导致AX 的分子量、FA 酯键水解程度等结构差异[11]。例如采用超声辅助酶法提取麦麸AX,响应面优化提取工艺后AX 平均提取率为17.38%,所得AX 分子量集中分布在1.53×104~2.51×104Da,A/X 分布在0.29~0.81 之间[12−13]。探究不同提取方法所得AX 的结构和性质对于AX 在食品工业中的进一步应用具有重大意义。目前,关于碱法提取所得AX 氧化交联形成的凝胶研究较少,碱法提取所得AX 的结构对凝胶特性的影响尚不清楚。本研究选用碱法提取玉米麸皮中的AX,响应面优化AX 提取工艺。分析AX 的得率、单糖组成、魏酸含量和分子量等结构参数,并用漆酶对AX 进行氧化交联,研究氧化后AX 的凝胶特性、凝胶强度、热稳定性等特征,为AX 及其凝胶在食品工业中的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
玉米麸皮 由保龄宝生物科技有限公司提供;KTSTA 总淀粉试剂盒、耐高温α-淀粉酶(3000 U/mL)、淀粉葡糖苷酶(3300 U/mL)爱尔兰Magezyme 公司;Bradford 蛋白浓度测定试剂盒P006 上海碧云天生物技术有限公司;碱性蛋白酶(200 U/mg)上海士锋生物科技有限公司;β-葡聚糖、漆酶(120 U/g)
南京草本源生物科技有限公司;葡聚糖标准品(分子量分别为150、410、670、1080、2000 kDa)迈瑞尔化学技术有限公司;阿拉伯糖(Ara)、木糖(Xyl)美国Sigma-Aldrich 有限公司;氢氧化钡、氢氧化钠、磷酸二氢钠、甲醇、三氟乙酸、盐酸等试剂 均为分析纯级,国药集团化学试剂有限公司。
Mikro220R 台式高速冷冻离心机 德国Hettich公司;Multiskan FC 酶标仪 美国Thermo Fisher 公司;LGJ-12 立式真空冷冻干燥机 北京松源华兴生物有限公司;1260 Infinity II Prime 高效液相色谱仪、XDB-C18色谱柱(Zorbax Eclipse,4.6 mm×150 mm,5 μm)美国Agilent 公司;TSKgel G4000PWXL 色谱柱(7.8 mm×300 mm)日本TOSOH 公司;Nicolet iS20 红外光谱仪 美国Thermo Fisher 公司;MCR 302旋转流变仪 奥地利Anton paar 公司。Verios XHR SEM 电子显微镜 美国Thermo Fisher 公司。
1.2 实验方法
1.2.1 玉米麸皮的组成测定
1.2.1.1 淀粉含量测定 淀粉含量使用总淀粉试剂盒进行测定,称量100 mg 玉米麸皮,加入0.2 mL 浓度为80%的乙醇溶液。用pH5.0,100 mmol/L 醋酸钠缓冲液稀释1 mL 耐高温α-淀粉酶至30 mL,准确吸取3 mL 加入样品溶液中。将样品溶液放入100 ℃水浴锅沸水浴6 min,冷却至室温后放入50 ℃水浴锅,同时加入淀粉葡糖苷酶0.1 mL,充分反应后稀释并离心(3000 r/min,10 min)。吸取1 mL上清液到试管中,用去离子水稀释到10 mL。吸取0.1 mL 稀释过后的样品溶液,加入3 mL 的葡糖氧化酶/过氧化物酶试剂(GOPOD)后立即放入50 ℃的水浴锅中加热20 min,充分反应后在510 nm 处测定吸光值,以葡萄糖标准溶液为参考,葡萄糖标准曲线为y=0.6159x+0.0443,R2=0.9921。
1.2.1.2 蛋白质含量测定 使用Bradford 蛋白浓度测定试剂盒进行测定,方法如下:在蛋白质检测试剂中加入不同浓度梯度的蛋白质标准溶液,室温下反应5 min 后,在595 nm 处测定吸光值,绘制蛋白质标准曲线。称量1 g 玉米麸皮,加入6 mL 去离子水充分分散后,离心(6000 r/min,10 min)取上清液,加入考马斯亮蓝G250 试剂,反应后在595 nm 处测定吸光值。蛋白质标准曲线为y=2.3587x+0.4209,R2=0.9951。
1.2.1.3β-葡聚糖含量测定 采用刚果红法测定玉米麸皮中β-葡聚糖的含量[14]。称取一定量的玉米麸皮,加入一定体积0.01 mol/L 的NaOH 溶液,充分反应后离心取上清,提取其中的β-葡聚糖。加入过量的硫酸铵溶液后再次离心。准确吸取100 μL 上清液,加入去离子水稀释为2.0 mL,随后加入4.0 mL刚果红染液,室温下反应一定时间,545 nm 处测定样品吸光度,以不同浓度β-葡聚糖作标准曲线计算样品中β-葡聚糖含量,β-葡聚糖含量计算中葡聚糖标准曲线为y=2.4068x+0.1036,R2=0.9958。
1.2.1.4 纤维素和半纤维素的含量测定 采用72%浓硫酸水解法测定纤维素含量[15],称取适量玉米麸皮,加入5 mL 醋酸和硝酸混合液,沸水浴25 min,冷却后离心取沉淀,加入10 mL 质量分数为10%的硫酸及10 mL 0.01 mol/L 的重铬酸钾溶液,沸水浴10 min,冷却后加入5 mL 20%的KI 溶液及1 mL质量分数为0.5%淀粉溶液,使用0.2 moI/L 的硫代硫酸钠滴定测量纤维素。
采用2 mol/L 盐酸水解法测定半纤维素含量[15]。称取适量玉米麸皮,加入10 mL 质量分数为80%的硝酸钙溶液,沸水浴5 min,冷却后离心取沉淀,加入10 mL 浓度为2 mol/L 的盐酸,沸水浴45 min。冷却后离心取上清液,将其调至碱性,用DNS 法测定溶液中的还原糖。所得半纤维素含量即玉米麸皮中的AX 含量。
1.2.2 玉米麸皮的预处理 称取一定量的玉米麸皮,按1:7(w/v)的料液比加入0.05 mol/L 磷酸缓冲液(pH6.5),在室温下静置18 h。然后在75 ℃下水浴加热,加入耐高温α-淀粉酶(10 μL/g),搅拌反应1 h,加入淀粉葡糖苷酶,60 ℃水浴锅加热,振荡反应30 min 后加入碱性蛋白酶,搅拌下反应 4 h,沸水浴10 min 灭酶结束反应。弃上清液,沉淀干燥后即得去淀粉玉米麸皮[2],根据1.2.1 中方法测定主要成分,并以此为原料,进行后续实验。
1.2.3 AX 的提取及得率的测定 称取一定量预处理后玉米麸皮,按1:10(w/v)的料液比加入饱和Ba(OH)2溶液,充分混合后在25 ℃下提取4 h。然后对混合物进行离心(9000 r/min,10 min)取上清液,经冻干得到碱法制备AX[16],苯酚-硫酸法测定总糖含量。总糖标准曲线为y=7.8317x+0.0934,R2=0.9935。
AX 得率(S)按下式计算:
式中:C:根据标准曲线所得样品中的总糖浓度,mg/mL;V:样品的体积,mL;n:样品稀释倍数;W:样品的质量,g。
1.2.4 单因素对AX 得率影响的研究
1.2.4.1 料液比对AX 得率影响的研究 取去淀粉玉米麸皮10 g,分别按1:10、1:20、1:40、1:60(w/v)的料液比加入饱和Ba(OH)2溶液,充分混合后在25 ℃下提取4 h。然后对混合物进行离心(9000 r/min,10 min)取上清液,硫酸苯酚法测定其中总糖含量,即AX 含量,以此计算得率。
1.2.4.2 提取温度对AX 得率影响的研究 取去淀粉玉米麸皮10 g,按最优料液比加入饱和Ba(OH)2溶液,充分混合后分别在25、45、65、85 ℃下提取4 h。然后对混合物进行离心(9000 r/min,10 min)取上清液,硫酸苯酚法测定其中总糖含量,计算得率。
1.2.4.3 提取时间对AX 得率影响的研究 取去淀粉玉米麸皮10 g,按最优料液比加入饱和Ba(OH)2溶液,充分混合后在最优提取温度下分别提取2、4、6、8 h。然后对混合物进行离心(9000 r/min,10 min)取上清液,硫酸苯酚法测定其中总糖含量,计算得率。
1.2.5 AX 提取工艺的响应面优化试验 在单因素实验的基础上,选择料液比(A)、提取温度(B)、提取时间(C)3 个因素为自变量,以AX 得率(Y)为响应值构建3 因素3 水平的响应面试验,因素水平设计表如下表1 所示。
表1 因素水平设计表Table 1 Factor level design table
1.2.6 AX 的结构表征
1.2.6.1 AX 中FA 含量测定 称取50 mg 玉米麸皮提取物,添加2%亚硫酸钠作为保护剂,按1:10(w/v)料液比加入1%的NaOH 溶液之后,在80 ℃下进行2 h 的避光反应。充分反应后静置冷却至室温,在320 nm 处进行吸光值的测量。取FA 标准品重复上述步骤得标准曲线y=0.036x+0.1859,R2=0.9927。经计算得到样品中FA 含量。
1.2.6.2 AX 中的单糖组成测定 AX 的单糖组成采用PMP-HPLC 方法测定。准确称取2 mg 样品溶于1 mL 2 mol/L 三氟乙酸(TFA)中,120 °C 下水解反应2 h,用NaOH 溶液中和反应体系后,用1-苯基-3-甲基-5-吡唑啉酮(PMP)标记,使用HPLC 串联紫外检测器,结合XDB-C18色谱柱进行分析,以阿拉伯糖、木糖、葡萄糖和半乳糖作为标准品,分别根据峰的保留时间和紫外信号响应值计算单糖组成,根据峰面积计算Ara 和Xyl 的摩尔比。其中,色谱条件为:流动相为17%的乙腈和83%的0.1 mol/L 磷酸钠缓冲液(pH6.7),样品进样量为20 μL,流速为1 mL/min,柱温30 ℃,在245 nm 波长处检测。
1.2.6.3 凝胶排阻色谱法测定AX 的分子量分布AX 样品的分子量分布采用高效凝胶色谱法测定,HPLC 系统串联示差检测器和TSKgel G4000PWXL色谱柱进行分析,以不同分子量的系列葡聚糖(150、410、670、1080、2000 kDa)为标准品,根据标准品出峰时间绘制分子量标准曲线,以样品出峰时间计算AX 样品分子量。其中,色谱条件:流动相为0.2 mol/L的Na2SO4溶液,流速为0.8 mL/min,柱温35 ℃,进样量为20 μL。
1.2.7 AX 凝胶的制备及凝胶特性研究
1.2.7.1 漆酶氧化交联制备AX 凝胶 将AX 配制成3%(w/v)溶液,加入漆酶催化氧化交联(1 mg AX加入0.1 U 漆酶)[17],室温反应24 h 后,灭酶冻干,分别分散于pH2.0、5.0、8.0 的水溶液中,制备氧化交联AX 的凝胶体系(Alkaline extract gel,AEG)。
1.2.7.2 红外光谱分析 称取一定量AX 以及冷冻干燥后的AEG,溴化钾作分散剂与样品按100:1(w/w)的比例混合,充分研磨后压片,用红外光谱仪进行分析,测定参数如下:扫描波长范围400~4000 cm−1。
1.2.7.3 凝胶流变学性质分析 将AEG 置于旋转流变仪上,用40 mm,角度为1.999°的椎板,间距55 μm,扫描应变3%条件下进行频率扫描测试,根据储能模量(G´)和损耗模量(G")分析AEG 的动态粘弹性。在20~95 ℃范围内测量G´和G",升温速度为5 ℃/min,扫描应变为3%,频率为1 Hz,进行动态时间扫描测定[17]。
1.2.7.4 扫描电镜观察凝胶微观结构 称取一定量AX 以及冷冻干燥后的AEG,喷金增强导电性后进行电子显微镜扫描,观察其结构形态,加速电压为15 kV。
1.2.7.5 凝胶的热重分析 称取一定量冷冻干燥后的AEG,使用热重分析仪进行热稳定性的测定。仪器条件:氮气为60 mL/min,升温速率为10 ℃/min,从30 ℃ 线性升温至500 ℃。
1.3 数据处理
实验重复3 次,数据结果用“平均值±标准差”表示,IBM SPSS statistics 19.0 软件进行分析,方差分析(ANOVA)判断多重平均值的显著性,显著性水平P<0.05 表示具有统计学意义。
2 结果与分析
2.1 玉米麸皮化学组成分析
玉米麸皮的主要成分为纤维素、半纤维素、淀粉、蛋白质等,经测定其化学组成如表2 所示。

表2 预处理前后玉米麸皮化学组成Table 2 Indexes before and after pretreatment
过多的淀粉含量会影响后续AX 的提取纯度,采用耐高温α-淀粉酶处理使玉米麸皮中淀粉含量降至0.67%±0.18%,同时除去部分水溶性蛋白质,降低蛋白质含量,避免蛋白含量对后续研究产生影响。
2.2 单因素实验结果
2.2.1 料液比对AX 得率的影响 按1.2.3 中初始提取方法的AX 得率为4.85%±0.24%。从图2(A)可知,当饱和Ba(OH)2体积增加,AX 得率迅速上升,然后略有下降。料液比过低时,饱和Ba(OH)2较少,溶液流动性较差,饱和Ba(OH)2无法与玉米麸皮充分接触,无法将麸皮中的酯键断裂,不利于多糖的溶出,导致提取效率较低。随着饱和Ba(OH)2体积增加,得率明显提高,由图2(A)可知,料液比达到1:40 附近时,AX 的提取进行较为完全,因此选择1:40 作为提取的最佳料液比。
图2 单因素对AX 得率的影响Fig.2 Effect of single factor on the yield of AX
2.2.2 提取温度对AX 得率的影响 由图2(B)可知,随着提取温度上升,AX 得率呈现大幅提升随后减少的趋势。当提取温度达到65 ℃时,AX 得率达到最大值,继续提高提取温度后,AX 得率减小。随着温度升高,分子运动加快,饱和Ba(OH)2更加有效地打断了共价酯键,AX 得率提高。温度过高时,饱和Ba(OH)2易挥发,同时高温可能会破坏多糖的结构和生理活性[18],因此选择65 ℃为最佳提取温度。
2.2.3 提取时间对AX 得率的影响 从图2(C)中可以看出,AX 得率在4 h 前迅速提高,然后趋于平缓。提取时间小于6 h 时,饱和Ba(OH)2还未充分破坏麸皮内AX 与木质素、纤维素等组分连接的酯键,因此随提取时间延长,AX 得率迅速提高,6 h 后AX 得率略有下降,但无明显差异,选择6 h 为最佳提取时间。
2.3 AX 提取工艺优化响应面试验结果
在单因素实验基础上,选择料液比(A)、提取温度(B)、提取时间(C)3 个因素为自变量,AX 得率(Y)为响应值进行3 因素3 水平的响应面试验。响应面试验设计与结果见表3,方差分析结果见表4。

表3 AX 提取工艺优化响应面试验设计与结果Table 3 Response surface test design and results of AX extraction process optimization

表4 二次多项回归模型方差结果Table 4 Variance results of quadratic multinomial regression model
利用Design-Expert 软件对表3 试验结果进行回归拟合,得到AX 得率对料液比(A)、提取温度(B)、提取时间(C)的二次多项回归方程:Y=−57.89230+0.92810A+0.83594B+10.08060C+0.0033 5309AB−0.012944AC+0.00311111BC−0.012124A2−0.00733926B2−0.77137C2。由表4 可知,模型的P值<0.01,极显著,失拟项P值=0.2649>0.05,不显著,说明此模型可用于分析预测AX 提取工艺的优化程度。根据P值可知,3 个因素对AX 得率的影响主次顺序为A>B>C,即料液比>提取温度>提取时间。一次项A、B、C 和二次项A2、B2、C2、AB 对结果影响极显著(P<0.01),二次项AC 对结果影响显著(P<0.05)。
图3 是料液比、提取温度、提取时间及交互作用对AX 得率影响的响应面曲线及等高线。由图3(A)可以看出,当只有提取温度变化时,AX 得率先增加后下降。当只有料液比变化时,AX 得率同样表现为先升后降的趋势,但是变化幅度大于前者,因此料液比对于AX 得率的影响大于提取温度。同理可从图3(B)看出,料液比对于AX 得率的影响大于提取时间。从图3(C)可以看出,提取温度和提取时间的变化幅度相近,两者对于AX 得率的影响基本相同。因此,各因素对于AX 得率的影响顺序为:料液比>提取温度>提取时间,与从P值得出的结论相符。
图3 料液比、提取温度、提取时间及交互作用对AX 得率影响的响应面曲线及等高线Fig.3 Response surface curves and contours of the interaction of solid-liquid ratio,extraction temperature and extraction time on AX yield
由回归方程得AX 的最佳提取工艺条件:料液比1:44(g:mL),提取温度69.38 ℃,提取时间6.33 h。在此优化条件下,预测AX 得率达到23.08%。考虑到实验的可操作性,将最佳的提取条件调整为料液比1:44(g:mL),提取温度69 ℃,提取时间6.3 h。经实验,在此最优提取条件下AX 得率为23.07%±1.15%,与理论预测值基本一致。
2.4 AX 的结构参数分析
经测定,AX 中FA 含量为9.6±0.32 mg/100 g,研究表明,FA 含量与AX 凝胶特性密切相关,还会影响AX 的生理活性,FA 含量较高的AX 有较好的氧化交联特性[17]。
AX 的单糖组成如图4(A)所示,AX 由阿拉伯糖(Ara)和木糖(Xyl)组成。Ara 和Xyl 的摩尔比(A/X)表示阿拉伯木聚糖的支化度,A/X 为2.28±0.11。A/X 与多糖的溶解性有关,A/X 比值越大更易溶解,Ara 取代度的降低会导致水溶解度的下降[19]。来源于青稞麸皮的AX,A/X 为0.81[20];小麦麸皮中碱法提取的AX,A/X 集中在0.84~1.05[21]。
图4 AX 单糖组成和HPSEC 图Fig.4 AX monosaccharide composition and HPSEC diagram
AX 的凝胶色谱如图4(B),图中为单峰,且峰形尖锐对称,说明制备的AX 组分单一、纯度较高。分子量标准曲线为y=−0.3817x+9.0653,R2=0.9539,AX在9.54 min 出峰,经计算重均分子量为265±6.68 kDa。青稞麸皮中经纯化的AX 分子量为300 kDa[20];酶法提取小米糠中的AX,分子量在1.47×106左右[22];小麦麸皮AX 均集中于2200 kDa 和12~130 kDa 范围内[21]。田贝贝等[23]报道不同分子量和支化度的AX 抗氧化性能存在差异,分子量小且支化度高的AX 清除DPPH 自由基的能力较强。AX 的结构参数提示玉米麸皮中提取的AX 具有良好的潜在生理活性。
2.5 漆酶氧化交联AX 凝胶特性研究
将未交联和交联后的AX 分别溶于不同pH 的溶液中,发现未交联的AX 不成凝胶,经漆酶交联后的AX 在中性、偏碱性的溶液中不会形成凝胶,而在pH2 的溶液中形成凝胶。本研究中AX 在漆酶作用下形成了可溶性AX 交联中间体,该中间体在低pH溶液中形成凝胶[24]。碱法提取的玉米麸皮阿拉伯木聚糖经漆酶交联后形成凝胶,示意图如图5 所示。
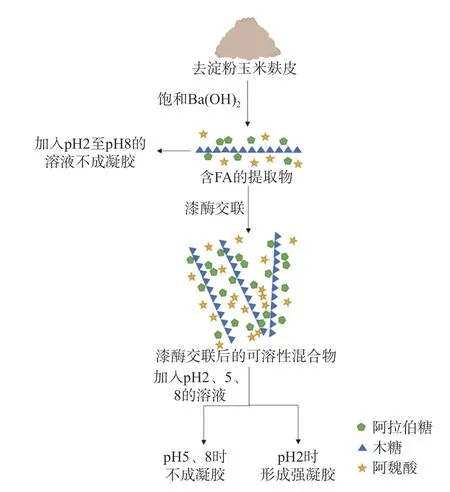
图5 玉米麸皮AX 凝胶形成示意图Fig.5 Schematic diagram of maize bran AX gel formation
2.5.1 AX 和AEG 的红外光谱图分析 AEG 和AX的红外光谱图如图6 所示,AX 在3400 cm−1附近的吸收峰为-OH 的伸缩振动,其中不对称CH2基团的C-H 伸缩振动在2929 cm−1。此外,1573 cm−1和1557 cm−1处属于酚类物质和蛋白质的特定吸收带,由于制备多糖中蛋白含量极低,该吸收带表明AX中含有酚类物质阿魏酸基团。红外谱图1200~800 cm−1之间常含有多种耦合C-O-C、C-C-O 和COH 振动峰,也属于多糖的特征峰[25]。其中1041 cm−1处的峰表示C-O 伸缩振动,是木聚糖的典型特征峰[26],结合859 cm−1和923 cm−1处的β-糖苷键伸缩振动峰[27],可判断提取物为典型的木聚糖型多糖。

图6 AX 和AEG 的红外光谱图Fig.6 Infrared spectroscopy of AX and AEG
图6 中AEG 在1585 cm−1附近的吸收峰为N=N双键的伸缩振动峰,吸收强度大于AX,说明漆酶交联作用于阿魏酸基团;在1410 cm−1附近的吸收峰为烷烃基团中C-H 的弯曲振动峰,其吸收强度小于AX,以及854 cm−1处的β-糖苷键吸收峰变小,表明漆酶交联作用使多糖结构发生改变。
2.5.2 AEG 的流变性能 AEG 的动态粘弹性曲线如图7(A)所示。储能模量(G´)是指凝胶因外力作用发生形变时,由于弹性形变而储存能量的大小,反映了弹性大小;损耗模量(G")则是指凝胶由于粘性形变而损耗的能量大小,反映粘性大小。G´大于损耗模量G"时即弹性形变大于粘性形变,样品表现出一定的刚性,反之呈现流体特性,当两者相等时,为凝胶转变点。图7(A)中,AEG 的G´远大于G",且与频率无关,说明AEG 表现出典型的凝胶性质。
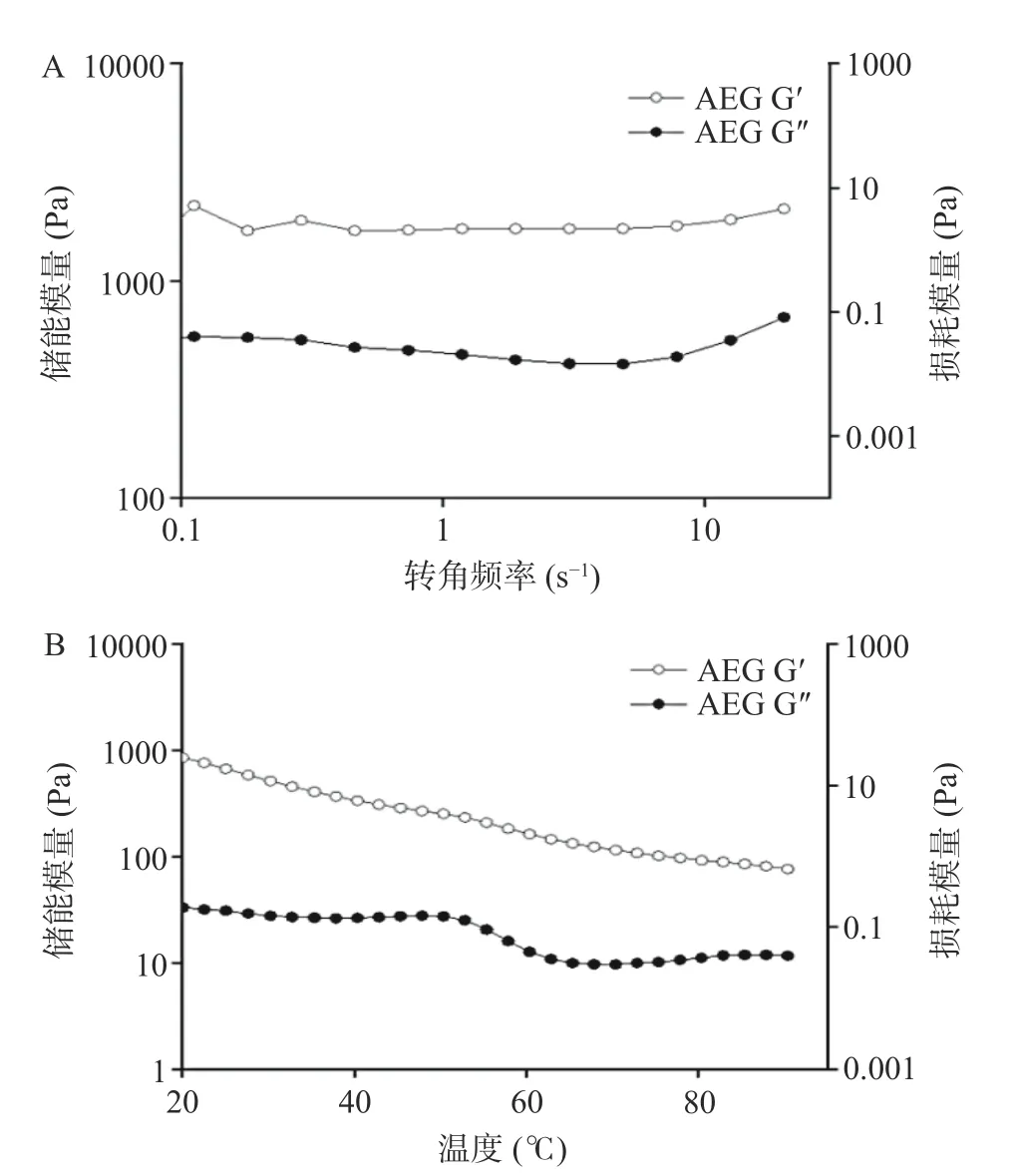
图7 AEG 凝胶特性图Fig.7 Rheological properties of AEG
图7(B)为AEG 的温度扫描测定曲线。由图可知,在20~95 ℃范围内,随着温度的升高,AEG 的G´呈降低趋势,始终保持大于G",说明AEG 的强凝胶状态受温度影响较小,是稳定的凝胶结构。
2.5.3 AEG 的扫描电镜图 图8 为AX 及凝胶的扫描电镜图。从图8(A)可知AX 微观结构呈不规则片状。从图8(C)可以看出,AEG 具有较为规律的致密多孔结构,孔径大小在100 μm 左右,孔壁平滑。这种均匀的蜂窝状结构,可以提升凝胶运载活性物质的能力,能够更好地包埋活性物质[28]。杨桔[29]同时使用多孔和无孔的水凝胶负载蛋白质,发现多孔水凝胶不仅能够负载更多蛋白质,且释放速率和最终释放量都要高于无孔水凝胶。这提示AEG 可用于低pH 的环境或添加在饮料中,以延缓饥饿感或增加饱腹感,也可作包埋物用于活性成分或药物的运输。

图8 AX 和AEG 的扫描电镜图Fig.8 SEM images of AX and AEG
2.5.4 AEG 的热重分析 AEG 的热重分析(Thermal gravity analysis,TG)曲线如图9 所示。从图中可以看出质量损失分为三个阶段。第一阶段在30~200 ℃之间,AEG 质量下降了2%左右,这是由于凝胶中残留自由水的吸热蒸发以及部分结合水的解吸所造成的[30]。第二阶段在200~270 ℃之间,AEG 质量减少了8%,这是由于多糖(阿拉伯糖、木糖等)在高温下被分解造成的[31]。第三阶段在270~500 ℃之间,AEG缓慢失重,最后形成灰分。从图中可知,凝胶结构具有较好的热稳定性,可满足应用中加热的需求。
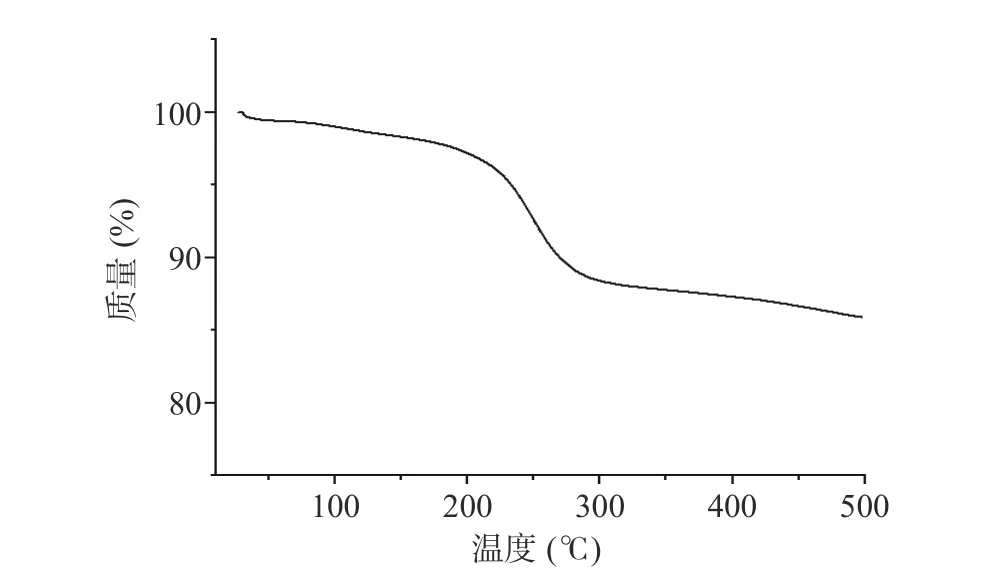
图9 AEG 热重分析图Fig.9 Thermogravimetric analysis of AEG
3 结论
本研究以玉米加工副产物麸皮为原料,响应面优化AX 的提取工艺,最佳提取工艺为料液比1:44(g:mL),提取温度69 ℃、提取时间6.3 h,在此工艺条件下,AX 得率为23.07%±1.15%,较优化前提升18.22%。经测定AX 单糖组成主要为阿拉伯糖和木糖,A/X 为2.28±0.11,FA 含量为9.6±0.32 mg/100 g,分子量为265±6.68 kDa。结合傅里叶红外光谱分析发现,在漆酶作用下AX 的阿魏酸基团发生改变,交联后在pH2.0 下可形成稳定的凝胶体系,热稳定性好且具有均匀多孔的微观结构,可用于焙烤食品或低pH 如胃环境中益生菌包埋等应用。本文为AX 及其凝胶在食品工业的开发和应用提供理论基础。

