甘草多糖对断奶仔猪生长性能和生长基因表达量的影响
杨又兵 李新月 娄然 刘永建 任旭鸽 曾凡林 游祥宾 李淦 徐志谦 雷莹 白俊艳


摘要:选取甘草多糖(GPS)为原料,主要研究甘草多糖对断奶仔猪生长性能、血清免疫指标和生长基因表达量的影响。结果表明,在对断奶仔猪生长性能影响中,800、1 500 mg/kg GPS处理组的ADG与对照组相比,差异显著;在对断奶仔猪腹泻率影响中,400、800、1 000 mg/kg GPS处理组和对照组相比,腹泻率显著下降;在对断奶仔猪血清免疫球蛋白中,1 000、15 000 g/kg GPS处理组与对照组相比,血清中IgG含量显著升高,800、1 500 mg/kg GPS处理组与对照组相比,血清中IgM含量显著升高;在断奶仔猪生长基因表达量中,肝脏中800 mg/kg GPS处理组的IGF-1基因mRNA表达量与对照组相比显著升高,背长肌中1 000 mg/kg GPS处理组的IGF-1基因mRNA表达量与对照组相比显著升高,800 mg/kg GPS处理组IGF-2基因的mRNA表达量与对照组相比显著升高(P<0.05)。
关键词:甘草多糖;生长性能;cDNA;基因表达量;断奶仔猪
中图分类号:S816.7 文献标志码:A
文章编号:1002-1302(2023)13-0182-07
甘草,或称光果甘草,是中药中“必不可少的草药”。甘草在我国的使用早于希腊和罗马帝国,有着悠久的传统药物和民间疗法历史[1]。甘草原产于南欧和亚洲部分地区,它被广泛用作草药和天然甜味剂。甘草被认为是最重要的6种草药之一,并且在联合应用时可以降低某些草药的毒性并提高其疗效,有一个经典的中医理论称“五方十有八九含甘草”[2]。在临床方面甘草也是一种重要中药,它含有20多种三萜类化合物和300多种黄酮类化合物[3]。甘草可以用于治疗多种疾病,如呼吸系统疾病、癫痫、发热、性衰弱、瘫痪、胃溃疡、风湿、皮肤病、出血性疾病、黄疸等,这与甘草自身的活性和药理作用有很大的联系[4]。和甘草相关的衍生物包括甘草酸、甘草次酸、甘草皂苷和甘草黄酮类中的甘草总黄酮、异甘草素、甘草苷、光甘草定、甘草多糖等,这些甘草衍生物都是近些年发现的从甘草中提取的活性成分[5-6]。
甘草多糖(glycyrrhiza polysaccharide,GPS)是一种酸性吡喃多糖,内部有小气泡状孔洞。相关研究表明,GPS因能增强免疫调节和抗肿瘤、抗氧化、抗病毒、抗菌、抗过敏、抗炎等重要生物活性而备受重视。GPS具有毒性小、易提取等优势,在动物产品上也可用做饲料添加剂,能够显著加强畜禽免疫调节功能,提高生长性能,有着广泛的应用前景。本试验主要研究了GPS作为饲料添加剂对断奶仔猪生长性能和免疫等方面指标的影响,旨在为健康养殖和畜牧业发展提供理论依据。
1 材料与方法
1.1 试验材料
甘草多糖原料购自河南省洛阳蓝斯利科技有限公司,饲料购自河南省洛阳市六和饲料有限责任公司。试验选用60头 健康、初始体质量为(8.33±0.39)kg/头的28日龄的杜洛克×长白×大白 三元杂交猪,公母各半。试验于2021年5—7月在河南省新郑市银发牧业猪场进行。
1.2 试验方法
1.2.1 样品采集 采取单因素设计,随机分为5个处理组,每个处理组包括3个重复,每个重复(栏)4头仔猪。预试期3 d,正试期28 d。试验组分别饲喂添加400、800、1 200、1 500 mg/kg GPS的试验日粮,对照组饲喂基础日粮。在每个重复中选取1头健康状况良好的断奶仔猪,空腹时进行前腔静脉采血 10 mL,并加入ACD抗凝血剂(ACD与血液的体积比为1 ∶5),将采集完成的血样放置在冰盒中,用记号笔编号,带回实验室进行离心并收集血清,用于后续的指标测定。断奶仔猪放血后进行屠宰,以组为单位,采集每个重复1头断奶仔猪的肝脏和背最长肌组织,并用无菌手术剪剪成小块(约1 cm3),放入冻存管中,用记号笔标注编号,随即装入液氮中,带回实验室保存待测。
1.2.2 生长性能指标测定 仔猪日采食量(average daily feed intake,ADFI):每天早晨在投料前对仔猪逐个称质量,并对前1 d仔猪所吃剩的料进行称质量,统计各组仔猪采食量,计算每头猪平均日采食量。仔猪平均日增质量(average daily gain,ADG):以每个组重复为单位,在试验开始进行至结束每天07:00对仔猪进行空腹称质量,并计算平均日增质量。料肉比F/G(Feed/Gain)=ADFI /ADG。
1.2.3 腹泻率测定 每天观察猪的健康状况,记录各栏猪的腹泻次数,计算各处理组的腹泻率。
腹泻率=(腹泻猪头数×猪腹泻天数)/(试验猪头数×试验天数)×100%
1.2.4 血清免疫指标测定 使用南京建成试剂盒,具体型号为免疫球蛋白IgA测定试剂盒E027-1-1、免疫球蛋白IgM测定试剂盒E025-1-1、免疫球蛋白IgG测定试剂盒H106-1-1,分别测定血清的IgA、IgG、IgM含量,并按照试剂盒中步骤进行操作。
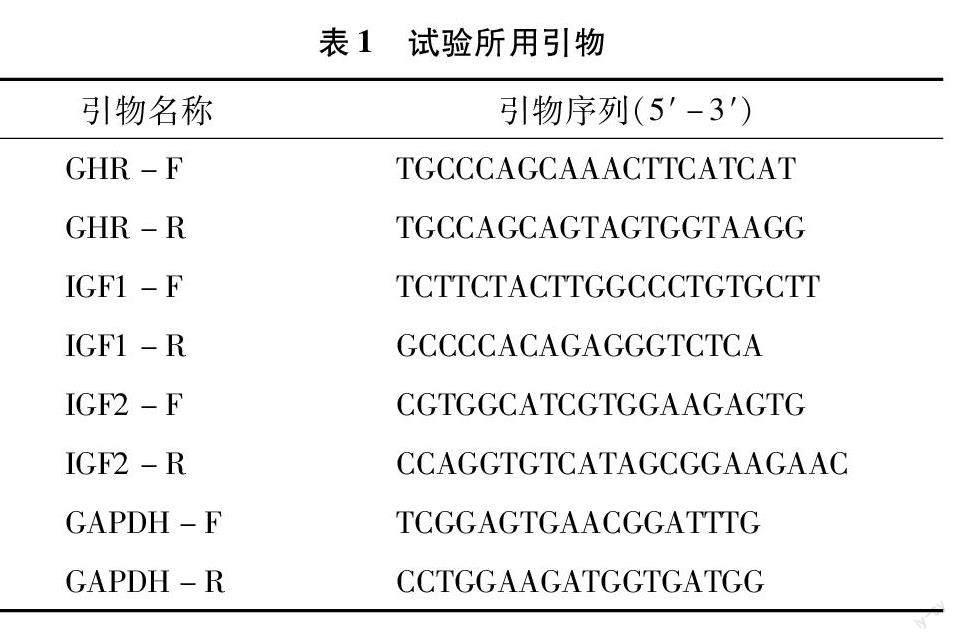
1.2.5 引物设计 引物由生工生物工程(上海)股份有限公司合成,具体引物信息见表1。
1.2.6 组织样RNA提取、检测 (1)从冻存管里取大约100 mg的组织样品,采用液氮充分碾磨后,用提前預冷的小勺把组织转入1.5 mL的RNase-free离心管中加入1 000 μL的RNAiso Plus(trizol)进行匀浆,室温静置5 min,10 000 g 4 ℃离心6 min。(2)取上清到新的1.5 mL的RNase-free离心管中,加入200 μL的三氯甲烷并振荡15 s,放置 10 min,期间不断摇晃,然后离心10 min。(3)取上清到新的1.5 mL的RNase-free离心管中,加入500 μL异丙醇,室温放置10 min,10 000 g离心 10 min,离心后底部管壁会产生白色RNA沉淀。(4)弃上清,保留白色沉淀物,加1 mL 75%乙醇,然后把离心管放入4 ℃、7 500 g的离心机内离心 5 min,弃上清,再次离心1 min,打开盖子晾干 5 min,乙醇易挥发,可以将离心管中的残留液体挥发带走。(5)往晾干的离心管内加入20 μL DEPC水,用枪头吹打混匀。(6)用超微量分光光度计检测,检测D260 nm/D280 nm值在1.8~2.0之间,表明RNA纯度较高,可以用于后续反转录和荧光定量试验。
1.2.7 cDNA合成 试验使用TaKaRa反转录试剂盒合成cDNA。反转录的体系(1)共10 μL,具体配制见表2。将体系(1)各分部试剂混合均匀后,放入PCR仪中,并按说明书程序进行设置,来进行反转录反应,具体设置为42 ℃ 2 min,4 ℃冷却。反转录体系(2)共20 μL,具体配制见表3。混匀体系(2)各部分试剂,按说明书进行反转录反应,设置为 37 ℃ 15 min,85 ℃ 5 s,4 ℃冷却。上述试操作都在冰盒上进行,合成的cDNA储存于-20 ℃。
1.2.8 实时荧光定量PCR 试验使用TaKaRa试剂盒,反转录的体系共20 μL,具体配制见表4。
1.2.9 数据处理 生产数据采用SPSS 25.0进行单因素方差分析,并用Duncan s法进行多重比较检验,结果以平均数±标准差表示。相对定量数据采用Excel 2010对数据进行整理,用2-ΔΔCT法进行计算。试验结果进行t检验分析其显著性,使用GraphPad Prism 8.0.1进行作图。*代表差异显著(P<0.05);**代表差异极显著(P<0.01)。
2 结果与分析
2.1 甘草多糖对断奶仔猪生长性能的影响
由表5可知,400、800、1 000、1 500 mg/kg GPS处理组与对照组相比,始质量、末质量、ADFI、F/G没有显著差异,但ADFI、ADG相比对照组有所升高;800、1 500 mg/kg GPS处理组的ADG与对照组相比,差异显著(P<0.05)。
2.2 甘草多糖对断奶仔猪腹泻率的影响
由表6可知,400、800、1 000 mg/kg GPS处理组的腹泻率和对照组相比,显著下降(P<0.05)。1 500 mg/kg GPS处理组也可以使腹泻率降低,但差异不显著。
2.3 甘草多糖对断奶仔猪血清免疫球蛋白的影响
由表7可知,试验各组血清中IgA含量没有显著差异;1 000、1 500 g/kg GPS处理组与对照组相比,血清中IgG含量显著升高(P<0.05);800、1 500 mg/kg GPS处理组与对照组相比,血清中IgM含量显著升高(P<0.05)。
2.4 甘草多糖对断奶仔猪生长基因表达量的影响
由图1可知,在肝脏中,GPS处理组和对照组相比,GHR基因和IGF-2基因的mRNA表达量差异不显著;800 mg/kg GPS处理组的IGF-1基因的mRNA表达量与对照组相比,显著升高(P<0.05);其余各处理组IGF-1基因的mRNA表达量与对照组相比,差异不显著。
由图2可知,在背长肌中,与对照组相比,GPS处理组GHR基因的mRNA表达量差异不显著;1 000 mg/kg GPS处理组的IGF-1基因的mRNA表达量显著升高(P<0.05);其余各处理组的IGF-1基因mRNA表达量差异不显著。800 mg/kg GPS处理组IGF-2基因的mRNA表达量与对照组相比显著升高(P<0.05),其余各处理组IGF-2基因的mRNA表达量与对照组相比差异不显著。
3 讨论
3.1 甘草多糖对断奶仔猪生长性能的影响
自1943年首次将多糖用作药物以来,随着生物化学的发展以及各种分离技术的研究和应用,多糖的复杂结构和多样性逐渐被人们所认识[7]。植物多糖对动物机体有诸多有益功效,能够改善畜禽的生长性能,提升动物机体的抗病能力,并且增进机体对营养物质的消化吸收和利用等[8-9]。在基础日粮中添加一定剂量的多糖可以提高仔猪ADFI、ADG,并降低F/G。Zhao等研究发现,添加桑叶多糖饲喂断奶仔猪,在低(0.3 g/kg)、中(0.6 g/kg)、高(0.9 g/kg)剂量组中的ADFI均高于对照组[10]。另有研究表明,在饲粮中添加酵母壁多糖和黄芪多糖、刺五加皂苷混合物,可以增高断奶仔猪的ADG、ADFI,并且有减弱F/G的趋势[11-12]。本试验结果表明,日粮中添加800、1 500 mg/kg的GPS可以显著提高断奶仔猪的ADG,而其余指标与各处理组之间没有明显差别,但添加GPS各剂量组的ADFI均高于对照组。据前人研究,在断奶仔猪饲粮中加入太子参茎叶多糖和白术多糖,可以使断奶仔猪的ADG增加;添加白术多糖还可以降低F/G[13-14],本试验结果与之相似。本试验各处理组GPS增加了断奶仔猪的ADFI,显著增加了ADG,并且在高剂量组中数值最大,生长性能基本呈剂量依赖性关系。总体而言,GPS有助于改善饲料的适口性和增加饲料的消化吸收率,提高断奶仔猪的生长性能。
3.2 甘草多糖对断奶仔猪腹泻率的影响
断奶是仔猪生活中营养方式与生存环境改变的转折点。仔猪腹泻目前仍是养猪业需要关注的重点问题,防控不到位会造成巨大损失;伴随着胃肠结构、肠道功能和免疫系统的明显变化,断奶后仔猪肠道疾病和腹泻的发病率较高,生长迟缓[15-16]。在實际生产过程中,还可能由于一些致病菌的侵入,导致猪的机体出现腹泻等症状。多糖对降低断奶仔猪的腹泻率有良好的作用效果,在断奶仔猪饲粮中单独添加黄芪多糖、白术多糖和牛膝多糖,可以明显改善断奶仔猪发生腹泻的情况,3种多糖类添加剂联合使用也有较好的功效[17]。刘佳等在饲粮中添加酵母多糖,可以抑制断奶仔猪发生腹泻的情况,添加0.2%酵母多糖作用效果最好[18]。另有研究发现,白术多糖与上述多糖作用效果类似,并且仔猪在14~28日龄时,添加 9 g/kg 白术多糖腹泻率最低[19]。本试验结果显示,添加400、800、1 000 mg/kg GPS,可以明显控制断奶仔猪腹泻情况的发生,与其他多糖类饲养试验结果相同;添加 400 mg/kg GPS时,仔猪腹泻率最低,随着GPS剂量的增加,仔猪腹泻率有所升高,这可能是由断奶仔猪胃肠消化及吸收能力的下降而引起;但相比于对照组,GPS处理组的腹泻率显著性减少。本试验说明,在饲粮中添加GPS可以改善仔猪的腹泻率,在添加剂量为400 mg/kg时,效果最佳。
3.3 甘草多糖对断奶仔猪血清中免疫球蛋白的影响
近年来,随着畜牧业绿色健康养殖的发展,人们对营养调控和免疫的联系更加关注。许多研究表明,良好的营养条件可以增强动物机体的免疫防御能力,促进机体的免疫活动[20]。免疫球蛋白是一种由抗原刺激动物体内产生的球蛋白,它具有结合抗原、刺激补体产生等生物学功能,普遍存在于血液、组织液和外分泌液中[21]。其中,IgA、IgG、IgM普遍存在于各种哺乳动物的血清中,形成反映机体体液免疫的主要指标。因此,在断奶仔猪阶段,IgA、IgG、IgM含量的提高可以在一定程度上减少疾病的发生[22]。科学研究已证实,众多植物多糖可产生免疫调控作用,是天然的免疫调节剂,并能够活化T、B淋巴细胞,提高动物机体血清中的抗体水平,增强免疫调节[23]。有研究称,在日粮中添加高剂量浓度(0.08%)的决明子多糖,能够使血清中IgA、IgM、IgG的含量明显提高[24]。Chen等在断奶仔猪日粮中添加1 000、1 500 mg/kg牛膝多糖,仔猪在第14天和第28天的血清中IgG、IgA、IgM含量明显增多[25]。本试验结果表明,添加800、1 500 mg/kg GPS,可以使仔豬血清中IgM含量显著升高;添加 1 000、1 500 mg/kg GPS,可以使仔猪血清中IgG含量显著升高。胡菁等研究发现,GPS可以增加小鼠血清中IgG、IgM浓度,在600 mg/kg浓度时有显著性的增加,从而增强机体的体液免疫[26],本试验研究结论与之一致。表明GPS能够增加血清中免疫球蛋白浓度,提高动物机体的体液免疫。
3.4 甘草多糖对断奶仔猪生长基因表达量的影响
生长激素受体(GHR)基因与GH基因有很高的关联度,GHR可以调控GH基因的表达,也是生长轴的重要组成部分,被认为是产后体细胞生长的主要调节因子,在刺激细胞分裂、骨骼生长、蛋白质合成等过程中有所影响,在动物的生长发育中起着重要作用[27-28]。GH发挥作用的前提需要与GHR结合;如果GHR不足,GH发挥作用也会受到抑制。以往认为GHR仅在鱼类和哺乳动物的肝脏中表达,介导IGF1的释放以响应GH结合;另有数据表明,GHR也在外周组织中表达,局部调节GH的促生长作用[29]。不同的营养水平下,不同物种GHR基因的mRNA表达量也有所不同。有研究表明,在饲粮中添加复方中药制剂,能够提高仔猪胸腺、脾脏GHR基因的mRNA表达量[30]。Kareem等研究发现,在饲料中添加益生元和菊糖,对肉鸡肝脏中GHR基因的mRNA表达量有所升高[31]。本试验结果发现,添加不同剂量的GPS,肌肉中GHR基因的mRNA表达量与对照组相比没有显著差异,但添加GPS后各组的表达水平有所提高;在添加 800 mg/kg 剂量GPS时,GHR基因的mRNA表达量最高。Gasparino等发现,在高饲料效率(FE)肉鹌鹑肝脏和肌肉中IGF-1的mRNA表达量较高,肌肉中GHR基因mRNA表达量较高[32]。饲喂玉米须粉和非淀粉多糖酶提高了仔猪的生长激素受体(GHR)和胰岛素生长因子(IGF)的mRNA相对表达量[33]。但本试验中,肝脏和背最长肌中,各剂量组和对照组相比,GHR基因的mRNA表达量没有显著性的提高,但800、1 000 mg/kg GPS处理组与对照组相比,GHR基因的mRNA表达量有升高趋势,这表明添加适当浓度的GPS对动物机体GHR基因的表达有上调作用。综上所述,在添加 800 mg/kg 剂量的GPS时,GHR基因表达量最高,效果最佳。
IGF-1可以通过调节生长激素的多种作用,参与发育、生长、生殖、代谢相关的关键生物学功能[34-36]。安静等分离培养绵羊原代成肌细胞,用重组慢病毒感染细胞等过程绘制细胞生长曲线,发现IGF-1能够促进绵羊成肌细胞的增殖[37]。同时,IGF-1也能够促进兔脂肪干细胞的生长和成骨分化,并且呈量效依赖性关系[38]。以上研究说明,IGF-1 最典型的功能之一是促生长作用,可以促进细胞的增殖和分化,进而来调节细胞的有丝分裂。本试验研究表明,添加800 mg/kg GPS后,肝脏中IGF-1基因mRNA表达量与对照组相比显著升高;添加1 000 mg/kg的GPS后,背最长肌中IGF-1基因的mRNA表达量与对照组相比显著升高。有研究称,在断奶仔猪饲粮中添加桑叶多糖,肝脏和背最长肌组织中IGF-1基因的mRNA表达水平都有了明显提高,低剂量组的背最长肌中IGF-1基因的mRNA表达量显著高于抗生素组,本试验结果与之相似;通过试验发现IGF-1基因mRNA表达量总体呈量效依赖性关系,在表达量达到最高后相对下降[39]。文贵辉等利用白术多糖饲喂樱桃谷鸭发现,白术多糖可以提高樱桃谷鸭肌肉中IGF-1基因的表达量[40]。本试验结果表明,GPS有一定的促生长作用,可能是由于GPS可以促进组织中 IGF-1 基因的mRNA表达量,进而提高细胞的增殖和分裂,促进动物的生长发育,但其具体机制还需要进一步验证。
IGF-2是一种小分子单链结构的肽类物质(分子量7 471 u,67个氨基酸残基),在胎儿发育和产后生长发育中起着主要作用,因此也称为胚胎样生长因子[41],在猪体内位于2号染色体上。研究表明IGF-2对牛骨骼肌卫星细胞的生长具有促进作用[42]。郭玉姣等利用荧光定量PCR技术,在长白猪和太湖猪身上发现IGF-2与早期脂肪细胞的增殖分化有关[43]。以上结果说明IGF-2在肌肉生长和分化过程中和脂肪性状方面也扮演着重要的作用。IGF-2基因在不同猪种不同组织中的表达量也有些许差异,朱晓峰等表明IGF-2基因在从江香猪肝脏和肺脏中的表达量最高,而在大白猪背最长肌和心脏的表达量均超过其他组织[44]。本研究结果表明,在肝脏中,各剂量组与对照组相比,IGF-2基因的mRNA表达量差异不显著。在背长肌中,添加800 mg/kg GPS,IGF-2基因mRNA表达量显著升高;在添加剂量为800 mg/kg时,IGF-2基因的表达量最高,在此浓度基础上增加剂量而表达量逐渐降低。而张冰等研究发现,IGF-2基因对猪的平均日增质量影响显著,与前面结果发现添加800、1 500 mg/kg GPS对断奶仔猪平均日增质量影响有显著差异结果相似,说明不同剂量的GPS可以调节IGF-2基因的表达,可能是由于IGF-2促进机体的骨骼肌细胞增殖分裂,提高了断奶仔猪的生长发育[45]。
4 结论
日粮中添加不同剂量的GPS能够增加断奶仔猪的日采食量,添加800、1 500 mg/kg浓度的GPS能够明显增加断奶仔猪的平均日增质量,400、800 mg/kg 低剂量组可以降低料肉比,但差异不明显。说明GPS在一定程度上可以提高断奶仔猪的生长性能,添加剂量在800 mg/kg时,效果最佳。日粮中添加400、800、1 500 mg/kg GPS,能显著降低断奶仔猪的腹泻率,添加400 mg/kg GPS效果最佳。日粮中添加1 000、1 500 mg/kg GPS对IgG含量有显著性提高;添加800、1 500 mg/kg GPS对IgM含量有显著性提高,但各试验组之间IgA含量没有显著差异。日粮中添加GPS在一定程度上可以上调GHR、IGF-1、IGF-2基因mRNA的表达量并有一定的显著性关系,对提高动物生长性能具有正向调控作用。
参考文献:
[1]Pastorino G,Cornara L,Soares S,et al. Liquorice (Glycyrrhiza glabra):a phytochemical and pharmacological review[J]. Phytotherapy Research,2018,32(12):2323-2339.
[2]Jiang M,Zhao S,Yang S,et al. An “essential herbal medicine”-licorice:a review of phytochemicals and its effects in combination preparations[J]. J Ethnopharmacol,2020,249:112439.
[3]Wang D N,Liang J,Zhang J,et al. Natural chalcones in Chinese materia Medica:licorice[J]. Evidence-Based Complementary and Alternative Medicine,2020,2020:3821248.
[4]El-Saber B G,Magdy B A,El-Mleeh A,et al. Traditional uses,bioactive chemical constituents,and pharmacological and toxicological activities of Glycyrrhiza glabra L.(Fabaceae)[J]. Biomolecules,2020,10(3):352.
[5]Karahan F,Avsar C,Ozyigit I I,et al. Antimicrobial and antioxidant activities of medicinal plant Glycyrrhiza glabra var. glandulifera from different habitats[J]. Biotechnology & Biotechnological Equipment,2016,30(4):797-804.
[6]李 想,李 冀. 甘草提取物活性成分藥理作用研究进展[J]. 江苏中医药,2019,51(5):81-86.
[7]Huang H L,Huang G L.Extraction,separation,modification,structural characterization,and antioxidant activity of plant polysaccharides[J]. Chemical Biology & Drug Design,2020,96(5):1209-1222.
[8]Liu W,Liu Y M,Zhu R,et al. Structure characterization,chemical and enzymatic degradation,and chain conformation of an acidic polysaccharide from Lycium barbarum L.[J]. Carbohydrate Polymers,2016,147:114-124.
[9]杨 玲,胡睿智,夏嗣廷,等. 植物多糖的功能性研究进展及其在动物生产中的应用[J]. 动物营养学报,2019,31(6):2534-2543.
[10]Zhao X J,Li L,Luo Q L,et al. Effects of mulberry (Morus alba L.) leaf polysaccharides on growth performance,diarrhea,blood parameters,and gut microbiota of early-weanling pigs[J]. Livestock Science,2015,177:88-94.
[11]贺 琴,王自蕊,游金明,等. 酵母壁多糖对断奶仔猪生长性能和小肠黏膜形态结构的影响[J]. 动物营养学报,2016,28(11):3536-3541.
[12]Kang P,Xiao H,Hou Y Q,et al. Effects of Astragalus polysaccharides,Achyranthes bidentata polysaccharides,and Acantbepanax senticosus saponin on the performance and immunity in weaned pigs[J]. Asian-Australasian Journal of Animal Sciences,2010,23:750-756.
[13]蔡旭滨,陈凌锋,檀新珠,等. 太子参茎叶多糖对断奶仔猪生长性能和血清抗氧化指标、免疫指标及生化指标的影响[J]. 动物营养学报,2016,28(12):147-154.
[14]Li L L,Yin F G,Zhang B,et al. Dietary supplementation with Atractylodes Macrophala Koidz polysaccharides ameliorate metabolic status and improve immune function in early-weaned pigs[J]. Livestock Science,2011,142(1/2/3):33-41.
[15]Heo J M,Opapeju F O,Pluske J R,et al. Gastrointestinal health and function in weaned pigs:a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds[J]. Journal of Animal Physiology and Animal Nutrition,2013,97(2):207-237.
[16]Jayaraman B,Nyachoti C M.Husbandry practices and gut health outcomes in weaned piglets:a review[J]. Animal Nutrition,2017,3(3):205-211.
[17]谢红兵,邹 云,刘丽莉,等. 植物多糖对断奶仔猪生长性能及肠道内环境的影响[J]. 动物营养学报,2018,30(7):2662-2671.
[18]刘 佳,何书海,朱忠珂,等. 酵母多糖对仔猪生长性能、免疫力、抗氧化及肠道健康的影响[J]. 饲料研究,2021,44(14):38-41.
[19]Li L L,Wu X,Peng H Z,et al. The effect of dietary addition of a polysaccharide from Atractylodes macrophala Koidz on growth performance,immunoglobulin concentration and IL-1β expression in weaned piglets[J]. The Journal of Agricultural Science,2009,147(5):625-631.
[20]皇甫冰. 浅谈幼龄动物的营养与免疫[J]. 中国畜牧业,2022(15):126-127.
[21]Wu H Z,Yang J,Wang S B,et al. Effects of soybean isoflavone and Astragalus polysaccharide mixture on colostrum components,serum antioxidant,immune and hormone levels of lactating sows[J]. Animals,2021,11(1):132.
[22]Wu Y,Pan L,Shang Q H,et al. Effects of isomalto-oligosaccharides as potential prebiotics on performance,immune function and gut microbiota in weaned pigs[J]. Animal Feed Science and Technology,2017,230:126-135.
[23]尚慶辉,解玉怀,张桂国,等. 植物多糖的免疫调节作用及其机制研究进展[J]. 动物营养学报,2015,27(1):49-58.
[24]Deng Z Y,Zhang J W,Wu G Y,et al. Dietary supplementation with polysaccharides from semen cassiae enhances immunoglobulin production and interleukin gene expression in early-weaned piglets[J]. Journal of the Science of Food and Agriculture,2007,87(10):1868-1873.
[25]Chen Q H,Liu Z Y,He J H.Achyranthes bidentata polysaccharide enhances immune response in weaned piglets[J]. Immunopharmacology and Immunotoxicology,2009,31(2):253-260.
[26]胡 菁,敖明章,崔永明,等. 甘草多糖的抗肿瘤活性及对免疫功能的影响[J]. 天然产物研究与开发,2008,20(5):911-913,38.
[27]Sharma A,Dutt G,Sivalingam J,et al. Novel SNPs in IGF1,GHR and IGFBP-3 genes reveal significant association with growth traits in Indian goat breeds[J]. Small Ruminant Research,2013,115(1/2/3):7-14.
[28]Chen C,Zheng Y,Wang M L,et al. SINE insertion in the intron of pig GHR may decrease its expression by acting as a repressor[J]. Animals,2021,11(7):1871.
[29]Bertucci J I,Blanco A M,Canosa L F,et al. Direct actions of macronutrient components on goldfish hepatopancreas in vitro to modulate the expression of ghr-Ⅰ,ghr-Ⅱ,igf-Ⅰ and igf-Ⅱ mRNAs[J]. General and Comparative Endocrinology,2017,250:1-8.
[30]刘 莉,郝福星,冒海银. 四君子汤对仔猪胸腺及脾脏生长激素受体mRNA表达的影响[J]. 动物医学进展,2009,30(6):66-69.
[31]Kareem K Y,Loh T C,Foo H L,et al. Effects of dietary postbiotic and inulin on growth performance,IGF1 and GHR mRNA expression,faecal microbiota and volatile fatty acids in broilers[J]. BMC Veterinary Research,2016,12(1):163.
[32]Gasparino E,del Vesco A P,Voltolini D M,et al. The effect of heat stress on GHR,IGF-I,ANT,UCP and COXⅢ mRNA expression in the liver and muscle of high and low feed efficiency female quail[J]. British Poultry Science,2014,55(4):466-473.
[33]Kirrella A A,Abdo S E,El Naggar K,et al. Use of corn silk meal in broiler diet:effect on growth performance,blood biochemistry,immunological responses,and growth-related gene expression[J]. Animals,2021,11(4):1170.
[34]Liu J L,LeRoith D.Insulin-like growth factor I is essential for postnatal growth in response to growth hormone[J]. Endocrinology,1999,140(11):5178-5184.
[35]Fontanesi L,Scotti E,Buttazzoni L,et al. Analysis of association between a microsatellite at intron 1 of the insulin-like growth factor 1 (IGF1) gene and fat deposition,meat production and quality traits in Italian large white and Italian duroc pigs[J]. Italian Journal of Animal Science,2013,12(3):e72.
[36]Buonomo F C,Lauterio T J,Baile C A,et al. Determination of insulin-like growth factor 1 (IGF1) and IGF binding protein levels in swine[J]. Domestic Animal Endocrinology,1987,4(1):23-31.
[37]安 靜,张雪梅,刘晨曦,等. 绵羊IGF-1基因慢病毒表达载体的构建及其促肌细胞生长作用研究[J]. 西北农林科技大学学报(自然科学版),2014,42(4):15-21.
[38]朱思斌,张 雪,江 飞,等. IGF-1对兔脂肪干细胞增殖和成骨分化的影响[J]. 安徽医科大学学报,2019,54(12):1913-1917.
[39]Zhao X J,Yang R L,Bi Y H,et al. Effects of dietary supplementation with mulberry (Morus alba L.) leaf polysaccharides on immune parameters of weanling pigs[J]. Animals,2019,10(1):35.
[40]文贵辉,李丽立,张 彬,等. 白术粗多糖对樱桃谷鸭IGF-1基因表达的影响[J]. 中国畜牧杂志,2011,47(13):63-65.
[41]Liu X F,Liu H B,Wang M,et al. Disruption of the ZBED6 binding site in intron 3 of IGF2 by CRISPR/Cas9 leads to enhanced muscle
development in Liang Guang Small Spotted pigs[J]. Transgenic Research,2019,28(1):141-150.
[42]孙晓丽,李树峰,佟慧丽,等. 不同肌肉特异性启动子IGF2表达载体构建及对牛骨骼肌卫星细胞增殖的影响[J]. 畜牧兽医学报,2015,46(4):555-560.
[43]郭玉姣,唐国庆,李学伟,等. 猪脂肪组织中IGF2和IGFBP3基因表达的发育性变化及其品种差异[J]. 遗传,2008,30(5):602-606.
[44]朱晓锋,许厚强,陈 伟,等. 从江香猪IGF-1和IGF-2基因的克隆、表达及生物信息学分析[J]. 农业生物技术学报,2019,27(8):1382-1391.
[45]张 冰,马青艳,覃 倩,等. 陆川猪和大白猪IGF2基因对生长性状的效应分析[C]. 广西畜牧兽医学会养猪分会2014年年会暨学术报告会论文集. 南宁,2014.

