MALDI-TOF MS在NTM临床分离株快速鉴定中的应用研究*
黄琨波,陈桂春,林玉玲,陈清清,李 科,张建明△
福建医科大学附属泉州第一医院:1.检验科;2.心内科,福建泉州 362000
非结核分枝杆菌(NTM)病是指人体感染了NTM引起相关组织或脏器的病变。NTM肺病与肺结核有着类似的临床症状和影像特征,二者无法通过痰标本抗酸染色进行区分,常造成误诊[1]。目前可以通过胶体金和荧光PCR检测等手段初步排除结核菌的感染,但仍无法明确诊断NTM病,更无法区分至亚种,误诊率也较高。滞后的鉴定技术严重阻碍了NTM病的诊治[2]。由于诊断困难、高度耐药且容易复发,近年来我国NTM病的发病率明显上升,对人类健康构成极大的威胁[3]。
NTM传统培养方法操作繁杂,培养周期长,可重复性差,加之分枝杆菌大多属于慢生长菌,培养条件较苛刻,不易生长,已无法满足临床实际工作的需求[3]。近年来,基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)技术在临床微生物鉴定中的应用日渐广泛。MALDI-TOF MS与传统方法和分子生物学技术相比,具有快速、准确、灵敏及经济等优点,尽管不能完全替代传统培养方法,但也弥补了传统方法操作复杂、费时等不足[4-5]。MALDI-TOF MS技术在国内用于NTM的鉴别较少见,因此临床参考数据较为有限[6]。本研究拟通过优化质谱上机前处理条件,建立适用于临床的NTM MALDI-TOF MS鉴定方法。现报道如下。
1 材料与方法
1.1菌株来源 收集2018-2020年泉州某三甲医院微生物实验室的部分临床疑似NTM感染(涂片抗酸染色阳性,分离培养并经结核DNA检测为阴性,初步鉴为NTM)患者的痰液、肺泡灌洗液、胸部穿刺液和脑脊液等样本。采用改良罗氏培养基(L-J培养基)进行分离培养。NTM参考株来源于美国菌种保藏中心。
1.2仪器与试剂 主要仪器:全自动快速生物质谱检测系统(Bruker Daltonik GmbH);基因扩增仪(杭州博日科技有限公司);二氧化碳培养箱(赛默飞世尔科技公司)。 主要试剂:基质液;甲酸水溶液;乙腈水溶液;无水乙醇;固体培养基;哥伦比亚血琼脂平板;PCR 试剂盒、Ex Taq DNA 聚合酶及标准分子量DNA(Marker)购自TaKaRa 公司。
1.3方法
1.3.1传统(常规)质谱法
1.3.1.1临床标本前处理 (1)痰标本:首先将痰样本转移至螺口管中,视样本具体性状,在生物安全柜内加入1~2倍体积的N-乙酰-L-半胱胺酸-氢氧化钠(NALC-NaOH)处理液。旋紧盖子,在涡旋振荡器上涡旋振荡充分混匀,静置15 min。小心打开盖子,加入适量磷酸盐缓冲液(pH值为6.8)至总体积约40 mL;3 000×g离心20 min,弃上清液用l mL磷酸盐缓冲液重悬沉淀,并将重悬液接种至新的培养基上。(2)支气管灌洗液、脑脊液等无菌体液:直接将样本离心后取沉淀接种进行培养。
1.3.1.2NTM菌株筛选 将经Bactec MGT960系统培养阳性的分枝杆菌菌液接种于罗氏培养基上,37 ℃持续培养4周,记录菌落的生长状态。其中,经结核DNA检测呈阴性的初步判定为NTM。
1.3.1.3菌株DNA提取 采用煮沸裂解法进行菌株DNA的提取。
1.3.2MALDI-TOF MS改良前处理(甲酸提取法)
1.3.2.1标本处理 (1)在1.5 mL的离心管中先加入300 μL去离子水;转移分枝杆菌样本到上述离心管中(避免取到培养基,尽可能转移1~3份10 μL接种环的菌量。取菌量更直观的概念:离心管中2 μL水的量代表一小份沉淀,5 μL的量代表合适大小的沉淀);煮沸30 min以灭活分枝杆菌(可使用95 ℃的金属浴或水浴)。(2)使用移液枪反复吹打混匀,然后涡旋振荡至少1 min,在离心管中形成悬液。(3)添加900 μL的无水乙醇溶液,然后悬液振荡至少1 min。(4)离心菌体细胞(离心2 min,13 000 r/min)并吸净上清液。(5)将第4步重复一次,使用移液枪小心吸取剩下的乙醇,以完全除去乙醇溶液。(6)将10 μL 70%甲酸水溶液加入沉淀物中,通过移液枪反复吹打,然后进行涡旋充分混匀,(7)加入10 μL乙腈,通过移液枪反复吹打混合悬液。(8)离心细菌提取物(离心2 min,13 000 r/min )。
1.3.2.2MALDI-TOF MS测定 参考质谱仪的操作说明进行。
1.3.316S rRNA测序
1.3.3.1PCR扩增 参考文献[7]合成16S rRNA基因的引物,引物均由上海生工生物有限公司合成。PCR体系50 μL,2xTaq MasterMix 25 μL,DNA模板5 μL,引物(10 pmol/L)各1 μL,ddH2O 18 μL。阳性对照为标准株,阴性对照组为ddH2O。PCR反应条件:94 ℃预变性5 min,94 ℃变性1 min,60 ℃退火1 min,72℃延伸1 min,第2~4步30个循环,最后72 ℃充分延伸10 min。将配好的体系放置到PCR仪中进行PCR反应。
1.3.3.2PCR序列分析 扩增产物经电泳检测验证后,取20 pmol/L扩增产物送往上海生工生物技术有限公司进行纯化及测序。将基因序列分析结果与GenBank中分枝杆菌标准序列进行比对,相似度最高的菌种为标本所属菌种。
1.4统计学处理 采用SPSS20.0统计软件进行数据分析。计数资料以例数或百分比表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1标本收集基本情况 本研究共收集临床微生物实验室初步鉴定为NTM的标本50例,以呼吸内科、感染科、ICU和发热门诊来源的标本较为常见。将已有标本转种于固体培养基上,以获取单个菌落用于后续实验分析。
2.2传统(常规)质谱方法与甲酸提取法的鉴定结果比较 用传统(常规)质谱方法共鉴定出4例菌株,检出率为8.0%(4/50),包括脓肿分枝杆菌3例和鸟分枝杆菌1例。采用甲酸提取法共鉴定出24株菌株,检出率为48.0%(24/50),鉴定结果见表1。在26株未能鉴定出结果的菌株中,有6株的蛋白指纹图谱具有良好波谱谱峰。两种方法检出率比较,差异有统计学意义(P<0.05)。

表1 甲酸提取法鉴定结果
2.316s rRNA基因测序结果
2.3.116s rRNA基因扩增 将甲酸提取法处理后有鉴定结果的菌株,采用加热裂解法提取核酸,以16S F、16S R作为引物进行16 s rRNA基因扩增,分2批次扩增,第1次扩增10株,第2次扩增14株,共扩增了24株菌株,凝胶电泳结果表明全部有明亮的目的基因扩增条带出来,选用Mark分子量大小约为2.0 kb,目的核酸片段分子量约为1.5 kb,电泳条带1.0~2.0 kb,符合试验预期。部分凝胶电泳条带见图1。
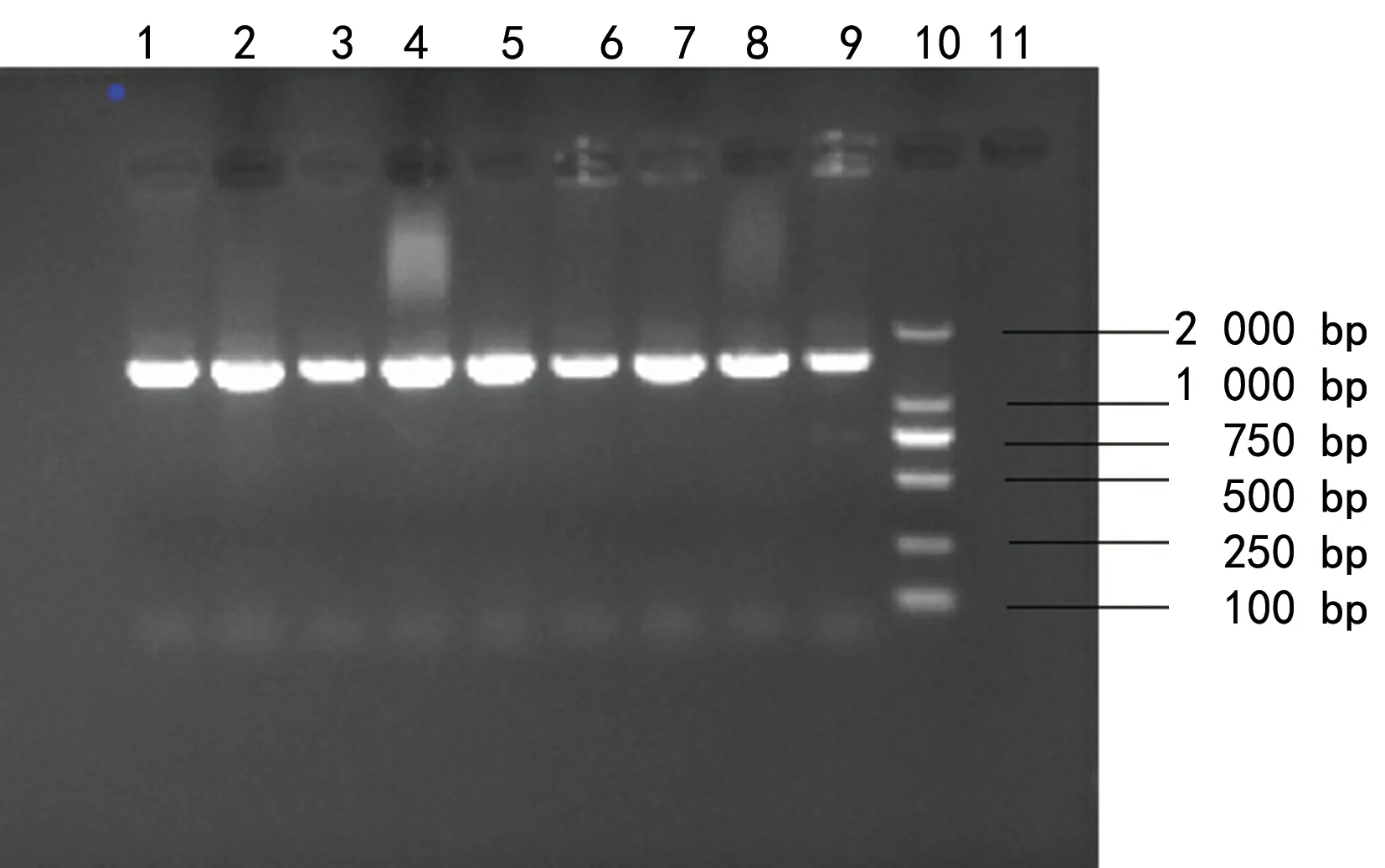
注:1~9为菌株扩增结果(约1 500 bp);10为相对分子质量标准DL 2000;11为阴性对照。
2.3.2测序结果分析 将甲酸提取法处理后有鉴定结果的菌株的扩增产物送上海生物技术公司进行测序,通过GenBank进行Blast比对,结果显示24株均为NTM,结果与质谱鉴定完全一致,符合率为100.0%,其中胞内分枝杆菌6株,马赛分枝杆菌3株,脓肿分枝杆菌4株,哥伦比亚分枝杆菌1株,鸟分枝杆菌3株,福特分枝杆菌1株,堪萨斯分枝杆菌2株,拟杆菌分枝杆菌1株,隐藏分枝杆菌1株,产黏液分枝杆菌1株,猿分枝杆菌1株。
3 讨 论
NTM毒性弱于结核分枝杆菌,大多是机会性致病菌,感染范围广,但临床普遍耐药,治疗方案存在较大差异。近年来,NTM感染率和发病率逐渐增加,其潜在危害越来越受到重视[3]。全球性的结核病高负担国家中,我国的情况一直不容乐观。
临床患者中发生联合耐药的概率在升高,且具有广泛的耐药率[8-10]。因此临床实验室中快速、准确地鉴定NTM就显得极为迫切。传统生化方法可以用于鉴别MTBC和NTM,却无法避免操作烦琐、实验周期长的缺陷,生化培养以细菌生长特点和生化反应为依据作出判断,本身存在一定的局限性。近年来,分子诊断技术已经得到全面发展,PCR、PCR直接测序法、限制性片段长度多态性聚合酶链反应(PCR-RFLP)已成为较常用的鉴定结核分枝杆菌的方法[11]。
有文献报道PCR-核酸探针技术,能有效鉴别23种临床常见分枝杆菌;PCR单链构象多态性(PCR-SSCP)分析技术、荧光定量PCR(qPCR)技术等,能够对特定的一种或多种NTM进行快速鉴定,极大地丰富了临床分枝杆菌鉴定实验方法;基因芯片技术即cDNA微阵列芯片,能够对临床常见20种NTM进行快速鉴定[12]。这些分子生物学技术虽可以快速诊断NTM,但局限于特定的一些分枝杆菌,而且费用高,操作难度较大,对实验室检验人员要求较高,测序引物又因方案不同而变动,引物扩增长度没有达到一定要求,也很难鉴定出相应菌种,难以做到统一操作,故此,探索新的更为简便、快速、准确的鉴定方法对临床工作意义重大。
质谱方法是近年快速发展的一种生物质谱技术,具有极大的潜在价值[13-15]。MALDI-TOF MS技术的基本原理是获取细菌蛋白质,形成质量图谱。国内已有MALDI-TOF MS技术应用于细菌分型、耐药分析的相关文献报道,充分显示了其巨大的应用价值。但国内目前MALDI-TOF MS在分枝杆菌鉴定的应用中还未达到预期效果,使NTM在质谱鉴定方面远落后于细菌。本研究中依照布鲁克公司的操作标准,检出率仅为8.0%(4/50),而采用改良前处理方法(甲酸提取法)后检出率为48.0%(24/50),差异有统计学意义(P<0.01)。NTM细胞壁中蜡质成分占60%以上,可抵抗机体免疫力和药物的攻击,同时能耐受搅拌,不易破碎,因此,传统方法不易使其细胞壁破碎释放出蛋白质形成图谱[16-17]。而采用改良的甲酸提取法后,甲酸能有效地诱导细胞壁破裂,使得细菌缓慢释放出细胞质中的蛋白,从而提升质谱的鉴定效率[18-19]。本研究表明改良前处理方法后的质谱技术用于NTM 鉴定,与传统的质谱鉴定方法比较检出率更高;且与传统微生物临床鉴定相比同样具有质谱本身的经济、快速等优点。因此,用于鉴别NTM与结核分枝杆菌复合群,一定程度上能够满足临床工作中NTM快速鉴定的需求,对于临床NTM菌种鉴定有一定的应用价值。
标准数据库的菌株库存容量是影响质谱鉴定的一个重要因素[20-21]。本研究中发现,采用甲酸提取法时,在26株未能鉴定出结果的菌株中,有6例菌株质谱鉴定图谱峰值比较理想,但却没有明确结果,分析原因可能是由于本实验室数据库不够全面,没有对应的标准菌株,从而导致质谱鉴定结果失败。另一个影响因素就是乙腈溶液和甲酸溶液的稀释浓度偏低,对蛋白酸化和提取产生影响。除此之外的一个决定性的实验因素是细菌细胞壁坚实,常规实验手段难以破坏细菌细胞壁,导致细菌蛋白质获取困难,甚至蛋白质基本没有提取出来,以致实验分析失败。本研究采用了加热、加酸、加生物酶等方法,以提高蛋白质含量,不过效果并不理想,因此需要探索破除细菌细胞壁的新方法。
MALDI-TOF MS技术用于NTM鉴定的临床价值,仍有待于未来大量样本的研究分析给予更为客观和科学的评价。本课题在研究过程中,收集标本相对有限,后续研究工作将进一步继续深入开展下去,以期探索出更加准确、可靠、快速的NTM鉴定技术。综上所述,MALDI-TOF MS技术用于NTM鉴定及分型,具有实际的应用价值,可用于临床实验室检验工作。

