基于核酸适配体的纳米金比色法快速检测肠炎沙门氏菌
董蕾,黄利华,江津津,郑玉玺
(广州城市职业学院食品科学与美食养生学院,广东 广州 510650)
食源性致病菌是导致食品安全事件频发的主要原因之一。在世界范围内,每年感染沙门氏菌(Salmonella spp.)导致死亡或患病而造成的直接经济损失超30 亿美元[1-2]。沙门氏菌常见的主要有鼠伤寒沙门氏菌、肠炎沙门氏菌和猪霍乱沙门氏菌等,是引起全球细菌性食物中毒的主要食源性致病菌之一,其中肠炎沙门氏菌(Salmonella enteritidis)由于不分解蛋白质,食品基本不会发生感官变化,十分容易被忽略[3]。
传统食源性致病菌检测方法包括平板分离法[4]、分子生物学方法[5-7]、免疫学方法[8]等。平板分离法作为食品安全检验的金标准,需要依靠增菌培养、生化鉴定、血清分型等,其检测周期长、灵敏度不高;同时检测过程中可能出现非目标菌干扰、污染、质粒转移等问题,影响检测结果,出现假阳性或假阴性的问题[9];分子生物学方法要求技术条件高、检测过程中一旦出现环境污染,则极易出现假阳性现象,影响检测结果;免疫学方法前期抗体制备周期长、研发成本高、抗体稳定性较差,且易受检测环境影响,很难满足食品安全快速检测中对食源性致病菌快速、灵敏、特异的检测需求[10]。
适配体是一类能够与蛋白结合、产生高特异性和亲和度的单链核酸序列[11],其通常仅含有15~40 个碱基,分子量为5~25 kDa。其片段短、性质稳定,因此环境适应性好、易保存、不易降解;同时由于适配体为单链寡核苷酸DNA 或RNA,可形成各种所需的空间构象(如发卡结构、G-四聚体等),与食源性致病菌的标志性蛋白或致病毒素的特异性结构高特异性结合,而不与其他类似结构物产生交叉反应[12-13],从而实现高特异性识别和高亲和性结合靶物质。且靶物质可为生物分子、化学分子及细胞等多种物质,探针也具有分子量小、无免疫原性、修饰简单等特点[14-16],因此被广泛应用于药物生产、医学检测等领域[17]。近年来,研究者利用核酸适配体进行沙门氏菌检验,如Duan 等[18]筛选鼠伤寒沙门氏菌核酸适配体,将其结合荧光技术检测鼠伤寒沙门氏菌,其检出限可达25 CFU/mL;Xu等[19]结合金纳米颗粒变色效应检测沙门氏菌和大肠杆菌O157:H7,当有靶标出现时,金纳米颗粒由红色变为蓝或紫色,其检出限为105CFU/mL;Yuan 等[20]利用纳米金适配体进行鼠伤寒沙门氏菌检测时,检出限可达7 CFU/mL,实现鼠伤寒沙门氏菌的可视化检测,且检测结果与传统方法一致。
纳米金(nano-gold,AuNPs)是金的微小颗粒,其具有优异的催化活性和独特的光学特性,能与多种生物大分子结合,且不影响其生物活性。中等粒径(10~20 nm)大小的纳米金在分散态下呈红色,高盐情况下凝聚成蓝色,而在含有单链DNA(ssDNA)条件下,ssDNA 的正电荷碱基自由状态暴露,通过静电吸附在纳米金上,使纳米金在高盐溶液中仍保持稳定性,纳米金溶液仍为红色[21-22]。通过纳米金进行检验,产生的变色比色反应,其灵敏度可达荧光检测法的灵敏程度[23-24]。纳米金在存在特异性靶标的情况下,适配体形成特定三维结构,与靶标特异性结合;而未吸附适配体的纳米金则在高盐溶液中发生聚集,最终使溶液呈深蓝色。
本文通过配制纳米金溶液,结合已开发的肠炎沙门氏菌核酸适配体,通过优化肠炎沙门氏菌适配体浓度,研究纳米金-适配体体系的肠炎沙门氏菌检测限、特异性及适用温度;同时以人工污染样品为例,评价纳米金-适配体的加标回收率,从而构建一种操作成本低、特异性强的肠炎沙门氏菌检测方法。同时,通过更换其他致病菌特异性的适配体,又可进行其他致病菌的快捷检测,具有良好推广效果。
1 材料与方法
1.1 主要材料及药品
标准菌株:大肠埃希氏菌(Escherichia coli)标准菌株ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)标准菌株ATCC6538、肠炎沙门氏菌(Salmonella Enteritidis)标准菌株CMCC(B)50335,购自中国医学细菌菌种保藏管理中心。
冷鲜鸡肉:市售,散装称重,于4 ℃保存。
木糖-赖氨酸-硫酸四癸钠琼脂(xylose-lysinesodium tetrahydrosulfate agar,XLT4)、脑心浸液肉汤(brain heart infusion broth,BHI)、缓冲蛋白胨水(buffered peptone water,BPW)、M9 基础培养基(M9 minimal medium)、LB 培养基(Luria-Bertani):广东环凯生物科技有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)(分析纯):赛默飞世尔科技(中国)有限公司;聚乙二醇20000(polyethylene glycol,PEG)、三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、NaCl、KH2PO4、KCl、MgCl2、4-羟乙基哌嗪乙磺酸、氯金酸(HAuCl4·4H2O)、柠檬酸三钠(均为分析纯):上海阿拉丁生化股份有限公司;肠炎沙门氏菌核酸适配体序列参考Joshi 等[25],序列:5'-TAT GGC GGC GTC ACC CGA CGG GGA CTT GAC ATT ATG ACA G-3';引物1和引物2 分别为5'-GGT GAC GCC ATA-3'和5'-CTG TCA TAA TGT C-3'由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
85-2ws 加热型磁力搅拌器:上海沪析实业有限公司;UV1810S 型紫外分光光度计:青岛聚创环保有限公司;LDZX-40AI 立式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;DH5000AB 型电热恒温培养箱:天津泰斯特仪器有限公司;SW-CJ-1F 超净工作台:苏州安泰空气技术有限公司。
1.3 方法
1.3.1 纳米金溶液制备
锥形瓶中加入95.8 mL 超纯水和4.2 mL 氯金酸溶液,磁力加热搅拌器混匀后,加入10 mL 柠檬酸三钠溶液和5 mL PVP,持续搅拌加热至溶液变红,静置冷却至室温。
1.3.2 检测条件优化
1.3.2.1 菌种活化及菌悬液制备
3 种试验菌株接种于脑心浸液肉汤并涂布LB 平板划线,挑取单菌落于10 mL 营养肉汤中,37 ℃振荡培养(150 r/min)至达到对数生长期。4 ℃、2 850 r/min离心20 min,利用预冷的PBS 缓冲液(pH7.5)清洗2次,无菌水重悬,调整菌液浓度为1×109CFU/mL,此时OD550nm为6.30。
1.3.2.2 适配体浓度筛选
在96 孔板中加入1×109CFU/mL 的菌液50 μL,再分别加入等体积浓度为0、10、20、50、100、150、200、400、600、800、1 000 nmol/L 的适配体,混匀孵育5 min。加入纳米金溶液50 μL,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,筛选最佳适配体浓度。
1.3.2.3 适配体-纳米金溶液肠炎沙门氏菌检测限测试
梯度稀释菌悬液,使菌悬液浓度分别为101~109CFU/mL。96 孔板中分别加入1.3.2.2 中筛选出的最佳适配体浓度的适配体50 μL,再依次加入101~109CFU/mL 菌悬液50 μL,混匀孵育5 min,加入50 μL纳米金溶液,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,确定肠炎沙门氏菌的检测限。
1.3.2.4 适配体-纳米金溶液特异性检测
分别加入3 种试验菌株1×109CFU/mL 菌悬液50 μL,加入最佳适配体浓度适配体50 μL,混匀孵育5 min,加入纳米金溶液50 μL,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,检测肠炎沙门氏菌适配体-纳米金溶液的特异性。
1.3.2.5 适配体-纳米金溶液的适用温度测定
96 孔板中加入50 μL 1×109CFU/mL 的菌液、最佳适配体浓度适配体50 μL,混匀孵育5 min 后,加入纳米金溶液50 μL,平衡5 min。加入10 μL 5 mol/L NaCl溶液后,置于15、25、35 ℃的水浴中,测定该体系的适用温度。
1.3.3 人工污染样品检测
冷鲜鸡肉切块,生理盐水冲洗,超净台紫外照射30 min,经GB 4789.4—2016《食品安全国家标准食品微生物学检验沙门氏菌检验》[26]方法检测,无肠炎沙门氏菌检出。称取50 g 鸡肉块为1 份,分别浸入102~109CFU/mL 的菌液中,放置1 h。取出后,利用生理盐水充分浸泡振荡30 min。冲洗溶液取50 μL 进行平板计数,另取50 μL 进行纳米金-适配体检验,以开始出现颜色变化所对应的平板计数浓度为纳米金-适配体的加标回收率。
1.4 数据处理
数据处理采用SPSS 18.0 软件进行分析,显著性分析为ANOVA(One-way analysis of variance,the Duncan test),多重比较采用LSD 检验。
2 结果与分析
2.1 适配体-纳米金溶液检测肠炎沙门氏菌
基于纳米金溶液在高盐环境下所产生的凝聚颜色变化原理[21,27-28],适配体-纳米金法检测肠炎沙门氏菌的颜色变化如图1 所示。若溶液中仅存在纳米金,则在高盐溶液环境下,会发生凝聚现象,使溶液变为蓝色;而当溶液中存在纳米金和适配体时,由于纳米金表面吸附了适配体,不会在高盐环境中发生凝聚,因此溶液仍为红色;当溶液中存在靶标菌(肠炎沙门氏菌)时,适配体与靶标细菌特异性结合,而未结合适配体的纳米金即在高盐环境下发生聚集,使溶液呈现深蓝色。

图1 适配体-纳米金肠炎沙门氏菌检测体系Fig.1 Aptamer nano gold detection system for Salmonella enteritidis
由图1 及纳米金溶液在高盐环境下的凝聚颜色变化原理可知,管1 中包含靶标细菌(肠炎沙门氏菌)、适配体和纳米金,靶标菌与适配体结合呈现的蓝色与未结合适配体的纳米金在高盐环境下发生凝集,使蓝色加深,呈现深蓝色;管2 中只有靶标菌及适配体,两者结合呈现蓝色;管3 中仅有适配体和纳米金,纳米金在高盐环境下呈现红色。结果表明,当测试溶液中包含靶标菌时,该体系应呈现深蓝色。
2.2 最佳适配体浓度筛选
最佳适配体浓度筛选结果如图2 所示。

图2 最佳适配体浓度筛选Fig.2 Optimal aptamer concentration screening
由图2 可知,当肠炎沙门氏菌浓度为109CFU/mL时,分别测试添加0、10、20、50、100、150、200、400、600、800、1 000 nmol/L 的适配体50 μL,随着适配体浓度不断升高,混合溶液的颜色逐渐加深,在200 nmol/L 时颜色最深(管7),其后增加适配体浓度,适配体数量多于菌数,多余的适配体与纳米金结合,在高盐溶液下呈红色,至1 000 nmol/L 时适配体数量远多于菌数,溶液呈现红色。因此选择适配体200 nmol/L 为最佳适配体添加浓度。
2.3 适配体-纳米金溶液肠炎沙门氏菌的检测限
通过在523 nm 处吸光度与肠炎沙门氏菌浓度的线性分析结果见图3。
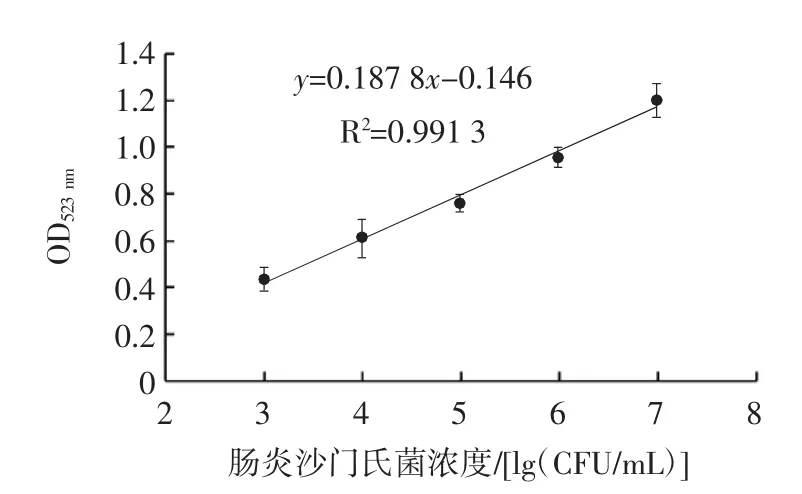
图3 肠炎沙门氏菌浓度与吸光度的线性关系Fig.3 Linear relationship between Salmonella enteritidis concentration and absorbance value
由图3 可知,在103~107CFU/mL 菌液浓度下,两者有较好的线性关系,线性方程:y=0.187 8x-0.146(R2=0.991 3),检测限为9.3×101CFU/mL。
3f 1H NMR(CDCl3) δ:7.91-7.79(m,2 H),7.77-7.75(m,1 H),7.56-7.53(m,1 H),7.37-7.33(m,2 H),7.27-7.16(m,1 H),2.43(s,6 H).
在体系中分别添加101~109CFU/mL 的肠炎沙门氏菌,其颜色变化在图4 中显示。
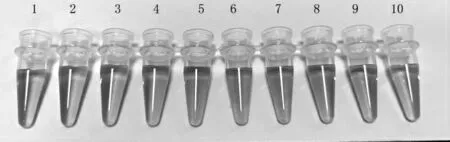
图4 适配体-纳米金溶液在肠炎沙门氏菌浓度不同时的颜色变化Fig.4 Color changes of aptamer nano gold solution at different concentrations of Salmonella enteritidis
由图4 可知,当没有肠炎沙门氏菌存在时,混合溶液为红色;当溶液中有靶标菌存在时,适配体与靶标菌结合,部分纳米金被未与靶标菌结合的适配体保护,保持红色,而未与适配体结合的纳米金颗粒在盐溶液环境下呈现蓝色,最终使溶液呈现紫红色;随着靶标菌数不断增加,适配体完全与靶标菌结合,纳米金颗粒暴露在盐溶液环境下凝集,最终使混合溶液呈现蓝色。
2.4 适配体-纳米金溶液肠炎沙门氏菌的特异性
利用适配体-纳米金溶液检测大肠埃希氏菌、金黄色葡萄球菌及肠炎沙门氏菌,检测反应体系的特异性,试验结果如图5 所示。

图5 适配体-纳米金溶液肠炎沙门氏菌的特异性Fig.5 Specificity of aptamer nano gold solution for Salmonella enteritidis
由图5 可知,肠炎沙门氏菌混合溶液出现颜色变化,其他两种菌的混合溶液则依然为红色。当反应体系中存在靶标菌时,由于适配体与靶标菌结合呈现蓝色,纳米金溶液在高盐环境下呈现红色,最终呈现出深蓝色(管3);而其他细菌与适配体无法特异性结合,纳米金与适配体结合,从而在高盐溶液下保护纳米金颗粒,使混合溶液依旧为红色(管1、管2)。
2.5 适配体-纳米金溶液肠炎沙门氏菌的适用温度
适配体-纳米金溶液肠炎沙门氏菌体系在不同温度下的反应见图6。

图6 适配体-纳米金溶液肠炎沙门氏菌体系在不同温度下的反应Fig.6 Reaction of aptamer nano gold solution Salmonlla enteritidis system at different temperatures
如图6 所示,在相同的添加量下,改变反应体系的环境温度,结果无明显差异。表明该反应体系在日常室温条件下(15~35 ℃)可以使用,环境温度变化对该反应体系的检测效果无明显影响。
2.6 人工污染样品检测结果分析

表1 适配体-纳米金溶液检测肠炎沙门氏菌与平板计数法的对比Table 1 Comparison of Salmonella enteritis detection with plate counting method
由表1 可知,基于核酸适配体的纳米金比色法检测肠炎沙门氏菌的方法加标回收率为93.68%~117.89%。与平板计数方法检测肠炎沙门氏菌的结果没有明显差异,表明适配体-纳米金溶液可以灵敏地检测出食品中的肠炎沙门氏菌污染。
3 结论
本研究建立了一种基于核酸适配体的纳米金比色法检测肠炎沙门氏菌,本方法可以特异性检测肠炎沙门氏菌,对其他食源性致病菌无特异反应。通过条件优化,在适配体浓度200 nmol/L 下,肠炎沙门氏菌的最低检测限为9.3×101CFU/mL,其线性范围为103~107CFU/mL,线性方程为y=0.187 8x-0.146(R2=0.991 3)。检测人工污染样品的加标回收率为93.68%~117.89%。
本研究建立的快捷、可视的进行肠炎沙门氏菌检测的方法,利用纳米金为显色信号,无需连接信号转换器,操作简便,可应用于现场分析检测;对比平板计数方法,其结果无明显差异,该方法可以特异、准确地检测食品中肠炎沙门氏菌污染情况,且无需进行样品采集、处理、培养等过程,操作时间大大缩短,技术要求降低,提升检测效率;同时该方法通过选择特异性识别菌种的核酸适配体,配合纳米金在高盐环境下的颜色变化,实现可视化检测。此外,筛选识别不同食源性致病菌的适配体时,仅需调整改变检测体系内适配体,其他成分无需改变(成分浓度根据检测靶标菌特性调整),即可实现不同致病微生物的检测,具有良好的通用性。

