重金属和Bt蛋白联合暴露对细菌毒性的影响
高帆帆,王莉,2,杨思培,高榕,2,吴志斌,2,方俊,2,梁运姗,2*
(1.湖南农业大学资源环境学院,洞庭湖区农村生态系统健康湖南省重点实验室,长沙 410128;2.湖南农业大学生物科学技术学院,湖南省猪场废弃物无害化处理与资源化利用工程研究中心,长沙 410128)
重金属污染一直受到国际、国内社会的高度关注。重金属沿着食物链,通过生物积累对生物体造成严重的健康威胁[1]。我国南方地区有色金属开采和冶炼活动的快速扩张导致镉、铜及其他金属污染严重,其中稻田镉污染导致稻米中镉含量超过食品安全标准限值[2]。不同重金属种类、有效性、存在形态及含量对生物体产生的毒害效果不同[3-5]。大多数金属阳离子会与蛋白质有效络合,从而形成不同的金属离子-有机络合物[6],而目前有关金属和其他物质联合暴露对生物体的毒性研究较为匮乏。因此探究重金属与其他物质联合暴露对生物体的毒性,可以更好地了解重金属对生物体的毒性行为。
苏云金芽孢杆菌(Bacillus thuringiensis,Bt)是一种革兰氏阳性芽孢杆菌,其分泌的结晶蛋白(如Cry1Ab 和Cry1Ac)可通过复杂的毒性机制控制鳞翅目昆虫[7]。Bt 转基因作物被大规模商业化推广种植,从而导致大量Bt毒素蛋白通过植物根系分泌、秸秆还田和花粉飘落的方式进入土壤和水生生态系统[8-10],Bt蛋白进入土壤初期会对土壤酶活性产生影响[11]。研究表明Bt毒素进入土壤环境后会与其他污染物,如杀虫剂、抗生素、重金属等相互结合[12-13]。Bt蛋白因富含酸性氨基酸结构而具有较强的金属络合能力,其倾向与过渡金属离子形成复合物[14],目前关于Bt抗虫蛋白和重金属联合暴露对微生物的毒理作用研究较少。因此,评估两者联合暴露对微生物活性的影响具有重要意义[15]。
本研究以Cry1Ac 蛋白作为Bt 蛋白代表,以Zn2+、Cd2+作为重金属代表,以大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)作为受试模式生物,分析Zn2+、Cd2+、Cry1Ac蛋白单独及联合暴露对两种细菌的毒性作用,以期为重金属与Bt 毒素联合暴露对微生物的生态安全风险进行有效评估。
1 材料与方法
1.1 菌种及培养基配制
1.1.1 菌种来源
大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Ba⁃cillus subtilis)由湖南农业大学微生物实验室提供;发光细菌为费氏弧菌(Vibrio fischeri),购自浙江清华长三角研究院。
1.1.2 LB培养基
液体培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、超纯水1 L、121 ℃灭菌25 min。
固体培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、超纯水1 L、加入1.5%琼脂、121 ℃灭菌25 min。
1.2 实验方法
1.2.1 细菌的生长曲线实验
将1 mL 不同浓度的Zn2+、Cd2+、Cry1Ac 蛋白单一及复合体系分别与1 mL 菌悬液和8 mL 液体培养基混合,最终Zn2+浓度为2、4、8、12、16、20 μg∙mL-1,Cd2+浓度为2、4、6、8、10 μg∙mL-1,Cry1Ac 蛋白浓度为0.2、0.8、1、2、4 μg∙mL-1,复合体系的浓度配比为1∶1,浓度为0.2、1、2、4 μg∙mL-1,培养24 h。不添加Zn2+、Cd2+、Cry1Ac蛋白的对照组加入1 mL蒸馏水。
B2C企业技术能力包括核心技术水平和技术创新能力两个方面。核心技术水平主要由信息技术水平和物流技术水平等构成。信息技术水平指B2C企业的网站系统建设、信息化水平的建设等;物流技术能力是指物流软技术,包括系统工程技术、价值工程技术、配送技术等。技术创新能力是引领市场需求、减少成本、增大企业市场规模的物质基础,B2C企业的信息技术和物流技术的学习创新在优化企业产品/服务组合、降低企业成本、提升企业主营业务的异质性、独特性方面发挥重要作用。
1.2.2 平板计数
在固体LB 培养基中分别加入不同浓度的Zn2+、Cd2+及Zn2+-Cry1Ac、Cd2+-Cry1Ac 复合体系(Zn2+:4、8、12、16、20 μg∙mL-1;Cd2+:2、4、6、8、10 μg∙mL-1;复合体系:2、4 μg∙mL-1)溶液,将对数期的E.coli和B.subti⁃lis 菌液稀释6 倍,分别取100 μL 均匀涂布于各平板上,在37 ℃恒温培养12 h 后进行活菌计数。以不添加Zn2+、Cd2+和Cry1Ac 蛋白培养的细菌菌落数作为对照活菌数(CK),用平板计数器对活菌进行计数,记录各平板上的菌落数,选取菌落数在30~300 个之间的平板用于计算,求出同一处理组平板上生长的平均菌落数。由公式(1)计算存活率:1.2.3 细菌活性氧测定
按照1.2.2的步骤收集处理后的E.coli和B.subtilis菌液至50 mL离心管,6 000 r∙min-1离心10 min;用pH为7.02 的PBS 缓冲液洗涤,6 000 r∙min-1离心5 min,涡旋去除残留;取10 μL 的活性氧(ROS)荧光探针(浓度为10 mol ∙L-1的DCFH-DA)工作液染色30 min,避光37 ℃孵育30 min,每隔10 min 轻轻摇动;孵育结束用磷酸盐缓冲液充分洗涤;用酶标仪在发射波长530 nm处检测样品的荧光强度。
1.2.4 急性毒性实验
在超净无菌工作台内将-20 ℃保存的Vibrio fisch⁃eri 冻干粉西林瓶打开,取复苏液1 mL 于室温下平衡复苏10 min,振荡摇匀。吸取发光菌液1 mL,用2%NaCl 稀释至40 mL。将不同浓度样品(Zn2+、Cd2+、Cry1Ac蛋白和复合体系)溶液放在96孔板中,不同物质每个浓度设置3 个平行,第一行设置为阴性质控(2%NaCl),为初始发光强度,第二行为阳性质控(10 mg∙L-1的ZnSO4溶液),为样品发光强度。各孔中加入样品液180 μL 和发光菌液20 μL,总体积200 μL,15 min 后放入检测仪测定发光强度。根据Vibrio fischeri的荧光强度计算抑制率(RI,%),计算公式如下:
式中:C0为阴性质控初始发光强度;St为t时样品的发光强度。
1.3 数据处理
每个实验设置3 个重复,采用SPSS 22 进行分析,采用单因素方差分析(ANOVA)和最小显著性差异(LSD)检验差异的显著性,采用Origin 9绘图。
2 结果与讨论
2.1 不同浓度Zn2+、Cd2+对细菌生长曲线的影响
重金属对细菌生长会产生抑制作用,浓度愈高抑制作用愈强[16]。Zn2+、Cd2+浓度增加对B.subtilis 和E.coli 的抑制增强(图1),E.coli 细胞壁具有带负电荷的脂多糖,其可与更多的金属阳离子结合[17-18],B.subtilis耐性强于E.coli。不同金属对生物体的毒性不同,Cd2+对B.subtilis 和E.coli生长的抑制作用大于Zn2+。Cd 是强毒性元素,低浓度就有很强的毒性;Zn 是生物体必需元素,低浓度Zn 可保护细胞免受伤害[19]。Zn2+和Cd2+的加入均对两种细菌产生了不同程度的毒害,如图1 所示,Cd2+对两种细菌的生长抑制效果强于Zn2+。不同浓度的Zn2+和Cd2+胁迫培养细菌生长0~24 h 时,OD 值均低于对照组。随着金属浓度的增加,0~11 h 为B.subtilis 的生长期,此时生长曲线呈快速生长趋势,吸光值增大,12~15 h 处于稳定期,15 h 以后OD 值减弱,此时为衰亡期。Zn2+和Cd2+浓度分别在20 μg∙mL-1和8 μg∙mL-1时完全抑制E.coli生长。

图1 不同浓度Zn2+、Cd2+对细菌生长曲线的影响Figure 1 Effects of different concentrations of metal ions on bacterial growth curve
2.2 Cry1Ac 蛋白及其与Zn2+、Cd2+联合暴露对细菌生长曲线的影响
图2 为Cry1Ac 蛋白及其与Zn2+、Cd2+联合暴露条件下的细菌生长曲线。在0~16 h,各处理组细菌生长曲线的OD600值均低于对照组。在0~10 h 内细菌处于生长期,Cry1Ac 蛋白和Zn2+-Cry1Ac、Cd2+-Cry1Ac 联合暴露对B.subtilis 和E.coli 生长产生抑制,且随浓度增加细菌生长受到的抑制作用增强,且E.coli 比B.subtilis 更为敏感。Cd2+单独及复合体系对两种细菌的毒性明显强于Zn2+单独及其复合体系,Zn在短期内的毒性可能与生物体内贮存浓度有关,当Zn 在生物体内积累到一定浓度就会启动金属硫蛋白,促使其与金属硫蛋白结合而降低毒性[20]。同时Zn2+和Cd2+都会与Cry1Ac 蛋白结合,从而减轻重金属对细菌的毒害[21]。
2.3 Cry1Ac 蛋白及其与Zn2+、Cd2+联合暴露下菌落平板生长状况观察
采用平板计数法检测Zn2+、Cd2+及Cry1Ac 蛋白联合暴露时对E.coli和B.subtilis存活的影响,结果如图3所示。随着重金属浓度的增加,细菌的存活率显著降低(P<0.05)。重金属会抑制细菌酶活性及其生长,高浓度重金属甚至会导致细菌死亡[22]。Cd2+浓度为10 μg∙mL-1时E.coli和B.subtilis的存活率均为0,表明Cd2+浓度为10 μg∙mL-1时对两种细菌的抑制率达到最大。当Zn2+浓度为16 μg∙mL-1时,E.coli 的存活率为0,Zn2+浓度为20 μg∙mL-1时,B.subtilis 的存活率为0,表明Zn2+浓度为16、20 μg∙mL-1时分别对两种细菌抑制率达到最大。当Zn2+-Cry1Ac 的浓度为4 μg∙mL-1时,对E.coli 和B.subtilis 的存活率分别为74.7%和76.8%,当Cd2+-Cry1Ac浓度为4 μg∙mL-1时,E.coli和B.subtilis的存活率分别为66.1%和71.2%,即Cd2+-Cry1Ac对两种细菌生长的抑制效果强于Zn2+-Cry1Ac。

图3 不同浓度Zn2+、Cd2+及其与Cry1Ac蛋白联合处理的细菌存活菌落电镜图Figure 3 Electron microscopic images of different concentrations of Zn2+,Cd2+and their combined with Cry1Ac protein against bacteria
2.4 细菌ROS活性检测
过量ROS 会造成细菌氧化损伤,甚至使细菌活性受到影响[23]。重金属氧化损伤所产生的ROS 可攻击膜脂,导致膜功能障碍,同时对蛋白质、DNA 和细胞内系统造成损害。图4 为暴露于Zn2+和Cd2+后细菌体内的ROS 产生量变化。单一金属对细菌毒性影响的结果表明:Zn2+浓度从2 μg∙mL-1增加到20 μg∙mL-1,E.coli 和B.subtilisti 产生的ROS 变化显著(P<0.05)。Zn在酶催化反应、细胞代谢、信号传递等生理调节过程中发挥重要作用,有助于抑制自由基和ROS的产生,从而可增强蛋白质的稳定性和抗氧化酶的活性[24]。然而过量的Zn 会起到毒性作用,Zn 会与其他金属发生错金属化阻断蛋白质硫醇表达,从而引发基本生物功能的破坏,导致细胞毒性[25]。Cd2+浓度从2 μg∙mL-1增加到10 μg∙mL-1,E.coli 和B.subtilisti 产生的ROS 变化显著(P<0.05),虽然Cd2+浓度低,但其毒性很高[20]。Cd2+浓度的增加会诱导细菌产生过量的ROS,造成DNA 损伤,最后使生物体发生细胞凋亡[26]。此外,细胞内ROS 产生量的增加可能与金属引起的抗氧化剂消耗(如谷胱甘肽)有关[27]。直接影响重金属对生物体毒性效应的不是吸附金属离子的数量,而是能够与酶、蛋白质、DNA 以及其他细胞结构的功能基团反应的离子或分子的数量[28-30]。
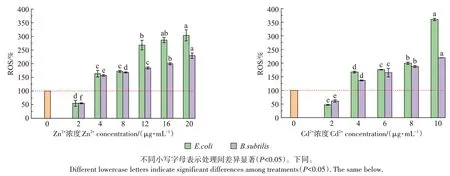
图4 Zn2+和Cd2+对两种细菌ROS产生量的影响Figure 4 Effects of Zn2+and Cd2+on ROS production of two kinds of bacteria
细菌处于Zn2+、Cd2+和Cry1Ac 蛋白联合暴露的条件下时,随着浓度增加两种菌体ROS 的产生量整体呈现先上升后降低趋势(图5),各处理组细菌ROS 产生量都低于对照组(除了浓度为2 μg∙mL-1的Zn2+-Cry1Ac复合体对E.coli的ROS产生量为103.1%)。如图5 所示,联合暴露下E.coli 和B.subtilis 的ROS 产生量呈显著性变化(P<0.05),这与单独金属离子暴露下细菌ROS 产生量呈现的趋势不同,是与金属离子与色氨酸的吲哚基团之间的N 配位有关。在Zn2+-Cry1Ac和Cd2+-Cry1Ac体系中,Zn2+和Cd2+对吲哚基团(色氨酸)中的N具有很强的结合能力,导致其对细菌的氧化损伤降低,从而进一步降低金属毒性[31]。Zn2+-Cry1Ac 处理比Cd2+-Cry1Ac 处理下E.coli 体内ROS 产生量多:一方面,Cd2+会诱导细菌防御机制响应诱导谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽-S-转移酶(GST)和金属硫蛋白(MT)等几种保护酶的升高,这些酶能够拮抗Cd 的毒性,更多的抗氧化酶能够清除生物体中Cd胁迫产生的超氧阴离子和过氧化氢等[7]。另一方面,用纯Cd2+溶液(如CdCl2)进行培养时,其对细菌的毒性大于Zn2+溶液。Cd2+-Cry1Ac 较Zn2+-Cry1A对细菌的毒性低,这是因为Cd2+与其他物质(例如各种离子或有机成分)之间的相互作用通常会改变Cd2+的毒性,此时Zn2+-Cry1A 联合暴露对细菌毒性更强[20]。

图5 Zn2+、Cd2+和Cry1Ac蛋白联合暴露对两种细菌ROS产生量的影响Figure 5 Effects of combined exposure of Zn2+,Cd2+and Cry1Ac protein binary systems on ROS production of the two bacteria
2.5 发光细菌急性毒性检验
发光细菌的发光抑制率反映重金属对细菌的毒性效应。有研究发现Zn 浓度大于1.2 mg∙L-1时对发光细菌的发光强度有明显抑制作用,Cd 和Pb 浓度改变对发光强度的影响不显著[32]。如图6 所示,不同浓度Zn2+、Cd2+均对Vibrio fischeri 产生抑制,且抑制率随金属浓度增加而变大(P<0.05)。Zn2+浓度从2 μg∙mL-1增加到20 μg∙mL-1,Zn2+对Vibrio fischeri的发光抑制率由41%增加到85%;Cd2+浓度从2 μg∙mL-1增加到10 μg∙mL-1,Cd2+对Vibrio fischeri 的发光抑制率由39%增加到61%;即不同浓度金属离子的毒性效果不同,浓度愈高,毒性愈强。相同浓度下Zn2+对Vibrio fischeri的抑制率大于Cd2+,即Zn2+对Vibrio fischeri的毒性较大。青海弧菌Q67 和费氏弧菌的毒性实验结果也表明Zn2+的毒性大于Cd2+,可能是Zn2+与硫的亲和力强于Cd2+,导致其对发光细菌毒性较大[33]。
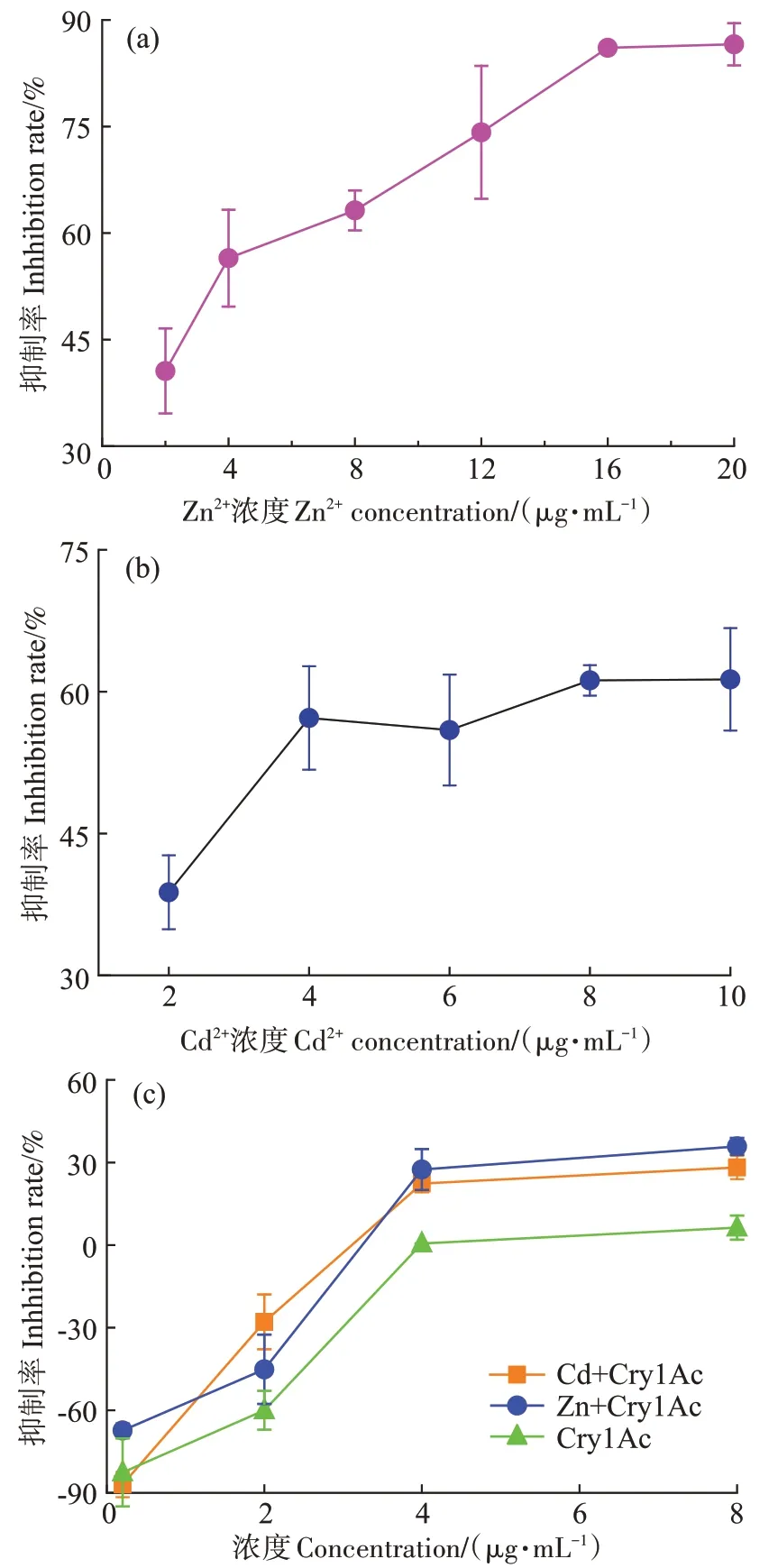
图6 不同浓度Zn2+、Cd2+、Cry1Ac蛋白及复合体系对费氏弧菌生长抑制率的影响曲线Figure 6 Influence curves of different concentrations of Zn2+,Cd2+,Cry1Ac proteins and their complex systems on growth inhibition rate of Vibrio fischeri
从图6(c)中可以看出,各处理对细菌作用15 min后,随着Cry1Ac 蛋白浓度升高,Vibrio fischeri 的发光抑制率由负到正,这是由于Cry1Ac 蛋白本身含有具有内源荧光特性的色氨酸(Trp)、苯丙氨酸(Phe)和酪氨酸(Tyr),其中最主要的是色氨酸[34-35]。具有荧光特性的Cry1Ac 蛋白与Vibrio fischeri 结合导致荧光强度增强,因此抑制率为负,随着Cry1Ac 蛋白浓度的增加,抑制率逐渐增大,但不会对细菌造成毒性影响。研究发现,转基因Bt 稻草(Cry1Ab 蛋白)在淹水条件下分解的Cry1Ab 蛋白对细菌不会造成毒害作用,即Bt蛋白不会对土壤微生物构成危害[15,36]。
Zn2+、Cd2+与Cry1Ac 联合暴露下Vibrio fischeri 的生长抑制率也由负到正,这是由于发出荧光的Cry1Ac 蛋白和Zn2+、Cd2+结合使自身荧光强度有所减弱。研究表明,具有荧光特性的Cry1Ac 蛋白与不发光的金属离子相互作用,降低了Vibrio fischeri 产生的荧光强度[37],这与本实验的结果一致。仇爱锋等[38]的研究表明随着Cd2+和Cu2+对费氏弧菌暴露时间的延长,菌体细胞膜通透性增强,毒性增大。本研究中,随着浓度的升高各处理对Vibrio fischeri 的抑制效果增强,相同浓度下各处理对Vibrio fischeri 的抑制效果 表 现 为 Zn2+>Cd2+>Zn2+-Cry1Ac>Cd2+-Cry1Ac>Cry1Ac。
3 结论
(1)高浓度的Zn2+、Cd2+会对E.coli、B.subtilis 生长产生抑制作用,细菌存活率也显著降低(P<0.05),两种细菌相比B.subtilis的耐受性强于E.coli。
(2)Cry1Ac 蛋白不会对细菌造成毒性损伤;二元体系联合暴露时Zn2+、Cd2+均与Cry1Ac 蛋白(吲哚基团)结合,使得Zn2+、Cd2+对两种细菌的毒性降低。
(3)两种细菌活性氧产生量表明Zn2+和Cd2+对E.coli 和B.subtilis 造 成 了 严 重 损 伤,Zn2+-Cry1Ac 和Cd2+-Cry1Ac 联合暴露对E.coli 和B.subtilis 没有造成严重损伤。
(4)Zn2+、Cd2+及Cry1Ac 蛋白浓度增加对Vibrio fischeri的发光强度抑制增强,相同浓度下各处理体系的发光抑制效果为Zn2+>Cd2+>Zn2+-Cry1Ac>Cd2+-Cry1Ac>Cry1Ac。

