ZrO2纳米晶高效地催化电化学氮气还原成氨
白馨月,郑坤屹,朱子娴,王敏,张祥
(临沂大学 化学化工学院,山东 临沂 276000)
氨(NH3)是地球上产量最大的化学品之一,其中80%以上作为肥料而被大量使用。氨分子中氢含量高(17.7%),重量能量密度高(3 kW·h·kg-1),是最有前景的绿色能源载体之一[1-2]。氮气作为地球上储量最丰富的氮源,将氮气高效地转化为氨更能满足可持续发展的战略需求。在自然界中,固氮微生物利用固氮酶在温和环境下将氮气还原成氨,这种方法叫做生物固氮。生物固氮具有能耗低、效率高的优点,但缺点同样明显,反应速率过低,这限制了它在实际中的应用[3]。在工业生产中,Haber-Bosch法是合成氨的主要生产工艺,每年可生产1.5亿t以上的氨。Haber-Bosch工艺以铁基或钌基化合物作为催化剂,将氮气和氢气转化为氨。但是,Haber-Bosch工艺需在高温(350~550 ℃)和高压(150~300 atm)下进行,每年由该工艺消耗的化石燃料占世界能源消耗量的1%~2%,同时排出超过3亿t的温室气体二氧化碳[4]。与之相比,电催化氮气还原成氨反应一般在室温下进行,反应条件温和,且以风能或太阳能等转化的电能为能源,在转化过程中没有温室气体的排放,更符合“碳中和”和“碳达峰”的要求[5-6]。因此电化学氮气还原反应成为最有可能替代Haber-Bosch人工合成氨的方法之一。
电化学氮气还原反应(简写ENRR)通常以氮气(N2)和水原料,其合成氨的效率主要受两个因素的限制:(1)N≡N三键断裂的能垒较高,难以被打破[7];(2)阴极竞争性的氢气析出反应降低了反应的选择性[8]。因此需要高性能的电催化剂来降低反应的活化能、加快电子转移、提高反应的选择性。在目前的研究中,贵金属催化剂(如Au,Pd,Ru等)展示了相对令人满意的催化固氮性能[9]。但是贵金属储量较少、价格昂贵,增加了固氮成本,而且产氨量低,尚未达到工业应用水平。因此,发展储量丰富、便宜易得的非贵金属催化剂以实现高效的ENRR成为研究热点。近些年来,多种过渡金属化合物[10]尤其是过渡金属氧化物[11](如Fe2O3[12],TiO2[13],Bi4V2O11/ CeO2[14]等)被广泛研究并应用于催化ENRR。虽然这些研究也取得了很多相对令人鼓舞的进展,但多数过渡金属氧化物催化ENRR的催化活性仍然不能令人满意,例如催化产氨的法拉第效率:Fe2O31.97%[12];TiO22.50%[13]。根据理论计算,后过渡金属(如Fe、Rh、Ru等)的催化活性中心更容易吸附氢原子而不是氮原子[15],因而竞争性的氢气析出反应抑制了催化ENRR的活性。
基于锆对氮气优异的吸附能力[16],我们推测锆能够选择性地吸附N2,进而促进N2H*中间体的形成,同时通过限制活性中心与氢原子的结合,抑制氢气析出过程。并且锆基化合物费米能级附近的密度态主要集中在锆原子周围,因此锆原子可以作为活性中心提供电子,激活N2,从而提高催化ENRR活性。基于此,这里首次开发了ZrO2纳米晶作为电催化剂催化ENRR。如预想的那样,在温和反应条件下,ZrO2纳米晶在氮气还为NH3的电化学转化中表现出极高的催化性能:在-0.65 V(vs.RHE),产氨量为27.93 μg·h-1·mg-1,法拉第效率高达6.18%。这种高活性氧化锆纳米晶的开发,为新型、高效的ENRR催化剂的设计与合成提供了新的启发。
1 实验材料和方法
1.1 材料
D(+)-葡萄糖一水合物(默克公司),氯化氧锆八水合物(Sigma公司),盐酸 、氢氧化钠、乙醇 、水杨酸、二水柠檬酸钠、次氯酸钠溶液、硝普钠(均购自国药集团化学试剂有限公司)等试剂均为分析纯,且购入后直接使用,无需纯化。超纯水由ultrapure超纯水制备机制备。
1.2 葡萄糖-Zr复合粒子的制备
1.3 氧化锆纳米晶的制备
将制备的葡萄糖-锆离子复合粒子转移到磁舟中,并将磁舟置于马弗炉中。以2 ℃/min的升温速率升至550 ℃,空气氛围中煅烧4 h,冷却后得到黑色的氧化锆纳米晶(简写ZNC)粉末,研磨备用。
1.4 材料的表征方法
通过X射线粉末衍射(XRD)技术测定氧化锆样品的物相结构。XRD数据在装备Cu Kα 的粉末衍射仪上(Rigua D/Max,2200)测试获得。测试范围15°~ 80°,测试速度10°/min。通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)研究含锆样品的微观结构。将表面喷Pt处理的样品在日立S-4800场发射扫描电子显微镜(FE SEM,TOSHIBA S4800)上进行扫描电镜测量,加速电压为20 kV。TEM图片在高分辨透射电子显微镜(Zeiss Libra 200 FETEM)上测得,其工作电压为200 kV。X射线光电子能谱(XPS)在以Mg为激发源的ESCALABMK II X射线光电子能谱仪上采集。
1.5 氧化锆纳米晶催化ENRR的性能测试
1.5.1 电化学测试
工作电极的制备:将超声分散好的ZNC溶液,滴于抛光好的玻碳电极(简写GCE)表面干燥(简写ZNC/GCE)(上样量为50 μg)。电化学测试在上海辰华(CHE 660)电化学工作站上进行。采用经典的三电极体系:以ZNC/GCE为工作电极,以Ag/AgCl(填充饱和KCl溶液)为参比电极,以石磨棒为对电极。在H型电解池中,以约35 mL的0.1 mol/L的盐酸溶液为电解质。所有电化学测试实验均在室温中进行。在测试ENRR性能时,需不断向阴极鼓入氮气。测试时未进行Rs校正。电势(相对于标准氢电极)的转化公式:
E(vs.RHE) =E(vs.Ag/AgCl) + 0.199 + 0.059×pH
(1)
1.5.2 氨含量标准曲线的制定
利用靛酚蓝指示剂法对氨进行定量[17]。具体过程:取阴极电解液2 mL,依次加入2 mL 含水杨酸和二水柠檬酸钠(5%)的氢氧化钠溶液,1 mL 次氯酸钠 (0.05 mol/L) 溶液和0.2 mL硝普钠 (1%)溶液。将混合液置于室温,避光反应2 h后测定紫外吸收。氨含量为0,0.1,0.2,0.3 ,0.4 ,0.5,0.6,0.8,2.0 μg/mL标准溶液的紫外吸收光谱如图1所示。由图可知,紫外吸收强度随着氨浓度的升高而不断升高。 通过靛酚蓝在656 nm处的紫外吸收强度进行氨浓度定量。结果显示,在0~2.0 μg/mL范围内氨浓度与靛酚蓝的紫外吸收强度呈现良好的线性关系。如图1内图所示,所得的氨浓度标准曲线的线性方程为y=0.381x+0.061(x为氨质量浓度,单位μg/mL),其线性相关系数R2为0.999。
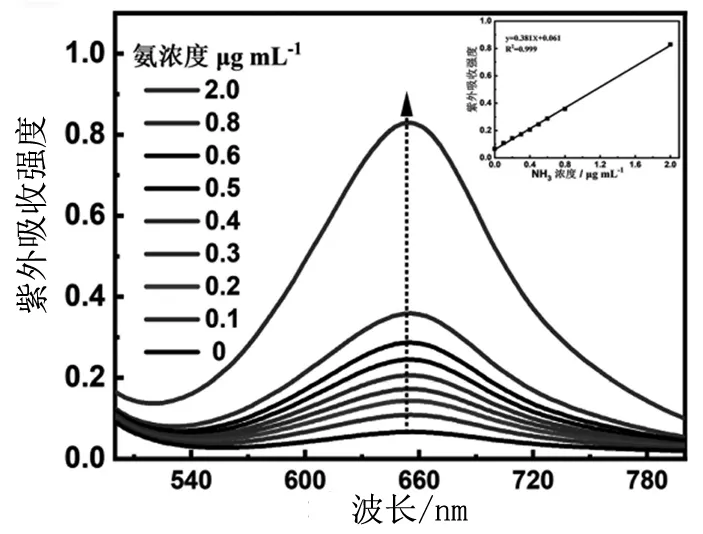
图1 不同浓度的氨溶液的紫外吸收光谱
1.5.3 产氨量和法拉第效率的计算
调查结果显示,有待进一步提高的知识包括跨学科知识、专业基础知识、研究方法论知识、专业前沿知识等。分别有42.5%和22.5%的学生认为要提高专业前沿知识和研究方法论知识;另有17.5%和12.5%学生认为应该提高跨学科知识和专业基础知识。其中,大部分学生把专业前沿知识看做最需要提高的知识。在课程设置时,如果没有按照学生的知识结构合理整合课程知识内容,将会降低应有的知识覆盖面。在能力提升方面,大多数学生认为创新能力和解决问题能力有待提高。从目前高校对学生培养情况看,这两种能力的确也是当今大学生最欠缺的。
ZNC催化ENRR形成氨的产氨量和法拉第效率的计算公式如下:
产氨量=mNH3/ (t×mcat.)
(2)
其中,mNH3=CNH3×V, 单位:μg;t为催化ENRR时间;mcat.为催化剂用量,单位为mg。
法拉第效率(简写为FE)= 3×F/(17×Q) 其中,F为法拉第常数,Q为催化过程中消耗的电量=i×t。i为电流,t为催化ENRR时间。
2 实验结果与讨论
2.1 氧化锆纳米晶的表征
以葡萄糖-锆离子复合粒子为前驱体,在空气退火处理后制备氧化锆纳米晶。在水热反应完成后,得到葡萄糖微球,而锆离子吸附在微球的表面。如SEM图片所示(图2a),葡萄糖-锆离子复合粒子的直径约为2 μm。空气退火过程中葡萄糖被氧化,氧化锆纳米晶形成。XRD证实了ZrO2纳米晶的形成(图2b)。在衍射图谱中,30.18°,35.16°,50.40°和60.17°处的强的特征衍射峰分别对应于四方晶相的ZrO2(JCPDS # 27-0097)的(111),(200),(220)和(311)平面。SEM图片显示氧化锆的微观形貌,有些纳米晶仍组装一起保持微米球的形貌,绝大部分的微球坍塌。TEM图片显示ZrO2纳米晶为直径约10~15 nm的纳米粒子。高分辨透射电子显微镜(HR-TEM)图片(图2d的内图)展示了ZrO2纳米晶的清晰的晶格条纹。其中0.293 nm 和0.255 nm的晶面间距分别与四方晶相ZrO2的(110)和(200)平面对应。另外,ZrO2纳米晶的选区电子衍射(SAED)图片清晰了显示ZrO2的(110),(200)和(220)平面对应的衍射环。以上结果证实了四方晶相的氧化锆纳米晶的成功合成。
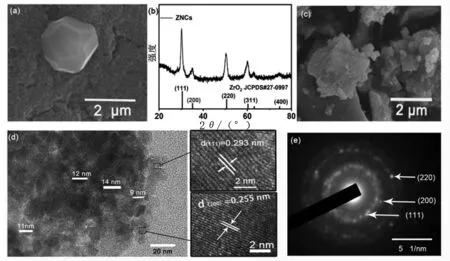
图2 (a)葡萄糖-Zr复合粒子的SEM图片;(b) ZrO2纳米晶的XRD图谱;(c) ZrO2纳米晶的SEM 图片;(d) ZrO2纳米晶的TEM 图片,内图:ZrO2纳米晶的高分辨TEM 图片;(e) ZrO2纳米晶的SAED 图案
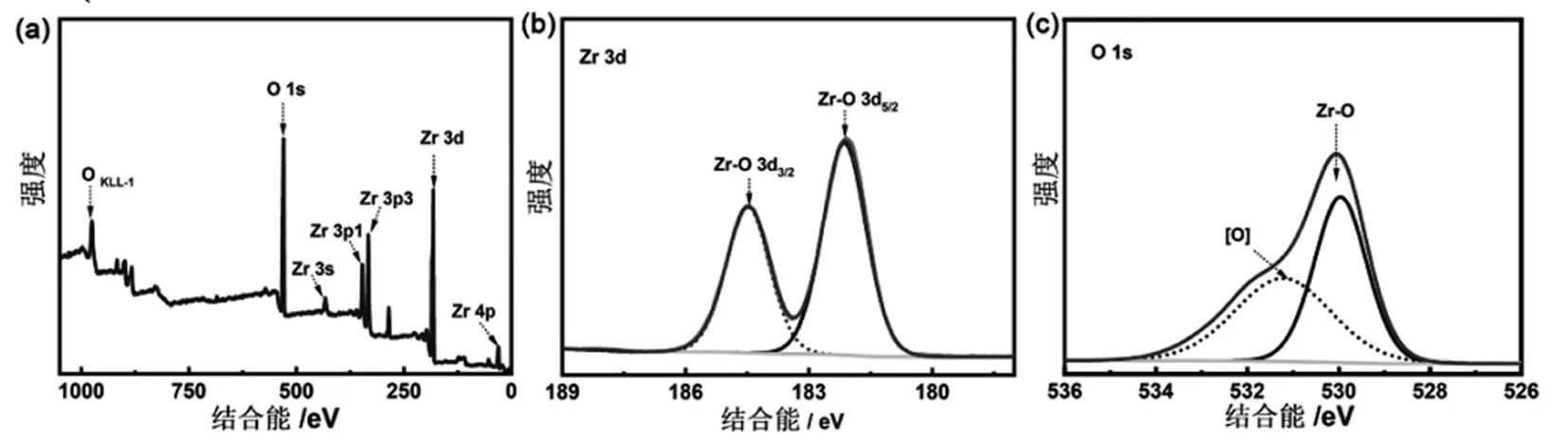
图3 ZrO2 纳米晶的高分辨XPS 图谱 (a) XPS测量光谱;(b) ZrO2纳米晶中的Zr3d 谱;(c) ZrO2纳米晶中的O1s谱
2.2 氧化锆纳米晶(ZNC)的XPS 表征
通过XPS的测定研究了ZNC的表面状态。XPS测量光谱证实了该纳米晶由Zr和O元素组成。其中,在Zr 3d 图谱中,结合能在184.5 eV和182.1 eV的强峰分别与Zr 3d3/2和Zr3d5/2相对应。这证明纳米晶中锆元素以高度氧化的Zr(IV)形式存在[18]。从O1s 图谱得知,氧化锆纳米晶体中主要存在两种形式的氧:(1)结合能在530.0 eV附近的氧化锆纳米晶晶格中的氧;(2)纳米晶表面结合的羟基(Zr-OH)或吸附的水分子(结合能在531 eV附近)。
2.3 氧化锆纳米晶(ZNC)催化ENRR合成氨的电化学性能研究
理论计算表明酸性条件更利于氮气被还原为氨,因此我们以氮气预饱和的0.1 mol/L的盐酸溶液为电解质研究了氧化锆纳米晶催化ENRR的性能。首先,分别在氮气和氩气氛围中初步研究ZNC的催化性能。线性扫描曲线显示(图4),在同样的电势下ZNC在N2氛围中的电流密度比在氩气氛围中大。这表明ZNC可能具有较好的催化ENNR性能。
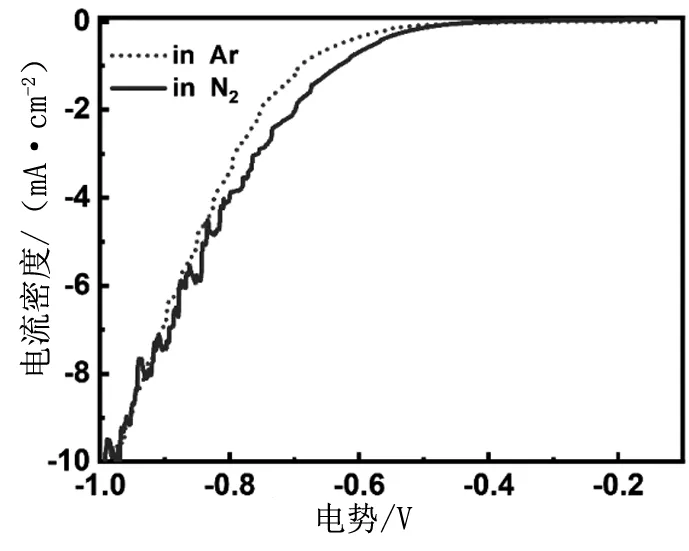
图4 ZNC 分别在氩气和氮气饱和的0.1 mol/L的盐酸溶液中的线性扫描曲线(扫描速率:5 mV/s)
随后在N2氛围中研究了不同的电势下(分别为:-0.55,-0.65,-0.75,-0.85 V vs.RHE),ZNC连续3 h催化ENRR 合成氨的性能。通过靛酚蓝指示剂法对氨定量。阴极电解质溶液的紫外吸收光谱(图5)证明了不同的电势下ZrO2纳米晶都能催化氮气还原为氨。而且,外加电势为-0.65 V的电解质溶液的紫外吸收强度最大,这预示可能在此电势下ZNC的催化性能最好。
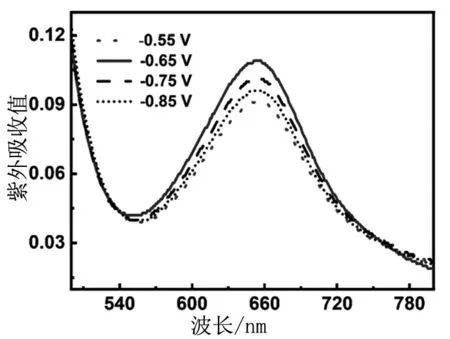
图5 靛酚蓝指示剂法测定的ZNC在不同的电势下催化ENRR的电解质溶液的紫外-可见吸收光谱
图6 展示了不同电势条件下ZNC催化ENRR的产氨量和法拉第效率。如图所示,外加电势为-0.55 V,ZNC的催化产氨量较低。但由于该电势下产生的电流相对较小,因而产氨的法拉第效率仍为6.23%。在-0.65V时,催化剂的产氨量和法拉第效率均比较高,分别为27.93 μg·h-1·mg-1和 6.18 %。这高于很多已经报导的氧化物的催化ENRR活性。然而,当外加电势更负时,产氨量并未提高。同时电流随着电势增大而增大,所消耗的电量也随之增加,而导致法拉第效率急剧降低(-0.85 V 时,产氨量20.4 μg·h-1·mg-1,法拉第效率0.86%)。因此,外加电势为-0.65 V时,ZNC 催化效果最佳。
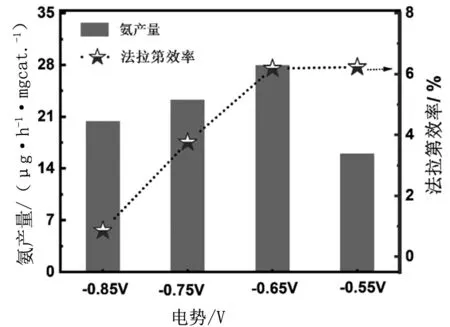
图6 不同电势下ZNC催化的ENRR的产氨量和法拉第效率
随后将电压固定在-0.65V,测试ZNC的催化ENRR性能的稳定性。令我们惊喜的是,循环5次ZNC的催化产氨量在21.63~ 31.78 μg·h-1·mg-1之间,平均值为26.53 μg·h-1·mg-1。相应的法拉第效率在5.82%~8.80%之间,平均值6.67%(图7)。因而ZNC表现出令人满意的催化ENRR活性和稳定性。
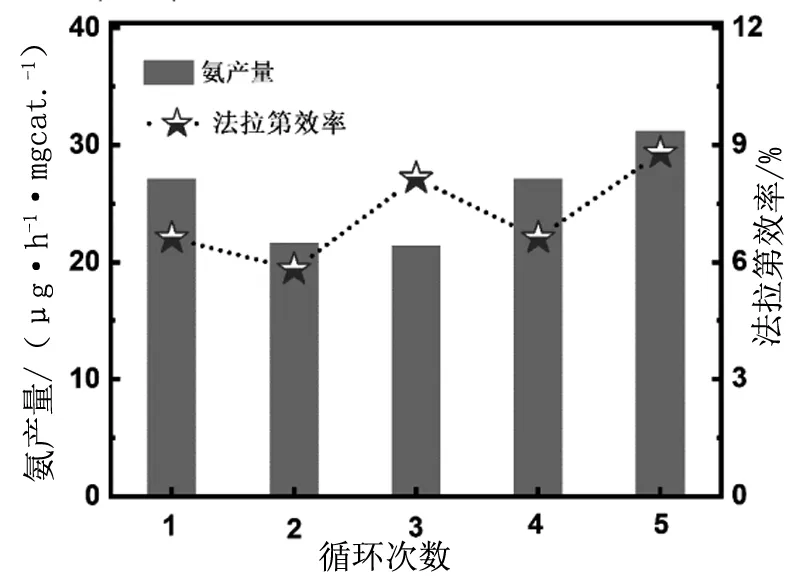
图7 电势为-0.65V(vs.RHE) 时,ZNC在0.1 mol/L HCl溶液中催化ENRR循环5次的产氨量和法拉第效率
另外,肼(N2H4)是ENRR中一个常见的副产物。根据Watt和Chrisp发展的N2H4含量测定法[19],若溶液中含有N2H4,则在波长460 nm处产生紫外吸收峰。不同电势下(-0.65,-0.75,-0.85 V)ZNC连续催化ENRR 3 h的电解质溶液的紫外吸收光谱显示,每个电势下均未出现460 nm 紫外吸收峰(图8)。 这说明,ZNC催化ENRR反应只形成NH3,并未形成N2H4,表现出良好的催化专一性。我们推测,锆对氮气强的吸附和活化能力,以及氧化纳米晶大的比表面积是氧化锆纳米晶优异催化性能的主要因素。
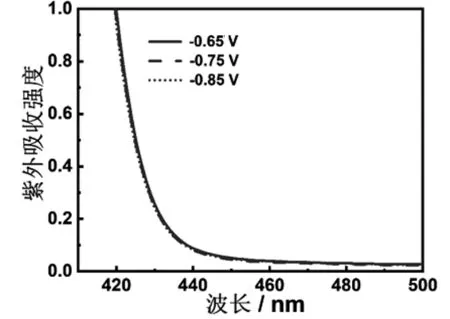
图8 不同电势下,ZNC在0.1 mol/L HCl溶液中催化ENRR产生的N2H4的紫外-可见光谱
3 结论
通过两步法合成了粒径在10~15 nm之间氧化锆纳米晶体。并首次将氧化锆纳米晶体用于催化电化学氮气还原成氨的反应。电化学合成氨测试表明氧化锆纳米晶体的产氨量和法拉第效率高达27.93 μg·h-1·mg-1和 6.18 %,并且催化过程中没有肼生成。该催化剂展现了出色的催化活性、稳定性和选择性。这为新型、高效的ENRR电催化剂的开发,提供了新的启示。

