有机实验课程设计:三组分串联反应高效合成苯并噻吩衍生物
孟祥太,季津琪,谢昊岩,黄思旖,梁茂
(天津理工大学 化学化工学院,天津 300384)
有机化学实验课程是与化学类相关的本科专业所开设的重要实验课程之一,开设此课程的目的是为了让本科生同学对一些重要有机实验的原理和操作有一定量的了解和认知。科学研究注重的是与时代背景相结合,目前,各个高校对有机化学实验课程的重视程度大不相同,一些学校的有机实验课程内容仍然一直沿用最初设立课程时所用的方案,设立的一些方案内容已经不能满足当今时代发展进步的需求,所以高校应该及时对一些落后的有机实验课程方案进行相应的调整。对于有机实验课程的实验内容选取有一定的要求,在保证参与实验课程的学生们能够正确掌握实验之外还应注意实验设计的价格成本、所需药品的危险程度、设立反应的难易程度、实验课程的开设课时以及实验老师对在实验室进行实验操作的学生管理的难易程度。因此设计环保、高效、安全的基础有机实验课程方案可以推进学科高质量发展和建设。
1 实验设计思路
1.1 引入绿色化学
由于部分有机化学反应会使用多种催化剂和一些严格的条件,并且会出现大量的中间体和副产物,其毒副作用容易对环境造成污染以及对资源造成浪费,所以,绿色化学环保理念是当代科研人员必须熟知的理念[1]。因此将绿色化学理念引入到本科有机化学实验中是当今实验课程创新改革的要点之一。“双碳”计划,即碳达峰与碳中和计划,是当今社会所追寻的目标挑战之一,目的是为了为人们生活提供绿色环保的生存环境。多米诺反应(Domino reaction)即串联反应,其是指在同一个反应环境内,向反应容器内投入多种反应物进行两步以上的反应,从环保和经济的角度讲,这在一定条件下可以在最大程度上省去中间体的分离和提纯,在一定程度上减少了有机溶剂的使用,符合国家预期的碳达峰与碳中和计划期望,已经成为有机合成中一种常见的反应模式[2]。所以我们设想将串联反应融入到有机实验课中,可以让学生们学习到绿色化学的观念,培养高校学生的环保理念,践行习近平生态文明思想,符合《高等学校课程思政建设指导刚要》中全面推进高校课程思政建设,发挥好每门课程的育人作用的要求[3]。
1.2 引入化学前沿
近些年来,随着科学研究的深入,有机合成化学有了长足的发展,最初,从利用繁琐的合成方法来合成一些简单的有机分子到现在利用串联反应可以实现复杂结构的高效构架。随着“碳中和”和“碳达峰”目标的提出,人们对于绿色能源的需求越来越高,因此,发展新型有机光电功能材料越来越受到人们的关注[4]。苯并噻吩及其衍生物是有机合成领域中重要的合成框架,因为其具有良好的光电性质,被广泛应用于有机光电功能性材料[5]。苯并噻吩及其衍生物还在作为药物中间体,合成农药以及合成染料等方向皆有着长足的发展前景,是有机合成方向的热点。最近几年,硫代靛红C-S断裂引发的多米诺反应受到科研工作者的关注[6],尤其是在三组分多米诺环化[7-9]有了长足的发展。同时,有些三组分多米诺反应可以在绿色溶剂中实现[10-11]。将这种化学前沿研究方向,引入基础有机实验课程,设计与基础有机化学理论课程知识紧密联系的有机实验课程,可以开拓学生视野,认识有机化学对世界发展产生的影响。
因此我们设计了一个成本低、产率高、安全性高、重复性好、反应时间短且符合当今时代进步发展的反应,以硫代靛红、溴代苯乙酮和哌啶为反应物,三组分在室温的条件下使用串联反应,原位合成全新的苯并噻吩衍生物,该生成物可以作为药物中间体进行进一步研究。进一步通过底物拓展和条件筛选,对反应在底物适应性方面做出了考查和测试不同溶剂对此反应的速率和产率的影响,该反应可以放大到克级,并且可以通过实验让学生们掌握利用薄层色谱(TLC)检测反应进度,利用柱层析色谱分离纯化产物,重结晶,旋转蒸发等基础实验操作,以及利用核磁共振,质谱,单晶衍射等检测手段初步对反应机理进行了解和探索,这种将实验理论和操作实践相互结合的课程设计,可以较为全面的加深本科生对有机实验机理学习能力和实验操作熟练度[12],因此本实验适合作为有机实验课程在高校中进行普及和推广。
2 实验部分
2.1 引言
本实验通过硫代靛红1a、溴代苯乙酮2a、哌啶3三组分反应,在室温下可以得到苯并噻吩类化合物4a(如图1所示)。同时,对苯并噻吩类化合物4a通过单晶衍射,核磁共振氢谱、碳谱检测以及质谱检测确定了其结构的正确性。
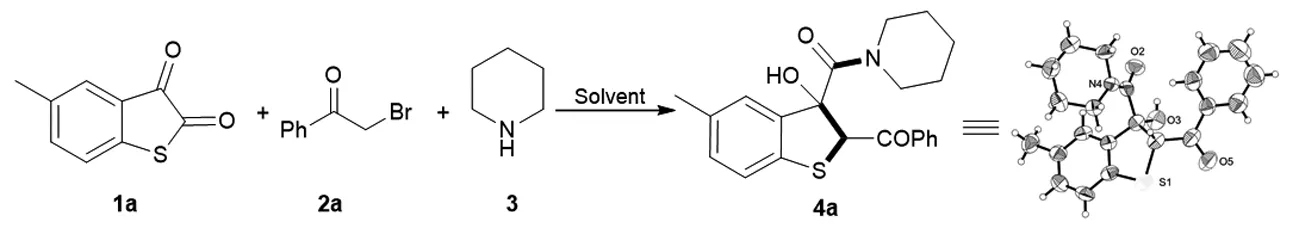
图1 苯并噻吩类化合物反应合成路线
2.2 试剂或材料
试剂材料见表1。

表1 试剂具体信息
2.3 仪器和表征方法
所用仪器见表2。
表2 仪器具体信息
2.4 条件筛选
反应的产物在通过单晶衍射进一步确定之后,随即对反应的最佳条件做出了筛选。在反应的伊始,首先,当使用的溶剂是CH2Cl2,CHCl3,CH3CN,CCl4,均以优异的收率得到目标化合物4a (表 1,Entry 1-4)。当使用醚类溶剂THF,1,4-Dioxane时,目标化合物4a的产率并没有得到提升,反而有所下降(表 1,Entry 5-6),当使用DCE作为该反应的反应溶剂时,4a的收率相较于之前仍然有所下降,仅为68%(表 1,Entry 7)。为了进一步的提高反应的收率,当Acetone作为反应溶剂时,产物4a可以以优异的收率90%得到(表 1,Entry 8)。最终通过溶剂的筛选,确定了反应的最佳溶剂为丙酮。
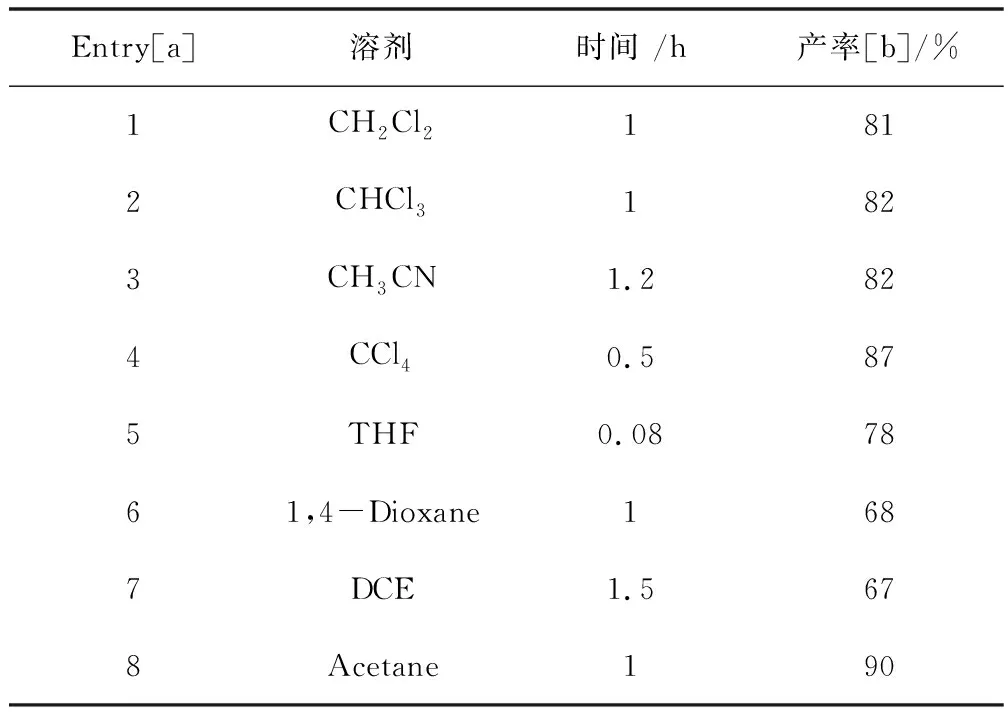
表3 反应溶剂筛选
2.5 底物拓展
为了进一步研究该串联反应,在确定了反应的最佳条件后,对于反应在底物适应性方面做出了考查(如图2所示)。首先,对溴代苯乙酮的位阻效应进行了考查,发现当R2=2-CH3时,反应仍然保持着良好的收率,以81%的收率得到产物4b。当R2=4-CH3,4-F取代时,产物4c和产物4d分别以77%和80%的收率得到。当硫代靛红被甲氧基取代时,相应的目标化合物4e以71%的收率得到。
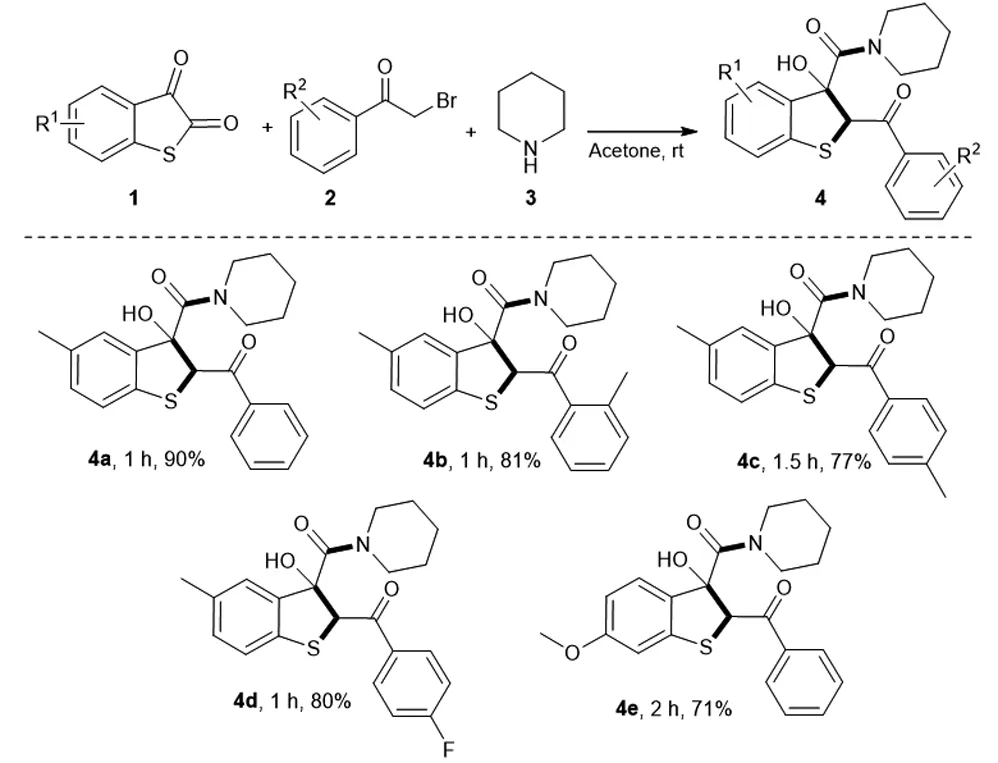
图2 底物适应性考查
2.6 反应机理研究
对于该三组分反应,通过文献的查阅[3-4],提出了合理的反应机理(如图3所示),在哌啶3的作用下,硫代靛红1a发生C-S键的断裂,得到中间体Int-A,中间体Int-A与溴代苯乙酮2a发生亲核取代反应,得到中间体Int-B,随即,中间体Int- B发生分子内的缩合得到苯并噻吩的产物4a。
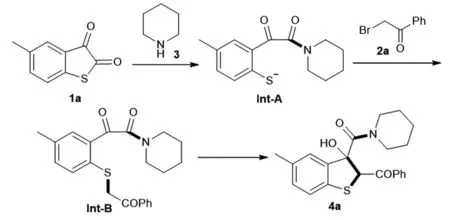
图3 反应机理
3 结果与讨论
在氩气保护下,将硫代靛红1a (0.30 mmol) 和2a (0.75 mmol) 溶于3 mL的丙酮中,随即,加入哌啶 ( 0.90 mmol),室温搅拌,TLC检测反应完全(约1h),除去溶剂,DCM萃取 (2 × 10 mL),MgSO4干燥,过滤后进行目标产物的纯化,将目标产物粗品,转于至旋转蒸发仪上进行旋蒸,之后利用柱层析法洗脱分离粗产物,并用TLC法监测洗脱过程,最终得到目标产物4。目标产物通过单晶衍射,核磁共振检测以及质谱进行表征(图4~8)。
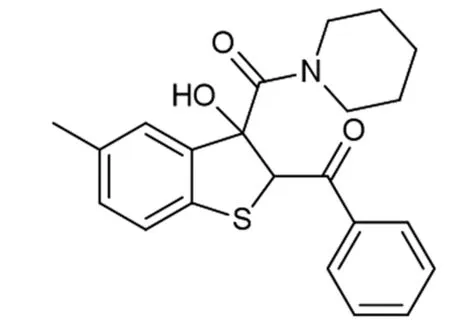
图4 化合物4a的结构图1H NMR (400 MHz,CDCl3) δ 7.85~7.76 (m,2H),7.57 (t,J=7.4 Hz,1H),7.43 (t,J = 7.8 Hz,2H),7.15 (d,J=8.0 Hz,1H),7.09 (d,J=8.0 Hz,1H),6.85 (s,1H),5.76 (s,1H),5.63 (s,1H),3.93~3.75 (m,1H),3.62~3.46 (m,2H),3.33 (s,3H),1.75~1.56 (m,4H),1.51~1.38 (m,1H),1.24~1.14 (m,1H).13C{1H} NMR (100 MHz,CDCl3) δ 193.4,170.2,139.7,137.1,136.4,135.3,133.3,131.1,128.4,125.0,122.1,85.1,61.7,47.6,45.6,25.7,25.6,24.2,20.9.HRMS (ESI-TOF) m/z [M+H]+ calcd for C22H24NO3S+382.1471,found 382.146 0。
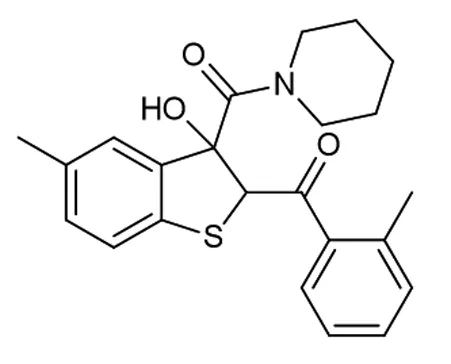
图5 化合物4b的结构图1H NMR (400 MHz,CDCl3) δ 7.41~7.34 (m,2H),7.31~7.26 (m,2H),7.20~7.13 (m,2H),7.07 (d,J=8.0 Hz,1H),6.75 (s,1H),5.70 (s,1H),5.66 (s,1H),3.77~3.62 (m,1H),3.44~3.33 (m,2H),3.26~3.11 (m,2H),2.46 (s,3H),2.25 (s,3H),1.72 ~1.53 (m,4H),1.47~1.38 (m,1H),1.24~1.13 (m,1H) 。13C{1H} NMR (100 MHz,CDCl3) δ 196.1,169.9,139.9,138.4,137.8,136.3,135.1,132.0,131.3,131.1,1267.0,124.7,124.4,122.2,84.4,65.2,47.8,45.3,25.47,25.45,24.1,20.9,20.2。
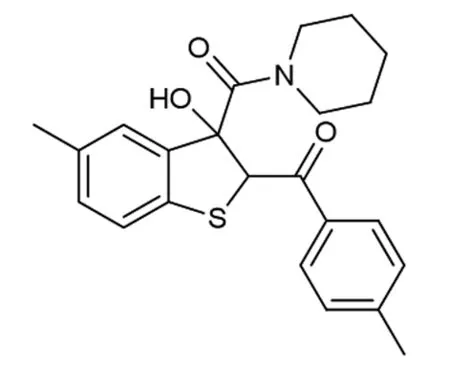
图6 化合物4c的结构图1H NMR (400 MHz,CDCl3) δ 7.74 (d,J=7.8 Hz,2H),7.23 (d,J=8.0 Hz,2H),7.14 (d,J=8.0 Hz,1H),7.08 (d,J=8.0 Hz,1H),6.86 (s,1H),5.75 (s,1H),5.63 (s,1H),3.94~3.78 (m,1H),3.62~3.48 (m,1H),3.36 (s,2H),2.40 (s,3H),2.28 (s,3H),1.73~1.39 (m,5H),1.26-1.18 (m,1H)。13C{1H} NMR (100 MHz,CDCl3) δ 192.9,170.2,144.2,139.7,136.5,135.2,134.4,131.0,129.2,128.6,125.1,122.1,100.0,85.2,61.3,47.7,45.6,25.8,25.6,24.3,21.7,20.9。

图7 化合物4d的结构图1H NMR (400 MHz,CDCl3) δ7.95~7.81 (m,2H),7.17~7.06 (m,4H),6.87 (s,1H),5.82 (s,1H),5.52 (s,1H),3.96~3.84 (m,1H),3.58 ~3.49 (m,1H),3.32 (s,2H),2.29 (s,3H),1.75~1.62 (m,4H),1.48~1.38 (m,1H),1.23-1.11 (m,1H) 。13C{1H} NMR (100 MHz,CDCl3)δ 192.10,170.18,165.7 (d,J=253.9 Hz),139.51,136.32,135.43,133.2 (d,J=3.0 Hz),131.38,131.2 (d,J=7.5 Hz),125.11,122.12,115.6 (d,J=21.8 Hz),85.09,61.72,47.60,45.71,25.79,25.49,24.20,20.97。
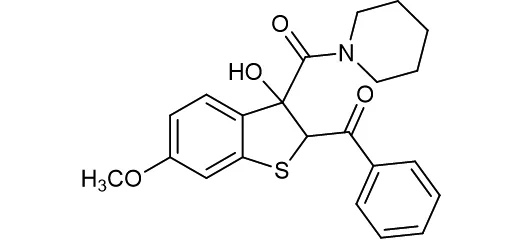
图8 化合物4e的结构图1H NMR (400 MHz,CDCl3) δ 7.81 (d,J=7.6 Hz,2H),7.57 (t,J=7.2 Hz,1H),7.43 (t,J=7.6 Hz,2H),6.94 (d,J=8.8 Hz,1H),6.83~6.75 (m,1H),6.69~6.61 (m,1H),5.73 (s,1H),5.68 (s,1H),3.93~3.86 (m,1H),3.79 (s,3H),3.54~3.44 (m,1H),3.35 (s,2H),1.69 (s,4H),1.49~1.40 (m,1H),1.25~1.13 (m,1H)。13C NMR{1H} (101 MHz,CDCl3)δ193.4,170.4,161.5,141.8,137.2,133.4,132.0,128.6,128.6,125.4,112.1,107.3,84.6,62.6,55.7,47.9,45.8,25.8,24.3。
4 结语
本实验将全新的三组分串联反应与“双碳”目标联系起来作为本科有机实验,目的让学生们懂得绿色化学的理念。本实验反应时间短,反应装置简单,包含了亲核取代反应和分子内羟醛缩合反应这两种基础有机化学重要知识点,与基础有机化学课程紧密联系,训练本科生在学习理论知识之后通过实验进一步掌握所学内容。并且本实验覆盖多种有机实验基础技术操作,例如 TLC薄层层析技术、柱层析分离技术、重结晶操作、萃取和旋蒸等操作,综合性较强。此反应重复性强,且可以放大至克量级,没有危险性操作,便于教师管理,利用4学时左右即可完成,适合在各大高校有机实验课程中进行推广开设。
5 创新性/特点/特色声明
(1)三组分串联反应具有步骤短,节省时间,节省人力、经费等优点,将传统的多步合成变成一步反应,反应选择性较高,能够引起本科生的强烈兴趣,对促进有机化学的学习和提高有机化学实验动手能力具有较大的意义。因此该实验课时短,占用学时少,值得推广。
(2)实验含有亲核取代和羟醛缩合反应,都是基础有机化学中的典型反应,综合性强。
(3)实验符合绿色化学理念,符合国家预期的碳达峰与碳中和计划。

