基于TCGA数据库分析胸苷酸合成酶基因在食管癌组织中的表达及临床意义
张文君,陈清江,张旭东,唐灿伟,吴晓爽,李 冲,王妍杰,刘栋林,马珊珊
(1.新乡医学院第三附属医院肿瘤科,河南 新乡 453003;2.新乡医学院,河南 新乡 453003; 3.郑州大学第一附属医院肿瘤科,河南 郑州 450052)
食管癌(esophageal carcinoma,ESCA)是发生在食管上皮组织的恶性肿瘤,病死率高,为全球第6大癌症死亡原因。据统计,我国2020年ESCA新发和死亡病例分别为32.4万例、30.1万例[1]。目前,化学治疗、放射治疗和手术治疗是ESCA的主要治疗措施,但经治疗许多患者仍会出现疾病进展和复发。分子靶向治疗是肿瘤治疗领域的突破性和革命性的发展,相对于化学治疗、放射治疗和手术治疗三大传统治疗手段更具有“治本”效果。新型分子标志物的研究对于ESCA的诊断、治疗靶点确定及判断预后具有重要意义,甚至可提高对发病机制的认识[2-3]。胸苷酸合成酶(thymidylate synthase,TYMS)基因编码蛋白是合成脱氧胸苷三磷酸(deoxy-thymidine monophosphate,dTMP)的限速酶,为叶酸代谢过程中重要的关键酶,在细胞增殖、分化及DNA合成方面起着关键作用;TYMS基因编码蛋白可从CH2H4转移亚甲基叶酸,催化脱氧胸苷二磷酸的还原甲基化,从而产生dTMP;而dTMP进一步磷酸化形成三磷酸(deoxythymidine triphosphate,dTTP),dTTP 是用于合成DNA的4种前体之一[4]。因此,在DNA的合成中TYMS基因表达起关键作用。TYMS功能紊乱可导致生物和遗传学异常。目前认为,TYMS基因表达与胰腺癌[5]和非小细胞肺癌[6]等多种肿瘤的细胞增殖密切相关;但是,关于TYMS基因在ESCA中的表达及其与肿瘤免疫相关性的报道很少。基于此,本研究基于癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库分析ESCA患者TYMS基因表达及其与临床特征的关系,旨在为研究TYMS在ESCA早期诊疗中的价值提供参考。
1 资料与方法
1.1 数据来源
在TCGA数据库中检索并下载ESCA的原始转录组测序数据和患者的临床信息。检索时间:2022-06-01。检索条件:(1)Cancer type:ESCA;(2)Gene:TYMS;(3)Data type:mRNA;(4)Analysis type:cancer vs.normal analysis;(5)Preferences:P-value<0.05。
1.2 方法
1.2.1 TYMS 基因表达情况与ESCA患者临床特征关系分析
以TYMS表达水平将患者分为高表达组和低表达组,采用t检验和χ2检验分析在TCGA数据库中检索到的ESCA样本和正常样本TYMS基因表达情况,分析TYMS 基因表达情况与ESCA患者临床特征的关系,
1.2.2 TYMS表达与ESCA患者预后关系分析
提取正常组织和肿瘤组织中TYMS基因表达相关的临床信息,进行差异表达及配对分析;应用Cox回归分析和预后列线图对ESCA患者进行预后分析,应用Kaplan-Meier生存分析对TYMS表达情况和临床性状与ESCA患者生存时间的关系进行分析,应用受试者操作特征(receiver operating characteristic,ROC)曲线预测TYMS与ESCA预后的相关性。
1.2.3 免疫细胞浸润水平与TYMS基因表达量的相关性分析
使用单样本基因集合富集分析(single sample gene collection enrichment analysis,ssGSEA)评估肿瘤组织浸润性免疫细胞的相对丰度,使用“GSVA”(R包)和免疫数据集分析ESCA相关基因表达谱中免疫细胞的浸润水平,采用Spearman相关性和Wilcoxon秩和检验分析免疫细胞与高表达TYMS的相关性。
1.3 统计学处理

2 结果
2.1 ESCA组织与正常组织及配对癌旁组织中TYMS基因表达水平比较
共获取173例样本的临床病理学资料,其中11例为正常样本,162例为ESCA样本。总样本中,ESCA组织中TYMS基因表达水平显著高于正常样本,差异有统计学意义 (t=6.344,P<0.001),见图1A;在8例配对ESCA和邻近癌旁组织中,ESCA组织中TYMS基因表达水平显著高于邻近癌旁组织,差异有统计学意义(t=6.866,P<0.001),见图1B。
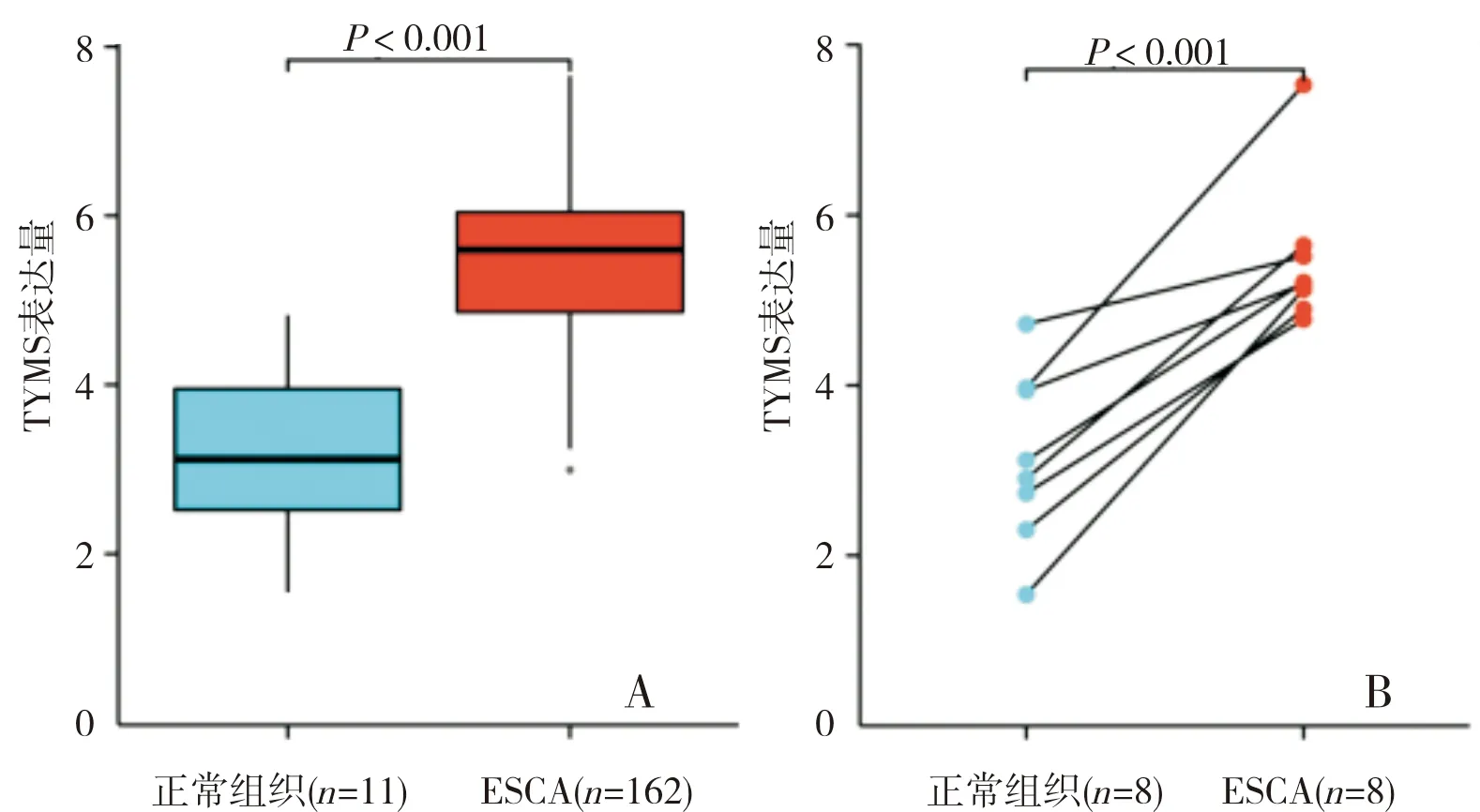
A:总样本中ESCA组织与正常组织中TYMS基因表达水平比较;B:8对匹配的ESCA组织和癌旁组织中TYMS基因表达水平比较。图1 ESCA组织与正常组织及配对癌旁组织中TYMS基因表达水平比较Fig.1 Comparison of TYMS expression level between ESCA tissue and normal tissue and paired adjacent cancer tissue
2.2 TYMS高表达组与TYMS低表达组ESCA患者临床特征比较
将ESCA样本分为TYMS高表达组和TYMS低表达组。2组患者的临床分期、病理分级、是否放射治疗及是否为Barrett食管比较差异无统计学意义(P>0.05);2组患者的年龄、体质量及组织学分型比较差异有统计学意义(P<0.05),见表1。
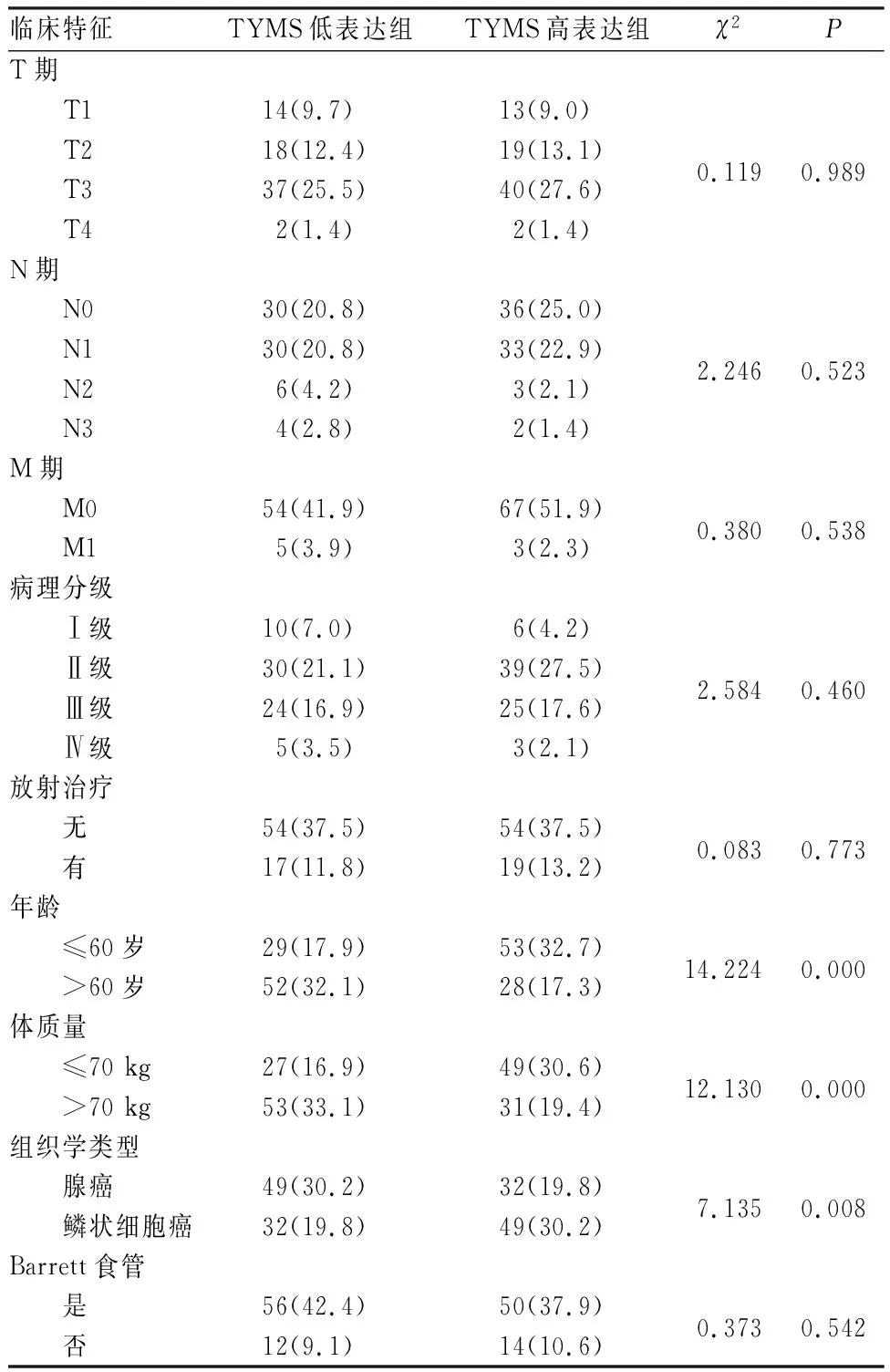
表1 TYMS高表达组与TYMS低表达组ESCA患者临床特征比较Tab.1 Comparison of clinical characteristics of ESCA patients in high expression of TYMS group and low expression of TYMS group 例(%)
2.3 TYMS对ESCA的诊断价值
ROC曲线显示,TYMS诊断ESCA的曲线下面积为0.949,95%置信区间(confidence interval,CI)为0.896~1.000,敏感度为0.909,特异度为0.791,见图2。

图2 TYMS诊断ESCA的ROC曲线Fig.2 ROC curve of TYMS in diagnosis of ESCA
2.4 TYMS基因高表达患者与低表达患者生存率的比较
TYMS基因高表达患者与TYMS基因低表达患者的总生存(overall survival,OS)率、疾病特异性生存(disease specific survival,DSS)率和无进展间隔(progress free interval,PFI)率比较差异无统计学意义(HR=0.940、1.040、0.980,P>0.05),见图3。

A:ESCA患者OS率与TYMS表达的关系;B:ESCA患者DSS率与TYMS表达的关系;C:ESCA患者PFI率与TYMS表达的关系。图3 TYMS表达与OS率的关系Fig.3 Relationship between TYMS expression and survival rate
2.5 不同临床特征患者TYMS基因表达水平与OS率的关系
在84例体质量>70 kg的ESCA患者中,TYMS基因高表达患者的OS率显著低于TYMS基因低表达患者,差异有统计学意义(P<0.05),见图4A;在106例非Barrett食管疾病的ESCA患者中,TYMS基因高表达患者的OS率显著低于TYMS基因低表达患者,差异有统计学意义(P<0.05),见图4B。在不同T、N、M分期及病理分级、是否行放射治疗、不同年龄段、食管癌、Barrett食管疾病及体质量≤70 kg患者中,TYMS基因高表达与TYMS基因低表达患者的OS率比较差异无统计学意义(P>0.05),见图4C~4T。

A:体质量>70 kg的ESCA患者TYMS与OS率的关系;B.非Barrett食管ESCA患者TYMS与OS率的关系;C:T1期ESCA患者TYMS与OS率的关系;D:T2期ESCA患者TYMS与OS率的关系;E:T3期ESCA患者TYMS与OS率的关系;F:N0期ESCA患者TYMS与OS率的关系;G:N1期ESCA患者TYMS与OS率的关系;H:N2期ESCA患者TYMS与OS率的关系;I:M0期ESCA患者TYMS与OS率的关系;J:M1期ESCA患者TYMS与OS率的关系;K:病理分级II级ESCA患者TYMS与OS率的关系;L:病理分级III级ESCA患者TYMS与OS率的关系;M:病理分级IV级ESCA患者TYMS与OS率的关系;N:未行放射治疗ESCA患者TYMS与OS率的关系;O:行放射治疗ESCA患者TYMS与OS率的关系;P:≤60岁患者ESCA患者TYMS与OS率的关系;Q:>60岁患者ESCA患者TYMS与OS率的关系;R:体质量≤70 kg的ESCA患者TYMS与OS率的关系;S:食管鳞状细胞癌ESCA患者TYMS与OS率的关系;T:Barrett食管ESCA患者TYMS与OS率的关系。图4 不同临床特征ESCA患者TYMS基因表达水平与OS率的关系Fig.4 Relationship between expression level of TYMS and OS rate in ESCA patients with different clinical characteristics
2.6 ESCA生存率预测列线图
从ESCA患者体质量及非Barrett食管ESCA患者2个方面,构建TYMS水平预测ESCA患者生存列线图,图中显示随总分值的增加,1、2、3 a生存率下降,见图5A。该预测模型的校准曲线显示,预后列线图的C指数达到0.563(0.474~0.650),所建立的1、2、3 a存活曲线与理想存活曲线匹配,见图5B。

A:预测ESCA患者1、2、3 a生存率的列线图;B:列线图的校准曲线图。图5 TYMS预测ESCA患者1、2、3 a生存率的列线图和校准曲线图Fig.5 Column and calibration plots of TYMS in predicting 1,2 and 3 years survival rates of ESCA patients
2.7 ESCA患者OS率影响因素的单因素和多因素Cox回归分析
单因素分析显示,M期、N期和初次治疗结果与ESCA患者的OS率相关(P<0.05),TYMS基因表达量与ESCA患者的OS率无关(P>0.05),见表2。多因素分析显示,肿瘤分期M期、N期是影响ESCA患者生存期的独立危险因素(P<0.05),见表3。

表2 ESCA患者OS率影响因素的单因素Cox回归分析Tab.2 Univariate Cox regression analysis of influencing factor of OS rate in ESCA patients
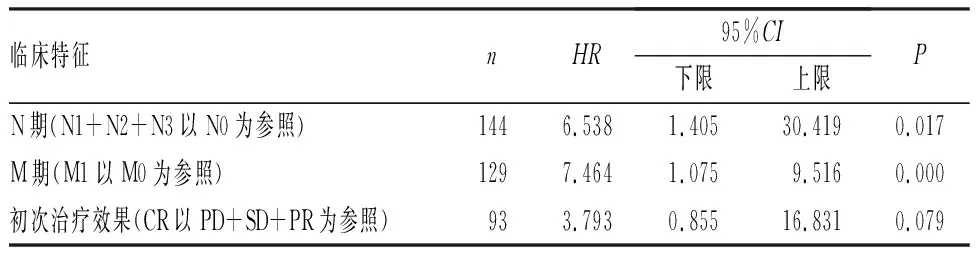
表3 ESCA患者OS率影响因素的多因素Cox回归分析Tab.3 Univariate Cox regression analysis of influencing factor of OS rate in ESCA patients
2.8 TYMS表达量与免疫浸润的相关性分析
在162例ESCA患者中,TYMS的表达水平与肥大细胞(r=0.302,P<0.05)、嗜酸性粒细胞(r=0.244,P<0.05)、树突状细胞(dendritic cell,DC)(r=0.256,P<0.05)和辅助性T细胞17(T helper cell 17,Th17)细胞的富集(r=0.270,P<0.05)呈负相关,见图6。

图6 ESCA患者TYMS表达水平与免疫细胞浸润水平的关系Fig.6 Relationship between the expression level of TYMS and the infiltration level of immune cells in ESCA patients
3 讨论
ESCA是发生在食管上皮组织的恶性肿瘤,与环境、生活习惯及遗传等因素相关[7],占所有恶性肿瘤的2%。我国ESCA的病死率位居恶性肿瘤的第6位[8],5 a生存率仅20%[9]。尽管关于食管癌的手术切除和新辅助治疗技术不断改进,但食管癌的OS率仍低于其他实体瘤,且仅有不到20%的晚期ESCA患者受益于新辅助治疗;因此,寻找有效的ESCA生物标志物,可提高诊断和治疗效率,甚至提高对发病机制的认识[10]。
TYMS是细胞分裂中的关键蛋白质,是嘧啶“从头”合成的限速酶,对于DNA复制至关重要[11],在细胞有丝分裂间期,需要dTMP对DNA进行复制、修复,在细胞快速分裂中的作用至关重要;抑制TYMS会导致核苷酸失衡,从而导致细胞死亡,因此TYMS基因在细胞的增殖和存活方面起着至关重要的作用,TYMS基因的异常表达则可能导致恶性肿瘤的发生。目前研究证实,TYMS基因在胰腺癌[5]、乳腺癌[12]、非小细胞肺癌[13]以及前列腺癌[14]中高表达。本研究结果显示,总样本中,ESCA组织中TYMS表达水平显著高于正常样本;在8例配对ESCA组织和邻近癌旁组织中,ESCA组织中TYMS表达水平显著高于邻近癌旁组织;说明TYMS基因在ESCA组织中呈高表达,该结果与其在其他肿瘤中报道的结果一致[5,12-14]。有研究表明,TYMS基因存在多态性,TYMS基因的表达受多态性的影响,TYMS基因多态性可能是评估肿瘤易感性的重要指标[15],即TYMS基因多态性可能为可靠的诊断指标,但并非可靠的预后指标。徐望红[16]研究报道,TYMS rs3819102的变异等位基因增加子宫内膜癌的发病风险,但与预后无直接关联。有研究报道,位于microRNA结合位点的3种SNP的TYMS等位基因和TYMS基因单体型的表达可提示ESCA高发病风险,但与患者的OS无关[17]。本研究结果显示,TYMS诊断ESCA的曲线下面积为0.949,95%CI为0.896~1.000,敏感度为0.909,特异度为0.791,说明TYMS对ESCA具有较高的诊断价值。但是,本研究结果显示,TYMS高表达患者与TYMS低表达患者的OS率、DSS率和PFI率比较差异无统计学意义,说明TYMS高表达对ESCA患者的OS率、DSS率及PFI率无明显影响,这可能与TYMS基因的多态性相关,与上述报道基本一致[15-17],具体机制需进一步验证。
研究表明,肥胖个体的血浆中肿瘤坏死因子-α、白细胞介素-6等促炎细胞因子和脂肪因子的异常,可促进ESCA的发展[18]。研究证实,肥胖个体的可溶性肿瘤坏死因子受体2、抵抗素、纤溶酶原激活物抑制剂1、C-反应蛋白和血清淀粉样蛋白A已被确定为肥胖-食管腺癌相关性的潜在介质[19]。Barrett食管是一种食管疾病,通常由长期的胃食管反流引起。这种疾病会导致食管黏膜发生变化,从而增加了患上食管癌的风险。本研究单因素和多因素Cox分析结果显示,TYMS基因表达水平与ESCA患者的OS率无关;但在84例体质量>70 kg的ESCA患者中,TYMS高表达患者的OS率显著低于TYMS低表达患者;在非Barrett食管疾病的ESCA患者中,TYMS高表达患者的OS率显著低于TYMS低表达患者;这说明,在体质量大、非Barrett食管的ESCA患者中TYMS是不良预后的影响因素,提示TYMS高表达可能为体质量大、非Barrett食管ESCA患者具有较高预后评估价值的生物标志物,但具体机制需进一步验证。此外,本研究从ESCA患者体质量及非Barrett食管ESCA患者2个方面构建TYMS水平预测ESCA患者生存列线图,结果显示,随总分值的增加,1、2、3 a生存率下降;该预测模型的校准曲线显示,预后列线图的C指数达到0.563(0.474~0.650),所建立的1、2、3 a 存活曲线与理想存活曲线匹配,表明该模型在预测ESCA患者OS方面具有一定的潜力。
近年来,在癌症发生发展中,免疫细胞的作用受到广泛关注[20]。研究表明,肥大细胞通过调节肿瘤的生物学过程如细胞增殖和存活、血管生成、侵袭和转移,在肿瘤微环境中发挥多方面的作用[21];嗜酸性粒细胞浸润多个肿瘤,并能够通过与肿瘤细胞相互作用直接或通过塑造肿瘤微环境间接调节肿瘤进展[22];DC作为最有效的抗原呈递细胞在抗肿瘤免疫反应的启动、进展和诱导方面起关键作用。大量研究表明,在多种肿瘤类型中都存在肿瘤浸润性DC[23];Th17细胞产生高水平IL-17,增强自然杀伤细胞和细胞毒性T淋巴细胞功能,通过激活肿瘤血管生成来产生抗肿瘤作用并促进肿瘤发展[24]。本研究结果显示,ESCA患者TYMS的表达水平与肥大细胞、嗜酸性粒细胞、DC和Th17细胞的表达量呈负相关,说明TYMS高表达会引起肥大细胞、嗜酸性粒细胞、DC和Th17细胞表达量下降,提示TYMS可能在调节ESCA免疫微环境中发挥重要作用,TYMS基因高表达会不同程度地促进肿瘤发展,然而,TYMS影响ESCA肿瘤免疫微环境和肿瘤进展的具体机制仍不清楚。
4 结论
TYMS基因在ESCA组织中呈高表达,其可在调节ESCA免疫微环境中发挥重要作用,不同程度地促进肿瘤发展;且TYMS可作为ESCA的诊断和部分类型ESCA患者预后预测的潜在生物标志物。但本研究存在一些问题:(1)TCGA数据库中包含的样本量较少,仍需要纳入更多的数据以提高结果的可靠性;(2)ESCA是恶性程度较高的肿瘤之一,并非某一个基因就可以对其预后起到决定性作用的,TYMS基因存在多态性,很可能会受到其他因素影响;(3)本模型以TCGA数据库为基础构建,缺少亚洲人群的转录组数据,在预测国人生存期方面的准确性较差;(4)此次研究TYMS基因的分子生物功能为生物信息预测工具所得,尚需要实验进一步验证。

