干旱胁迫下外源内生真菌对燕麦种子萌发及幼苗生长的影响
李晓婷,李立军,张永平,郭云飞,韩 雪
(内蒙古农业大学 农学院,呼和浩特 010019)
0 引 言
【研究意义】干旱是制约我国农业可持续发展的主要非生物胁迫因素之一[1],尤其在作物生长早期会抑制种子萌发和降低出苗率[2],制约植物的生产力[3]。外源物质在提高种子萌发,促进作物生长和缓解干旱胁迫方面已有诸多研究,如外源生长物质[4-6]、矿物质元素[7]和纳米颗粒[8-10]等。植物内生菌广泛存在于植物体内,因其与宿主植物的相容性、再感染的便捷性和不同接种方式,较非生物外源物质更有利于农业的可持续发展[11-12]。因此,探究干旱胁迫下外源内生菌下种子萌发及幼苗生长的变化,对促进旱作区作物稳产高产具有重要意义。【研究进展】植物内生菌是存在于植物体内且不会引起明显症状或对宿主造成损害的微生物类群[13]。作为新型的微生物资源,植物内生菌不仅具有较高的生态适应性,还能提高作物应对非生物胁迫的能力[14-15]。植物内生菌与植物共生体能提高宿主植物对干旱胁迫的耐受性,通过分泌有益的植物激素和其他代谢物促进植物生长,提高植物渗透调节和抗氧化能力[16-17]。在干旱胁迫下感染内生真菌的种子的发芽率高于未感染种子,且感染内生真菌的植物生物量和株高均优于未感染真菌植株。沙生梭梭的部分内生菌能够提高种子的发芽率[18],并促进植物生长。内生菌的定殖能提高种子活力,改善干旱和重金属镉等非生物胁迫下种子发芽[19-20]。当前,内生真菌作为外源物质的研究主要集中在增强植物的抗逆性方面,而干旱条件下外源内生真菌如何提高种子萌发和改变根系空间结构的相关研究仍然较少。
燕麦(Avena sativaL.)是优质的粮饲兼用作物[21],作为内蒙古地区的特色作物,多种植在农牧交错的干旱半干旱区,由于年均降水量偏少且分布不均,连年受到干旱的影响。【切入点】干旱缺水影响燕麦整个生育期的生长发育,尤其是在生长发育前期,表现为出苗率和成苗率低,造成该区燕麦产量较低。外源物质浸种是提高种子萌发的技术手段,而关于外源内生真菌对干旱胁迫下种子萌发和幼苗生长及生理特性变化的报道较少。【拟解决的关键问题】本研究利用PEG-6000 模拟干旱胁迫,结合不同内生真菌发酵液处理,探究正常水分和干旱胁迫下外源内生真菌对种子萌发和幼苗形态指标变化特征的影响,进一步揭示外源内生真菌提高植物耐旱特性的生理机制,以期为农业生产中外源植物内生真菌的合理应用提供理论依据。
1 材料与方法
1.1 试验材料
供试内生真菌为镰刀菌属 O-2(Fusarium equiseti,登录号 ON495943)和链隔孢属 O-66(Alternaria pomicola,登录号ON500608),由内蒙古农业大学燕麦产业研究中心从农牧交错区燕麦中分离纯化获得,保存于-80 ℃超低温冰箱。菌种预先在马铃薯葡萄糖培养基中(PDA)(马铃薯葡萄糖培养基20 g,琼脂22 g,蒸馏水1 000 mL)培养7 d。供试内生真菌发酵培养基为Czapek 培养基(NaNO33 g、K2HPO41 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、FeSO40.01 g、蔗糖30 g、蒸馏水1 000 mL)。供试作物为燕麦(Aνena satiνaL.),品种为燕科2 号。
1.2 内生真菌发酵液的培养和燕麦种子表面消毒
将在PDA 培养基上培养7 d 的内生真菌用打孔器打出直径5 mm 的菌饼,用接种针挑取菌饼分别接种到250 mL 的锥形瓶中,每个锥形瓶含有100 mL 的Czapek 培养基,培养基中放置3 个菌饼,在恒温振荡箱中28 ℃、160 r/min 黑暗条件下培养7 d,调节发酵液的吸光度值(OD600nm)为1(约为1×108CFU/mL)。
燕麦种子的表面消毒在超净工作台中进行。选取籽粒饱满、大小均匀的燕麦种子,置于75%乙醇中浸泡1 min,无菌水冲洗2 次,再用3%的NaClO溶液消毒5 min,接着用无菌水冲洗5 次,然后将种子置于无菌滤纸上晾干备用。
1.3 试验设计
1.3.1 燕麦种子萌发试验
试验采用水培养基法进行种子萌发试验。设2个水分处理,分别为正常水分(WW)和12%的PEG-6000 干旱胁迫处理(HD);向培养皿添加100µL 的O-2、O-66 内生真菌发酵液,以添加等量Czapek 培养基为对照(CK),共计3 种添加液,合计6 个处理,每个处理重复3 次。将消毒后的燕麦种子置于不同处理的培养皿中,每个培养皿(直径90 mm)放置燕麦种子30 粒,将培养皿置于人工气候箱中培养(光照25 ℃、16 h,黑暗20 ℃、8 h,湿度70%)。以种子胚芽长达到燕麦种子的1/2 为萌发标准,逐日观察种子发芽情况并记录种子发芽数,待连续2 d 种子发芽数不变视为种子发芽结束,持续观察7 d。
1.3.2 干旱胁迫下外源内生真菌对燕麦幼苗影响的试验
将表面消毒过的燕麦种子均匀置于消毒并含有2 层用无菌水浸润滤纸的发芽盒(13 cm×19 cm×12 cm)中培养,待种子发芽5~7 d 后,选取长势均匀一致的幼苗用海绵固定在35 孔育苗盘上,每孔1 株苗,同时用无菌的刀片割破燕麦的根系表皮,移栽到含有无菌1/4 的Hoagland 营养液的水培盒(1.25 L)中,水培盒大小与发芽盒一致,周围用黑色胶带裹缠,避免根系透光。每隔4 d 更换1 次营养液,并逐次提高Hoagland 营养液质量浓度。将幼苗置于光照充足、恒温的育苗室中培养,并保持16 h 光照、8 h 黑暗,温度分别控制在25、20 ℃,光温交替周期循环。
试验采用二因素随机区组设计。将经过水培的燕麦苗分成3 组进行内生真菌处理,分别为对照(CK,添加10 mL 的Czapek 培养基)、O-2 和O-66内生真菌处理(分别添加10 mL 内生真菌发酵液)。在幼苗培养15 d 后进行模拟干旱胁迫处理,每个内生真菌处理的燕麦苗分为2 组,一组为Hoagland 营养液处理(WW),另一组为添加12%的PEG-6000的Hoagland 营养液(HD),共6 个处理,每个处理重复3 次。试验期间定期随机调整各处理燕麦幼苗的位置,并每隔4 d 更换1 次营养液。干旱胁迫15 d 后结束,随即进行各项指标的测定。
1.4 外源内生真菌在植株体内的检测
在种子萌发试验结束后,取不同水分处理及外源内生真菌处理下的燕麦幼苗胚根检测内生真菌的定殖情况。将燕麦幼苗的根系碎片经过无菌水冲洗后,置于95%乙醇内进行表面消毒10 s,然后在5%的NaClO 溶液浸泡30 s,再用无菌蒸馏水冲洗5次,使用无菌滤纸擦净水分,无菌剪刀修剪根系两端,使之成为约0.5 cm 的片段,然后将根段置于直径90 mm 含有PDA 培养基的培养皿内,每个培养皿内放置15 个根片段,共重复3 次,在28 ℃培养箱内黑暗培养7 d,观察根系中的内生真菌情况,并统计各内生真菌处理下根中的内生真菌侵染率。
1.5 测试指标及方法
根据许文博等[22]、王欢等[23]的方法计算种子发芽势和发芽率,计算式分别为:
种子发芽结束后,从每个处理中随机选取10 株燕麦,测定燕麦胚根长和胚芽长。
水培试验结束后,每个处理随机选取15 株燕麦幼苗测量株高;随机选取9 株燕麦的根系用根系扫描仪(Epson Expression 10000XL,日本爱普生)和根系形态与结构分析应用系统WinRHIZO Pro2005b测定根系总长度、根系投影面积、根系总表面积、根系总体积和根尖数;取20 株燕麦幼苗置于牛皮纸袋中,105 ℃杀青30 min,85 ℃烘干至恒质量后称量并记录冠层和根干质量。
根系活力采用TTC 法测定[24],超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)光还原法测定[25],过氧化物歧化酶(POD)采用愈创木酚法测定[25],过氧化氢酶(CAT)采用过氧化氢法测定[26],丙二醛(MDA)采用硫代巴比妥酸法测定[27]。
1.6 数据分析
使用Excel 2019 整理数据并绘图,采用IBM SPSS Statistics 25 进行方差分析,运用Origin 2021对幼苗形态指标进行主成分分析(PCA)。
2 结果与分析
2.1 外源内生真菌在燕麦根中的侵染率
2 个接种外源内生真菌处理的燕麦根系在各水分处理下均能发现内生真菌,如图1 所示,图中同一水分处理间不同外源内生真菌添加处理上不同小写字母表示添加不同外源内生真菌处理的该项指标差异显著,下同。在正常水分(WW)处理下,接种内生真菌根系侵染率均达到60%以上,干旱胁迫下燕麦幼苗根系的侵染率显著低于正常水分处理(P<0.05),但侵染率均在40%以上,但添加外源内生真菌处理间的差异不显著。
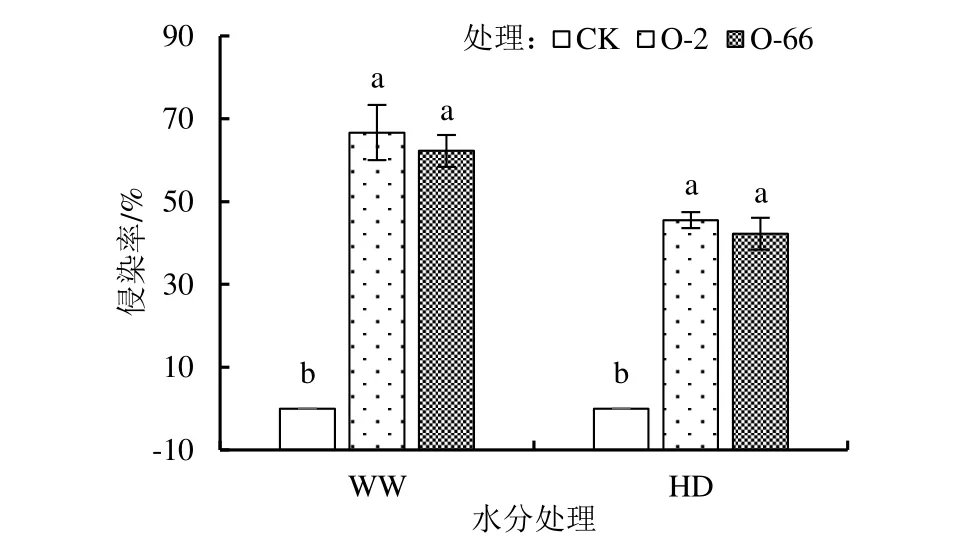
图1 外源内生真菌在燕麦胚根中的侵染率Fig.1 Infection rate of exogenous endophytic fungi in oat radicle
2.2 外源内生真菌对不同水分处理下燕麦种子萌发的影响
外源内生真菌对干旱胁迫下燕麦发芽率和发芽势的影响如图2 所示。由图2 可知,在正常水分处理(WW)下,添加外源内生真菌O-2、O-66 处理均提高了燕麦种子的发芽率,但与CK 差异不显著;在干旱胁迫下(HD),添加外源内生真菌处理显著提高了种子发芽率(P<0.05),分别较CK 提高了48.94%和44.68%(图2(a))。正常水分处理(WW)下,添加外源内生真菌处理的燕麦种子发芽势显著高于CK;干旱胁迫下(HD),仅添加外源内生真菌O-66 处理较CK 显著增加了41.18%(P<0.05)。水分和添加内生真菌均极显著的影响种子的发芽率和发芽势(P<0.001),二者的交互作用对种子发芽率达显著水平(P<0.05),且极显著的影响种子发芽势(P<0.001)(表1)。

表1 水分处理和添加外源内生真菌对燕麦种子萌发指标双因素方差分析Table 1 Two-factor variance analysis of oat seed germination indexes under different water treatments and exogenous endophytic fungi

图2 不同水分处理下添加外源内生真菌对燕麦种子发芽率和发芽势的影响Fig.2 Effects of exogenous endophytic fungi on germination rate and germination potential of oat seeds under different water treatments
2.3 外源内生真菌对不同水分处理下燕麦胚根长和胚芽长的影响
外源内生真菌对不同水分处理下燕麦胚根长和胚芽长的影响如图3 所示。由图3 可知,在正常水分(WW)和干旱胁迫处理下(HD),添加外源内生真菌均显著增加了燕麦胚根长和胚芽长(P<0.05)。O-2、O-66 处理的胚根长在正常水分处理下(WW)分别是CK 的1.13 倍和1.19 倍,在干旱胁迫下(HD)分别是CK 的1.15 倍和1.36 倍。O-2、O-66 处理的胚芽长在正常水分(WW)处理下较CK 分别增加了14.65%和31.23%,而在干旱胁迫(HD)下分别较CK 增加了17.93%和42.45%。水分处理和添加外源内生真菌均极显著影响胚根长和胚芽长(P<0.001),而二者交互作用对各指标的影响不显著(表1)。
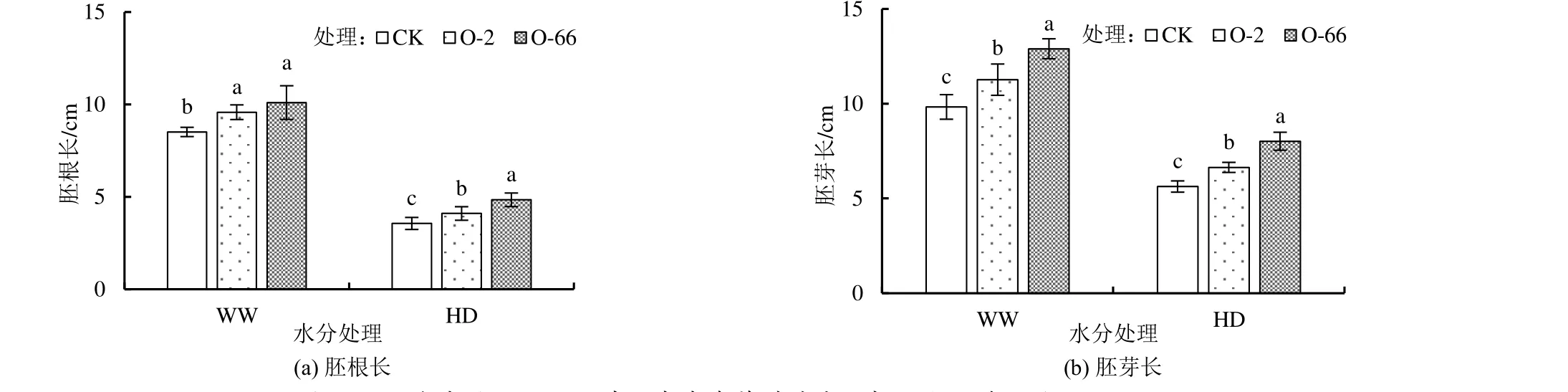
图3 不同水分处理下添加外源内生真菌对燕麦胚根长和胚芽长的影响Fig.3 Effects of exogenous endophytic fungi on radicle and germ length of oat under different water treatments
2.4 外源内生真菌对不同水分处理下燕麦幼苗表型指标的影响
外源内生真菌对不同水分处理下燕麦幼苗形态指标的影响如图4 所示。由图4 可知,在正常水分处理下(WW),O-66 处理显著提高了燕麦的株高、冠层干质量和根干质量,分别较CK 增加了21.41%、27.92%和30.63%(P<0.05)。在干旱胁迫下(HD),添加内生真菌O-2、O-66 均显著提高了燕麦株高、冠层干质量和根干质量(P<0.05)。干旱胁迫(HD)下,CK 的株高和总干质量(冠层干质量+根干质量)分别较正常水分(WW)下降低了10.26%和34.63%,而 O-2 处理的株高和总干质量降低了 9.33%和33.69%,O-66 处理的株高和总干质量降低了8.59%和29.28%。故干旱胁迫(HD)下,O-2 处理燕麦根冠比显著增加(P<0.05)。由表2 可知,干旱对燕麦各指标的影响均达到极显著水平,添加内生真菌处理对燕麦株高、冠层干质量和根干质量的影响极显著(P<0.001),对根冠比的影响显著(P<0.05),而水分与添加内生真菌的交互作用对各指标的影响不显著。
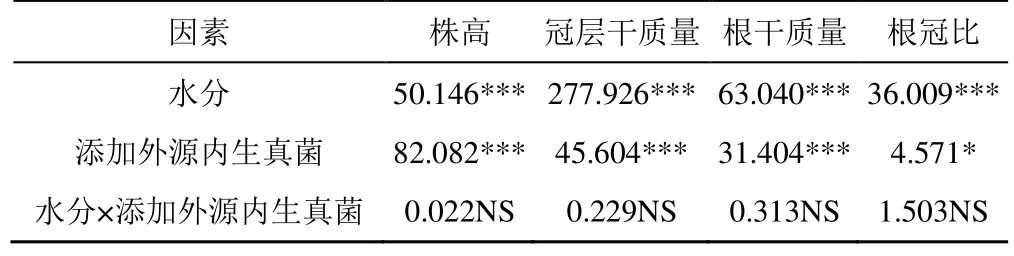
表2 外源内生真菌和水分处理对燕麦幼苗表型指标的双因素方差分析Table 2 Two-factor variance analysis of exogenous endophytic fungi and water treatment on phenotypic indexes of oat seedlings
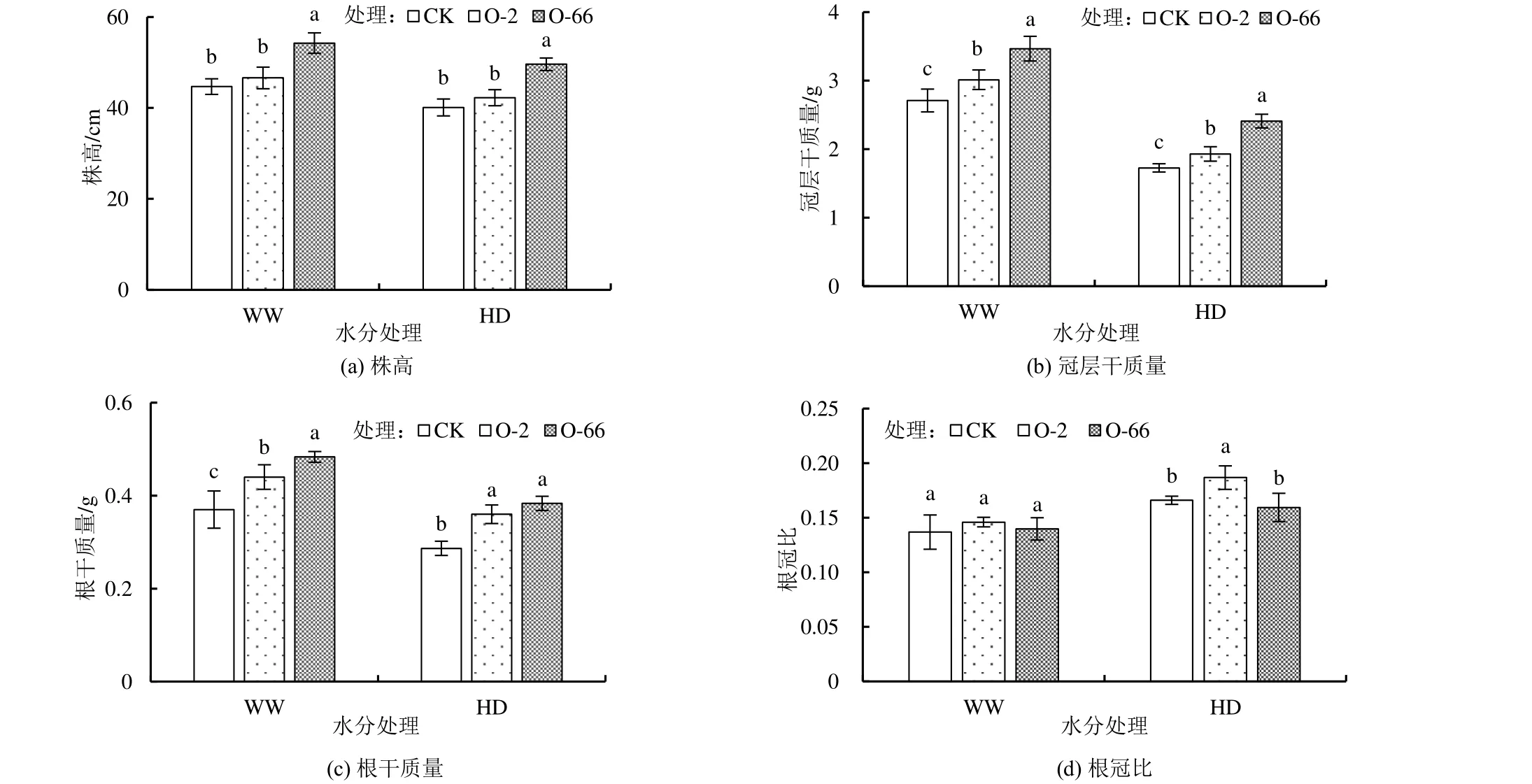
图4 不同水分处理下添加外源内生真菌对燕麦幼苗表型指标的影响Fig.4 Effects of exogenous endophytic fungi on morphological indexes of oat seedlings under different water treatments
2.5 外源内生真菌对不同水分处理下燕麦幼苗根系的影响
外源内生真菌对不同水分处理下燕麦幼苗根系指标的影响如表3 所示。由表3 可知,正常水分处理下(WW),添加外源内生真菌O-2、O-66 处理均显著提高了根系总长度、根系投影面积、根系总表面积和根尖数,而对根系总体积影响显著的为O-66 处理。在干旱胁迫下(HD),添加外源内生真菌O-66处理显著促进了根系总长度、根系投影面积、根系总表面积、根系总体积和根尖数的增加,分别较CK增加了20.40%、35.47%、31.84%、36.94%和59.24%。双因素方差分析表明(表3),水分胁迫和内生真菌处理均对根系总长度、根系投影面积、根系总表面积和根系总体积有极显著影响(P<0.001),而水分处理对根尖数的影响显著(P<0.05),内生真菌对根尖数的影响达到极显著水平(P<0.001)。水分和内生真菌的交互作用对根系总表面积(P<0.001)和根系总体积(P<0.01)的影响极显著,对根系投影面积的影响达到显著水平(P<0.05)。
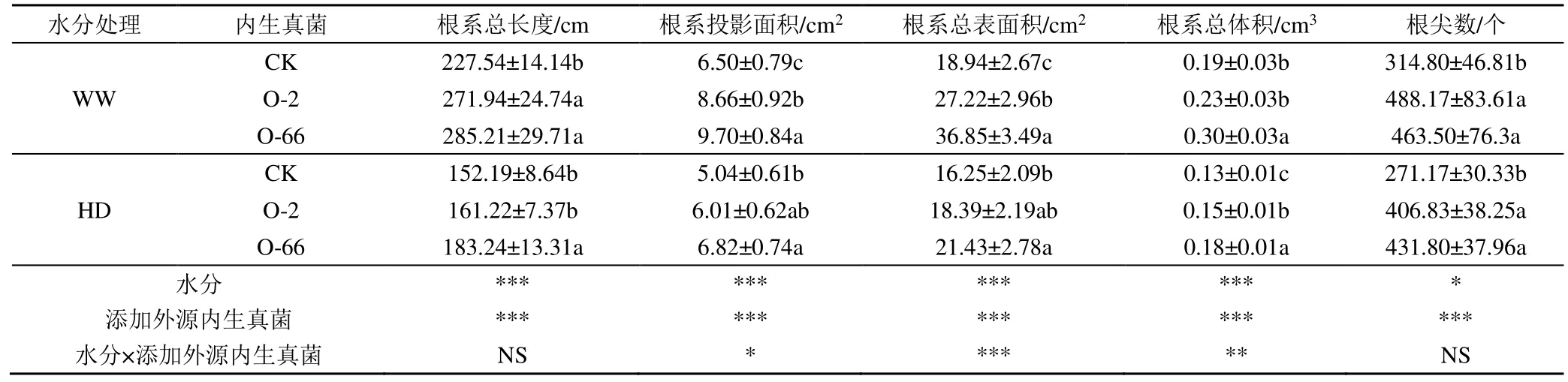
表3 外源内生真菌对不同水分胁迫下的燕麦根系指标的影响Table 3 Effects of exogenous endophytic fungi on morphological indexes of oat seedlings under different water treatments
2.6 不同处理燕麦形态指标的主成分分析(PCA)
对各处理燕麦种子萌发及幼苗形态指标进行主成分分析(PCA)如图5 所示,PC1 和PC2 分别解释了总体方差的78.4%和9.6%,PC1 很好地把不同水分处理分开,WW 水分处理出现在第2、第3 象限,HD 水分处理出现在第1、第4 象限,根冠比与HD 水分处理关系密切,而其他指标均与WW 水分处理关系密切(图5(a));对不同外源内生真菌处理下的燕麦指标进行主成分分析(图5(b))发现,PC1 和PC2 分别解释了总体方差的71.7%和13.3%,PC1 和PC2 分别将3 个处理明显分离,添加外源内生真菌O-2 处理的根冠比最大,添加外源O-66 处理与根系结构指标、发芽率、发芽势、干物质积累量等指标的关系密切,CK 出现在第4 象限,与各指标的距离均较远。
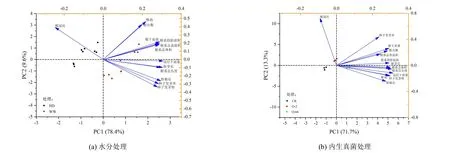
图5 不同水分处理和不同外源内生真菌处理燕麦各形态指标的主成分分析Fig.5 Principal component analysis of oat indexes under different water and different exogenous fungal treatments
2.7 外源内生真菌对不同水分处理下燕麦生理特性的影响
内生真菌对不同水分处理下燕麦幼苗生理特性的影响如图6 和表4 所示。干旱胁迫下(HD),添加外源内生真菌O-2、O-66 处理的根系活力显著高于CK(P<0.05),分别增加了23.54%和15.34%。添加外源内生真菌处理的SOD、POD、CAT 活性均高于CK,在干旱胁迫下均显著高于CK(P<0.05),而2 个添加外源内生真菌处理间差异不显著。正常水分(WW)下,各处理的丙二醛(MDA)量变化差异不显著;干旱胁迫下,添加外源内生真菌处理显著降低了MDA 量(P<0.05),与CK 相比,O-2、O-66 处理分别降低了10.33%和9.27%。双因素方差分析(表4)表明,水分和外源内生真菌交互作用显著(P<0.05)影响对燕麦POD 活性和CAT 活性(P<0.05)。
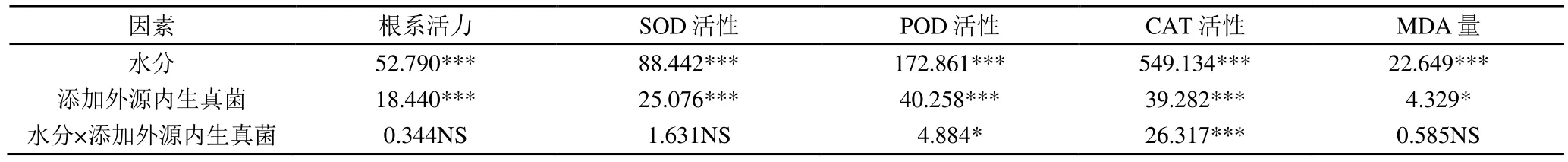
表4 水分和添加外源内生真菌对燕麦幼苗各指标双因素方差分析Table 4 Two-factor variance analysis of indexes of oat seedlings under different water treatments and exogenous endophytic fungi
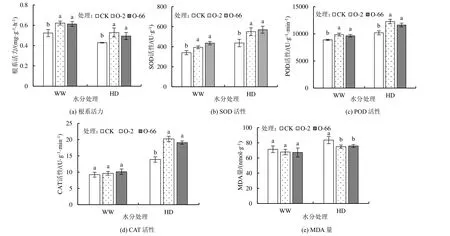
图6 不同水分处理下添加外源内生真菌对燕麦生理指标的影响Fig.6 Effects of exogenous endophytic fungi on physiological indexes of oat under different water treatments
3 讨 论
3.1 外源内生真菌对种子萌发的影响
种子萌发是植物生命周期中关键的阶段之一[28],会受到多方面因素的影响[29-30]。内蒙古农牧交错区是我国燕麦作物的主栽区,播种时期常会面临风大雨少、土壤墒情差的情况,直接影响种子萌发。本研究采用PEG-6000 模拟干旱胁迫下接种内生真菌对种子萌发的影响,发现外源内生真菌O-2、O-66 均能定殖在燕麦的胚根上,干旱胁迫下接种外源内生真菌均提高了燕麦种子的发芽率和发芽势,这说明外源内生真菌侵染种子后,增强了种子对胁迫的耐受性[31],缓解了干旱胁迫对种子萌发的抑制作用。本研究参与试验的内生真菌分别是镰刀菌属(Fusariumsp.)和链格孢属(Alternariasp.)对种子萌发均有积极的作用,这二类内生真菌的功能也从Qiang 等[32]和Khan 等[33]的研究中证实。内生真菌侵染后提高了草甸羊茅种子的发芽率,而对高羊茅种子的影响不显著[34],甚至接种内生真菌镰刀菌(Fusariumsp.)会降低种子发芽率[35]。这表明内生真菌对不同作物的种子萌发均有一定的促进或抑制作用,这可能与内生真菌与作物互作产生的代谢产物有关。在自然界中,内生真菌广泛存在于植物中,经过长期的进化后一部分可能与作物互利共生,而另一部分在特定环境下会对寄主产生不利影响[36-37]。本研究发现接种内生真菌会显著促进燕麦胚根和胚芽的生长。内生真菌对燕麦种子萌发的积极作用,可能是由于提高了种子的渗透调节能力,或产生生长调节物质,打破干旱胁迫对种子的休眠作用,提高种子活力,促进了种子萌发[38-39]。
3.2 外源内生真菌对燕麦水培幼苗生长的影响
本研究发现干旱胁迫会抑制燕麦幼苗的生长,而添加外源内生真菌O-2、O-66 处理的燕麦株高、冠层干质量和根干质量均显著高于CK,故接种外源内生真菌会缓解干旱胁迫对燕麦生长的影响,这与Waqas 等[40]的研究一致,内生真菌在干旱胁迫下显著提高了植株生物量和相关生长参数。干旱胁迫会破坏质膜系统,打破渗透平衡,抑制植物的生长。抗氧化酶可以清除活性氧物质,本研究发现,干旱胁迫下接种内生真菌均显著增加了SOD、POD、CAT 酶活性,降低了MDA 量,这与Yogendra 等[17]的研究一致,表明外源内生真菌的定殖能提高抗氧化保护酶活性,抑制活性氧物质的累积,有效缓解干旱胁迫对细胞膜的损伤,提高燕麦的抗旱能力。
本研究中干旱胁迫显著降低了根干质量和根系活力,而添加外源内生真菌提高了根干质量和根系活力,同时提高了根系总长度、总表面积、总体积和根尖数,说明接种内生真菌能改变根系结构,其原因可能是内生真菌最初先定殖在根中并产生促进根系生长的调节物质[41-42],提高了根系活力,也可能是由于内生真菌发酵液中的物质能够间接影响植物的生长[43],这与Martinuz 等[44]和Verma 等[45-46]的研究结果一致。内生真菌与作物的生长存在一定的同步性,且会提高作物的耐旱性。植物根中的内生真菌可能会促进碳水化合物的积累,或改变根系生理生态,从而减轻干旱胁迫的影响[47]。
本研究中,外源内生真菌的应用缓解了干旱胁迫对燕麦种子萌发和幼苗生长的影响,且2 种外源内生真菌均对燕麦生长有积极的作用,该结果为外源内生真菌提高作物耐旱性的应用提供了理论基础。同时,后续即将开展内生真菌对燕麦在萌发和幼苗生长阶段植株代谢物变化、内源激素及渗透调节物质等方面的研究,从多角度揭示内生真菌提高燕麦耐旱性的机理。
4 结 论
1)干旱胁迫抑制了燕麦种子的萌发,而外源内生真菌处理提高了种子的发芽率,且能促进胚根和胚芽的伸长。
2)外源内生真菌的应用缓解干旱胁迫对植株的不利影响,提高了抗氧化酶活性,降低植株体内丙二醛量,改善根系结构,提高根系活力,促进幼苗生物量的累积。其中,添加外源内生真菌O-66 处理燕麦的抗旱效果较好。
(作者声明本文无实际或潜在的利益冲突)

