高血压肾病患者血清PEPT1和PEPT2表达与肾功能减退及预后的相关性分析*
雷 琳,董有睿,王晓平
贵州航天医院/遵义医科大学附属航天医院健康管理科,贵州遵义 563000
高血压肾病是高血压最常见的并发症,基本病理特征为肾小动脉硬化继发的肾实质损害,发病机制主要为肾脏血流动力学改变和血管重构导致[1]。高血压可诱发肾纤维化或肾小管间质纤维化,纤维化组织逐渐取代正常肾组织,导致肾功能衰竭,20%~40%肾病患者在肾活检确诊后20年内最终进展为终末期肾病(ESRD)[2]。研究显示不受控制的血压增高是ESRD的主要危险因素,高血压患者较健康人群增加2倍的ESRD风险,加强血压控制可能会减缓慢性肾病的进展,降低ESRD的风险[3-4]。肠肽转运蛋白(PEPT)1、PEPT2在肽类物质和药物吸收发挥着关键的作用,肠黏膜和肾脏组织中PEPT表达异常可影响降压药物的吸收,降低其生物利用度[5],不利于血压控制。因此推测PEPT1、PEPT2可能与高血压肾病存在一定关联,本研究通过检测血清PEPT1、PEPT2水平,分析其与高血压肾病预后的关系,以期为临床诊治提供参考。现报道如下。
1 资料与方法
1.1一般资料 选取2010年1月至2020年1月本院肾内科收治的192例高血压肾病患者作为高血压肾病组。男121例,女71例,年龄52~75岁,平均(62.35±5.49)岁,高血压病程8~16年,平均(12.65±2.85)年,高血压肾病病程5~14年,平均(9.15±2.65)年,合并疾病:冠心病38例,脑梗死29例,慢性阻塞性肺疾病19例。纳入标准:(1)符合《中国高血压防治指南2010》中诊断标准[6];(2)符合改善全球肾脏病预后组织(KDIGO)拟题的慢性肾病诊断标准[7];(3)年龄>18岁。排除标准:(1)糖尿病、系统性红斑狼疮等其他因素导致的继发性肾病;(2)原发性肾小球肾炎、肾病综合征或先天性肾脏疾病;(3)恶性肿瘤、消化系统疾病、免疫系统疾病及急慢性感染;(4)血液系统疾病。另随机选择同期于本院门诊体检的63例健康志愿者为对照组,已排除先天或继发性肾病及全身系统性疾病,男34例,女29例,年龄53~77岁,平均(62.41±5.03)岁,两组基线资料比较差异无统计学意义(P>0.05),具有可比性。本研究获得本院伦理会批准,所有受试者对本研究相关事宜知情并签署知情同意书。
1.2仪器与试剂 EasyPure micro RNA Kit购自北京全式金生物技术公司,7500 实时荧光定量聚合链反应仪购自美国ABI 公司,AU680全自动生化分析仪购自美国贝克曼库尔特公司。
1.3方法
1.3.1PEPT1、PEPT2检测 所有受试者入组后均采集静脉血5 mL注入促凝管中,取上层液以3 000 r/min 速度离心10 min,收集血清-80 ℃储存。取血清样本,室温复融,EasyPure micro RNA Kit从血清中提取总RNA,通过紫外分光光度计和琼脂糖凝胶电泳检测其纯度、浓度和完整性,选择吸光度(A)比值A260/A280为1.6~1.8的RNA,采用TransScript®miRNA RT Enzyme Mix、 2×TS miRNA Reaction Mix 对总 RNA 进行逆转录。应用实时定量聚合链反应检测PEPT1、PEPT2表达。PCR反应体系如下:cDNA 1 μL,上下游引物0.4 μL,2×TransTaq®Tip Green qPCR SuperMix 10.0 μL,参比染料(50×) 0.4 μL,最后添加双蒸水至20.0 μL。PCR反应条件为94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火30 s,共40个循环。引物序列为PEPT1上游:5′-CTCCCAATGTTCTGGGCCTT-3′;下游:5′-CGTTCACGGTCTGCATCTGA-3′。PEPT2 上游:5′-ATCAGCAGGGTTCACGATGG-3′;下游:5′-CCACACTTGGAGACCAGACG-3′。U6上游:5′-CTCGCTTCGGCAGCACA-3′;下游:5′-AACGCTTCACGAATTTGCGT-3′。以U6为内参,采用2-ΔΔct计算PEPT1、PEPT2相对表达水平。取血清样本,全自动生化分析仪检测血尿素氮(BUN)、血肌酐(Scr),采用肾脏病膳食改良试验公式计算出估算的肾小球滤过率(eGFR)。
1.3.2随访和临床资料收集 所有高血压肾病患者出院后均定期电话随访和门诊定期复查肾功能,随访截止2022年7月,记录ESRD发生情况,ESRD定义为eGFR持续性低于15 mL/(min·1.73 m2),或开始透析或肾移植治疗[8]。收集患者年龄、性别、收缩压、舒张压、高血压病程、高血压肾病病程、合并疾病(冠心病、脑梗死、慢性阻塞性肺疾病)、降压治疗[血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、血管紧张素受体脑啡肽酶抑制剂(ARNI)]资料。
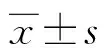
2 结 果
2.1两组血清PEPT1、PEPT2和肾功能指标水平比较 高血压肾病组血清PEPT1、PEPT2相对表达水平和eGFR低于对照组,BUN、SCr 水平高于对照组,差异均有统计学意义(P<0.05)。见表1。
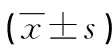
表1 两组血清PEPT1、PEPT2和肾功能指标水平比较
2.2高血压肾病患者PEPT1、PEPT2和肾功能指标的相关性分析 高血压肾病患者血清PEPT1、PEPT2与BUN、SCr呈负相关(P<0.05),与eGFR呈正相关(P<0.05)。见表2。
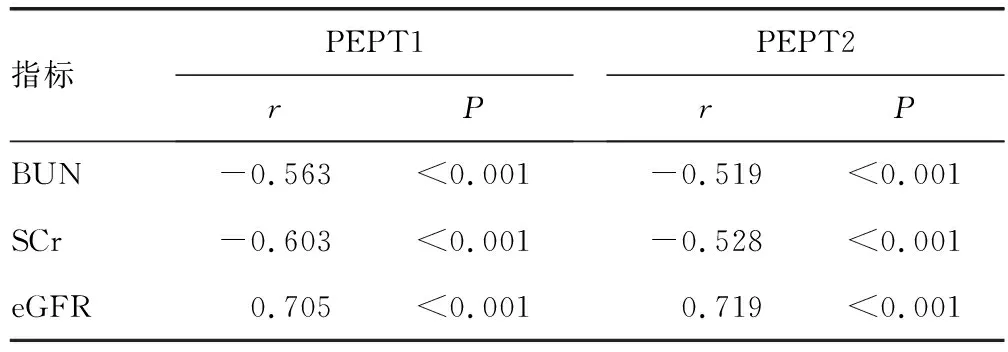
表2 高血压肾病患者PEPT1、PEPT2和肾功能指标的相关性分析
2.3影响高血压肾病进展为ESRD的因素分析 中位随访时间为98(30~150)个月,随访期间失访15例,将23例发生ESRD患者作为ESRD组,154例未发生ESRD患者作为NESRD组。ESRD组年龄、收缩压、舒张压、高血压肾病病程、BUN、SCr高于NESRD组,血清PEPT1、PEPT2、eGFR低于NESRD组,差异有统计学意义(P<0.05);两组性别、高血压病程、合并疾病、降压治疗比较差异无统计学意义(P>0.05)。见表3。
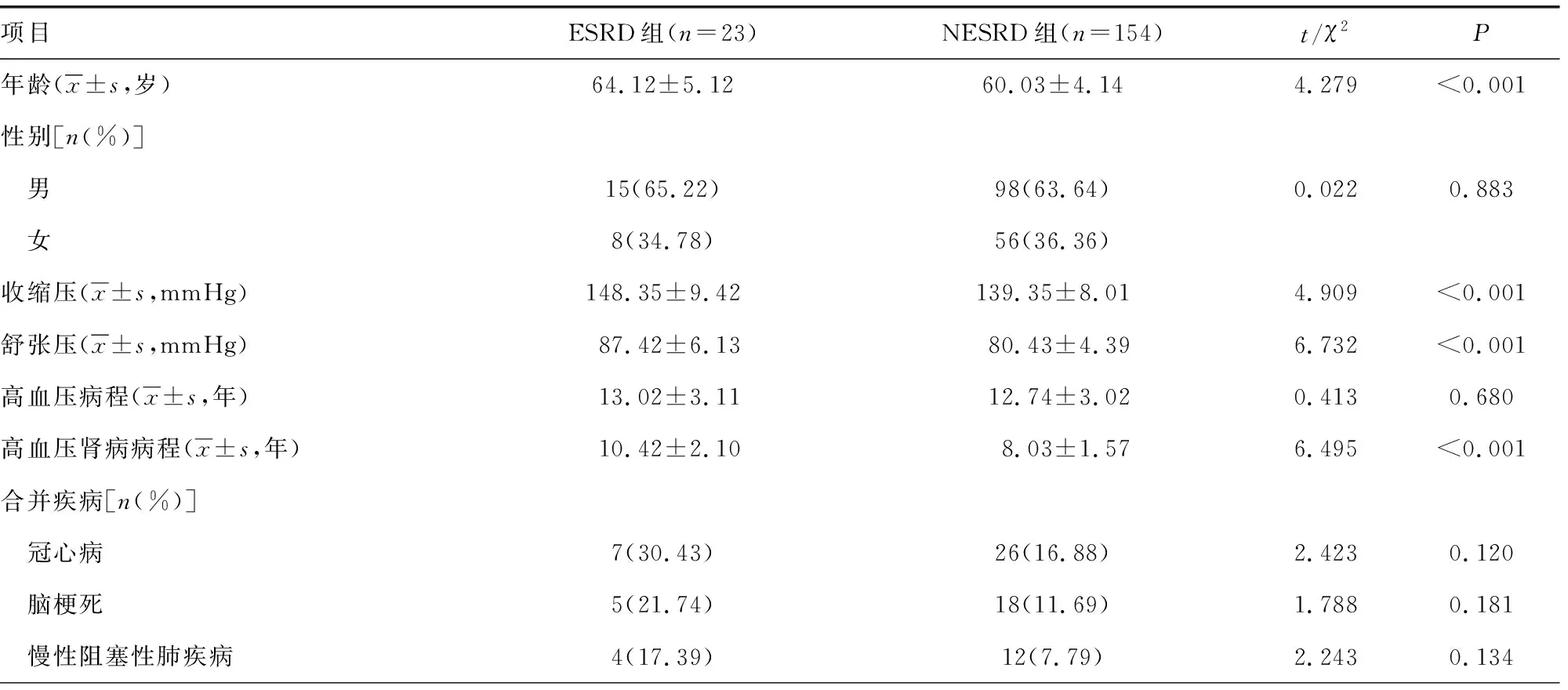
表3 影响高血压肾病进展为ESRD 的单因素分析
2.4影响高血压肾病进展为ESRD的多因素分析 以收缩压、高血压肾病病程、PEPT1、PEPT2、eGFR为自变量(均原值代入),高血压肾病是否进展为ESRD为因变量(赋值:0=否,1=是),向后逐步法排除无关变量,最终收缩压、高血压肾病病程是高血压肾病进展为ESRD的危险因素(P<0.05),PEPT1、PEPT2、eGFR是保护因素(P<0.05)。见表4。
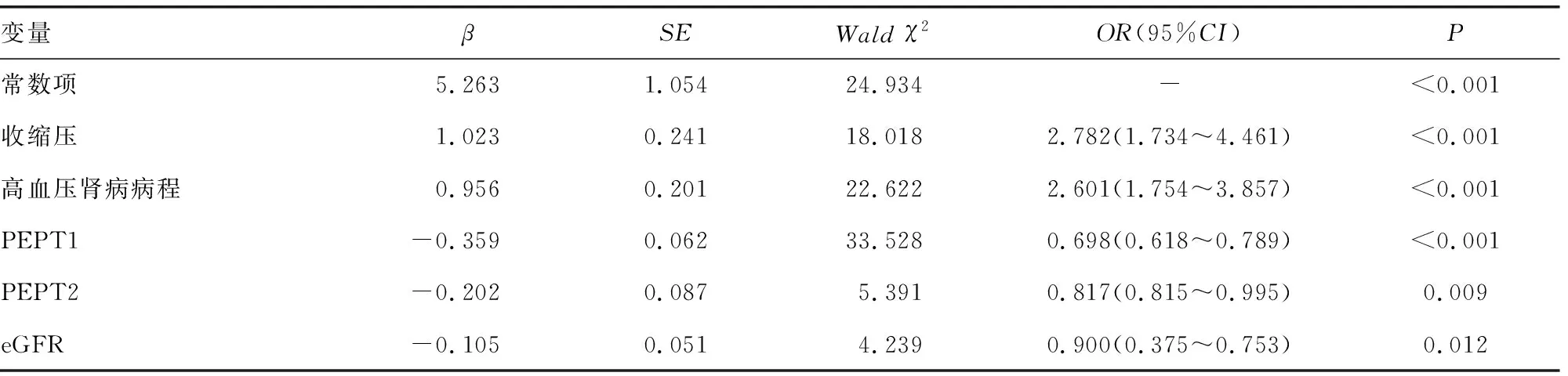
表4 影响高血压肾病进展为ESRD的Logistic回归方程
2.5PEPT1、PEPT2预测高血压肾病进展为ESRD的价值 PEPT1、PEPT2预测高血压肾病进展为ESRD的ROC曲线下面积(AUC)为0.636、0.714,联合PEPT1和PEPT2预测高血压肾病进展为ESRD的AUC为0.897,高于单独PEPT1、PEPT2(Z=3.680、3.542,P<0.05)。见表5和图1。
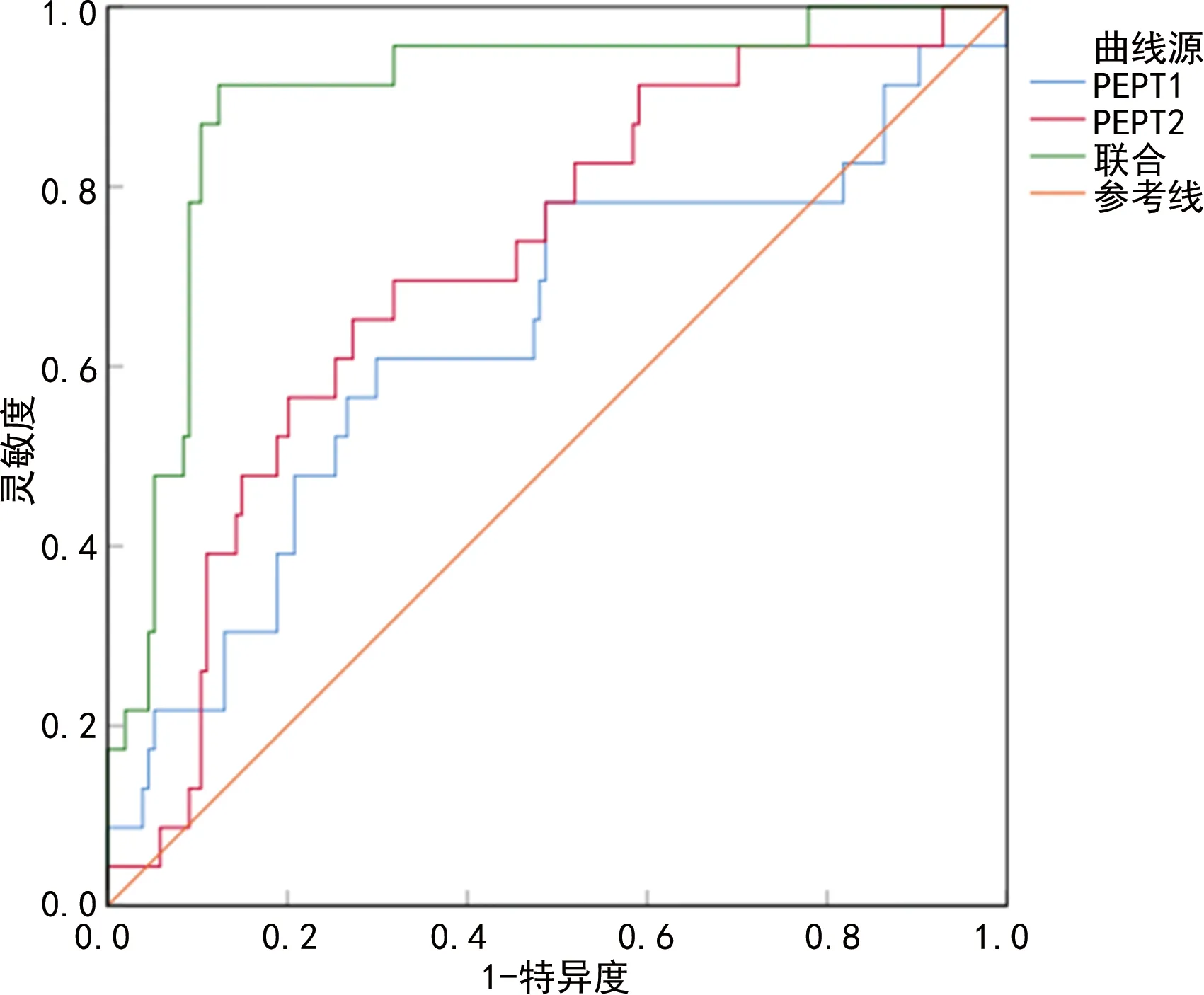
图1 PEPT1、PEPT2预测高血压肾病进展为ESRD的ROC曲线

表5 PEPT1、PEPT2预测高血压肾病进展为ESRD的效能
3 讨 论
高血压是一种慢性心血管疾病,在普通人群中发病率约30%,高血压肾病是长期高血压控制不佳的后果之一,传统观念认为高血压肾病是肾硬化和毛细血管玻璃样变及肾素-血管紧张素系统活性增加导致,随着分子生物学研究的进展,发现高血压诱导内皮损伤和缺氧,引发炎症、上皮-间质转化和肾小管间质纤维化,继而引起肾组织广泛性损伤和肾功能衰竭[9]。血压升高会加速慢性肾脏病的进展,降压至目标血压对延缓慢性肾脏病进展十分重要,但高血压肾病患者往往血压控制率偏低,最终导致向ESRD进展[10]。
PEPT1是一种质子寡肽转运蛋白,属于质子转运载体15家族的成员,主要位于小肠上皮细胞的顶膜上,在肝脏、胰腺和结肠等组织中也有表达,PEPT1在二肽、三肽吸收及维持肠道稳态中发挥着至关重要的作用,PEPT1通过介导向内定向的质子电化学梯度诱导小肽流入肠上皮细胞后被吸收,可从膳食蛋白质中消化超过400 种二肽和 8 000种三肽,研究显示结肠中PEPT1表达缺失会导致肠道微生物群失衡,导致溃疡性结肠炎和克罗恩病[11]。PEPT1在人类结肠直肠癌、胃癌、纤维肉瘤、肝癌、胰腺癌等多种恶性肿瘤中表达上调,并与癌症增殖生长、恶性进展有关[12]。PEPT1在药物运输中也发挥重要作用,作为药物活性化合物口服吸收的主要途径,PEPT1通过调节药物在细胞进出影响药物的药代动力学性能[13],提高肽类药物的生物利用度,例如抗癌剂、β-内酰胺抗菌药物及治疗高血压的ACEI,药理研究尝试开发靶向PEPT1的拟肽药物,以提高膜通透性,加强药物吸收度[14]。PEPT1与ACEI具有较高的亲和力,ACEI主要通过PEPT1从肠道吸收或从肾脏中再吸收[15]。
PEPT2是另一种质子偶联肽转运蛋白,主要在肾近端肾小管细胞顶膜中表达,其功能和底物选择性方面与 PEPT1 相似并远高于PEPT1,PEPT2通过促使肾小管中底物重吸收至近端肾小管,负责细胞摄取包括激素、类固醇、毒素等在内的多种物质,影响全身药代动力学和暴露[16]。PEPT2还可通过肾小管重吸收减少外源性分子的清除,并促使药物从脑脊液流出到脉络丛,影响药物在大脑中的分布、动力学和毒性[17]。PEPT2在调节降压药物在肾脏重吸收中起关键作用,研究显示ACEI降压药物福辛普利通过 PEPT2以高亲和力和质子耦合的可饱和过程完整运输[18]。本研究结果显示,PEPT1、PEPT2与高血压肾病及其向ESRD进展也存在密切关系,高血压肾病组血清PEPT1、PEPT2相对表达水平低于对照组,高血压肾病患者血清PEPT1、PEPT2与BUN、SCr呈负相关(P<0.05),与eGFR呈正相关(P<0.05),收缩压、高血压肾病病程是高血压肾病进展为ESRD的危险因素(P<0.05)。PEPT1、PEPT2有望作为高血压肾病患者ESRD的潜在指标,可为临床高血压肾病患者预后预测提供参考,并为临床治疗提供新的靶点和思路。分析原因为ACEI和二肽、三肽类药物治疗高血压可阻止肾脏恶化的进展并延长寿命,降压药物底物在肾脏的重吸收主要由PEPT1 和 PEPT2协同转运蛋白介导,高血压可改变PEPT1、PEPT2在肾近端小管中的重新分布,并抑制其表达,影响降压药物的重吸收,进而导致血压控制不良,促使肾脏功能恶化[19]。
本研究回归分析结果显示除PEPT1、PEPT2外,收缩压、高血压肾病病程、eGFR与高血压肾病患者ESRD进展也存在密切关系,说明血压控制不良,高血压肾病病程延长、肾功能减退是导致ESRD进展的主要原因,提示临床应重视对高危患者的干预和管理,以延缓ESRD进程,可通过结合除PEPT1、PEPT2外其他高危因素进一步提高对高血压肾病患者预后分析的效能。ROC曲线分析结果显示PEPT1、PEPT2预测高血压肾病患者ESRD进展的AUC为0.636、0.714,高于单独指标诊断,提示PEPT1、PEPT2可作为预测高血压肾病患者ESRD进展的生物学标志物,验证了上述推测,PEPT1、PEPT2可为临床预防和治疗提供参考。
综上所述,高血压肾病患者血清PEPT1、PEPT2相对表达水平增高,PEPT1、PEPT2与高血压肾病患者肾功能减退及ESRD进展有关,PEPT1、PEPT2是高血压肾病患者预后预测的标志物,并有望成为高血压肾病治疗的潜在靶点。本研究局限性在于未观察肾组织中PEPT1、PEPT2表达状态,PEPT1、PEPT2与高血压肾病肾脏病理特征的关系尚不确定,其次随访时间较短,因此以后需进一步延长随访,开展基础研究加以证实。

