可溶性共刺激分子sPD-L1、sB7-H3、sB7-H4在结直肠癌患者血清中的表达水平及临床意义分析*
周 娟,黄莉莉,芮 棵,张 慧△
1.苏州大学附属儿童医院检验科,江苏苏州 215002;2.江苏大学附属江滨医院检验科,江苏镇江 212001
近年来,随着经济发展及生活方式和饮食习惯的改变,我国结直肠癌的发病率和病死率均有所上升[1]。如果结直肠癌患者在转移前得到诊断和治疗,5年生存率可达68%,一旦出现浸润,存活率降至31%,如果发生远处转移,则患者存活率急降至5%[2]。目前对于结直肠癌的诊断及进程的判断,主要依赖于组织病理检查。因此,亟需寻找合适的无创血清标志物用以评判患者的病理特征及进展情况。随着肿瘤免疫和肿瘤微环境研究的不断深入,多种共刺激分子成为了目前肿瘤免疫干预的重要靶点,针对程序性细胞死亡蛋白-1(PD-1)、程序性细胞死亡蛋白配体1(PD-L1)及细胞毒性T淋巴细胞相关抗原4的多种单抗在临床抗肿瘤应用中显示出卓越的疗效,使得负性B7 家族免疫检查点分子在肿瘤免疫治疗中的前景受到空前关注。PD-L1、B7同源体3(B7-H3)、B7同源体4(B7-H4)是目前研究比较多的免疫共刺激分子。近年来越来越多的实验证实,除了膜表达,这些共刺激分子的可溶性形式在多种实体肿瘤患者血清中异常表达,并且与肿瘤的预后密切相关,提示这些可溶性分子在肿瘤的发生发展过程中扮演重要角色[3]。但多种可溶性共刺激分子的比较分析在肿瘤中的研究较少。本研究对68例结直肠癌患者血清可溶性PD-L1(sPD-L1)、可溶性B7-H3(sB7-H3)、可溶性B7-H4(sB7-H4)表达水平及与患者的临床病理参数之间的相关性进行了研究,以期探索sPD-L1、sB7-H3、sB7-H4在结直肠癌肿瘤诊断及预后评判中的临床价值。
1 资料与方法
1.1一般资料 血清标本收集于2021年1—12月在江苏大学附属江滨医院确诊的68例结直肠癌患者(结直肠癌组),年龄38~84岁,男45例,女23例。结直肠癌组纳入标准:(1)经病理确诊为结直肠癌;(2)术前未进行过任何放、化疗,无其他肿瘤史,且临床病理及随访信息均齐全;(3)排除其他系统的疾病。选取同期28例经肠镜检查确诊为良性病变(肠道息肉5例、慢性肠炎23例)患者的血清标本作为良性病变组,年龄38~70岁,男17例,女11例。选取同期20例体检健康者的血清标本作为健康对照组,年龄30~75岁,男13例,女7例。各组人群资料见表1。本研究经医学伦理委员会批准,受试者均知情同意。
1.2血清收集 采集入组者空腹静脉血2 mL,置于含促凝剂和分离胶的真空采集管中,室温下3 000×g离心15 min后,分离血清,置于-80 ℃冰箱冻存。禁止样本反复冻融或加热。
1.3血清sPD-L1、sB7-H3、sB7-H4检测 使用酶联免疫吸附试验(ELISA)法检测结直肠癌患者血清sPD-L1、sB7-H3、sB7-H4表达水平。sPD-L1表达水平检测按照人sPD-L1 ELISA试剂盒 (英国Abcam公司) 说明书进行。简述如下:(1)将所有检测试剂在室温平衡30 min;(2)取50 μL样品、标准品、阴性对照加入酶标板微孔中,标准品浓度为0.00、7.81、15.63、31.25、62.50、125.00、250.00、500.00 pg/mL。室温孵育1 h;(3)弃去孔内液体,甩干,洗板3次;(4)加100 μL 3,3,5,5-四甲基联苯胺 (TMB)显色液至每个酶标板微孔中,孵育10 min;(5)加100 μL终止液,在450 nm读取吸光度(A值)。sB7-H3表达水平检测按照人sB7-H3检测试剂盒(苏州旭光科星抗体生物科技有限公司)说明书进行。简述如下:(1)将所有检测试剂在室温平衡30 min;(2)取100 μL样品、标准品、阴性对照加入酶标板微孔中,标准品浓度为2 000.00、1 000.00、500.00、250.00、125.00、62.50、31.25、15.63 pg/mL。室温孵育2 h;(3)弃去孔内液体,甩干,洗板3次;洗板:(4)加检测抗体:加入稀释好的Antibody-Bio 每孔100 μL,盖上封板膜,37 ℃孵育1 h。(5)弃去孔内液体,洗板3遍。(6)加入Avidin-HRP工作液每孔100 μL,盖上封板膜,37 ℃孵育1 h。(7)洗板6遍,弃去孔内液体。(8)加入TMB,每孔100 μL,室温避光孵育约15 min。(9)加100 μL终止液,在450 nm读取A值。sB7-H4表达水平检测按照人sB7-H4 ELISA试剂盒(英国Abcam公司)说明书进行。简述如下:(1)将所有检测试剂在室温平衡30 min;(2)取50 μL样品、标准品、阴性对照加入酶标板微孔中,标准品浓度为0、23、47、94、188、375、750、1 500 pg/mL。室温孵育1 h;(3)弃去孔内液体,甩干,洗板3次;(4)加100 μL TMB显色液至每个酶标板微孔中,孵育10 min;(5)加100 μL终止液,在450 nm读取吸光度(A值)。最后依据标准品浓度和对应的A值建立标准曲线,带入样品的A值,计算sPD-L1、sB7-H3、sB7-H4的实际表达水平。
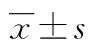
2 结 果
2.1各组血清sPD-L1、sB7-H3、sB7-H4表达水平 结直肠癌组 sPD-L1表达水平为(0.519±0.082)ng/mL,良性病变组和健康对照组sPD-L1表达水平分别为(0.501±0.057)、(0.436±0.048)ng/mL,差异无统计学意义(P>0.05);结直肠癌组 sB7-H3表达水平为(9.128±0.509)ng/mL,良性病变组和健康对照组sB7-H3表达水平分别为(7.029±0.293)、(6.701±0.373)ng/mL,差异有统计学意义(P<0.05);结直肠癌组 sB7-H4表达水平为(45.093±6.891)ng/mL,良性病变组和健康对照组sB7-H4表达水平分别为(30.005±5.271)、(24.684±4.149)ng/mL,差异无统计学意义(P>0.05)。见图1。
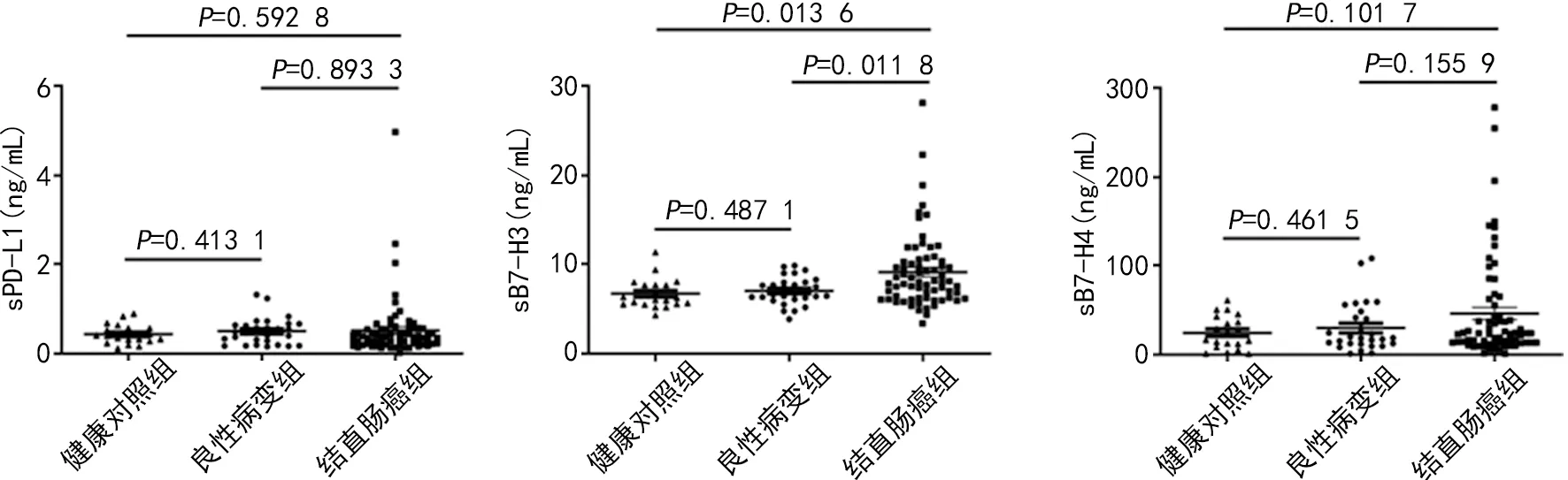
图1 3组血清sPD-L1、sB7-H3、sB7-H4表达水平比较
2.2结直肠癌患者中血清可溶性共刺激分子的诊断价值 通过ROC曲线分析,当sPD-L1作为区分结直肠癌组和良性病变组、健康对照组的诊断指标时,截断值(Cut-off值)为0.466 ng/mL,灵敏度为70.59%(95%CI:58.89%~80.08%),特异度为45.83%(95%CI:32.58%~59.71%)。曲线下面积(AUC)为0.569 1(95%CI:0.463 5~0.674 7),P=0.206 2;当sB7-H3作为区分结直肠癌组和良性病变组、健康对照组的诊断指标时,Cut-off值为6.940 ng/mL,灵敏度为69.12%(95%CI:57.36%~78.83%),特异度为58.33%(95%CI:44.28%~71.15%),AUC为0.680 5(95%CI:0.584 8~0.776 1),P=0.001 0;而当sB7-H4作为区分结直肠癌组和良性病变组、健康对照组的诊断指标时,Cut-off值为18.61 ng/mL,灵敏度为58.82%(95%CI:46.96%~69.74%),特异度为50.00%(95%CI:36.39%~63.61%)。AUC为0.569 5(95%CI:0.463 8~0.675 3),P=0.203 2。
2.3结直肠癌患者血清sPD-L1、sB7-H4、sB7-H3表达水平与临床病理参数的关系 将sPD-L1、sB7-H3、sB7-H4表达水平分别与患者的性别、年龄、肿瘤最大径、TNM分期、分化程度及是否淋巴结转移等临床病理参数通过非配对t检验进行统计学分析。结果显示,sPD-L1表达水平与患者的各种病理参数比较差异均无统计学意义(P>0.05)。sB7-H3表达水平与患者肿瘤最大径,TNM分期及淋巴结转移显著相关(P=0.042 4、0.006 3、0.037 2);与肿瘤最大径<5 cm、TNM分期Ⅰ+Ⅱ期、无淋巴结转移患者比较,肿瘤最大径≥5 cm、TNM分期Ⅲ+Ⅳ期、有淋巴结转移患者血清sB7-H3表达水平显著增高。sB7-H4水平则与患者TNM分期及有无淋巴结转移显著相关(P=0.037 2、0.007 8);与TNM分期Ⅰ+Ⅱ期、无淋巴结转移患者比较,TNM分期Ⅲ+Ⅳ期、有淋巴结转移的患者血清sB7-H4表达水平明显增加。见表2。
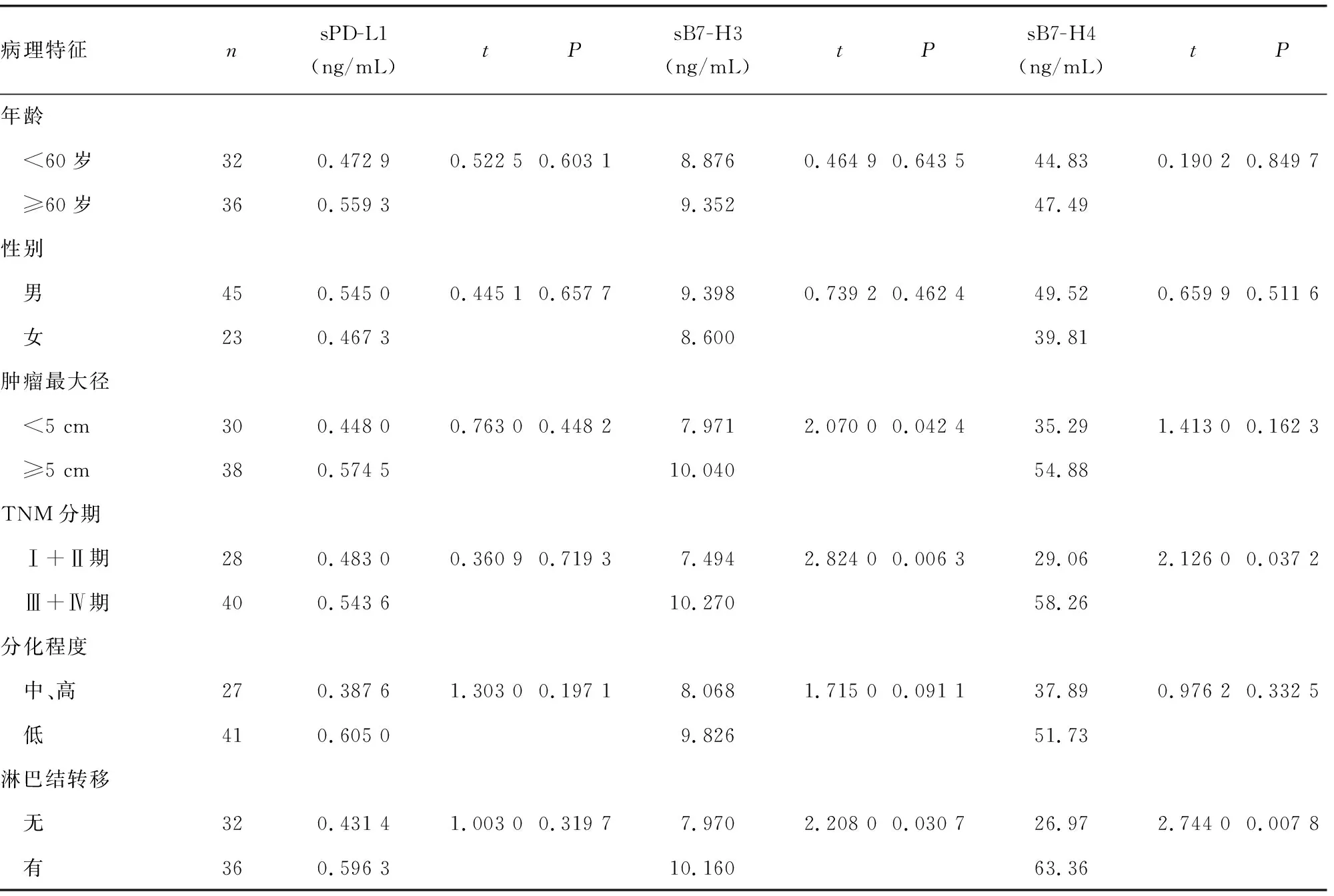
表2 血清sPD-L1、sB7-H3、sB7-H4表达水平与患者临床病理参数的关系
3 讨 论
结直肠癌是发病率第三高的肿瘤,也是全球第二大癌症死亡原因。2020年,全球约有190万新发结直肠癌患者,935 000例结直肠癌患者死亡[4]。多项研究表明在肿瘤细胞异常表达的PD-L1、B7-H3、B7-H4等共刺激分子与多种实体肿瘤的进展,及预后相关,可作为肿瘤治疗的靶点及预测肿瘤进展的分子标志[5-9]。目前,检测这些负性共刺激分子在肿瘤细胞表达水平,主要通过对肿瘤组织进行免疫组化分析,而病理组织的取样对患者创伤较大。血清中出现的这些B7家族可溶性蛋白的来源被认为是肿瘤组织中高表达的细胞分泌并释放入血的。因此,血清中可溶性B7分子蛋白的表达水平一定程度上反映病变组织的B7分子表达水平,这是本课题的理论基础。
本研究结果显示,与健康对照组相比,结直肠癌组血清sPD-L1水平并没有显著增加,同时sPD-L1水平也与患者的病理参数无明显相关,这与WU等[10]在胰腺癌患者中研究结果相类似。但是肿瘤患者血清sPD-L1水平是否与患者的临床病理参数具有相关性,不同的研究得出了不同的结论[5,11]。这提示不同细胞表达的PD-L1在肿瘤进展中的作用不尽相同。很重要的一个原因是不同肿瘤组织中PD-L1的表达差异很大,且很多肿瘤的PD-L1表达率整体较低[12]。在非小细胞肺癌治疗中患者PD-L1的表达率>1%时,帕博利珠单抗(抗PD1单抗)就可以使一线化疗失败的肺癌患者获益[13]。相对于B7-H3和B7-H4在多种肿瘤组织中广泛的表达,PD-L1在肿瘤组织中的表达水平并不高[14],这也许是sPD-L1在肿瘤患者血清中表达不高的原因。同样,较少的sPD-L1进入血液循环也使sPD-L1表达水平很难作为结直肠癌患者的疾病进展及预后标志物。
本研究结果显示,与肿瘤最大径<5 cm、TNM分期Ⅰ+Ⅱ期、无淋巴结转移患者比较,肿瘤最大径≥5 cm、TNM分期Ⅲ+Ⅳ期、有淋巴结转移患者血清sB7-H3表达水平显著增高,这与在卵巢癌、膀胱癌及骨癌中研究结果相一致[3]。与sPD-L1不同,结直肠癌组sB7-H3表达水平显著高于健康对照组(P=0.013 6)。同样与肠癌组织的PD-L1表达水平不同,有研究显示,B7-H3在肠癌组织中有超过50%的表达率,而在正常组织中则低表达[6],提示B7-H3是一种肿瘤特异性标志物。这种肿瘤组织的表达差异很可能是血清sB7-H3表达具有结直肠癌诊断潜能的原因。HUANG等[15]研究也发现,血清sB7-H3与胃癌组织中肿瘤细胞来源的B7-H3表达具有很强的相关性,提示sB7-H3主要来源于肿瘤细胞表达的膜型B7-H3,而非肿瘤微环境中表达的膜型B7-H3。这些研究结果提示,结直肠癌患者血清sB7-H3可能参与了疾病进程,其表达水平的异常增加可作为结直肠癌诊断及预后判断的潜在的分子标志。
目前有研究指出,对于sB7-H4在肿瘤中的诊断价值研究结论不一致,MACH等[7]研究发现,仅有14%的卵巢上皮癌患者血清中可以检测到sB7-H4,且血清sB7-H4表达水平与患者的FIGO分级、淋巴结转移、顺铂的耐药性等病理参数无相关性。而在肝癌、肾癌的研究中,sB7-H4与肿瘤最大径、淋巴结转移、肿瘤浸润深度、TNM分期显著相关[3]。本研究结直肠癌患者的sB7-H4表达水平高于健康对照组,但由于肿瘤患者之间差异很大(变异系数高),因此结果并无统计学意义(P=0.101 7)。有研究报道B7-H4与患者的肿瘤转移密切相关,包括肠癌、胰腺癌的远处转移等[3,16]。尽管B7-H4介导转移的具体机制尚未明确,但B7-H4与肿瘤转移的发生具有很强的相关性,本研究结果也说明了除了肿瘤细胞膜表面的B7-H4以外、可溶性B7-H4也与肿瘤转移有密切关系,考虑到sB7-H4与肿瘤淋巴结转移显著相关(P=0.007 8),尽管血清sB7-H4表达水平不是诊断结直肠癌的良好分子指标,但却是预测肿瘤不良进展,特别是预测淋巴结转移的优良指标。
目前,市面上有多种可溶性共刺激分子的ELISA检测试剂盒,由于包被/检测抗体的不同,以及不同试剂制作过程中的差异导致同一种可溶性共刺激分子的不同检测试剂盒之间存在较大的浓度量值差异,量值溯源很难统一。因此,相对于可溶性共刺激分子的绝对表达水平,同一试剂盒检测的相对表达水平差异更具有参考价值。但随着可溶性共刺激分子应用范围的不断拓展,量值溯源,统一蛋白标准品,建立标准参考系统,更有利于可溶性共刺激分子的临床应用。
综上所述,结直肠癌患者血清sB7-H3表达水平显著升高,是诊断结直肠癌疾病的良好标志物。血清sB7-H3表达水平与患者的多项病理参数相关,可作为结直肠癌进展与预后判断的潜在分子标志,而血清sB7-H4表达水平则是判断结直肠癌患者是否发生淋巴结转移的优良分子标志物。

