骨桥蛋白通过PI3K/AKT/mTOR 信号通路调控低氧诱导的肺动脉平滑肌细胞自噬和增殖的机制探讨
丁 琦,刘川川,王 泽,周 锐,刘辉琦,陈辛玲,王生兰青海大学医学部,青海 西宁 8000;青海大学附属医院包虫病实验室,青海 西宁 8000;中国人民武装警察部队河北省总队医院,河北 石家庄 0500;重庆市开州区人民医院,重庆 0599
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是指因低氧导致肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)过度增殖从而引起血管重构,进而使其压力升高,最终发展为右心衰竭的病理生理学过程[1-2]。骨桥蛋白(osteopontin,OPN)在血管重构中发挥重要调节作用[3]。OPN 是由Spp1 编码的一种具有多种生理功能的整合素结合蛋白,广泛表达于骨细胞、神经细胞、上皮细胞、内皮细胞、血管平滑肌细胞等各种细胞[4]。其生理功能与细胞增殖、自噬、黏附、迁移和血管生成等密切相关[5]。研究发现,OPN 可使PASMCs 由收缩表型转变为合成表型,使PASMCs 增殖,引起血管重塑,导致肺动脉压力升高[6]。但在低氧条件下OPN 调控PASMCs自噬在低氧性肺动脉高压形成中的作用机制尚未不明确。因此,本研究以OPN 通过PI3K/AKT/mTOR 信号通路调控细胞自噬为切入点,探讨OPN 在低氧条件刺激下对PASMCs 自噬、增殖的影响及其机制。
材料与方法
1 动物、主要材料及仪器 6 周SPF 级雄性SD大鼠10 只(130 ~ 150 g,由北京华阜康生物科技股份有限公司提供,合格证号:110322220100347 884)。Ⅱ型胶原酶(C8150) 购于北京索莱宝公司;DMEM 培养基(PM150210)购于武汉Procell 公司;免疫组化试剂盒(E-IR-R215)购于Elabscience 公司;EdU-488 细胞增殖检测试剂盒(C0071S)、EdU-555细胞增殖检测试剂盒(C0075S)购于上海碧云天公司;胎牛血清(10099-141C)购于美国Gibco 公司;BCA 蛋白定量试剂盒(23227) 购于Thermo Fisher Scientific 公司;OPN shRNA 干扰慢病毒(VPSLV22 0223CHH1)由赛业生物科技有限公司合成并包装;β-actin 内参抗体(AC026)购于武汉Abclonal 公司;OPN(ab63856)、PI3K(ab191606)、Beclin1(ab207612)、LC3B(ab192890)购于Abcam 公司。超净工作台(京东联哈尔公司,DL-CJ-1NDII);CO2细胞培养箱(美国ThermoFisher 公司,Thermo HERAcell 150i);三气培养箱(德国BINDER 公司,CB53);蛋白电泳仪(美国Bio-Rad 公司,1645050),台式离心机(德国Sigma 公司,3K15);倒置荧光显微镜(德国蔡司Zeiss 公司,Ax10 Axio)。
2 原代PASMCs 分离培养 大鼠经2%戊巴比妥钠腹腔注射麻醉后颈椎脱臼安乐死,置于75%乙醇中消毒3 min。在超净工作台中打开胸腔取出心肺组织,置于盛有4℃预冷无菌PBS 的培养皿中。去除心脏并用PBS 清洗肺组织,将肺组织固定于含浮漂培养皿中。沿肺动脉主干向下逐级分离出二、三级肺动脉。将其转移至新的培养皿中,清洗后纵向剪开肺小动脉,用手术刀轻轻刮除内皮细胞,用眼科镊分离外膜和中膜。将中层平滑肌组织剪成1 mm3大小的组织块,随后将组织块转移至含有1 ~ 2 mL 0.2% Ⅱ型胶原酶的15 mL离心管中,将离心管置于37℃水浴锅消化1 h 左右,观察组织块变为絮状时即可结束消化。消化结束后细胞用含有20% FBS 和1% PS 的DMEM培养基重悬,置于37℃、5% CO2湿润培养箱中培养。待细胞生长至培养瓶70%左右时,用差速贴壁法纯化细胞。免疫细胞化学法进行鉴定,第3 ~5 代细胞用于后续实验研究。
3 免疫细胞化学法鉴定PASMCs 对数生长期PASMCs 用0.2% 的胰蛋白酶消化,将1 × 104个细胞接种于6 孔细胞培养板。细胞贴壁后,弃去原有培养基,用PBS 洗涤两次,加入4%多聚甲醛室温固定细胞15min。后续按二步法免疫组化试剂盒步骤操作。用苏木素复染细胞核,在荧光显微镜下观察拍照。
4 细胞慢病毒转染和分组 对数生长期PASMCs接种于25 mm2培养瓶中,待细胞长至30% ~ 40%时进行细胞转染(干扰序列见表1)。常氧对照组(Normoxia)加DMEM 基础培养基;低氧对照组(Hypoxia)加DMEM 基础培养基;低氧 + OPN 干扰空病毒组(H + OPN EV)加OPN 空病毒;低氧 +OPN 干扰慢病毒组(H + OPN shRNA)加OPN 干扰慢病毒;低氧 + PI3K 抑制剂LY294002 组(H +LY)加含PI3K 抑制剂LY294002 的基础培养基。转染12 h 后在荧光显微镜下观察,转染成功后更换培养液,将细胞置于低氧培养箱( 37℃,5%CO2,1% O2)中培养48 h。收集各组细胞用于后续实验。
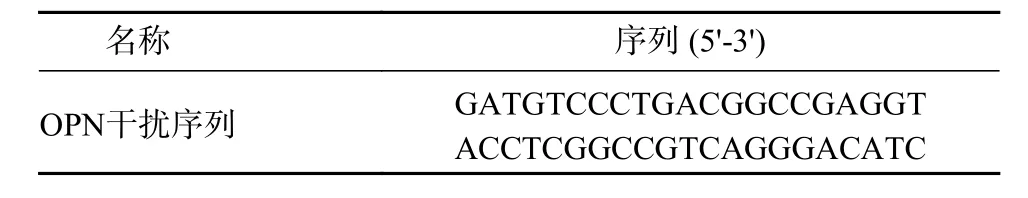
表1 干扰序列Tab. 1 Interference sequence
5 Western blot 检测LC3B、Beclin1、OPN、PI3K、AKT、mTOR 蛋白表达 收集各组细胞,加入适量RIPA 裂解液在冰上裂解后收集上清。用BCA法检测蛋白浓度。以每孔30 µg 蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE),将目的蛋白转膜至PVDF 膜上,用5%脱脂奶粉室温封闭1 h。将膜与LC3B(1:1000)、Beclin1(1:1000)、OPN(1:1000)、PI3K(1:1000)、AKT(1:1000)、mTOR(1:1000)、βactin(1:1500)抗体4℃冰箱孵育过夜。次日TBST洗膜3 次后加入二抗室温孵育1 h。洗涤后用ECL超敏发光液在凝胶成像仪中显影并保存图像,用Image J 软件分析条带灰度值,以β-actin 为内参计算蛋白相对表达量。
6 细胞免疫荧光染色 对数生长期PASMCs 接种于激光共聚焦专用培养皿,待细胞贴壁后根据分组进行干预。收集5 组细胞,PBS 洗涤后加入4%多聚甲醛室温固定15 min。PBS 洗去多聚甲醛后,加入0.25% Triton X-100 通透液室温通透30 min。随后滴加3% BSA 封闭室温封闭30 min。弃去封闭液,加入Beclin1(1:200)、LC3B(1:200)一抗4℃孵育过夜。次日,细胞经PBS 洗涤后加入Cy3 标记山羊抗兔二抗(1:200) 室温避光孵育1 h。PBS 洗涤后滴加DAPI 避光染细胞核5 min。PBS 洗去多余的DAPI,在激光共聚焦显微镜下观察并采集图像。
7 透射电镜 收集5 组细胞,加入3%戊二醛固定液于4℃固定24 h,加入1%四氧化锇再固定2 h。将固定好的样品浸入丙酮逐级脱水,脱水完成后用环氧树脂包埋。将样品制备成50 nm切片,切片用柠檬酸铅染色后置于JEM-1400FLASH 透射电镜下观察并采集图像。自噬体特征:双层或多层膜滤泡状结构,内含细胞质成分。
8 EdU 检 测 细胞增 殖 将对 数 生长期PASMCs用0.2% 胰蛋白酶消化,将4 × 103个细胞接种于24 孔细胞培养板,待细胞贴壁后进行相应干预处理,每组设置3 个复孔。培养48 h 后,每孔加入200 µL 终浓度为10 µmol/L EdU 工作液,置于培养箱中继续孵育2 h。随后,用4%多聚甲醛室温固定细胞15min,后续按EdU 细胞增殖检测试剂盒说明书操作。在荧光显微镜下观察,每组随机选择5 个视野拍照。
9 统计学分析 实验结果采用 Graph Pad Prism 8.0.2 软件进行统计分析和图形绘制。服从正态分布数据以x¯±s表示,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
结 果
1 PASMCs 的免疫学鉴定 免疫细胞化学染色结果显示,观察到细胞呈典型的峰谷样生长,99%的细胞均能表达α-SMA,表明培养的细胞为平滑肌细胞。见图1。

图1 α-SMA 免疫细胞化学染色鉴定Fig.1 α-SMA Immunocytochemical staining
2 干 扰OPN 表 达 后PASMCs 中OPN、Beclin1、LC3B、PI3K、AKT、mTOR 蛋白表达水平 Western blot 实验结果表明,与Normoxia 组相比,低氧处理的PASMCs 中OPN、PI3K、AKT、mTOR 及自噬相关蛋白Beclin1、LC3B 的蛋白表达水平均升高(P<0.05);与Hypoxia 组相比,H + OPN EV组OPN、PI3K、AKT、mTOR 及自噬相关蛋白Beclin1、LC3B 的蛋白表达水平无统计学差异(P>0.05),H + OPN shRNA 组OPN、PI3K、AKT、mTOR 蛋白表达降低(P<0.05),自噬相关蛋白Beclin1、LC3B 表达增加(P<0.05)。见图2。

图2 各组细胞PI3K、AKT、mTOR、OPN 及自噬相关蛋白表达量(x ¯±s,n=4)aP<0.05,vs常氧对照组;bP<0.05,vs低氧对照组Fig.2 Expression levels of PI3K, AKT, mTOR, OPN and autophagy-related proteins in each group (x ¯±s, n=4)aP<0.05, vsNormoxia group; bP<0.05, vsHypoxia group
3 使用PI3K 抑制剂后PASMCs 中OPN、Beclin1、LC3B、PI3K、AKT、mTOR 蛋白表达水平 Western blot 实验结果表明,与Hypoxia 组相比,低氧下加入PI3K 抑制剂LY294002 后,OPN、PI3K、AKT、mTOR 表达降低(P<0.05),自噬相关蛋白Beclin1、LC3B 表达增加(P<0.05)。见图3。

图3 各组细胞PI3K、AKT、mTOR、OPN 及自噬相关蛋白表达量(x ¯±s,n=4)aP<0.05,vs常氧对照组;bP<0.05,vs低氧对照组Fig.3 Expression levels of PI3K, AKT, mTOR, OPN and autophagy-related proteins in each group (x ¯±s, n=4)aP<0.05, vsnormoxia;bP<0.05, vshypoxia
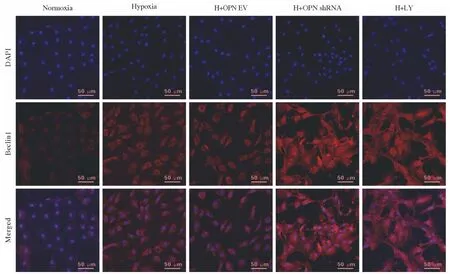
4 细胞免疫荧光法观察各组细胞自噬蛋白表达的情况 为进一步观察各组细胞自噬相关蛋白变化情况,免疫荧光染色法检测PASMCs 中LC3B、Beclin1 表达。结果显示,5 组PASMCs 中LC3B、Beclin1 阳性均定位于细胞质。与Normoxia 组相比,低氧处理的PASMCs 中LC3B、Beclin1 红色荧光强度增强(P<0.05);与Hypoxia 相比,H +OPN EV 组LC3B、Beclin1 红色荧光强度无统计学差异(P>0.05),H + OPN shRNA 组LC3B、Beclin1红色荧光强度增强(P<0.05),H + LY 组LC3B、Beclin1 红色荧光强度增强(P<0.05)。见图4、图5。
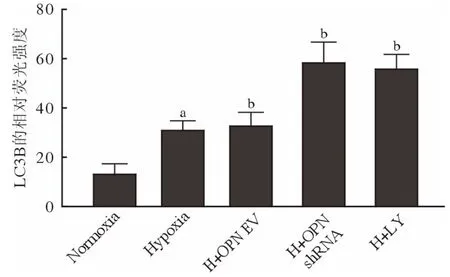
图4 细胞免疫荧光观察各组PASMCs LC3B 表达情况aP<0.05,vs常氧对照组;bP<0.05,vs低氧对照组Fig.4 LC3B expression of PASMCs in each group was observed by immunofluorescenceaP <0.05, vsNormoxia group; bP <0.05, vsHypoxia group
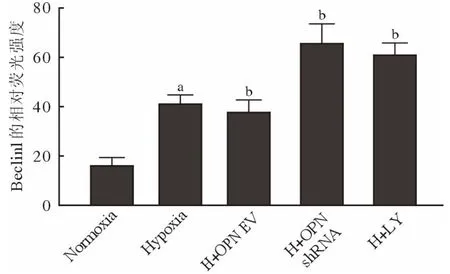
图5 细胞免疫荧光观察各组PASMCs Beclin1 表达情况aP<0.05,vs常氧对照组;bP<0.05,vs低氧对照组Fig.5 Beclin1 expression of PASMCs in each group was observed by immunofluorescenceaP<0.05, vsNormoxia group; bP<0.05, vsHypoxia group
5 透射电镜观察各组细胞自噬小体形成情况 为更加直观地观察各组细胞自噬的变化情况,采用透射电镜观察各组细胞自噬小体形成情况。结果表明,Normoxia 组中存在少量自噬小体(↑),粗面内质网轻度扩张(↑);Hypoxia 组中自噬小体数量较Normoxia 组增多(↑),粗面内质网扩张呈囊状(↑);H + OPN EV 组与Hypoxia 组中自噬小体数量无统计学差异,粗面内质网轻度扩张(↑);H +OPN shRNA 组细胞质内有大量自噬小体(↑),线粒体轻度肿胀(↑),粗面内质网扩张呈囊状(↑);H +LY 组细胞质内有大量自噬小体(↑),粗面内质网扩张呈囊状(↑)。见图6。

图6 电镜观察各组PASMCs 超微结构变化(20000×)N:细胞核;Mi:线粒体;RER:粗面内质网;GB:高尔基体;Atg:自噬小体Fig.6 Ultrastructural changes of PASMCs in each group were observed by electron microscopy (20000×)N: nucleus; Mi: mitochondrion; RER: rough endoplasmic reticulum; GB: Golgi body; Atg: autophagosome
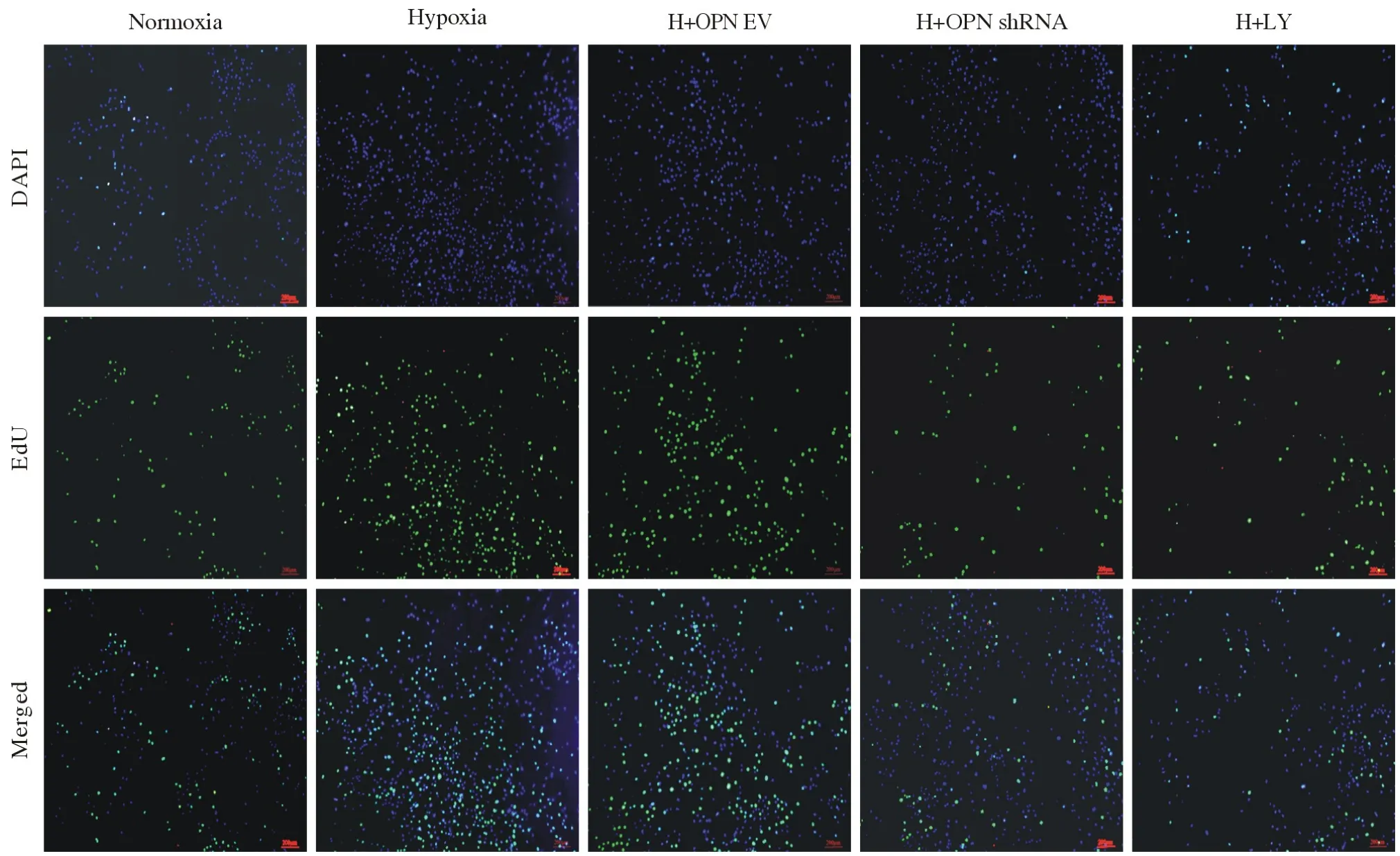
6 各组细胞增殖能力 为检测各组PASMCs 增殖能力变化,使用EdU 细胞增殖检测试剂盒检测各组细胞增殖情况。结果显示,与Normoxia 组相比,Hypoxia 组细胞增殖能力增强(P<0.05);与Hypoxia 组相比,H + OPN EV 组细胞增殖能力无统计学差异(P>0.05),H + OPN shRNA 组、H +LY 组细胞增殖能力均降低(P<0.05)。见图7。


图7 EdU 检测细胞增殖(x¯±s,n=5)aP<0.05,vs常氧对照组;bP<0.05,vs低氧对照组Fig.7 Cell proliferation detected by EdU assay (x ¯±s, n=5)aP<0.05, vsNormoxia group; bP<0.05, vsHypoxia group
讨 论
HPH 是一种以肺血管收缩和血管重构为主要特征的病理过程,其发病机制复杂,目前未完全阐明。研究发现其发病机制包括炎症介质因素、细胞因素(增殖、凋亡、自噬)、细胞外神经体液因素(神经递质、血管活性肽、细胞因子、生长因子等)、离子通道(钙通道、钾通道)和基因表达等[7-9]。
OPN 是一种多功能蛋白质,具有免疫调节、参与细胞的增殖和转移等作用[6]。OPN 经细胞释放后,其RGD 序列可与靶细胞表面整合素受体结合,从而激活细胞内特异性信号传导系统,介导细胞间的自噬、炎症与免疫、增殖和凋亡,进而诱发各种疾病[3,10]。Wohlleben 等[11]研究发现,低氧可以诱导结直肠癌细胞OPN 表达上调,放射抗性增加。Bellan 等[12]研究发现,结缔组织病引起肺动脉高压患者的OPN 血浆值显著高于单纯结缔组织病患者,OPN 可能作为肺动脉高压的非侵入性疾病生物标志物发挥作用。Mura 等[13]研究表明,在重症肺动脉高压患者的肺组织中OPN 表达升高,并可促进PASMCs 增殖、增强血管重塑,且OPN 表达水平与疾病严重程度相关。这与本研究结果一致,低氧条件下PASMCs 内OPN 表达增加,且OPN 可以促进低氧诱导的PASMCs 增殖。
自噬是指通过一系列途径将细胞质内的某些物质转移至溶酶体中进而被降解的过程[14]。自噬体的形成由Ⅲ类磷酸肌醇3-激酶和自噬相关基因6(也称为 Beclin1,BECN1) 启动[15]。自噬过程中,LC3Ⅱ可参与自噬体形成并可与溶酶体融合,故作为自噬体的标记,且LC3Ⅱ的水平从某种程度上反映了自噬体的数量[16]。Beclin1、LC3Ⅱ的含量可作为监测自噬活动的强度指标[15-16]。自噬与肺动脉高压的机制研究发现,自噬激活的程度可能决定自噬是抑制因子还是启动子,在不同的实验条件下,自噬可能是肺动脉高压发展的一把双刃剑[16]。Yamanaka 等[17]研究发现,TP53 诱导的糖酵解和凋亡调节剂可以减弱PASMCs 自噬,能够预防肺动脉高压。Zhai 等[18]发现,激活磷酸腺苷活化蛋白激酶可以通过抑制NF-κB 介导的自噬来阻止野百合碱诱导的PAH。Liu 等[19]研究发现,与正常大鼠相比,低氧大鼠肺动脉中BECN-1 和LC3B-Ⅱ/Ⅰ比值显著增加,且二甲双胍可能通过抑制自噬来阻止低氧诱导的肺动脉高压的发展。这些文献报道表明,自噬可能参与了HPH 形成。这与本研究结果一致,在低氧诱导的PASMCs 内自噬相关蛋白LC3B、Beclin1 表达升高。
细胞自噬的发生受多种基因和信号通路的调控。目前相关文献显示OPN 在不同的细胞中对自噬的调控有所不同,既可促进细胞自噬,也可抑制细胞自噬。 Sun 等[20]研究发现,在大鼠模型中给予重组OPN 可以激活蛛网膜下腔出血后神经元的自噬,此过程可能与FAK-ERK 信号通路有关。Lin 等[21]在研究心房纤维化中发现,OPN 可以通过激活AKT/GSK-3β/β-catenin 信号通路和抑制自噬,实现促纤维化作用。Tang 等[22]在研究非酒精性脂肪性肝病的发病过程中发现,OPN 可作为自噬的负调节因子,抑制自噬成熟,加速脂质积累。本实验在低氧条件下使用OPN 干扰慢病毒降低OPN 表达后,自噬相关指标表达升高,说明OPN 可以抑制低氧诱导的SD 大鼠PASMCs 自噬。
大量研究显示,OPN 可能通过多种信号转导通路调节细胞自噬。其中包括p38MAPK、PI3K/AKT/mTOR、CD44 等途径[23-24]。其中最典型的是PI3K/AKT/mTOR 信号通路。PI3K/AKT/mTOR信号传导通路的活化可诱导细胞生长、增殖、迁移,加快细胞周期,抑制细胞凋亡,调控细胞自噬,参与新生血管形成[24-26]。Peng 等[27]研究发现,NPS2390 可通过抑制下游PI3K/AKT/mTOR 信号通路,降低自噬蛋白和合成表型标记蛋白OPN的表达,提高收缩表型标记蛋白α-SMA 和钙调蛋白的表达。Zhang 等[28]研究发现,在乳腺癌中OPN 通过激活PI3K/AKT/mTOR 信号通路调控细胞自噬,且当OPN 基因敲低后会抑制αvβ3 诱导的细胞迁移和迁徙,而使PI3K/AKT/mTOR 途径失活。本实验在低氧条件下使用OPN 慢病毒降低OPN 表达后,PI3K、AKT、mTOR 蛋白表达降低,自噬相关指标表达升高;当在低氧条件下加入PI3K 抑制剂LY294002 后,自噬相关指标表达升高。这些结果表明OPN 可能通过PI3K/AKT/mTOR 信号通路抑制低氧诱导的PASMCs 自噬。
细胞增殖与细胞自噬之间具有密切联系[29]。有研究发现,eIF2α 可以通过加速自噬途径促进野百合碱诱导的PAH 大鼠PASMCs 的增殖和血管重塑[30]。刘琦[31]研究发现,葛根素可能通过抑制自噬的活化而减轻低氧诱导的PASMCs 异常增殖。商萍等[32]研究发现,伞形酮在抑制低氧诱导的PASMCs 自噬时可通过防止PASMCs 的过度增殖减缓HPAH 发展。Li 等[33]研究发现,mTOR 抑制剂可以上调Beclin1 表达并激活AMPK-ULK1 信号通路,上调自噬标志LC3Ⅱ/LC3Ⅰ以激活细胞的自噬活动,抑制PASMCs 增殖。王莹等[34]研究发现,安石榴苷可以通过抑制AKT/NF-κB/Cyclin D1通路增强细胞自噬,抑制大鼠气道平滑肌细胞增殖并诱导其凋亡。由此可知细胞自噬与细胞增殖紧密相关,且当不同的因子调控细胞自噬时细胞增殖变化不同。本实验结果显示,OPN 可抑制低氧诱导的PASMCs 自噬,促进低氧诱导的PASMCs增殖。但在低氧条件下OPN 调控的细胞自噬与增殖是否存在关系尚未明确,有待进一步研究。
综上所述,低氧环境下OPN 可促进PASMCs增殖,并且通过PI3K/AKT/mTOR 信号通路抑制PASMCs 自噬。
致谢感谢青海大学高原医学研究中心实验室提供实验平台。
作者贡献丁琦:细胞培养,实验指标检测,实验数据分析处理,论文撰写;陈辛玲、周锐:细胞培养;王泽:实验数据分析处理;王生兰、刘川川:实验设计,文章校对;刘辉琦:文章校对。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:1244939963@qq.com。

