云南省大姚县青石棉污染区恶性胸膜间皮瘤与致瘤性猿猴病毒SV40 的关联研究
刘如爱,王播勇,陈 欣,普元倩,自加吉,,梅 雯,张也频,邱 璐,熊 伟,大理大学基础医学院,云南 大理 67000;云南省高校临床生物化学检验重点实验室,云南 大理 67000;云南省昆虫生物医药研发重点实验室, 云南 大理 67000;楚雄州第一人民医院病理科,云南 楚雄 6000;楚雄师范学院化学与生命科学系,云南 楚雄 6000
恶性间皮瘤(malignant mesothelioma,MM)是一种来源于胸膜或其他部位(如腹膜、细胞和睾丸鞘膜等)间皮细胞的罕见肿瘤,其中恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM) 病例约占所有MM 病例的81%[1]。MPM 侵袭性高,预后极差,患者中位生存时间约为1 年,5 年生存率约为10%,治愈病例罕见[2-3]。国外有文献报道在48例间皮瘤中检测出29 例(占60%) 含有猿猴病毒40 (simian virus 40,SV40) DNA 序列,提出SV40与人体恶性间皮瘤的发生有关[4]。随之许多欧洲国家、美国和日本的研究也证实了这一点,他们认为可能这些国家在1955 - 1967 年使用了被该病毒污染的脊髓灰质炎疫苗[5-7]。也有少数国家如土耳其、芬兰、德国在间皮瘤中未检出SV40 DNA 序列,推测这些国家的疫苗未受到污染[8],这些差异可能是地理差异导致。
我国云南省楚雄彝族自治州大姚县 5% 的地表散布着蓝色的青石棉[9]。自20 世纪80 年代以来,大姚县当地居民任意开采使用青石棉,造成空气污染。流行病学调查显示,该地区恶性间皮瘤发病率达到8.5/100 000 (1977 - 1983 年)、17.75/100 000 (1987 - 1995 年),高出一般人群[(0.1 ~ 0.6)/100 000]几十倍[9]。已有的研究结果表明,SV40与MPM 的发生发展可能存在一定关联。然而在我国,尤其是云南省大姚县青石棉污染区的MPM 与SV40 之间的关系尚未见报道。本研究中,我们体外培养3 株不同病理类型的MPM 细胞系,同时收集了51 例MPM 组织和12 例非MPM 胸膜组织,采用聚合酶链式反应(PCR)、Western blotting 和免疫组织化学方法探讨SV40 与云南省青石棉污染区MPM 的关系,为探究SV40 是否为MPM 的致病因素,明确与之相应的临床诊治对策提供实验基础。
材料与方法
1 主 要 材 料、试 剂 与 仪 器 人 胚 肾 细 胞系HEK239、HEK293T、HEK293JCT、MPM 细胞系NCI-H28 (上皮 型)、NCI-H2052 (肉 瘤型)、NCIH2452 (双相混合型) 和人正常胸膜间皮细胞系LP9、Met5A (SV40 转化的胸膜间皮细胞) 均购自美国标准生物品收藏中心(American Type Culture Collection,ATCC);RPMI 1640 培 养 基(Gibco,Thermo Scientific);胎牛血清(Gibco);动物基因组DNA 提取试剂盒(北京TIANGEN 公司);PCR Master Mix、引物(北京擎科生物科技有限公司);TransDetect 荧光素酶支原体检测试剂盒、细胞裂解液、柠檬酸(Servicebio);BCA 蛋白质定量试剂盒(Beyotime);ECL 化学发光液、PVDF 膜(Millipore);二甲苯(国药集团化学试剂有限公司);苏木素-伊红染色试剂盒(杭州昊鑫生物科技股份有限公司);鼠抗PAb101 单克隆抗体(MA5-12458,Invitrogen)、鼠抗PAb416 单克隆抗体(ab16879,Abcam)、兔抗β-actin 多克隆抗体(ab8227,Abcam);TBST 缓冲液及其他生化试剂(上海生工生物工程公司);凝胶成像仪、免疫印迹电泳系统、半干转膜仪(Bio-RAD); NanoDrop 2000 超微量紫外分光光度计(Thermo Scientific)。
2 细胞培养 所有细胞系均通过短串联重复序列(short tandem repeat,STR)鉴定,并定期使用支原体检测试剂盒检查细胞有无支原体污染。所有细胞系均用含10% (v/v)胎牛血清和1% (v/v)抗生素(100 U/mL 青霉素,100 mg/L 链霉素)的RPMI 1640 培养基进行体外培养,将培养条件控制为37℃、5% CO2,待细胞融合至80%时,加入胰蛋白酶进行消化传代。
3 MPM 组织样本收集 收集大理大学第四附属医院(楚雄彝族自治州第一人民医院)和大姚县人民医院胸外科2014 年1 月 - 2019 年12 月诊治的51 例MPM 患者的肿瘤组织和12 例非MPM 患者的胸膜组织(包括肺大疱、肺结核等疾病)。所有MPM 标本均来源于大姚县青石棉污染区的MPM患者,对进行胸腔镜和开胸手术切除患者的病理组织进行病理学检查,将所有新鲜组织及时储存在液氮中。所有MPM 患者术前均未进行放疗、化疗、激素治疗和其他相关抗肿瘤治疗。纳入本研究之前,所有患者签署书面知情同意。本研究已获大理大学附属医院联盟医学伦理委员会批准(批准号:2020-YXLL20)。
4 MPM 组织和非MPM 胸膜间皮组织的苏木精-伊红(HE) 染色 取MPM 组织和非MPM 组织的石蜡包埋组织蜡块,脱蜡至水,二甲苯透明,石蜡包埋,连续3 µm 厚度切片。切片入Harris 苏木素染核3 ~ 8 min,自来水洗;然后分化数秒,自来水冲洗;再用伊红染细胞质1 ~ 3 min,自来水洗涤,脱水固定。使用中性树胶封片,自然晾干后置于显微镜下进行镜检,图像采集分析。
5 基因组DNA 提取和鉴定 各组胸膜间皮瘤组织和细胞系样本均使用动物基因组DNA 提取试剂盒提取DNA,提取过程严格按照试剂盒说明书操作进行。提取后,1.5% 琼脂糖凝胶电泳用于检测。使用超微量紫外分光光度计测定各组DNA 的OD260和OD280,选择OD260/OD280为1.6 ~ 1.8 的高纯度DNA 进行后续实验。
6 PCR 检测 分别使用文献报道[10]的低污染风险的特异性引物对SV40 进行PCR 扩增(β-actin 基因作为内参基因)。PCR 检测所用引物见表1。3 对SV40 TAg 引物组的位置见图1。PCR扩增体系为25 µL,包括:2 × Taq PCR Master Mix 12.5 µL、双蒸水(ddH2O) 9.5 µL、10 µmol/L 的上、下游引物各1.0 µL 以及1 µL 从新鲜组织中提取的高纯度DNA 或从培养细胞中提取的纯化DNA。PCR 扩增仪内依次进行94℃ ~ 95℃预变性,94℃变性、58℃退火、72℃延伸50 个循环,PCR 反应具体条件见表2。PCR 产物在1.5%琼脂糖凝胶上进行电泳,并用凝胶成像系统观察结果。

图1 SV40 TAg 引物组和抗体的位置黑色框对应SV40 TAg 四个区域的DNA。SV40 基因组的编号方向与TAg 的转录方向相反。本研究中使用的3 对低污染风险的特异性引物已用箭头标示Fig.1 Location of SV40 Tag primer sets and antibodies schematic representation of the SV40 genomic DNA encoding TAg The black boxes correspond to the DNA of the four regions of SV40 TAg. The SV40 genome is numbered in the opposite direction to the transcriptional direction of TAg. The three pairs of low contamination risk specific primers used in this study have been marked with arrows

表1 引物序列Tab. 1 Primer sequences

表2 PCR 反应条件Tab. 2 PCR reaction conditions
7 Western blotting 检测 收集各组正常胸膜间皮细胞和MPM 细胞,加入Western/IP 细胞裂解液提取各组样本的总蛋白,用BCA 法对各组蛋白质进行定量。根据样品体积加入蛋白质上样缓冲液使蛋白质充分变性。以10% SDS-聚丙烯酰胺凝胶电泳后转膜,用 5% 脱脂牛奶的TBST 缓冲液封闭。两种SV40 TAg 抗体的位置见图1。依次孵育鼠抗PAb101 单克隆抗体(1∶1000)或鼠抗PAb416 单克隆抗体(1∶1000),孵育相应的二抗后,通过化学发光成像系统检测,用ImageJ 软件进行定量分析。
8 免疫组织化学检测 免疫组化采用SP 法,非MPM 胸膜组织和MPM 组织用10%中性甲醛固定后,石蜡包埋。4 µm 切片,经脱蜡至水,柠檬酸缓冲液中进行抗原修复。滴加鼠抗PAb101 单克隆抗体(1∶100),4℃冰箱过夜,滴加羊抗鼠IgG 二抗,应用新鲜配制的DAB 显色液显色。以PBS 代替一抗作为阴性对照。由两名病理医师独立采用双盲法阅片,每张切片随机选取阳性细胞富集的10 个高倍视野(400 ×)观察。依据细胞染色强度和阳性细胞百分比判断结果[11]。
9 统计学分析 采用GraphPad Prism 8.01 和SPSS 23.0 软件进行统计学分析和作图。采用χ2检验或Fisher 确切概率检验进行统计学分析,P<0.05 为差异有统计学意义。
结 果
1 纳入患者临床资料 12 例非MPM 患者中,年龄≥50 岁8 例(66.67%),男性和女性各占50%。51 例MPM 患者发病年龄普遍偏大,年龄≥50 岁45 例(88.24%),男性居多(74.51%)。其中40 例(78.43%)有石棉暴露史,吸烟22 例(43.14%)。MPM 病理类型以上皮型MPM 最多(86.27%);其次为双相混合型MPM (7.84%),肉瘤型MPM 最少(5.88%)。见表3。

表3 12 例非MPM 组和51 例MPM 组患者一般资料和临床病理资料Tab. 3 General data and clinicopathological data of 12 non-MPM patients and 51 MPM patients
2 MPM 组 织和非MPM 胸膜 间 皮组 织 的HE 染色形态 HE 染色结果显示,非MPM 胸膜间皮组织表面为被覆良性间皮细胞,下方为纤维、脂肪及血管(图2A)。51 例MPM 患者中,上皮型 44 例(86.27%):瘤细胞主要由两种细胞构成,一种为具有中等量嗜酸性胞质的小细胞,另一种为嗜酸性或嗜碱性胞质的大细胞,这两种细胞可以一种为主,也可混合,因其分化程度的不同,在组织结构上有很大差异,可表现为管状、乳头状、管状乳头状、裂隙状、微囊性、实性巢状、片块状等,其间为丰富的水肿黏液样间质(图2B);肉瘤型 3 例(5.88%):瘤细胞呈梭形,细胞丰富,常交织成束,也可见局灶性漩涡状、车辐状及血管外皮瘤样构型;其胞核具有不典型性,染色较深,核分裂象多见(图2C);双相混合型4 例(7.84%):此种间皮瘤具有上皮型和肉瘤型间皮瘤两种成分,以不同的比例混合存在(图2D)。

图2 MPM 组织和非MPM 胸膜间皮组织的HE 染色结果(200 × )A:非MPM 胸膜间皮组织;B:上皮型MPM;C:肉瘤型MPM;D:双相混合型MPM;标尺:100 µmFig.2 HE staining results of MPM tissue and non-MPM pleural mesothelial tissue (200 × )A: Non-MPM pleural mesothelial tissue; B: Epithelial MPM; C: Sarcomatous MPM; D: Biphasic mixed MPM; Scale bar: 100 µm
3 PCR 引物的扩增特异性验证 293T 细胞是人肾胚293 细胞经病毒基因改造的稳定表达SV40的永生化细胞[12]。琼脂糖凝胶结果显示,293T 细胞中检测到了适当大小的产物条带,而不含SV40病毒基因组的293 细胞PCR 扩增结果为阴性。PCR 结果显示,本次实验中使用到的3 对低风险引物设计合理,特异性较强,扩增的片段大小与预期的片段大小均完全一致(图3)。
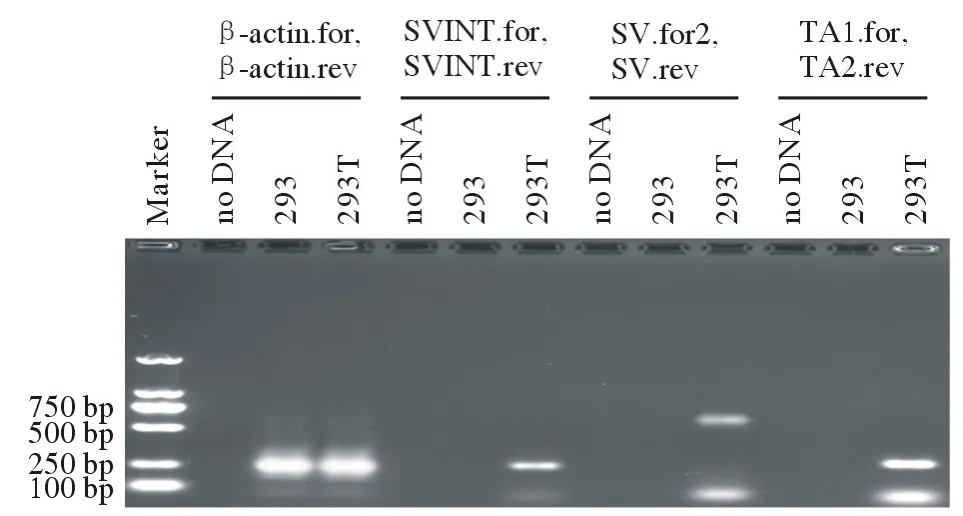
图3 3 对低污染风险PCR 引物的扩增特异性验证Fig.3 3 validation of amplification specificity for low contamina-tion risk PCR primers
4 MPM 组 织 和 各MPM 细 胞 系中 不存 在SV40 TAg 基因 对各组织样本的PCR 分析结果显示,12 例非MPM 胸膜间皮组织和51 例MPM 组织均未检测到SV40 DNA 序列。其中293T 阳性对照组的4 对引物均扩增出了适当大小的产物条带,阴性对照组无扩增产物出现(图3)。对正常间皮细胞系和MPM 细胞系的PCR 检测结果表明,正常间皮细胞系LP9 中SV40 为阴性,而SV40 转化的正常间皮细胞Met5A[13]中SV40 为阳性(表4)。同时,在各种不同病理类型的MPM 细胞系中均无法检测到SV40 TAg 特异性条带(图4)。上述结果表明,MPM 组织和各MPM 细胞系中均不含SV40 TAg 基因。

图4 PCR 检测MPM 组织中SV40 的表达情况M:DNA Marker;1 ~ 10:实验组(分组分别对2 例非MPM组织和51 例MPM 组织进行检测);11:无DNA 阴性对照组;12:293T 细胞 DNA 阳性对照组Fig.4 PCR detection of SV40 expression in MPM tissues M: DNA Marker; 1-10: experimental groups (grouped for 2 non-MPM tissues and 51 MPM tissues respectively); 11:without DNA negative control group; 12: 293T cells DNA positive control group

表4 PCR 和免疫组织化学检测各种MPM 细胞中TAg 表达结果Tab. 4 Results of PCR and immunohistochemistry assays
5 Western blotting 在各MPM 细胞系中未检测到SV40 TAg 蛋白表达 Western blotting 结果显示,正常胸膜间皮细胞系LP9 中无SV40 TAg 蛋白表达,而SV40 转化的Met5A 细胞系中可以检测到SV40 TAg 蛋白表达。此外,其他各种不同MPM细胞系NCI-H28 (上皮型)、NCI-H2052 (肉瘤型)、NCI-H2452 (双相混合型)中均未检测到SV40 TAg蛋白的表达(图5)。
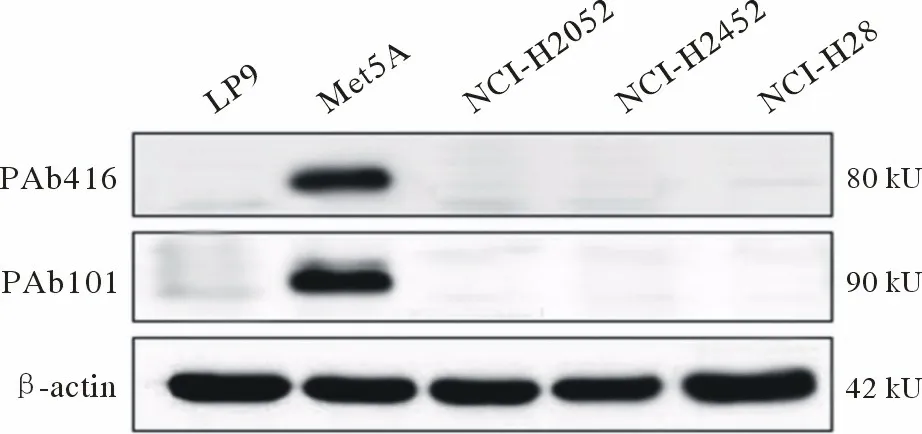
图5 Western blotting 检测正常胸膜间皮细胞系和MPM 细胞系中SV40 TAg 蛋白的表达Fig.5 Western blotting detection of SV40 TAg protein expression in normal pleural mesothelial cell lines and MPM cell lines
6 免疫组织化学检测MPM 组织和各MPM 细胞系中SV40 TAg 均为阴性 免疫组织化学结果显示,正常胸膜间皮细胞系LP9 中SV40 TAg 结果为阴性,而Met5A 细胞系SV40 TAg 结果为阳性,细胞呈明显的黄色或棕黄色,以细胞核内表达为主,证实了PAb101 抗体对SV40 TAg 抗原检测的敏感度和特异度。然而,所分析的12 例非MPM 胸膜间皮组织和51 例MPM 组织免疫组化染色结果均为阴性,细胞质、细胞核不着色(图6)。此外,免疫组化结果显示,各种MPM 细胞系中SV40 TAg 均为阴性(表4)。以上结果提示,MPM肿瘤组织和MPM 细胞系中均不存在SV40 TAg 蛋白表达。
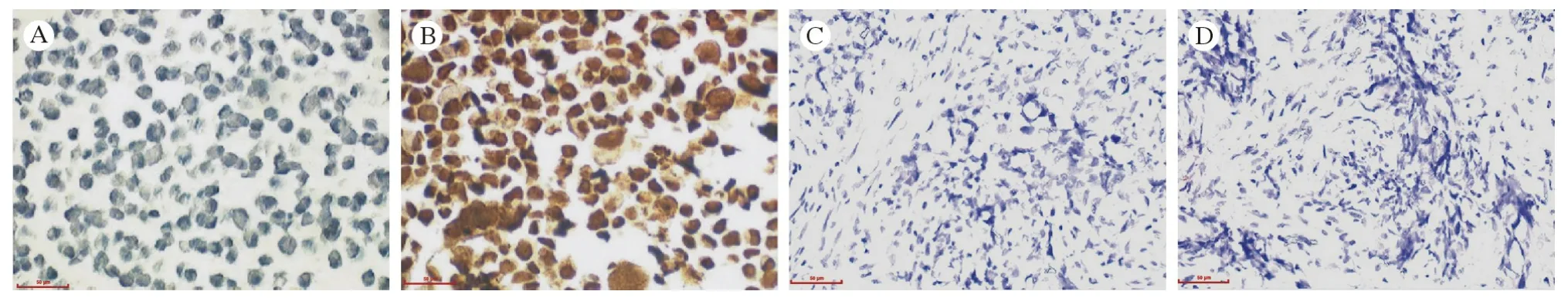
图6 免疫组织化学检测正常胸膜间皮细胞和MPM 组织中SV40 TAg 表达情况(400 ×;标尺:50 µm)A:LP9 细胞;B:Met5A 细胞;C:MPM 样本1;D: MPM 样本2Fig.6 Immunohistochemical detection of SV40 TAg expression in MPM tissues and MPM cell lines (400 ×; Scale bar: 50 µm)A: LP9 cell line; B: Met5A cell line; C: MPM sample 1; D: MPM sample 2
讨 论
SV40 是一种在恒河猴中流行的小型环状双链DNA 多瘤病毒,大小为5 243 bp,是实验室中使用的最有效的人类致癌物之一[14]。SV40 在体外可使人和动物多种组织类型正常细胞发生恶性转化,在仓鼠和转基因小鼠体内可诱发多种肿瘤形成,但与人类恶性肿瘤发生的病因学关系迄今未能明确[14]。SV40 TAg 是参与SV40 复制和介导细胞转化的主要基因产物。MPM 是一种恶性程度高、侵袭性高的罕见癌症。长期以来,普遍认为大量接触石棉会导致慢性炎症并诱导氧自由基的释放,激活促进细胞生长的各种途径,从而导致80% MPM 的发生[15]。随着研究的深入,越来越多研究者发现SV40 病毒可能感染人类间皮细胞[16]。但目前国内外关于SV40 病毒在人类MPM 中作用的研究仍然具有争议。为解决这些问题,我们的研究结合高敏感PCR 分子诊断、Western blotting和免疫组化等方法检测MPM 肿瘤样本和MPM 细胞系中SV40 的表达情况,结果并未发现SV40 病毒与云南省大姚县青石棉污染区MPM 的发生存在关联。
Mazzoni 等[17]的研究基于对SV40 TAg 的酶联免疫吸附测定,提示SV40 转化活性是由于TAg 的表达,它可能结合并灭活肿瘤抑制基因pRB 和TP53,导致SV40 感染患者更易在长期接触石棉后发生MPM。但基于抗体的实验方法可能受自身抗体和异嗜性抗体等干扰,造成假阳性的发生。且该研究只进行了蛋白质水平上的检测,未进行SV40 TAg 的基因水平的验证,所以SV40会引起p53 失活的结论仍缺乏明确、直接的实验支持。血清学研究表明,许多报告的SV40 血清阳
性可能是由于与之密切相关的多瘤病毒JC 病毒(John Cunningham virus,JCV)和BK病毒(BK virus,BKV)的交叉反应性[18]。有学者提出,PCR 检测到的SV40 阳性结果可能来自实验室本身的污染,因为二者有着相同的序列片段,该项研究表明PCR 检测结果可能存在一定程度的缺陷[19]。因此这些证据不能有力证明SV40 与大多数人类MPM的发生相关。此外,我们的结果与Mazzoni 等[20]在意大利、Jin 等[21]在日本、Ramael 等[22]在比利时进行的研究结果不同,中意、中日、中比以及其他国家之间MPM 与SV40 的相关性差异是否由于地域性差异导致,尚需要更多实验进行分析。
由于近年来MPM 发病率显著增加且缺乏有效的治疗方法,其正成为一个重大的健康难题,研究其发病机制具有很广泛的临床应用前景。本研究中,我们首先使用PCR 技术检测了SV40 TAg 在12 例非MPM 组织和51 例MPM 组织以及各种MPM 细胞系中的表达情况,结果表明SV40 TAg 的表达均为阴性。这一结果与最近报道的在MPM 或其他人类肿瘤中发现罕见或没有SV40 DNA 序列的大量证据一致[23]。Alchami 等[24]应用高敏感RNA 原位杂交技术的英国MPM 队列研究中并未检测到SV40 标签RNA。金木兰等[19]从17 例MPM 标本中检测到了3 例阳性标本,均为SV.for3/SV.rev 扩 增 的105 bp 片 段,其 他 两组SV40 TAg 引物均未获得阳性扩增结果,且免疫组化结果显示无MPM 样本表达SV40 TAg 蛋白,推测PCR 阳性可能是质粒污染的结果。此外,扩增产物较小也会导致更高的阳性率。在我们的研究中,Western blotting 和免疫组织化学染色结果也显示在51 例MPM 肿瘤组织和各种MPM 细胞系NCI-H28、NCI-H2052 和NCI-H2452 中均未检测到SV40 TAg 蛋白表达。由于本研究使用的PAb101 单抗与SV40 TAg 反应的良好特异性,与BKV 及JCV 表达的TAg 无交叉反应,故可排除因后两种病毒在正常人群中的普遍存在及TAg 的表达所造成的假阳性结果。总之,结合世界各地报道的大量关于MPM 组织中SV40 TAg 阴性的证据,我们的研究结果同样不支持SV40 病毒在人类MPM 中的致癌作用。
我们认为在MPM 中检测到SV40 TAg 的可能因素有以下几点:(1) 脊髓灰质炎病毒疫苗的污染,存在一定的地域因素差异。但流行病学调查尚未显示出暴露于受污染的脊髓灰质炎病毒疫苗人群中MPM 发病率可能性增加的明确关联[25]。(2)一些研究者认为SV40 TAg 在MPM 及其他人类肿瘤中的高检出率可能是由于实验室广泛使用含有SV40 TAg DNA 序列的质粒污染所致[18]。由于基因组中存在的或偶发性质粒污染DNA 样本无法检测,因此应该严格设置DNA 阴性对照,以防止这种潜在的假阳性结果。(3) 既往研究结果显示,不同的SV40 TAg 的PCR 引物组可能导致不同比例的阳性率[10]。文献中常用的引物SV.for3/SV.rev 可扩增SV40 TAg 上pRb 结合的编码区,并且跨越小TAg 的DNA 序列,TAg 基因片段常见于各种商品化的表达载体和报告载体,因此增加了检测到SV40 核苷酸4468 ~ 4372 bp 范围内105 bp DNA 序列的可能性[26]。本研究设计使用跨SV40 TAg 基因内含子序列的3 对低污染风险引物进一步降低了出现假阳性的风险。尽管我们的结果可能无法反映所有MPM 的情况,但结合世界各地的不同MPM 子集在SV40 的检测中大量阴性的证据,考虑到本次研究中使用的3 对低污染风险引物进行的SV40 TAg 基因检测,以及特异性抗体对SV40 TAg 蛋白质检测的高敏感度和特异度,我们有理由相信SV40 病毒感染并非云南省青石棉污染区MPM 的主要致病因素。
综上所述,我们的研究表明SV40 病毒与云南省青石棉污染区MPM 的发生关联并不密切,因此临床医师应继续将石棉暴露视为MPM 最可能和最确定的危险因素。
作者贡献刘如爱:细胞培养,试验指标检测,撰写初稿;王播勇、陈欣:数据整理,统计计算;自加吉、梅雯、邱璐:协助进行数据收集和整理;普元倩、张也频:文章校对;熊伟:研究设计,审读,修订。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:2578111066@qq.com。

