基于图论的胶质瘤患者脑结构网络分析
刘明航,攸 娜,杨晨轩,赵 恺,赵 悦,许百男解放军医学院,北京 00853;解放军总医院第一医学中心神经外科医学部,北京 00853
胶质瘤是颅内常见的恶性肿瘤,具有较强的侵袭性,往往在脑内呈浸润生长,对大脑局部或整体造成功能损害,常见症状包括偏瘫、失语等[1-2]。肿瘤位置的不同常会引起不同的临床症状,功能区与非功能区肿瘤手术最终切除程度和术后生存期常有很大差异。既往有研究表明,大脑可对病变造成的局部损伤进行神经重塑[3-5],当肿瘤位于语言区时,患者仍有可能具有良好的语言能力[6-7],表明大脑在受到损伤后出现了神经传导通路的重塑,深入研究大脑的神经可塑性对延长胶质瘤患者生存期、改善患者生活质量具有重要意义。
临床上对于胶质瘤的术前定位及研究依赖于无创性神经影像技术,其中功能磁共振成像(functional magnetic resonance imaging,fMRI)、扩散张量成像(diffusion tensor imaging,DTI)、正电子射线断层扫描等应用最为广泛[8-11]。DTI 是一种可用来描述大脑结构的成像手段[12-14],主要用于对白质纤维束的观察和追踪,脑发育和脑认知功能的研究,指导脑部手术的术前计划和术后评估。由于胶质瘤细胞常侵袭白质纤维束,导致局部功能失连接,进而引起一系列功能障碍,因此可通过DTI 对大脑的结构网络进行研究,观察其整体大脑的模式变化和神经重塑情况[15-17]。虽然既往对于神经重塑的研究已有不少发现[18-24],但对于胶质瘤人群的该方面研究较少。本文通过DTI 基于图论的方法构建大脑结构网络,研究处于不同位置的胶质瘤对于大脑结构网络的影响,进而分析大脑可塑性的机制[25],采用基于图论的方法分析胶质瘤患者脑结构网络属性,有助于理解肿瘤对大脑局部和整体脑区之间信息传导的影响。
资料与方法
1 研究对象 本研究中所有受试者均来自解放军总医院第一医学中心神经外科2018 年1 月 - 2020年12 月收治的胶质瘤患者。纳入标准:(1)经病理学检查确定为胶质瘤的初诊患者;(2) 右利手;(3)无心脏起搏器、神经刺激器、人工金属心脏瓣膜、体内顺磁性金属异物置入,无严重幽闭恐怖症、重度高热等MRI 采集禁忌证,能配合完成MRI检查。排除标准:(1) 无法配合完成MRI 扫描;(2)其他精神疾病、神经系统疾病;(3)严重躯体疾病、脑外伤、昏迷史;(4) 头颅结构MRI 异常;(5) MRI 扫描禁忌证;(6)曾经历过颅脑手术治疗。
2 MRI 检查方法 所有患者影像数据均为患者常规诊疗过程中应用的磁共振影像,磁共振数据均由影像科技师操作采集,患者进行磁共振扫描时有家属及临床医师陪同。所有受试者均采用德国西门子Espree 1.5 T 场强超导型MR。DTI 采用单次投照弥散加权自旋回波序列。 序列参数:回波时问147 ms,重复时间9400 ms,矩阵尺度128 ×128,视场251 mm × 251 mm,层厚3 mm, 带宽1502 Hz/px。弥散权重(high b value) 1000 s/ram2,进行12 个方向的弥散加权成像,同时进行1 次0 弥散加权(bO,low b value:0 s/mm2)成像用于后期处理时消减成像区域外周噪声。体素大小为1.9 mm × 1.9 mm × 3.0 mm。连续无间隔采集40 层,共采集5 次,以提高信噪比,总扫描时间约10 min。
3 肿瘤所在脑叶划分 本研究基于肿瘤所处的位置将所有患者分为额叶、颞叶、顶叶三组,本操作通过参考患者的磁共振T2 及FLAIR 序列在ITK snap 上完成。以中央后沟以及颞上沟为边界,肿瘤主体的50%以上位于中央后沟及以前的划分为额叶,肿瘤主体的50%以上位于中央后沟后方以及颞上沟上部的划分为顶叶,肿瘤主体的50%以上位于颞上沟下部的划分为颞叶。
4 数据处理方法
4.1 结构像数据处理 对T1 像进行颅骨剥脱得到脑组织图像,应用ITK snap 对肿瘤进行描画,期间参考个体的T2 像及Flair 像,使用SPM12 对患者的结构像以及肿瘤mask 像分别进行配准以及归一化处理,进而得到消除肿瘤密度影响的T1 结构像,再通过MRtrix3 软件包将被试的解剖像分为5 种组织(皮质、皮质下、白质、脑脊液和病变组织),将得到的结构像配准到个体弥散空间,进而确定灰、白质交界点,将灰质与白质的交界点作为纤维束重建开始的种子点。
4.2 脑区节点划分 本研究采用自动解剖标定模板(automated anatomical labeling,AAL) 作为脑分区模板,将大脑皮质划分为90 个脑区(左右半球各45 个脑区),因为使用的AAL 模板处于MNI 空间,因此需要得到个体弥散像与MNI 空间的转化矩阵,首先将TI 结构像线性配准至弥散像上,将个体解剖像上述步骤中的肿瘤mask 图像通过ANTs 软件包进行消除密度处理,将配准后的T1 结构像非线性配准至MNI 空间,同时将消除密度影响的肿瘤mask 图像应用到该步骤中,进而得到转化矩阵,将该转化矩阵求逆得到逆矩阵,最后将该逆矩阵应用到患者的弥散像上,即可得到配准至个体空间的AAL 脑区模板,作为脑网络矩阵构建的节点。
4.3 弥散像数据处理 弥散像的预处理均在MRtrix3 工具包中进行,主要包括空间降噪、吉布斯环伪影去除、头动矫正和畸变矫正、偏倚场矫正。预处理完成后,构建二值化的大脑mask,以提高流线的可信度以及减少计算时间,然后分别对弥散像中的白质、灰质、脑脊液进行反应函数的计算,得到各组织的反应函数后,即可进行计算体素的纤维方向,因为部分区域纤维走行方向不唯一,因此采用msmt_csd 方法确定纤维走行方向,对得到的FOD 进行密度标准化,以便于进行组分析,使用概率性追踪算法进行纤维束追踪,作为脑网络矩阵构建的边。
4.4 全脑网络构建 通过以上步骤分别得到了个体水平的大脑网络节点和边,大脑网络矩阵的构建在MRtrix3 工具包中完成。
4.5 脑网络参数分析 得到被试的大脑网络矩阵后,后续脑网络参数提取在MATLAB 工具包的Gretna 软件中进行。网络稀疏性阈值定义为实际边缘数除以网络中最大可能边缘数的比率,本研究网络稀疏性的范围设置为0.1 ~ 0.4,阈值间隔为0.01,因为目前暂无金标准选择一个阈值,因此本研究计算了所有阈值下的参数,选择能表现所有节点的网络属性并确保最佳小世界网络属性的阈值,最终确定选取阈值为0.32。分析的全局参数包括小世界属性、最短路径长度(the shortest path length,Lp)、聚类系数(clustering coefficient,Cp)、全局网络效率(network efficiency,Eg)、局部效率(local efficiency,Eloc)以及4 个局部节点参数——介数中心性(betweenness centrality,NBc)、度中心性(degree centrality,NDc)、节点全局效率(nodular global efficiency,NEg)、节点最短路径长度(nodular shortest path length,NLp)。
5 统 计 学分 析 使 用SPSS 26.0 和R3.5.3 进 行统计分析,计量资料以x¯±s表示,数据符合正态性检验和方差齐性时,采用t检验和单因素方差分析, 使用LSD 检验进行组间多重比较,当不符合正态性检验或方差不齐时,采用Kruskal-WallisH检验,使用Tamhane T2 检验进行组间多重比较。P<0.05 为差异有统计学意义。
结 果
1 研究对象一般资料 共收集颅内不同部位胶质瘤患者113 例,经筛查4 例因肿瘤侵袭至对侧被排除,剩余男性76 例,女性33 例,平均年龄(50.92 ± 14.46)岁。肿瘤位于额叶55 例,颞叶40 例,顶叶14 例。WHO 2 级48 例,WHO 3 级19 例,WHO 4 级42 例。
2 全局拓扑属性分析
2.1 全局参数整体比较 三组之间的方差分析结果显示全局拓扑属性(Lp、Cp、Eg、Eloc)均表现为差异有统计学意义(P<0.05)。三组之间的标准化聚类系数、标准化最短路径长度和小世界属性无统计学差异(P>0.05),大脑结构网络的聚类系数与对应随机网络聚类系数的比值均大于 1(γ>1),平均路径长度与对应随机网络近似相等(λ≈1),σ 值也均大于1,额、颞、顶三组均表现出典型的小世界网络属性(σ>1,高聚类系数和短路径长度)。见表1、图1。
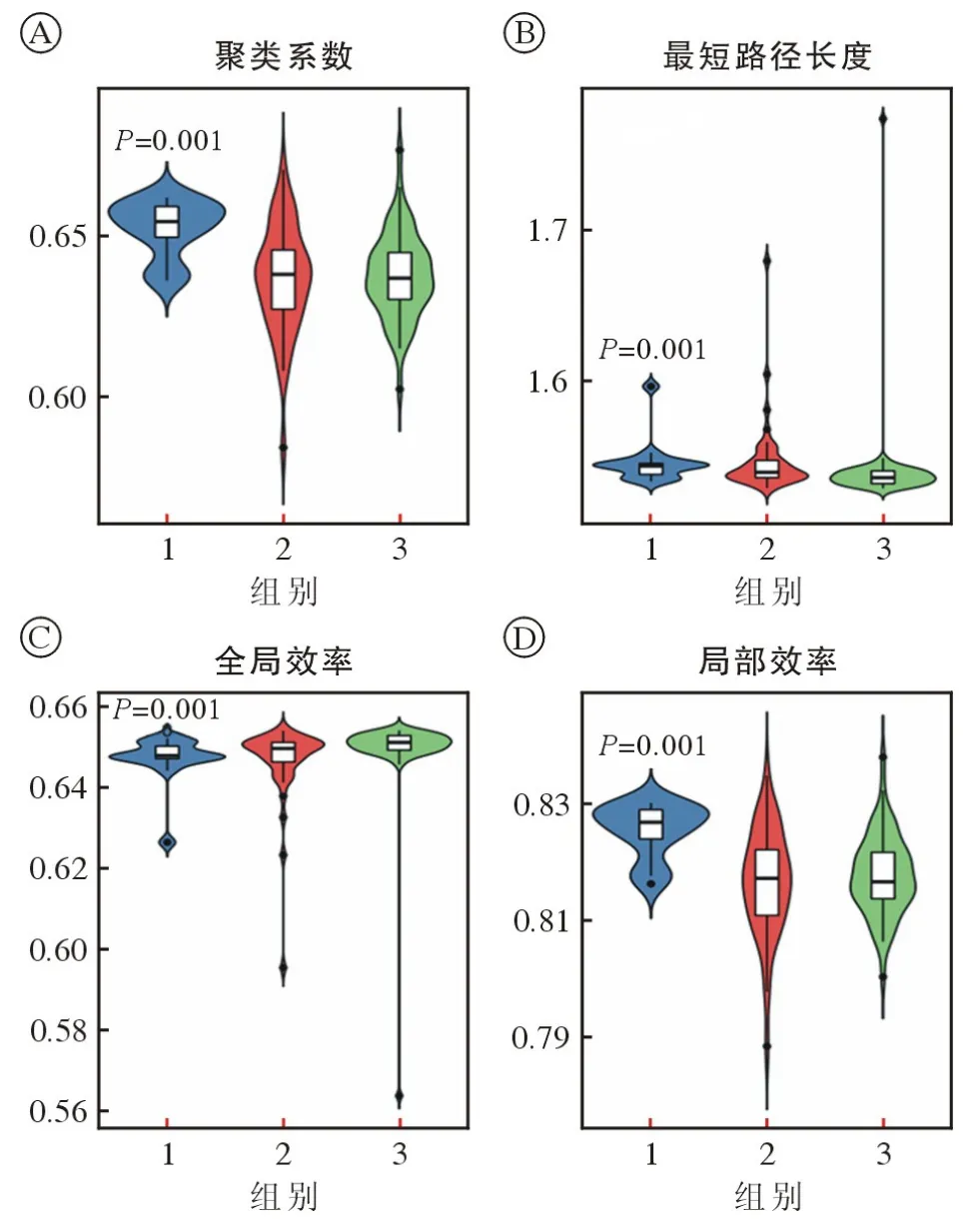
图1 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间全局参数比较(组别1:顶叶胶质瘤组;组别2:颞叶胶质瘤组;组别3:额叶胶质瘤组)A:三组间聚类系数指标比较;B:三组间最短路径长度比较;C:三组间全局效率比较;D:三组间局部效率比较Fig.1 Comparison of global parameters among frontal lobe glioma,temporal lobe glioma and parietal lobe glioma (Group 1:parietal lobe glioma group; Group 2: temporal lobe glioma group; Group 3: frontal lobe glioma group)A: cluster coefficient index comparison among the three groups; B: shortest path length comparison among the three groups; C: global efficiency comparison among the three groups; D: local efficiency comparison among the three groups

表1 全局拓扑属性比较Tab. 1 Comparison of global topology attribute
2.2 全局参数组间两两比较 肿瘤分别位于额、颞、顶叶时,三组之间聚类系数指标的比较结果显示:额、颞叶肿瘤患者的全局聚类系数指标差异无统计学意义(P=1.000),而额、顶(P=0.001)以及颞、顶(P=0.001)组间差异有统计学意义(图1A)。最短路径长度组间比较结果显示:额、顶(P=0.004) 以及额、颞(P=0.002) 组间差异有统计学意义,当肿瘤位于颞、顶叶时组间差异无统计学意义(P=0.665)(图1B)。全局效率组间比较结果显示:额、顶(P=0.004) 以及额、颞(P=0.002)组间差异有统计学意义,当肿瘤位于颞、顶叶时组间差异无统计学意义(P=0.663)(图1C)。局部效率组间比较结果显示:额、颞叶肿瘤患者的局部效率指标差异无统计学意义(P=0.944),而额、顶(P=0.001) 以及颞、顶(P=0.001) 组间差异有统计学意义(图1D)。
3 节点网络属性分析
3.1 节 点 介数 中 心性 额 叶 胶质 瘤、颞 叶胶 质瘤、顶叶胶质瘤三组间部分节点的介数中心性存在差异,差异有统计学意义(P<0.05)。见图2。
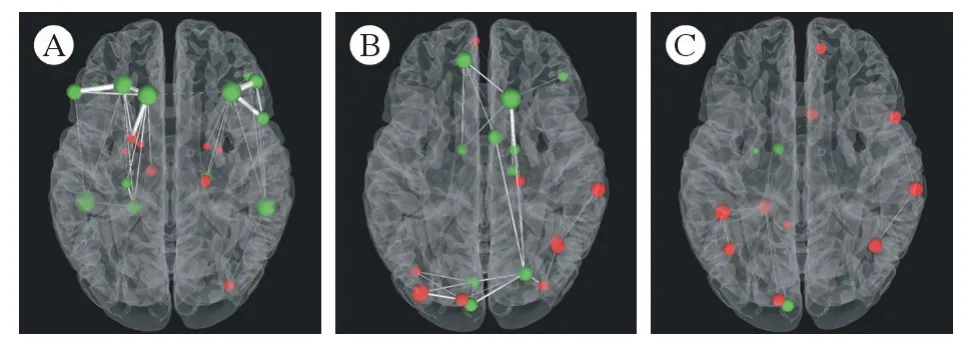
图2 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间节点的介数中心性比较(红色小球表示组间比较升高的脑区,绿色小球表示组间比较降低的脑区。小球越大,表示升高或降低越显著;小球间连接线越粗,表示两节点间连接强度越强)A:额叶胶质瘤组与颞叶胶质瘤组的比较;B:额叶胶质瘤组与顶叶胶质瘤组的比较;C:颞叶胶质瘤组与顶叶胶质瘤组的比较Fig.2 Comparison of the centrality of nodes among frontal lobe glioma, temporal lobe glioma and parietal lobe glioma (The red ball represents the elevated brain area of comparison between the groups, and the green ball indicates the decreased brain area of comparison between the groups. The larger the ball, the more obvious it is to rise or decrease. The thicker the connection line between the balls, the stronger the connection between the two nodes)A: comparison between frontal lobe glioma group and temporal lobe glioma group; B: comparison between frontal lobe glioma group and parietal lobe glioma group; C: comparison between temporal lobe glioma group and parietal lobe glioma group
与颞叶胶质瘤组相比,额叶胶质瘤组的NBc 在海马回(R)、杏仁核(L,R)、枕下回(R)、豆状壳核(L)、豆状苍白球(L,R)、丘脑(L)显著升高,而在背外侧额上回(L)、额中回(L,R)、岛盖部额下回(R)、三角部额下回(L,R)、眶部额下回(L,R)、海马旁回(L,R)、梭状回(L)、颞中回(L,R)显著下降(图2A)。
与顶叶胶质瘤组相比,额叶胶质瘤组的NBc 在眶内额上回(L)、海马(R)、枕上回(L)、枕中回(L)、枕下回(L,R)、顶下缘角回(R)、缘上回(R)、角回(R) 升高,在背外侧额上回(R)、眶部额下回(R)、内侧额上回(L)、内侧和旁扣带脑回(R)、楔叶(L)、舌回(L,R)、尾状核(L,R)、丘脑(R)显著下降(图2B)。
与顶叶胶质瘤组相比,颞叶胶质瘤组在岛盖部额下回(R)、眶内额上回(R)、前扣带与旁扣带脑回(R)、后扣带回(L)、枕上回(L)、梭状回(L)、顶下缘角回(L)、缘上回(R)、角回(L,R)显著升高,而在杏仁核(L)、楔叶(L)、尾状核(L)、丘脑(R)显著下降(图2C)。
3.2 节点度中心性 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间部分节点的介数中心度存在差异,差异有统计学意义(P<0.05)。见图3。

图3 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间节点的度中心性比较(红色小球表示组间比较升高的脑区,绿色小球表示组间比较降低的脑区。小球越大,表示升高或降低越显著;小球间连接线越粗,表示两节点间连接强度越强)A:额叶胶质瘤组与颞叶胶质瘤组的比较;B:额叶胶质瘤组与顶叶胶质瘤组的比较;C:颞叶胶质瘤组与顶叶胶质瘤组的比较Fig.3 Comparison of degree centrality of nodes among frontal lobe glioma, temporal lobe glioma and parietal lobe glioma (The red ball represents the elevated brain area of comparison between the groups, and the green ball indicates the decreased brain area of comparison between the groups. The larger the ball, the more obvious it is to rise or decrease. The thicker the connection line between the balls, the stronger the connection between the two nodes)A: comparison between frontal lobe glioma group and temporal lobe glioma group; B: comparison between frontal lobe glioma group and parietal lobe glioma group; C: comparison between temporal lobe glioma group and parietal lobe glioma group
与颞叶胶质瘤组相比,额叶胶质瘤组的NDc在额上回、额中回、额下回以及扣带回周围皮质显著下降,而在海马(L,R)、杏仁核(L,R)、枕上回(L)、枕中回(L)、枕下回(L)、中央旁小叶(R)、豆状核(L,R)、颞上回(L)、颞中回(L)、颞下回(L)表现为显著升高(图3A)。
与顶叶胶质瘤组相比,额叶胶质瘤组的NDc在中央前回(R)、后扣带回(L)、海马(R)、枕中回(L,R)、顶上回以及角回周围皮质(L,R)显著升高,而在额上回(L,R)、额中回(L,R)、额下回(L,R) 以及扣带回(L,R) 周围皮质显著下降(图3B)。
与顶叶胶质瘤组相比,颞叶胶质瘤组的NDc主要在中央前回(R)、扣带回(L)、枕上回(L,R)、顶上回(L,R)、缘上回(R)、楔前叶(L,R)周围皮质表现为升高(图3C)。
3.3 节点全局效率 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间部分节点的全局效率存在差异,差异有统计学意义(P<0.05)。见图4。
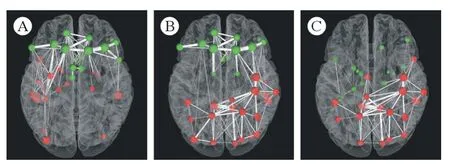
图4 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间节点的全局效率比较(红色小球表示组间比较升高的脑区,绿色小球表示组间比较降低的脑区。小球越大,表示升高或降低越显著;小球间连接线越粗,表示两节点间连接强度越强)A:额叶胶质瘤组与颞叶胶质瘤组的比较;B:额叶胶质瘤组与顶叶胶质瘤组的比较;C:颞叶胶质瘤组与顶叶胶质瘤组的比较Fig.4 Comparison of global efficiency of nodes among frontal lobe glioma, temporal lobe glioma and parietal lobe glioma (The red ball represents the elevated brain area of comparison between the groups, and the green ball indicates the decreased brain area of comparison between the groups. The larger the ball, the more obvious it is to rise or decrease. The thicker the connection line between the balls, the stronger the connection between the two nodes)A: comparison between frontal lobe glioma group and temporal lobe glioma group; B: comparison between frontal lobe glioma group and parietal lobe glioma group; C: comparison between temporal lobe glioma group and parietal lobe glioma group
与颞叶胶质瘤组相比,额叶胶质瘤组的Neg在海马(L,R)、杏仁核(L,R)、枕下回(L,R)、豆状核(L,R)、颞上回(L,R)、颞中回(L)、颞下回(L) 显著升高,而在额上回(L,R)、额中回(L,R)、额下回(L,R)、扣带回(L,R) 显著下降(图4A)。
与顶叶胶质瘤组相比,额叶胶质瘤组的Neg在中央前回(R)、后扣带回(L)、楔叶(R)、枕上回(L,R)、枕中回(L,R)、中央后回(R)、顶上回(L,R)、顶下缘角回(L,R)、缘上回(R)、角回(L,R)、楔前叶(L,R) 显著升高,而在额上回(L,R)、额中回(L,R)、额下回(L,R)、前扣带与旁扣带回(L,R)、尾状核(L,R) 处显著下降(图4B)。
与顶叶胶质瘤组相比,颞叶胶质瘤组的Neg在中央前回(R)、内侧和旁扣带回(L)、后扣带回(L)、枕上回(L,R)、中央后回(R)、顶上回(L,R)、顶下缘角回(L,R)、角回(L,R)、楔前叶(L,R)、中央旁小叶(L)显著升高,在杏仁核(L,R)、尾状核(L)、豆状核(L,R)、丘脑(L,R)、颞上回(L,R)、颞下回(L)显著下降(图4C)。
3.4 节点最短路径长度 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间部分节点的最短路径长度差异有统计学意义(P<0.05)。见图5。
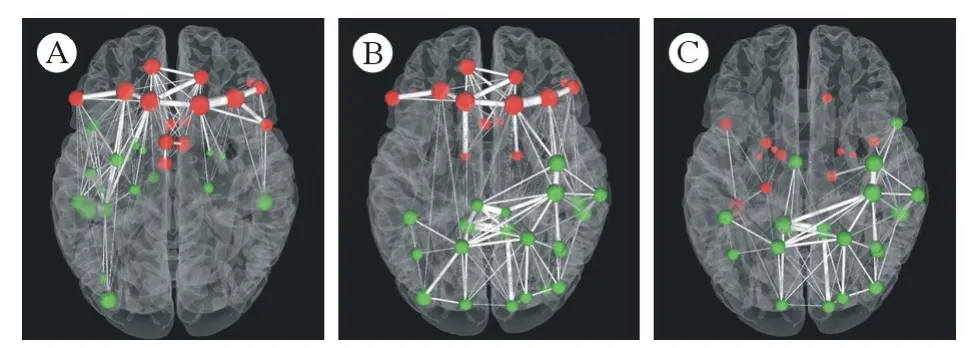
图5 额叶胶质瘤、颞叶胶质瘤、顶叶胶质瘤三组间节点的最短路径长度比较(红色小球表示组间比较升高的脑区,绿色小球表示组间比较降低的脑区。小球越大,表示升高或降低越显著;小球间连接线越粗,表示两节点间连接强度越强)A:额叶胶质瘤组与颞叶胶质瘤组的比较;B:额叶胶质瘤组与顶叶胶质瘤组的比较;C:颞叶胶质瘤组与顶叶胶质瘤组的比较Fig.5 Comparison of the shortest path length among frontal lobe glioma, temporal lobe glioma and parietal lobe glioma (The red ball represents the elevated brain area of comparison between the groups, and the green ball indicates the decreased brain area of comparison between the groups. The larger the ball, the more obvious it is to rise or decrease. The thicker the connection line between the balls, the stronger the connection between the two nodes)A: comparison between frontal lobe glioma group and temporal lobe glioma group; B: comparison between frontal lobe glioma group and parietal lobe glioma group; C: comparison between temporal lobe glioma group and parietal lobe glioma group
与颞叶胶质瘤组相比,额叶胶质瘤组的NLp在背外侧额上回(L,R)、眶部额上回(R)、额中回(L,R)、额下回(L,R)、辅助运动区(L)、内侧额上回(L,R)、扣带回(L,R)、显著升高,在海马(L,R)、杏仁核(L,R)、枕中回(L)、枕下回(L)、豆状核(L,R)、颞上回(L,R)、颞中回(L)、颞下回(L)显著下降(图5A)。
与顶叶胶质瘤组相比,额叶胶质瘤组的NLp在额上回(L,R)、额中回(L,R)、额下回(L,R)、前扣带与旁扣带脑回(L,R)、尾状核(R)显著升高,在中央前回(R)、后扣带回(L,R)、枕上回(L,R)、枕中回(L,R)、枕下回(R)、顶上回及角回周围皮质(L,R)显著下降(图5B)。
与顶叶胶质瘤组相比,颞叶胶质瘤组的NLp在回直肌(R)、海马(L)、杏仁核(L,R)、尾状核(L)、豆状核(L,R)、颞上回(L,R)、颞下回(L)显著升高,在中央前回(R)、扣带回(L)、枕上回(L,R)、顶上回及角回周围皮质(L,R)显著下降(图5C)。
讨 论
胶质瘤患者大脑的功能网络连接损害程度与肿瘤的性质和级别有关,但其背后的神经机制还没有明确定论。有研究认为,胶质瘤对周围组织的侵袭可对白质纤维束造成损害并改变病灶周围血管连接,导致各种功能缺失[26-29]。通过对胶质瘤患者大脑结构网络的研究,进一步揭示胶质瘤患者神经功能网络及结构网络的变化,探索神经可塑性的可能机制,给予临床个体患者更特异性的治疗指导,以期最终可以改善胶质瘤患者的生活质量和最终结局。对于胶质瘤患者,当清楚了解其神经网络变化后,可为手术医师提供手术决策指导,使其了解病变周围功能区以及相应功能的代偿情况,最终在最小损伤的前提下实现病变最大化切除。
脑结构连接分析展示了处于不同脑叶位置的肿瘤对网络连接属性连接性的影响,众多受影响的节点至少会有一个是位于病变周围,这也表明肿瘤对微结构完整性的影响与邻近病变的结构有关,节点之间连接性的改变值得进一步探索,一个解释是健侧脑区帮助患侧脑区进行神经重塑,另一个解释是肿瘤体积效应的存在使得患侧脑区的纤维密度增加,使得节点之间的连接属性发生变化[30-32],此外瘤周水肿也对纤维连接起到一定的影响作用[33]。有研究发现,对于颅内肿瘤患者,与健侧大脑的结构网络属性相比,其病变侧大脑的局部指标增加,纤维数量也有所增长,这与肿瘤生长过程中患侧半球发生神经重塑有关[34-36]。
既往对于胶质瘤患者的脑网络研究大多集中于fMRI 产生的功能脑网络[37-40],对于该类群体结构脑网络的研究较少,胶质瘤可破坏皮质下纤维的神经功能结构,了解肿瘤对于皮质下脑白质纤维束的影响对研究大脑的神经可塑性甚至比皮质功能的研究更有价值。图论是数学的一个分支,其在大脑的结构和功能进行网络化分析中具有重要作用,是未来我们进一步理解大脑的一个不可或缺的工具[41-42],本文基于图论来表征脑网络的拓扑关系,比较不同位置两两之间脑网络整体模态的变化来观察肿瘤位置对于大脑结构的影响。研究发现,当胶质瘤处于不同脑叶时,其大脑网络拓扑属性(介数中心性、度中心性、聚类系数、最短路径长度、全局效率、局部效率和小世界属性)均发生了不同程度的改变,这些发现表明肿瘤对脑结构网络的影响,这可能有助于揭示脑组织对神经肿瘤产生功能影响的代偿和可塑性机制,并指导该病的手术决策和远期预后。
首先,我们通过对胶质瘤患者大脑全局拓扑属性进行比较,结果显示各组之间的全局拓扑属性指标均有统计学差异,表明肿瘤处于不同位置时,其对大脑整体结构网络的影响不尽相同,但大脑网络仍保留有小世界属性,这可能与大脑对局部损伤产生了神经结构重塑有一定联系[43-47]。三组之间的指标两两比较结果显示,在四个全局拓扑属性指标下,顶叶胶质瘤组网络属性指标均表现出现高于额、颞叶胶质瘤组,表明顶叶胶质瘤可能存在更稳定的网络信息传输整体效率的提高以及大脑功能连通性的增强,提示顶叶病变可能对全脑功能的影响更小。
其次,我们比较胶质瘤患者局部节点拓扑属性变化,发现当肿瘤处于不同脑叶位置时,局部节点的脑网络指标(介数中心度、度中心度、全局效率、最短路径长度)均表现出差异,表明不同位置胶质瘤具有不同的节点模式。肿瘤对于脑网络的影响不仅局限于病变处,对于颅内其他脑区同样会造成影响,且根据颅内病变所处脑叶的不同,其对其他脑区的影响也表现出不同的结果。有研究报道在做第1 次胶质瘤切除时通过术中直接电刺激发现瘤周存在功能区,但第2 次手术时发现这些区域已不再存在功能,这也表明了在病变生长过程中发生的神经可塑性[48-50]。在本研究中观察到的节点网络属性改变也是由于神经可塑性机制的存在,应进一步研究病变对侧脑区拓扑网络属性,以更好地理解相关节点网络属性改变的机制。
本研究也有一些不足之处需要在未来的研究中解决:(1) 尽管本研究已尽力收集较大的样本量,但仍不足以完全展现大脑连接属性的改变,因此需要一个更大样本量的重复研究,以验证结果的可靠性;(2)本研究比较的网络指标为加权网络,采用不同的取值方式,如连边纤维束的FA 值或加权值,往往会影响脑结构网络指标的比较;(3)结构网络的改变与临床功能表现的相关性研究应在未来进行补充,以进一步理解是否有神经重塑的代偿发生;(4) 本研究使用AAL90 模板作为脑区节点模板,不同的模板选择也会对结构拓扑属性产生一定影响;(5) 由于枕叶病变患者较少,未来研究中应纳入枕叶病例来进一步完善肿瘤位置对于结构网络的影响。
综上所述,本研究展示了不同脑叶位置胶质瘤对于脑结构网络有着不同的影响,全局属性和局部节点均表现出网络连接性的改变,这项研究也需要进一步的组织病理学以及分子研究,以更好地理解不同解剖位置神经可塑性的改变。理解不同位置胶质瘤的神经可塑性机制及对结构的影响,有助于我们更好地理解其功能症状的改变,且可对临床治疗提供指导。
作者贡献刘明航:总体构思,数据管理,规范分析,调查研究,方法设计,软件处理,可视化处理,撰写初稿;攸娜:资源提供,软件处理;杨晨轩:调查研究,可视化处理;赵恺:有效验证;赵悦:监督指导;许百男:总体构思,资源提供,监督指导,审读和续订。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据暂不共享。

