远程缺血预处理在提升运动表现中的应用效果及作用机制
范紫菡 ,石丽君 ,吴迎 *
Murry等(1986)在动物实验中发现,心肌缺血前预先进行4次5 min的冠状动脉闭塞和5 min的再灌注,可显著降低心梗模型造成的心梗损伤,并由此提出了缺血预处理(ischemic preconditioning, IPC)的概念,即短暂、可逆的心肌缺血处理可增强心肌对后续缺血性损伤的抵抗,并在随后更长时间的缺血中抑制梗死进一步发展(陈玲 等,2021)。Przyklenk等(1993)提出远程缺血预处理(remote ischemic preconditioning, RIPC),即对某一器官进行短暂非致死性IPC后,可对发生缺血事件的远隔器官(或组织)产生保护作用或功能激活的现象。基于此,IPC可分为原位缺血预处理(local ischemic preconditioning, LIPC)和RIPC,两者划分主要依据产生作用效果的不同器官(或组织)。LIPC主要针对进行缺血预处理的器官(或组织)而言,而RIPC主要针对进行缺血预处理部位的远隔器官(或组织)。例如,对心脏冠状动脉进行多次、短暂的闭塞和再灌注,对其产生的作用效果视为LIPC;而临床选取右上臂进行缺血预处理刺激,对心肌产生的保护作用则为RIPC。现有临床研究表明,RIPC不仅可减轻心肌缺血再灌注损伤,还对脑、肾脏、脊髓等器官的缺血损伤具有保护作用(荆娜, 2018;许垚 等, 2017;周发展, 2018; Zarbock et al., 2016)。
De Groot等(2010)发现,递增负荷功率自行车测试前对单侧下肢股四头肌交替进行缺血预处理可提高下肢最大输出功率,从而将IPC从医学领域延伸到运动科学领域。该研究表明,IPC不仅可提升下肢爆发力,还可提高运动员的最大摄氧量(maximal oxygen uptake, V˙O2max),提示,IPC可能具有远程效应。此后,更多研究报道了IPC对运动表现的积极影响和可能机制。以跑步为例,跑前对肱二头肌施加缺血预处理刺激为远程缺血预处理,而跑前对股四头肌施加缺血预处理刺激则为原位缺血预处理(Cheng et al., 2021; Griffin et al., 2018)。相较于LIPC而言,RIPC具有以下优势:1)通过RIPC,可对某些无法进行或不便于进行LIPC的肌肉(例如背部肌群、腹部肌群、呼吸肌等)或深层肌群产生益处(Barbosa et al., 2014);2)对于某些以下肢肌肉参与为主的运动(例如跑步、自行车运动等),如果进行LIPC,由于腿部组织较多,要引起腿部动脉的全部闭塞需要较大压力,闭塞压力大会导致明显的痛感产生,而采用RIPC则可为运动员提供更舒适的方案(Kraus et al., 2015; Sharma et al., 2014);3)对于某些存在伤病不便进行LIPC的部位,可考虑通过RIPC的远程效应对其产生益处;4)RIPC相较于LIPC作用范围更广。实际上,在讨论LIPC和RIPC时,只是进行缺血预处理后关注的作用对象不同。由于机体循环系统的整体性特点,对某器官或组织进行缺血预处理后其产生远程效应的作用范围和作用效果都是应考虑的问题。
本研究通过梳理RIPC在运动科学领域中的相关研究,探讨其对运动员和健康人群运动表现的影响,阐明其在运动训练中的应用价值及可能机制。
1 RIPC对运动表现的影响
RIPC在改善运动员和健康人群的耐力、力量方面存在积极效果。研究证实,训练或比赛前对机体进行3~5次5 min闭塞(220 mmHg)和5 min再灌注预刺激,可有效提高运动表现。但闭塞压力大小、干预的单双侧、干预时长、运动方案、热身运动量、运动员机能水平、预处理与运动开始的时间间隔等都会影响RIPC的作用效果。本研究总结了RIPC对运动表现的影响(表1)。
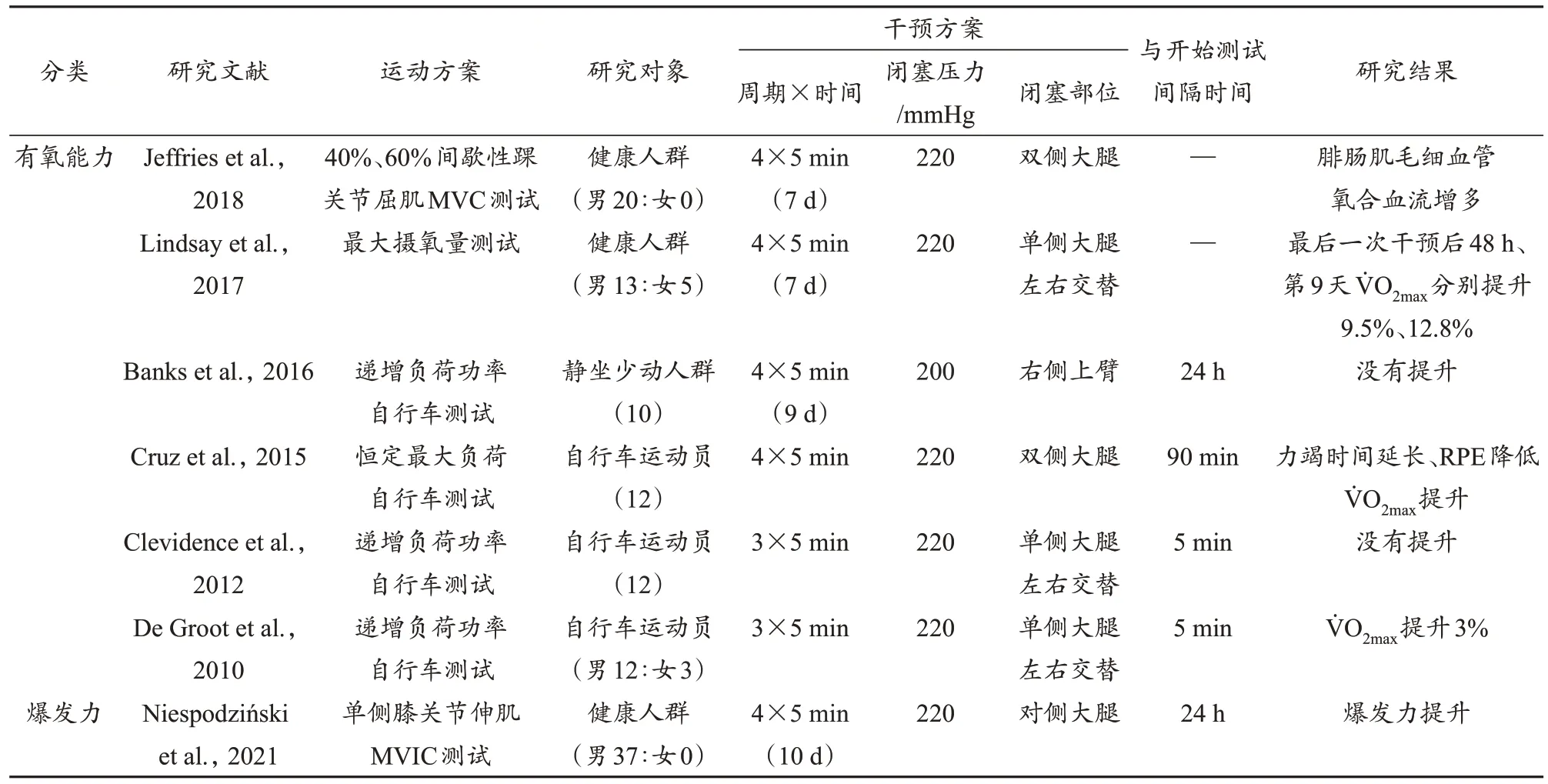
表1 RIPC对运动表现的影响Table 1 Effects of Remote Ischemic Preconditioning on Exercise Performance
1.1 有氧能力
对某肌群进行缺血预刺激后有氧能力的提升,可视为RIPC带来的全身远程效应。De Groot等(2010)对15名自行车运动员进行了递增负荷功率自行车测试,研究发现,运动前对运动员单侧大腿交替进行缺血预刺激(3×5 min,220 mmHg)可使提升3%。与此类似,在恒定最大负荷自行车测试前对自行车运动员双侧大腿进行缺血干预(4×5 min,220 mmHg),可延长力竭时间、降低主观疲劳感觉等级(rate of perceived exertion, RPE)、提升(Cruz et al., 2015)。Cruz等(2015)认为,有氧能力的提升是RIPC引起机体对疲劳信号的敏感性降低、运动单位募集增加所致。除此之外,重复使用缺血预刺激也能提升有氧能力。一项研究发现,对健康成年人单侧大腿(左右交替)进行连续7天缺血刺激(4×5 min,220 mmHg),可观察到最后一次干预后48 h、第9天的相较于基线水平分别提升9.5%和12.8%(Lindsay et al., 2017),该研究一方面表明重复缺血预刺激可提升有氧能力,另一方面提示其提升有氧能力的作用效果可能具有延时效应。但是,单次缺血预处理和重复缺血预处理对有氧能力的提升效果是否存在差异有待进一步研究。还有研究表明,对健康男性双侧股四头肌进行连续7天缺血干预(4×5 min,220 mmHg)可引起静息状态腓肠肌代谢率下降、毛细血管氧合血流量增多,且在40%、60%间歇性踝关节屈肌MVC测试中同样观察到腓肠肌毛细血管氧合血流升高,这进一步提示RIPC改善有氧能力可能是通过提升氧运输来实现的(Jeffries et al., 2018)。
尽管有研究表明缺血预刺激对有氧能力的提升具有积极作用,但是也有研究认为缺血预刺激无法引起这一改变。Clevidence等(2012)并未发现自行车运动员单侧下肢缺血预刺激(3×5 min,220 mmHg)后有氧能力有明显变化。此外,一项对静坐少动人群进行9天右侧上臂缺血预刺激(4×5 min,200 mmHg)干预的研究认为,RIPC不能提高,这可能与受试者的心肺水平有关(Banks et al., 2016)。提示,在应用RIPC提升有氧能力时要考虑到样本特征,例如受试者的健康状况(如亚健康)也可能会影响RIPC的作用效果。
1.2 无氧能力
1.2.1 爆发力
有研究认为,RIPC可提升爆发力运动表现。Kraus等(2015)发现,虽然在单侧上臂应用缺血预刺激不能提高下肢峰值输出功率(peak power output, PPO),但是以同样的干预方案应用在双侧上臂后,第4次Wingate下肢无氧功率测试的PPO明显提高。提示,单次RIPC引起爆发力提升的作用效果可能与干预的单、双侧有关,且具有一定的延时效应。研究表明,健康人群进行连续10天的单侧下肢RIPC(4×5 min,220 mmHg)干预可提高对侧下肢膝关节伸肌最大自主等长收缩(maximal voluntary isometric contraction, MVIC)晚期力量发展速率(rate of force development, RFD)(Niespodziński et al., 2021)。RFD是衡量爆发力的可靠指标,Niespodziński等(2021)的发现不仅提示RIPC可能对多种以爆发力为基础的运动项目(例如举重)有益,也为RIPC发挥作用效果的机制提供了新思路。除此之外,RIPC的作用效果存在“双峰”时程特点,即在RIPC后的4 h内和RIPC后的24~72 h,其预处理效应显著升高。基于这一特点,连续多天进行缺血预刺激也可能产生叠加效果(Lisbôa et al., 2017; Loukogeorgakis et al.,2005)。
但也有研究认为,RIPC对于提升爆发力没有影响。Griffin等(2018)发现,在重复冲刺跑之前对双侧上臂应用RIPC(4×5 min,220 mmHg)并不能减少全力冲刺跑用时。有研究表明,缺血处理对爆发力的影响存在一定的时间依赖性,缺血处理与开始运动的间隔时间与爆发力呈正相关趋势,即缺血干预和开始运动之间的间隔越长(40~50 min),效果越明显(Salvador et al., 2016)。与该研究一致,Patterson等(2015)也认为,对于持续时间较短的运动项目,缺血处理的作用效果易受其与运动间隔时间的影响,若间隔时间很短,可能效果甚微。此外,运动前使用RIPC(4×5 min,50 mmHg>SP)干预单侧上肢,既没有提升6 s功率自行车冲刺测试的运动表现,也没有提升Wingate下肢无氧功率测试中的PPO(Lalonde et al., 2015)。该研究结果与Kraus等(2015)在Wingate下肢无氧功率测试之前对运动员单侧上肢进行缺血预处理得到的结果一致。
1.2.2 无氧耐力
研究表明,RIPC对提升无氧耐力有积极作用。Kraus等(2015)研究发现,热身前对双侧上臂进行RIPC,与对照组相比可明显提高Wingate下肢无氧功率测试的平均输出功率(mean power output, MPO)。测试篮球运动员同样发现在热身前进行双侧上臂RIPC(4×5 min,30 mmHg>SP),可以提高Wingate下肢无氧功率测试的总输出功率(total power output, TPO)和第3次、第4次Wingate下肢无氧功率测试的MPO(Cheng et al., 2021)。除了通过不同形式的冲刺类项目来评价RIPC对无氧耐力的影响外,也有研究者采用最大氧亏积累(maximal accumulated oxygen deficit, MAOD)测试来评价RIPC对无氧耐力的影响。Paull等(2019)发现,在跑台运动前进行RIPC(4×5 min,220 mmHg)干预右侧上肢肱动脉,与对照组相比,RIPC干预组可明显提高中长跑运动员超大强度运动(110%)的 力 竭 时 间[RIPC:(122±38)s vs CON:(101±30)s]和MAOD[RIPC:(47±36)mL·kg-1vs CON:(38±32)mL·kg-1]。RIPC可能通过提高糖酵解系统代谢效率达到提升无氧耐力的目的(Paull et al., 2019)。与该研究一致,Chen等(2022)同样发现RIPC可提升400 m跑运动员的MAOD,且该研究比较了LIPC与RIPC在提升无氧耐力方面的作用效果,结果表明,LIPC与RIPC均可提升MAOD,延长力竭时间,两者的作用效果无显著差异。这与Cheng等(2021)的发现一致。而Griffin等(2018)则进一步比较了LIPC与RIPC在主观使用感受方面的差异,结果表明,尽管两者作用效果一致,但LIPC相较于RIPC而言引起的主观疼痛感更为强烈,这进一步体现了RIPC的方法学优势。
RIPC可否提升无氧耐力仍存争议,其作用效果需考虑多方面影响因素。也有研究发现,RIPC对于提升无氧耐力没有影响(Lalonde et al., 2015; Richard et al., 2018)。Richard等(2018)发现,在1 000 m速滑计时赛前90 min对双侧上肢进行RIPC(4×5 min,30 mmHg>SP),不能提高竞赛成绩。Richard等(2018)认为,赛前热身活动负荷及运动员训练水平可能是RIPC影响无氧耐力表现的重要因素。与Richard等(2018)在研究中要求运动员赛前进行不少于30 min热身不同的是,一些研究正式运动前热身时间只有0~5 min(Cheng et al., 2021; Kraus et al., 2015;Paull et al., 2019),这可能是RIPC对无氧耐力影响研究结果不同的重要原因之一,RIPC对运动表现的影响可能被赛前较长时间的热身所掩盖。此外,训练状态可能也会限制运动员对RIPC的反应,由于精英运动员训练水平高,受RIPC的影响可能较小(Richard et al., 2018)。
1.3 抗疲劳能力
由于RIPC在提升运动表现中主要是针对肌群加压的,因此有关缺血预处理应激是否影响肌肉运动表现值得关注,目前有关RIPC对肌肉功能的影响主要集中在肌肉抗疲劳能力。近年研究发现,RIPC对肌肉抗疲劳能力的提升有积极作用。Barbosa等(2014)报道,在健康成人节律性单手抓握测试前对双侧大腿进行RIPC(3×5 min,220 mmHg)干预,与对照组(3×5 min,10 mmHg)相比,可明显延缓手部肌肉疲劳并提升抓握测试的力竭时间[RIPC:(198±70)s vs. CON:(179±66)s]。以往研究证实,暴露于缺血预处理刺激中的组织体积越大,RIPC对缺血再灌注(ischemic reperfusion, IR)损伤的保护作用就越强。例如,对一侧下肢施加缺血预处理刺激(2×5 min,200 mmHg),可对随后肱动脉血管平滑肌缺血再灌注损伤产生保护作用,但以相同剂量对同侧上肢进行缺血预处理则没有产生肱动脉内皮保护作用(Loukogeorgakis et al., 2007)。因此,Barbosa等(2014)推测缺血预处理刺激对骨骼肌的影响也会出现类似的现象,即暴露在RIPC和运动中组织体积(或围度)的比值会影响RIPC对肌肉抗疲劳能力提升的效果。例如,以肱二头肌为目标肌肉,股四头肌缺血预处理的远程效果可能要优于肱二头肌的原位缺血预处理。除此之外,预处理股四头肌对靶肌肉肱二头肌的远程效应可能优于预处理小腿三头肌对肱二头肌的作用效果。反向思考时,对股四头肌进行加压刺激,其缺血预处理的远程效应可能亦对不同肌肉影响不同。另外,有研究表明,对健康成人单侧下肢股四头肌分别进行连续10天RIPC(4×5 min,220 mmHg)和对照处理(4×5 min,20 mmHg),在干预前后对另一侧下肢股四头肌进行50% MVIC测试,发现RIPC干预后股四头肌抗疲劳能力优于对照组,即重复RIPC亦可提升肌肉抗疲劳能力(Niespodziński et al., 2021)。同时,RIPC不仅可提升健康人群的肌肉抗疲劳能力,对业余水平力量训练者的肌肉耐力提升也有效果(Marocolo et al., 2016)。
同样由于影响实验控制的因素较多,目前有关RIPC对于股四头肌耐力影响的研究结果并不完全一致。与Niespodziński等(2021)的研究结果不同,另一项研究发现在右侧股四头肌进行20% MVIC测试之前应用RIPC(3×5 min,300 mmHg)干预左侧下肢,对于提升右侧股四头肌MVIC的力竭时间没有显著影响(Tanaka et al., 2020)。这可能与MVIC测试中使用的负荷不同有关。在MVIC疲劳测试中,使用的负荷太小(如20%)或者太大(100%)都可能会影响到RIPC的作用效果(Niespodziński et al.,2021)。
上述研究提示,在应用RIPC提升肌肉抗疲劳能力时,要考虑到运动方案、运动强度等因素,且暴露在RIPC中的组织与运动时主要肌群的体积(围度)之比可能影响其提升抗疲劳能力的效果。
1.4 最大肌肉力量
研究显示,用加压带对优势侧上臂进行缺血预处理刺激[5×5 min,(143±3)mmHg]结合对侧腕关节伸肌进行高强度抗阻训练(80% 1RM)2周,与进行相同抗阻训练强度的对照组[5×5 min,(65±2) mmHg]相比,RIPC组可显著提升对侧腕关节伸肌的1RM力量(Surkar et al.,2020)。更引人注意的是,进行2周RIPC干预的抗阻训练,促进肌肉力量增长的效果优于进行6~12周的同强度无RIPC干预的抗阻训练,前者可使1RM力量提升44%,而后者仅提升35%(Schoenfeld et al., 2017)。由于力量训练早期肌力增长多是神经适应的结果,因此RIPC可能更早地通过神经激活途径诱导力量增长,具有方法学优势。相比之下,以相似的训练方案、训练时间和强度进行无RIPC干预的抗阻训练只可提高相同肌群10%、17%的力量(Christie et al., 2010; Griffin et al., 2007)。综上所述,RIPC与抗阻训练结合可提升1RM力量。除了提升训练效率外,该方法一方面有可能在短时间内提升因伤病诱导的肌力下降,缩短运动员停训后力量增长周期,这对于高水平运动员很有意义。另一方面,对于运动康复治疗肌肉损伤恢复亦有广阔的应用前景,但如何在保证安全性的前提下对目标肌群进行缺血预处理,以达到加速力量恢复的效果,值得深入探究。除此之外,老年人进行适量抗阻训练前可否运用RIPC干预,除了考虑对力量的影响外,其安全因素需要重点关注,能产生远程效应的安全压力范围以及能否同样刺激内源性肌肉因子产生促健康效益,这些都是值得深入研究的问题。目前,RIPC对于骨骼肌力量的研究尚处于初级阶段,特别是RIPC对于肌肉围度或蛋白合成方面的研究仍处于空白,相关信号转导机制亟待深入挖掘。
2 RIPC提升运动表现的可能机制
临床实验表明,在远离缺血器官的部位实施缺血预处理刺激时,会向循环系统释放特定化学物质,它们可以在相应受体水平发挥调节作用,最终对缺血器官产生保护作用或功能激活(王军 等, 2021)。心脏缺血再灌注实验证实,短暂的缺血再灌注会产生腺苷、去甲肾上腺素等释放到冠状动脉流出物中,将这种冠脉流出物注入到受体的心脏内,可诱导受体心脏产生保护作用(Leung et al.,2014)。研究RIPC保护作用的体液机制很多,然而具体的体液介质仍未完全明了。另一方面,“传入神经-中枢-传出神经”构成的“远程预处理反射”在RIPC的缺血器官保护现象中起到了重要作用(王军 等, 2021)。例如,在心肌缺血再灌注模型中,切断下肢神经支配后在该肢体实施缺血预处理刺激,原有的心肌保护效应会随之消失;同样,用传入神经阻断剂辣椒素(capsaicin)预处理阻断传入神经纤维后,RIPC对心肌的保护效应也会受到抑制(Zhou et al., 2018)。虽然病理和生理调控存在差异,但临床医学研究为深入探讨RIPC提升运动表现的可能机制提供了依据。本研究结合临床医学与运动科学领域研究梳理了RIPC提升运动表现的相关机制(图1)。
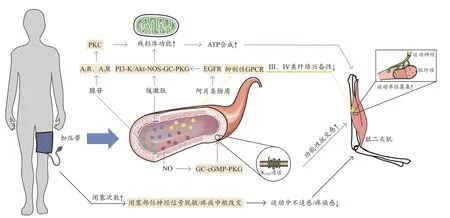
图1 远程缺血预处理提升运动表现的机制Figure 1. Mechanisms of RIPC on Enhancing Exercise Performance
2.1 调节血管收缩
RIPC可能通过增强功能性抗交感来调节运动骨骼肌的血管收缩(Sharma et al., 2015)。功能性抗交感指骨骼肌血管对运动中交感神经刺激反应出现钝化而发生舒张效应的生理现象(Segal, 2016)。如何通过应激途径而非药物增强运动中功能性抗交感,从而一定程度的舒张血管,改善血流,对于提升有氧能力具有重要实践意义。Horiuchi等(2015)指出,中等强度运动前对肢体施加缺血预处理刺激会使运动过程中功能性抗交感作用增强,即运动骨骼肌中血管收缩减弱、血流速度加快、血流量增加。机械刺激(如血管张力、切应力、内皮细胞变形及血液脉冲流动)可引起血管内NO的释放(Walford et al.,2003)。近年研究表明,血管内皮细胞存在机械敏感性离子通道(mechanosensitive ion channel, MSC),如大电导机械敏感性离子通道(mechanosensitive channel of large conductance,MscL)、小电导机械敏感性离子通道(mechanosensitive channel of small conductance,MscS)、Piezoes等(张珂诚 等, 2021),这些离子通道能够感受机械力变化并将机械信号转化为电信号或化学信号(刘凌云, 2021;汝一雯 等, 2019; 宋朋飞 等, 2017)。其中,Piezo1能促进NO生成从而改善内皮细胞功能(黄鹏 等, 2020)。研究发现,内皮细胞Piezo1敲除的小鼠失去诱导NO生成和血管扩张的能力,其原因可能是难以响应血液剪切应力以诱导NO生成从而舒张血管(Wang et al., 2016)。Piezo1可能在RIPC中起到“开关”的作用,即实施缺血预处理刺激的过程中,袖带闭塞对肢体产生的压力可激活Piezo1,诱导NO释放增强,从而开启下游的信号通路,需要进一步研究证实。NO释放后可激活谷氨酰环化酶(guanylyl cyclase, GC),刺激环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)的产生,进而激活蛋白激酶G(protein kinase G, PKG),而PKG的激活最终诱导血管平滑肌ATP敏感性钾(ATP-sensitive potassium,KATP)通道开放(Downey et al., 2007)。血管平滑肌KATP通道激活是运动中功能性抗交感的主要机制(Keller et al., 2004),该通道对NO敏感。RIPC像“钥匙”一样,刺激Piezo1,诱导NO生成,经过NO-GC-cGMP-PKG信号转导通路“打开”血管平滑肌KATP通道,进一步增强运动中的功能性抗交感,调节运动中骨骼肌血管收缩及血流量。Loukogeorgakis等(2007)同样证实了RIPC后会引起血管平滑肌KATP通道开放,且血管平滑肌KATP通道的开放是RIPC发挥内皮功能保护效应的关键。
2.2 降低运动中疲劳感或疼痛感
Cruz等(2017)和Crisafulli等(2011)认为,RIPC可通过降低Ⅲ类和Ⅳ类传入纤维的兴奋性来推迟疲劳感,从而延长受试者的运动时间。Amann等(2008)研究证实,Ⅲ类和Ⅳ类传入纤维依靠肌肉至大脑的感觉信息来影响运动性疲劳。运动中肌肉的传入反馈对中枢运动驱动具有抑制性作用,并将外周疲劳的发展限制在个体的临界阈值内。阻断阿片类物质介导的肌肉传入反馈,可增强中枢运动驱动,从而使中枢神经系统对运动引起的外周肌肉疲劳阈值增加(Amann et al., 2009)。内源性阿片肽在运动中可激活位于Ⅲ类和Ⅳ类传入纤维末梢的抑制性G-蛋白耦联受体(G-protein-coupled receptor, GPCR),从而降低兴奋性(Leal et al., 2013)。因此,肢体施加缺血预处理刺激后,可能通过释放内源性阿片肽进入循环系统(Dragasis et al., 2013; Swyers et al., 2014),激活其抑制性GPCR,减少Ⅲ类和Ⅳ类传入纤维的放电,募集额外的运动单位,使受试者疲劳阈值提高,推迟疲劳的出现,最终提高肌肉抗疲劳能力(Paull et al., 2019)。
另外,也有研究推测,RIPC可能通过降低运动中的疼痛感(或不适感)来提升肌肉抗疲劳能力(Sharma et al.,2014)。该研究发现,缺血预处理刺激过程中,由袖带闭塞引起的疼痛感(或不适感)会随着闭塞次数的增加而减少。这可能是闭塞部位神经信号的某种脱敏作用或者是疼痛中枢改变导致的(Sharma et al., 2015),其具体机制仍未完全清楚。
2.3 提高骨骼肌代谢效率
缺血预处理刺激后骨骼肌代谢效率的提升也被认为是RIPC改善运动表现的可能机制。一方面,RIPC可促进线粒体KATP通道的开放(陈玲 等, 2021)。线粒体KATP通道的开放是RIPC引起能量节省效益的关键(O’Rourke,2000)。缺血的大鼠心脏中,打开线粒体KATP通道会导致ATP合成增加;而在缺血预处理刺激前5 min用5-羟基癸酸选择性阻断线粒体KATP通道,则会削弱心脏中ATP的生成(Fryer et al., 2000)。该通道的开放可能是RIPC引起内源性物质(阿片类物质、缓激肽、NO等)释放,刺激相应受体引起的(Maldonado et al., 2013; Pan et al., 2011)。例如,阿片类物质通过表皮生长因子受体(epidermal growth factor receptor, EGFR)增强磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3-K)和蛋白激酶B(protein kinase B,Akt)活性,Akt进一步激活一氧化氮合成酶(nitric oxide synthase, NOS),最终经NO-GC-cGMP-PKG信号转导通路促使KATP通道开放;缓激肽则可直接刺激PI3-K和Akt激活KATP通道(Downey et al., 2007)。另一方面,RIPC可抑制线粒体通透性转化孔(mitochondrial permeability transition pore, mPTP)的开放(陈玲 等, 2021)。mPTP的开放会破坏线粒体膜电位,使氧化磷酸化解耦联,最终导致ATP耗竭及细胞死亡(Parks et al., 2018)。RIPC诱导腺苷释放(Maldonado et al., 2013; Pan et al., 2011),而腺苷可通过直接作用于其A1、A3受体,激活下游信号蛋白激酶C(protein kinase C,PKC),引起线粒体mPTP抑制(Downey et al.,2007)。综上,肢体进行缺血预处理刺激后,可引起阿片类物质、缓激肽及腺苷向循环系统释放,而阿片类物质、缓激肽可通过促进线粒体KATP通道的开放增加ATP合成,腺苷可通过抑制线粒体mPTP的开放来减少ATP耗竭,最终达到提升线粒体功能,提高骨骼肌代谢效率的作用。
3 RIPC提升运动表现亟待解决的问题
近年来,RIPC在提升运动表现中的作用逐渐受到关注,其在有氧和无氧能力提升方面均有报道,具有方法学优势。但RIPC在运动科学领域和临床医学领域应用的出发点不同,基于生理和病理需求的作用机制亦存在差异。因此,既不能将临床机制盲目“复制”在运动表现的研究中,也不能脱离人体各组织器官的内在生理、病理联系,孤立地看待RIPC对运动个体的影响。在继续深入研究RIPC的应用效果和作用机制的过程中,有如下问题需要深入思考和探究,以便更好地服务于运动实践。
1)目前有关RIPC的研究,无论是一次性干预还是持续几天的重复干预,都是从应激角度观察其对运动表现影响的,鲜有关于长期RIPC对运动能力影响的报道。长期RIPC是否会使机体产生适应性改变?从而弱化其促运动表现作用?尚未见研究报道。RIPC对于早期力量增长具有一定作用,但对于长期肌肉力量和体积的增加是否有效,值得关注。例如进行至少8~10周RIPC干预下的抗阻训练,能否提高蛋白质合成效率,可否更显著激活促蛋白合成通路,也是亟待解决的问题。若RIPC只有在应激中才发挥理想效果,则应更注重其在赛前的科学应用,需要在宏观层面从应激和适应的角度深入思考其作用原理。
2)RIPC相关作用机制的研究不够深入,是其科学应用的主要限制因素。与临床医学研究相比,运动科学领域对RIPC的作用机制研究较少且表浅,相关报道存在争议。解决这些争议的关键一方面在于实验控制,即对缺血干预方案、加压部位、热身强度、重复次数、与开始运动间隔时间等变量充分考虑,另一方面应注重结合动物实验观察其对神经、血管内皮、血液、骨骼肌等的影响,挖掘RIPC提升运动表现的分子生物学机制,重点在微观层面探究其诱导的信号转导通路,是探析RIPC的重要突破口。
3)RIPC远程效应的作用效果是否与刺激部位和靶肌肉之间的距离有关,值得进一步研究。例如,对单侧股四头肌加压,其对臀大肌、胸大肌产生的效果是否一致,如不一致,是距离干预部位越近越好?抑或无关?
4)现有研究表明,热身活动的强度可能会影响RIPC提升运动表现的效果,热身活动之前进行RIPC是否可以缩短热身时间从而达到相同的效果值得探索。除此之外,热身强度过高可能会弱化RIPC的作用效果,亦需要与项目实际相结合。
5)临床医学研究表明,RIPC可减轻心肌缺血再灌注损伤标志物达到保护心肌的目的,而RIPC在运动实践中应用时是否可通过提升心脏功能从而提升运动表现也值得关注,例如,RIPC作用后心脏后负荷是否会增大,前负荷是否会减小?
4 结语与展望
现有研究中,RIPC的干预方案较为统一,多采用220 mmHg的闭塞压力对靶肌群远隔部位进行3~5次5 min闭塞和5 min再灌注。RIPC一方面可通过向血液中释放腺苷、缓激肽、阿片类物质等提高代谢效率,达到增强肌肉爆发力和无氧耐力的目的;另一方面,也可通过释放NO激活GC-cGMP-PKG信号转导通路调节运动中血管收缩,促进氧合血流量增多来提升有氧能力。除此之外,RIPC可增强中枢运动驱动,使中枢神经系统对运动引起的外周肌肉疲劳阈值增加,从而促进骨骼肌抗疲劳能力增强。而要使RIPC在运动实践中发挥最佳效果,不仅要考虑到RIPC的具体实施方案,如根据不同人群的特征选择合适的闭塞压力与循环次数、干预的单双侧等;还要考虑到RIPC的作用效果可能与运动表现的主要影响因素有关,如肌肉抗疲劳能力、力量应考虑其运动强度。缺血预处理部位肌群的形状、体积、肌肉位置的深浅、肌纤维的类型、闭塞部位与靶肌群体积之比,都可能会影响RIPC的作用效果。由于现有研究未对实验控制(例如热身强度、RIPC与运动的间隔时间等)进行明确的限定,因此目前的研究结果仍存在争议。
RIPC具有广阔的应用前景,多维度、多层次研究RIPC十分必要,并应注重与其他方法的比较。首先,应深入思考缺血预处理和血流限制训练的差异。两者虽都为加压干预,但在缺血预处理中,缺血和运动是“前后”关系,而血流限制训练中缺血和运动则是“并列”关系,因此作用机制可能不同,甚至有较大差异。其次,应深入理解缺血预处理和激活后增强效应(post-activation potentiation,PAP)的内在联系。PAP和RIPC提高运动表现的出发点相同,RIPC也是一种具有增强效应的方法。RIPC是通过预缺血手段“增强”,而PAP则是通过预运动手段“增强”。PAP已在许多项目中广泛应用,而预运动和预缺血两者相结合是否会产生“1+1>2”的效果值得关注,抑或过多的“预”刺激会产生相互抵消的负面效应,也是需要考虑的问题,毕竟方法需要以最终提高运动表现为目的,而不是仅仅为了灵活而进行研究。目前RIPC与具体竞技项目结合较少,在探讨RIPC对运动员运动表现的影响时,应充分与专项相结合,考虑不同专项的需求与技术特点。除了在竞技体育领域,未来亦可关注RIPC在运动健康促进方面的作用。

