Notch信号通路介导运动对抑郁的调控机制
——基于整合生物学视角
刘文彬 ,漆正堂 ,刘微娜 *
Notch基因由Morgan(1917)发现,因其功能异常可导致果蝇翅膀的边缘出现锯齿状缺口(notches)而得名(Mohr, 1919)。Notch信号通路主要由Notch受体、Notch配体、细胞内效应分子以及下游靶点等组成(表1)。不同于目前已知的大多数经典信号通路,Notch通路的受体与配体相互作用均通过短时通讯介导,没有信号级联放大的过程(乔丽丽,2020)。Notch信号将一个细胞的命运与相邻细胞的命运联系在一起,在进化上高度保守,对细胞的增殖、分化和调亡等发挥重要作用(Schwanbeck et al.,2011)。Notch通路异常与多种人类疾病有关,包括发育综合征和一些复杂疾病,如缺血性损伤(Jin et al., 2019)、癌症(Aster et al., 2017)、双相情感障碍(Dmitrzak-Weglarz et al., 2021)、自闭症(盛飞,2021)和抑郁症(Wang et al., 2022)等。
Notch信号通路作为细胞命运的重要调控者,对脑区结构和功能的可塑性至关重要,其可能参与了应激条件下的神经可塑性受损与异常行为,如抑郁行为等。而运动作为一种非药物治疗手段,对改善抑郁的有效性已得到广泛证实,但其潜在机制尚不明确。在运动与脑健康的研究中,整合生物学是关键的理论之一。运动整合生物学认为,为应对运动挑战,多层次的整合和应答为机体建立新的动态平衡,从而提高肌肉能量和氧气供应,这种对系统稳态的扰乱及重塑不仅惠及骨骼肌本身,还给人体多个器官和系统带来了积极效应(Hawley et al., 2014)。Tsivitse等(2009)的研究发现,运动可能会调节多个器官组织中的Notch信号,且Notch的受体、配体、效应分子、下游靶点均与抑郁发病或运动调控过程有关。这使得Notch信号通路发挥健康效应,将介导运动对抑郁的调控机制成为可能。运动整合生物学的研究思路可以更直接地解释运动促进大脑健康的潜在机制(Moon et al., 2014)。基于此,本研究从整合生物学视角对Notch信号通路在运动调控抑郁中可能存在的神经生物学机制进行综述分析。
1 Notch受体在抑郁和运动干预中的作用机制
Notch受体是1个相对分子量约为300 kDa的I型跨膜蛋白,由胞外区(Notch extracellular domain,NECD)、跨膜区(transmembrane domain,TM)以及胞内区(Notch intracellular domain,NICD)3个结构域组成,具有高度保守性(Fiúza et al., 2007)。目前,哺乳动物中已发现4种同源Notch受体,分别为Notch1、Notch2、Notch3和Notch4,各亚型在生理功能上差别较小,且均在细胞分化、胚胎发育、组织自我更新等多个过程中发挥重要的调控作用(Zanotti et al., 2016)。
临床研究发现,重度抑郁症(major depressive disorder,MDD)患者外周血中的Notch1基因表达水平降低(Sun et al., 2016)。部分动物研究发现,慢性不可预见性轻度应激(chronic unpredictable mild stress,CUMS)小鼠(Guo et al., 2009)和卒中后抑郁(post-stroke depression,PSD)大鼠海马中Notch1的表达水平下调(Shang et al., 2017)。Notch1信号通路也参与了中年雌性大鼠慢性束缚应激(chronic restraint stress,CRS)后的行为变化(Shen et al.,2020)。这些改变可能源自Notch1介导的神经可塑性(李元 等,2011),也可能与Notch1信号在神经元活动的响应中被Arc/Arg3.1(即刻早期基因家族中的一员)动态调节有关(Alberi et al., 2011)。Liao等(2021)的研究发现,慢性社会挫败应激(chronic social defeat stress, CSDS)小鼠和Wistar Kyoto(WKY)大鼠内侧前额叶皮层中Notch2/NFKB信号通路的增加可能会介导抑郁的易感性,相关机制可能与Notch2在海马区参与了神经发生与凋亡的调节过程(Gruden’ et al., 2017)或发挥了对神经干细胞(neural stem cells, NSCs)静息状态的维持作用有关(Zhang et al.,2019)。另有研究证实,Notch3(Eikermann-Haerter et al.,2011)和Notch4(Skol et al., 2003)与抑郁易感性相关。
运动可通过Notch受体调控神经元活动和抗氧化过程,这也可能是运动调控抑郁的关键介导机制。Zhang等(2018)的研究发现,Notch1信号通路参与介导了自主跑轮运动增强突触可塑性和学习记忆等生理过程。在Notch1基因敲除小鼠中,YFP+Type-1 NSCs和瞬时扩增祖细胞的显著减少会导致YFP+颗粒神经元的产生减少,而30天的跑步运动可以消除这种缺陷(Ables et al., 2010)。成年海马神经发生是神经干/祖细胞产生新神经元的过程,抑郁症发病机制涉及成年海马神经发生障碍。微环境变化(如环境丰富和跑轮运动)会对成年海马的神经发生产生一定刺激,这可能与Notch3有关(Klein et al., 2017)。部分研究结果表明,Notch2通过下调Notch3的表达调控成肌细胞的分化(Ono et al., 2007),且Notch2的功能异常会引起免疫细胞的转化(Sakata-Yanagimoto et al., 2012),这都与运动可能引起的氧化应激有关。氧化应激是抑郁发病的重要诱因,而运动可提高机体的抗氧化能力,且Notch1在一定程度上通过PTEN/Akt信号通路介导抗氧化过程(Pei et al., 2013)。Scott等(2015)研究发现,急性运动与高海拔都可能使机体处于缺氧状态,与血管生成相关的基因Notch4在高原人群中表达较高;Lancaster等(2020)对受试者的抗氧化和神经发育基因常见功能进行多态性基因分型后也发现,Notch4多态性在受试者中显著升高。提示,运动后升高的Notch受体表达极有可能介导了运动的抗抑郁过程。
2 Notch配体在抑郁和运动干预中的作用机制
与受体相似,Notch配体也是细胞表面的I型跨膜蛋白,具有含N端的DSL结构域,其在进化中高度保守,为激活Notch信号所必需(Dongre et al., 2014)。目前,在哺乳动物中已发现2类同源Notch配体,包括Delta样配体(分别为 Delta-like1、Delta-like3和Delta-like4)和Serrate样配体(分别为Jagged1和Jagged2)(Kopan et al., 2009)。Notch配体在线虫中表现为Lag-2,因此Notch配体也被称为DSL(Delta/Serrate/Lag-2)蛋白。Notch受体与不同的配体发生作用后参与细胞的增殖和分化,影响突触可塑性与神经元衰老。
在哺乳动物中,活性的E3泛素连接酶Neuralized(Neur)蛋白有2个同源物,即Neur1和Neur2,它们都能与Notch配体Delta-like1(DLL1)、Delta-like4(DLL4)、Jagged1(JAG1)相互作用,在大脑胚胎发育和成年海马神经发生中发挥重要作用,因此,Notch配体可能通过影响神经发生而介导抑郁发病机制(Rullinkov et al., 2009)。Suchting等(2007)的研究表明,DLL4可作用于血管内皮生长因子(vascular endothelial growth factor,VEGF)下游,对VEGF修复的血管新生发挥负调控作用。JAG1是一种有效的促血管生成调节剂,可以拮抗DLL4介导的Notch信号在血管生成中的作用(Benedito et al., 2009),提示,抑郁发病机制也可能与Notch配体介导的血管新生有关。另外,Notch/DLL4信号通路也被证实参与机体的巨核细胞终末分化的抑制(Poirault-Chassac et al., 2010)。DLL1依赖性Notch信号传导和细胞因子可协同促进人类I型常规树突状细胞的生成,这对免疫系统启动起到关键作用(Balan et al., 2018)。更重要的是,DLL1、DLL4和JAG1在T细胞受体交联后会增强或抑制早期T细胞的活化和增殖(Rutz et al., 2005),由于抑郁也被视为一种精神免疫失调疾病,因此Notch配体介导的炎症免疫可能与抑郁的发生及发展有关。
Notch配体在机体的肌肉和骨骼系统中均发挥着重要的促更新和新生等作用,这可能与运动的抗抑郁机制有关。彭颖(2020)的研究表明,DLL1能够通过调控肌肉干细胞的稳态维持、自我更新和分化来调控肌肉干细胞库,并且在这一调控过程中,DLL1以细胞自主的方式来调控自身Notch信号和细胞功能。而骨骼系统中的血管新生和成骨耦合表明,内皮细胞和成骨细胞之间存在分子对话机制,且内皮Notch活性可促进成骨及骨中的血管新生,这与Notch信号及其配体DLL4在其他器官和肿瘤的内皮中已经确立的功能相反(Ramasamy et al., 2014)。Norum等(2016)的研究发现,血清DLL1的水平升高与心脏舒张功能障碍和运动能力降低有关。血管平滑肌细胞在运动过程中主要负责心脏的舒张与收缩功能,而JAG1通过与Notch3的相互作用可维持血管平滑肌的稳态(Mao et al., 2021)。此外,薛香莉等(2019)提出,运动可通过调控肠道微生态平衡来发挥抗抑郁效应,而DLL1和DLL4介导的Notch信号通路也是肠道干细胞稳态所必需的(Pellegrinet et al., 2011),因此Notch配体有可能具备通过调控肠道平衡介导抑郁的病理机制。
3 Notch效应分子在抑郁和运动干预中的作用机制
Notch信号的细胞内效应分子为CSL-DNA结合蛋白,Notch无DNA结合域,需要经过CSL等转录因子和MAML(mastermind-like)协同转录活化因子才能发挥转录调节作用。CSL即CBF1(C-promoter bindingprotein-1)、Su(H)(Suppressor of Hairless)、Lag-1的首字母缩写,分别为该蛋白在哺乳动物、果蝇、线虫中的不同名称。Notch受体与配体相互作用,受体的胞外区被金属蛋白酶(a disintegrin and metalloproteinase,ADAM)和γ-分泌酶(γ-secretase)切割后,释放出可溶性NICD(Majumder et al., 2021),其随后易位至细胞核并与细胞核内CSL蛋白结合,形成NICDCSL-MAML三元转录复合物,激活靶基因表达。
转录调控因子CBF1(即RBP-Jκ)通过介导经典Notch信号途径来调控神经细胞的定向和分化,并在特定发育环境中调节神经系统的形态,从而协调神经发生和形态形成2个过程(郑敏化,2009)。神经可塑性是抑郁发病的重要诱因之一,而转录因子RBP-J介导的Notch信号为海马神经发生过程中所必需,经典Notch/RBP-J信号在海马突触可塑性中发挥重要作用,且该作用的一部分由γ-氨基丁酸(Gamma-aminobutyric acid,GABA)转运蛋白调节(Liu et al., 2015)。在神经发生过程中,Notch/RBP-J信号一直被认为主要参与未分化神经前体的维持,且鉴定了Notch/RBP-J的组织特异性转录激活因子,也揭示了RBP-J在促进神经元成熟中的新作用(Tanigaki et al., 2010)。Fujimoto等(2009)的研究发现,RBP-J可促进神经元分化,抑制成年神经发生中的少突胶质细胞发育。小胶质细胞是中枢神经系统的免疫效应细胞,而Notch信号通路是小胶质细胞内与炎症相关的主要通路之一(吴海歌 等,2014)。刘娟(2016)在敲除Notch信号关键分子RBP-J之后,发现Notch信号通路可促使巨噬细胞向M2型极化,并发挥抗炎、促肿瘤的作用。Sun等(2016)还注意到 ,外周血中与Notch相关的微小核糖核酸(MicroRNA,miR)的差异表达可能也与MDD有关。通过探究miR-17~92在白介素-12(interleukin-12,IL-12)介导的免疫反应中发挥的作用,Zhang等(2021)确定了其为巨噬细胞中RBP-J的功能靶点。因此,Notch效应分子介导抑郁发病也可能与表观遗传机制有关。
目前,虽然鲜见Notch效应分子CSL-DNA结合蛋白在运动与疾病干预方面的研究,且RBP-J在运动调控抑郁机制中的作用未明,但RBP-J在中枢神经、机体代谢和运动系统之间的联系依然有迹可循。吕竺蔓(2017)在星形胶质细胞中特异性敲除RBP-J,发现能够促进小鼠脑缺血损伤后的神经再生,而小鼠脑缺血损伤后的第3~5天正是细胞增殖以及运动功能障碍的高峰期。此外,类固醇激素对于海马神经发生以及应激调节的影响已被广泛证实,且睾酮和雌激素水平在抑郁和运动对机体作用的过程中扮演着重要角色(Gheorghe et al., 2019)。运动训练可提高睾酮和雌激素水平,同时延缓破骨细胞活性,促进骨骼生长和骨密度升高(Robinson et al., 1996)。在破骨细胞的分化及成熟过程中,RBP-J作为负性调控因子抑制破骨细胞的分化及成熟,对于破骨细胞功能异常引发的疾病研究具有重要的临床意义(马静,2012)。另外,RBPJ/miR182介导的调控网络在肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的破骨细胞发生和炎性骨吸收中也发挥着重要作用(Inoue et al., 2020)。综上所述,RBP-J与神经发生、神经内分泌、炎症反应、破骨细胞发育均有所关联,后续可开展研究以明晰其与运动调控抑郁的关系及具体作用机制。
4 Notch下游靶点在抑郁和运动干预中的作用机制
在哺乳动物中,经典Notch信号通路靶基因主要有Hes(hairy/enhancer of split)和Hey(hairy/enhancer-of-split related with YRPW motif family members)两大家族,包括Hes1、Hes5和Hes7以及Hey1、Hey2等基因。非经典Notch信号通路不依赖RBP-J转录复合物,而是与PI3K、AKT、mTOR以及转录核因子(nuclear factor κB,NF-κB)等发生相互作用,进而调控细胞分化、代谢和凋亡等生命活动(Jiang et al., 2017)。
一方面,兴奋性神经元的Hes1失活可导致杏仁核异常的恐惧和焦虑行为,并伴有更高的神经元兴奋性,而抑制性神经元的Hes1失活可导致社交性和持续性倾向的增加(Matsuzaki et al., 2019)。Guo等(2009)的研究表明,Notch1下游靶点Hes1和Hes5可能参与了CUMS对缺血大鼠海马神经发生的调节。Notch/Hes-1信号通路的激活可能参与了前扣带回兴奋性突触传递的增强,这可能导致周围神经损伤后的持续性疼痛(Duan et al., 2021)。慢性疼痛是导致抑郁的重要诱因之一,患有慢性神经性疼痛的患者合并抑郁症的风险较高。Liu等(2016)发现白藜芦醇对二者共病具有较好的疗效,其可改善脂多糖诱导的NF-κB在海马内的激活,通过增强海马神经新生来抵消脂多糖诱导的抑郁样行为,同时上调Sirt1和Hes1水平。研究也发现,电针治疗通过抑制慢性轻度应激(chronic mild stress,CMS)小鼠海马NF-κB炎症通路来缓解抑郁行为(Wang et al., 2022)。中药丹栀逍遥散(Liu et al.,2021)和西药阿戈美拉汀(Fathi et al., 2021)对焦虑改善具有积极影响,治疗后二者将增加海马神经干细胞的增殖分化,促进神经元再生,同时伴随Hes1等靶基因的表达水平改变。此外,非经典Notch配体DLK2(Delta-like 2)的缺失增加了小鼠的焦虑和抑郁行为,并影响了室旁核、海马区以及杏仁核中Hes1、Hes5和Hey1的基因表达(Navarrete et al., 2017)。上述研究提示,Notch的下游靶点通过神经发生和炎症免疫影响抑郁行为。
另一方面,力竭运动与钝挫伤均可以引起大鼠骨骼肌和血清中的Hes1含量升高,这证实了Notch信号通路可能在骨骼肌卫星细胞激活及损伤修复中发挥正向调节作用(李娜,2016)。Khayrullin等(2016)的研究发现,在具有慢性酒精中毒性肌病的动物模型中,Hey1和Notch1的相关性显著升高,Notch信号的上调会抑制肌生成并维持肌肉卫星细胞的静止。此外,Notch下游靶点与运动中发生的能量代谢息息相关,这也可能是其发挥抗抑郁作用的重要中介变量。Mendes-da-Silva等(2015)和Curi等(2021)的研究表明,高脂膳食(high-fat diet,HFD)大鼠的后代表现出快感缺失行为,这可能与Notch1及其下游靶点Hes1、Hes5的蛋白表达增加有关;HFD可诱导与肥胖相关的抑郁发生,并显著上调海马NF-κB的表达(Huang et al., 2021)。而Scroyen等(2015)发现,Notch信号靶基因Hey1也具有抑制脂肪生成的作用。刘微娜等(2015)提出,能量代谢的重要调节因子瘦素,可能参与了抑郁症的运动干预机制,且其可能主要通过增加Hes1的mRNA表达以及对神经祖细胞的维持来促进大脑发育(Udagawa et al., 2006)。综上所述,Notch下游靶点活跃在神经祖细胞和骨骼肌祖细胞的生长发育及分化进程中,使得Hes1、Hes5及NF-κB在运动调控抑郁过程中发挥积极作用。
5 Notch信号通路在抑郁和运动干预中的作用机制
Notch信号通路介导2个细胞相互靠近接触之后的活化效应(图1),Notch通路并非通过激酶磷酸化逐步活化传递信号,而是由Notch通过蛋白酶切水解,逐步释放有转录调节活性的Notch蛋白片段NICD来实现活化,该转导方式无法放大信号,其全通路蛋白不存在任何加工修饰,因此信号传递非常迅速且精准(Nowell et al., 2017)。
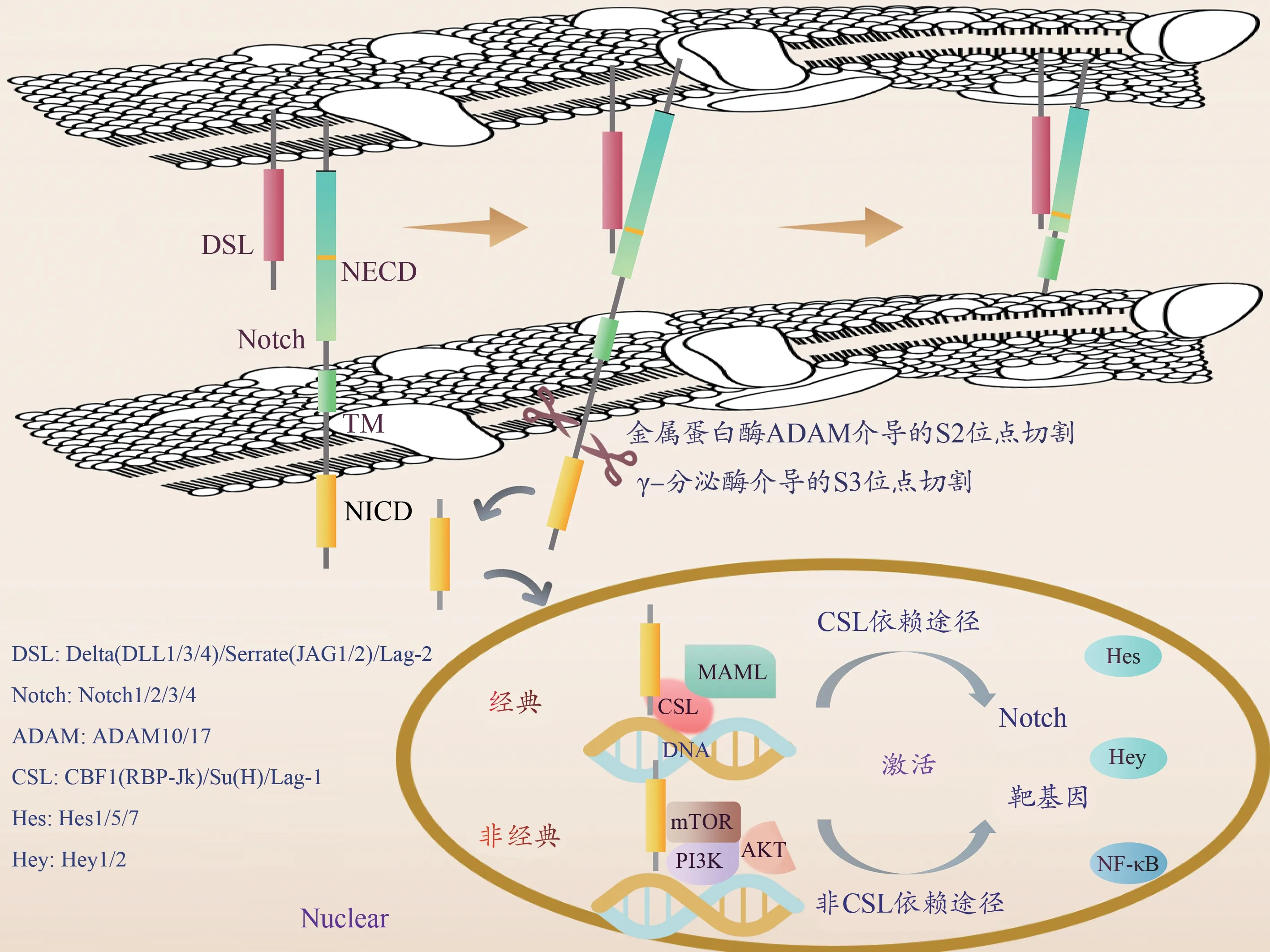
图1 Notch信号级联反应Figure 1. Cascade Reaction of the Notch Signaling
在全基因组关联研究中筛选出与MDD、双向情感障碍、精神分裂症相关的差异表达基因富集通路,发现其中包括Notch信号通路(Wang et al., 2022)。雷蕾等(2015)的临床研究显示,抑郁症患者外周血中可能存在Notch信号通路相关因子表达的调控异常。另有尸检结果证实,大脑特定区域Notch通路的异常表达可能是MDD患者自杀的潜在原因(Monsalve et al., 2014)。Tian等(2018)的动物研究表明,Notch信号通路可以动态调控神经发生,这可能是PSD的一种发病机制。CMS可以诱发缺血大鼠的抑郁行为,并伴有细胞凋亡标志物Bax/Bcl-2的比值升高、神经突触受损和齿状回突触素的表达减少,而阻断γ-分泌酶介导的Notch信号通路可通过逆转这些改变来发挥对PSD的治疗作用(Wang et al., 2012)。Luo等(2019)认为,血管生成是一个复杂的细胞过程,Notch信号通路在血管新生过程中参与调节内皮细胞的特殊功能和不同命运。如VEGF是与抑郁发病密切相关的神经营养因子之一,Notch信号可以通过其受体直接或间接调控血管生成。Shang等(2016)还提出,在Notch信号与炎症之间存在一种新的相互调节模式,即炎症刺激能够激活Notch信号,并且细胞中的Notch信号也会反过来调节炎症反应。在抑郁与炎症之间也存在类似的影响模式,即抑郁会加强炎症反应,炎症反应也会诱发抑郁。Orent等(2016)的研究表明,当经典Notch通路被激活后,Notch信号通路可诱导炎症细胞因子IL-9、IL-17A和γ-干扰素(interferon-γ,IFN-γ)等的表达。Notch信号通路还能够控制人类CD8(+)T细胞启动并影响效应T细胞的功能(Kuijk et al., 2013)。目前,与Notch相关的研究主要集中在癌症研究领域,表明Notch信号通路也极有可能涉及抑郁和癌症的共病机制。
Notch通路是肌卫星细胞激活的重要信号传导路径,通过受体与配体的相互作用传递信号,从而调控肌细胞增殖分化或细胞凋亡。邓桂勇等(2020)发现,运动可激活肌卫星细胞的Notch信号通路。Carey等(2007)在其细胞实验中发现,在培养人骨骼肌细胞的分化过程中,Notch3、JAG1、Hes1基因转录本表达增加。该研究还发现,在规律的抗阻训练中,Notch1的表达增加,DLL1的表达降低,且在运动训练后,不同年龄组之间的Notch表达差异不再明显。陆乐等(2015)的研究表明,8周自主跑轮运动促进了小鼠海马神经干细胞增殖,可能同样和Notch信号通路的激活有关。Brandt等(2010)发现,体育锻炼增加了成年海马神经发生过程中3型前体细胞的Notch活性、细胞增殖和细胞周期的退出。Kim等(2020)还发现,运动时被激活的低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)可以通过Notch信号通路调节参与神经干细胞的存活和分化。另外,有氧运动也可通过Notch信号通路有效缓解慢性脑缺血引起的神经元损伤,促进突触再生(Mao et al., 2017)。而大脑毛细血管在生理上能够经历血管生成的刺激,如运动和5-羟色胺再摄取抑制剂(serotonin selective reuptake inhibitors,SSRIs),因此血管生成可能在抑郁症的康复中发挥重要作用。此外,Notch信号通路可对免疫细胞的发育进行调控,高强度间歇训练通过靶向NF-κB和Notch信号通路逆转HFD诱导的巨噬细胞极化(Shanaki et al., 2020),该反应在运动免疫过程中较为活跃。综上所述,运动在激活Notch信号通路后,可通过调控神经发生、血管新生、中枢炎症来发挥改善抑郁等积极的健康效应。
Notch信号通路还可通过调节能量平衡来改善与抑郁相关的能量代谢紊乱。Notch受体类似“代谢传感器”,表现出对微环境变化(包括葡萄糖和脂质代谢物)极强的反应能力,直接影响相关基因的表达,从而在代谢和转录的变化之间建立起重要联系。Veys等(2020)发现,葡萄糖转运蛋白GLUT1在静息期以Notch信号依赖的方式与糖酵解解离,其对中枢神经系统发育性血管生成和成人中枢神经系统稳态至关重要。Notch信号对糖代谢的抑制作用有助于抑制骨髓间充质祖细胞中成骨细胞的形成,具体机制为Notch通过下调糖酵解和线粒体复合物I相关基因的表达水平,减弱线粒体呼吸,减少超氧化物产生,并降低腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)活性(Lee et al.,2018)。此外,陈祥和等(2021)的研究表明,下坡跑运动可通过激活Notch信号通路改善II型糖尿病(T2DM)小鼠的骨形成代谢紊乱。因此,Notch信号通路被认为是肌骨代谢中的关键角色,而肌肉因子中的脂联素(adiponectin,ADP)和鸢尾素(irisin)也可通过Notch信号发挥中枢保护效应。You等(2021)的研究发现,体育锻炼可以通过激活Adiponectin-Notch通路(尤其是ADAM10和Notch1 2个关键分子)改善慢性应激导致的海马神经发生和认知功能障碍,而敲除ADP基因或抑制Notch信号通路则会阻断跑步运动的治疗效果。运动诱发的irisin可以调节Notch信号通路,上调Notch1、NICD和Hes1的表达,下调IL-1β和TNF-α的表达,并抑制海马神经元凋亡,从而缓解全脑形态学损伤,改善大脑神经功能(Jin et al.,2019)。基于整合生物学的视角,这表明运动可调控Notch信号通路,先调节骨骼肌中的生长发育和能量代谢,再通过肌脑对话和骨脑对话重塑大脑能量平衡,发挥中枢保护效应并维持中枢系统稳态,最终参与神经退行性疾病的相关机制。
6 小结与展望
本研究通过综述相关文献,总结Notch信号通路介导运动对抑郁调控可能存在的作用机制(图2)。运动干预激活Notch信号通路(包括Notch受体、配体、效应分子、下游靶点等)后,通过外周-中枢对话机制,整合Notch信号通路对心脏的舒张和收缩、肠道的干细胞稳态、肌肉中的肌代谢、肌肉因子激活、成肌细胞分化、肌肉干细胞、骨骼肌祖细胞和肌肉卫星细胞的稳态、骨骼中的骨代谢、成骨血管新生、成骨细胞形成、破骨细胞活性和炎性骨吸收等产生的影响,进而调控神经祖/干细胞的增殖存活分化、神经发生与凋亡、神经营养与保护、神经可塑性、神经内分泌、血管新生、炎症免疫、肠道平衡、表观遗传、氧化应激和能量代谢以及其他信号转导等过程,最终完成外周改变后对中枢神经系统的信息递送,实现机体内环境稳态的调整乃至重塑。在运动整合生物学的研究视角下,多个运动敏感分子(如irisin、ADP、瘦素、IL-6、TNF-α、乳酸、色氨酸等)已被发现是大脑健康效应的介导者(夏杰 等,2017)。基于文献综述,Notch信号通路也可能是该介导体系中的重要成员,主要通过参与“肌-脑”“骨-脑”“肠-脑”和“心-脑”对话发挥作用,因此可以进一步推测Notch信号通路是运动调控抑郁机制中的关键介导通路之一。然而,目前鲜见相关研究且针对性不足,亟待开展相关实验及研究。
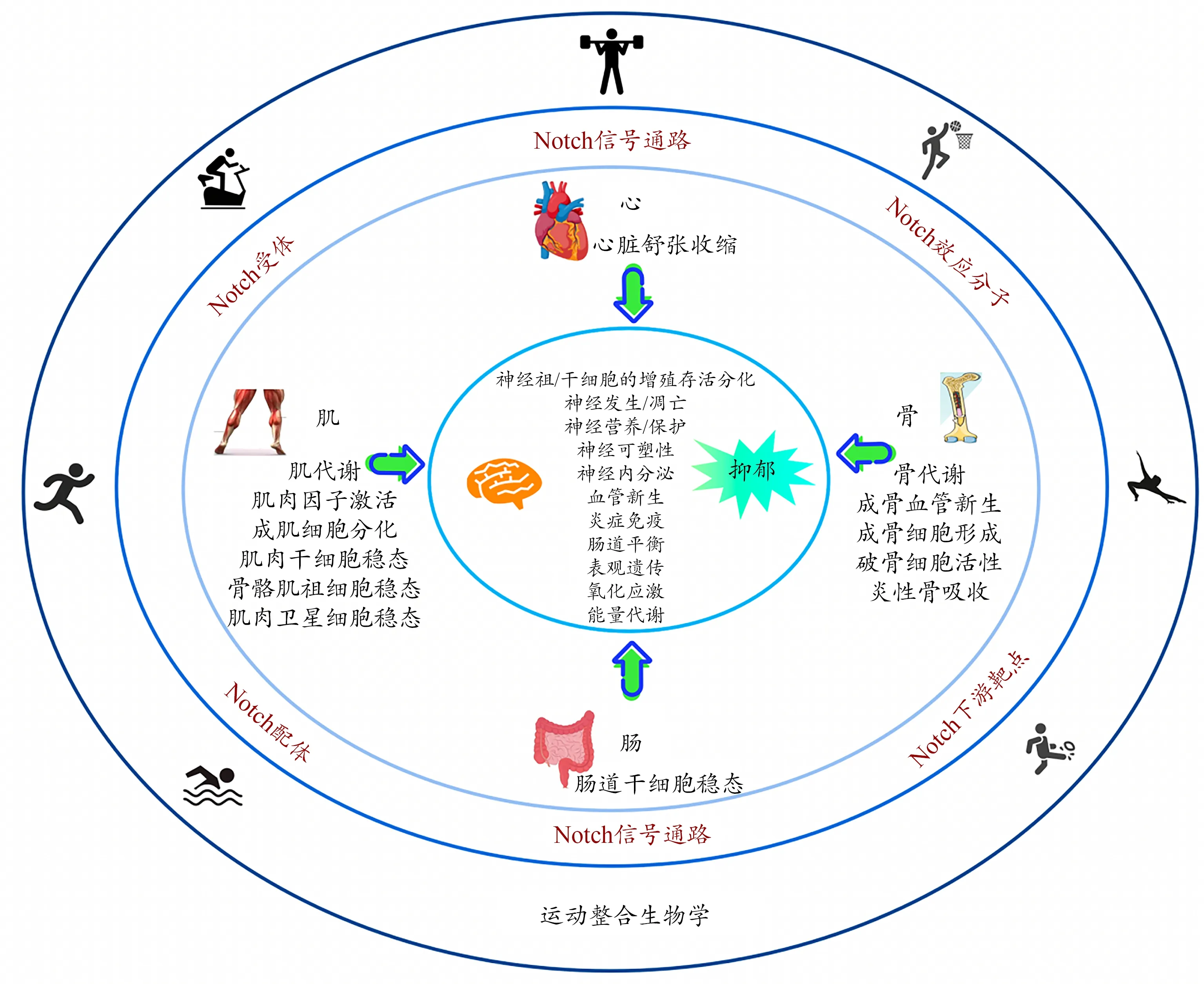
图2 Notch信号通路介导运动对抑郁的调控机制Figure 2. Regulation Mechanism of Exercise on Depression Mediated by the Notch Signaling Pathway
近年来,Notch信号通路的相关研究多集中于恶性癌症的生物学机制,且正在开发多种不同靶点的Notch通路抑制剂(靶向Notch配体的单克隆抗体以及靶向Notch受体的抗体)作为治疗药物。运动对癌症和抑郁的治疗在生物学基础上具有交叉性,因此,探究Notch信号通路在治疗抑郁症等神经系统疾病中所扮演的角色,对恶性癌症的治疗同样具有重要的临床意义。
基于目前的研究进展,以下问题仍需被进一步明晰和证实:1)Notch的受体、配体、效应分子及下游靶点等在抑郁发病及运动调控抑郁机制中的分工和协同调控的具体机制,以及其中发挥关键作用的分子类型;2)在运动调控抑郁的过程中,Notch信号作为重要的介导通路,其主要介导过程可能发生在肌肉、骨骼、心脏和肠道。除其分别与大脑的对话机制外,是否存在器官组织间的相互对话机制以及其具体的对话方式;3)运动对Notch信号通路的影响是否存在“运动处方特异性”,即不同的运动方式、强度、时间等是否对Notch的受体、配体、效应分子及下游靶点有不同的改变,并对抑郁产生不同影响;4)Notch信号通路已被报道可能参与多种疾病的发生发展机制,其是否与抑郁的共病现象及运动对其他疾病的干预机制有关。以上问题可促进运动对抑郁的干预及抑郁共病调控机制的研究成果转化。

