两株GI.1型和GI.2型兔出血症病毒RdRp基因的克隆与分析
庞雪晴,唐 诗,曾红梅,赵 位,王 印,罗 燕,姚学萍,任梅渗,任永军,杨泽晓,*
(1.四川农业大学 动物医学院,四川 成都 611130; 2.四川省畜牧科学研究院,四川 成都 610066)
兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)是引起兔出血症(rabbit hemorrhagic disease,RHD)的主要病原,属于杯状病毒科兔病毒属的未折叠单股正链RNA病毒[1],35 nm的病毒粒子包含7.4 kb的基因组RNA和额外的2.1 kb的亚基因组RNA片段,基因组和亚基因组RNA均在3′端进行多聚腺苷化,并在5′端与基因组结合蛋白(genome-linked protein)共价连接[2]。基因组RNA包含两个狭窄重叠的开放阅读框(ORF),即 ORF1(10~7 044 bp)和ORF2(7 025~7 378 bp)。其中 ORF1翻译为一个大的多聚蛋白,该蛋白被切割成几个非结构蛋白(螺旋酶、VPg和RdRp等)和主要结构蛋白——衣壳蛋白VP60,ORF2编码一种次要结构蛋白VP10[3-4]。
1984年我国首次报道RHD,由于RHD具有高度传染性,在疾病暴发的一年时间里迅速在亚洲、欧洲和非洲蔓延[5]。1998年在意大利检测到RHDV的第一株抗原变异[6],被命名为RHDVa,随着变异毒株的不断发现,RHDV最初根据其在系统发育树的位置和抗原特性,分为G1、G2、G3、G4、G5和G6/RHDVa等几种不同亚型[7]。直到2010年,法国一家已免疫了RHD疫苗的兔场暴发了非典型RHD,即RHDV2,分离得到的新毒株基因序列及抗原性与经典株有较大差异,两者之间交叉免疫较弱[8],该病毒在西班牙、英国(苏格兰)、意大利、澳大利亚等国家广泛传播。随后,Le Pendu等[9]基于系统发育和遗传距离提出了新的命名法,即将经典RHDV和RHDV2分别归类于LagovirusEuropaeus, GI.1、GI.2。
研究表明,RNA依赖性RNA聚合酶(RdRp)参与RHDV RNA的复制[2]。RdRp已被证明能催化VPg尿苷化,从而使得VPg作为蛋白质引物启动基因组RNA和亚基因组RNA的复制,而RHDV RdRp前体比成熟酶更有效地催化VPg尿苷化[10]。RdRp的形状类似右手,分为手指结构域,手掌结构域和拇指结构域,酶的活性位点位于手掌结构域中,其结构是高度保守的。到目前为止,已经鉴定出7个高度保守的氨基酸序列基序:4个在手掌域的基序(基序A、B、C和D),1个在拇指域的基序(基序E),2个在手指域的基序(基序F和G)[11]。这些短功能基序具有高度保守的氨基酸序列,基序B、D、E和F参与核苷酸识别和配位,基序B和G协调模板和引物结合,基序A和C执行核苷酸结合的催化作用[12]。RHDV RdRp不只发挥复制酶的作用,还具有能与细胞内膜相互作用从而改变高尔基体结构的能力[13],因此RdRp可能在复制复合物的建立过程中发挥关键作用。RHDV主要由RdRp复制自身遗传物质,这种酶没有修复复制过程中产生的错配的能力[14],对病毒适应环境甚至适应新宿主的能力和病毒演变方面有着重要影响。
VP60作为RHDV的主要结构蛋白和抗原蛋白,其核苷酸序列一直被用于新毒株的系统发育、免疫和诊断研究[15-16]。相对于VP60,RdRp在RHDV的生物合成与遗传变异研究方面更具有参考意义,然而国内外关于RdRp在此方面的研究相对较少。为了解RHDV RdRp基因的遗传稳定性及其在RHDV演变中的变异情况。本研究克隆了RHDV SCH04株和RHDV2 SCCN03株RdRp基因,并对其进行序列对比分析和编码蛋白质的理化性质、信号肽、跨膜区域、二级结构、磷酸化和糖基化修饰位点的预测等生物信息学分析,为RHDV病原学研究以及感染的防治提供参考。
1 材料与方法
1.1 材料
pMD19-T克隆载体、DH5α感受态细胞、2×TaqMaster Mix、DNA Marker等购自宝生物工程(大连)有限公司。RNA提取试剂盒等购自天根生化科技(北京)有限公司。兔出血症病毒分离株SCH04与SCCN03由四川农业大学动物检疫实验室保存。
1.2 引物的设计与合成
参照GenBank中RHDV和RHDV2基因序列(登录号:KY171748和MN901451)分别设计RdRp扩增引物。P1:5′-ACATCAAACTTCTTCTGTGGCG-3′;P2:5′-CTCCATAACATTCACAAATTCGTCGT-3′;P3:5′-ACATCAAACTTTTTCTGTGGTGAACC-3′;P4:5′-CTCCATAACATTCACAAACTCGTCG-3′。
1.3 总RNA的提取与反转录
将病料组织在研钵中充分研磨并加入生理盐水制成组织悬液,参考RNA提取试剂盒说明书提取组织总RNA,置于-70 ℃超低温冰箱保存。测定总RNA浓度,取500 ng总RNA,加入5×反转录试剂Mix 2 μL,随后加入RNase free water至10 μL。将混合物混匀瞬时离心后,37 ℃ 15 min,85 ℃ 5 s,4 ℃循环,获得cDNA,-20 ℃保存备用。
1.4 RdRp基因的扩增
以获得的cDNA作为模板,使用高保真酶(Pfu),用设计的特异性引物扩增RdRp基因片段。PCR体系为:2×PfuPCR Mix 25 μL,cDNA 4 μL,上下游引物各2 μL,加ddH2O至50 μL。扩增产物按照琼脂糖凝胶DNA回收试剂盒说明进行回收,随后按照pMD19-T克隆载体试剂盒使用说明将目的片段与pMD19-T载体连接并转化至DH5α感受态细胞中,培养并经过抗性筛选后,挑取阳性克隆菌落进行测序。
1.5 RdRp的生物信息学分析
利用DNAstar和DNAMAN软件对SCH04株和SCCN03株RdRp基因进行序列比对分析;利用MEGA 7.0软件基于RdRp基因核苷酸序列对于下载的RHDV各毒株进行遗传距离分析和系统进化树的构建;利用ExPASy在线软件(https://web.expasy.org/protparam/)分析编码蛋白质的理化性质;利用TMHMM-2.0在线软件(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测编码蛋白质的跨膜区域;利用SignalP-5.0在线软件(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)分析编码蛋白的信号肽;分别利用NetPhos-3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)和NetNGlyc-1.0(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)在线软件对编码蛋白的磷酸化位点和糖基化位点进行预测分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线软件预测编码蛋白质的二级结构;利用SWISS-MODEL(https://swissmodel.expasy.org/)在线软件预测编码蛋白质的三级结构。
2 结果与分析
2.1 RdRp基因的克隆结果
以从病料中提取的总RNA反转录所得的cDNA为模板进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测,所得产物大小为1 548 bp(图1),与预期片段大小相符。测序结果与GenBank已公布的对应序列一致性分别为99.94%和99.48%,并上传GenBank获得序列号分别为KX844830,MW178245。
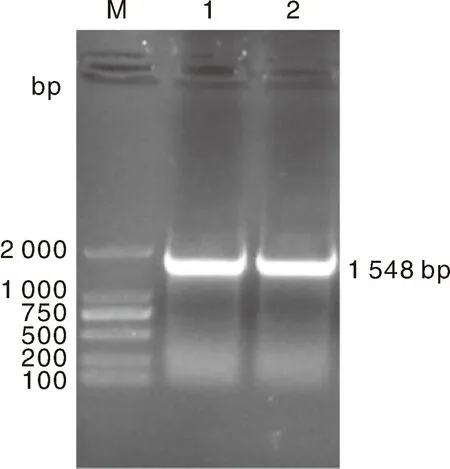
M,DNA分子量标准;1,SCH04株 RdRp基因扩增产物;2,SCCN03株 RdRp基因扩增产物。M, DNA marker; 1: Amplification product of RdRp gene of SCH04 strain; 2, Amplification product of RdRp gene of SCCN03 strain.图1 RdRp基因的RT-PCR扩增Fig.1 RT-PCR amplification of RdRp gene
2.2 基于RdRp基因构建系统发育树
从NCBI下载45株GI.1型和14株GI.2型RHDVRdRp基因序列,并选择2株兔杯状病毒(RCV)的RdRp基因序列作为对照序列(表1)。使用MEGA7.0软件进行比对分析,计算遗传距离,构建基于RdRp基因核苷酸序列的NJ树(图2)。
表1 RHDV、RCV各毒株的序列信息
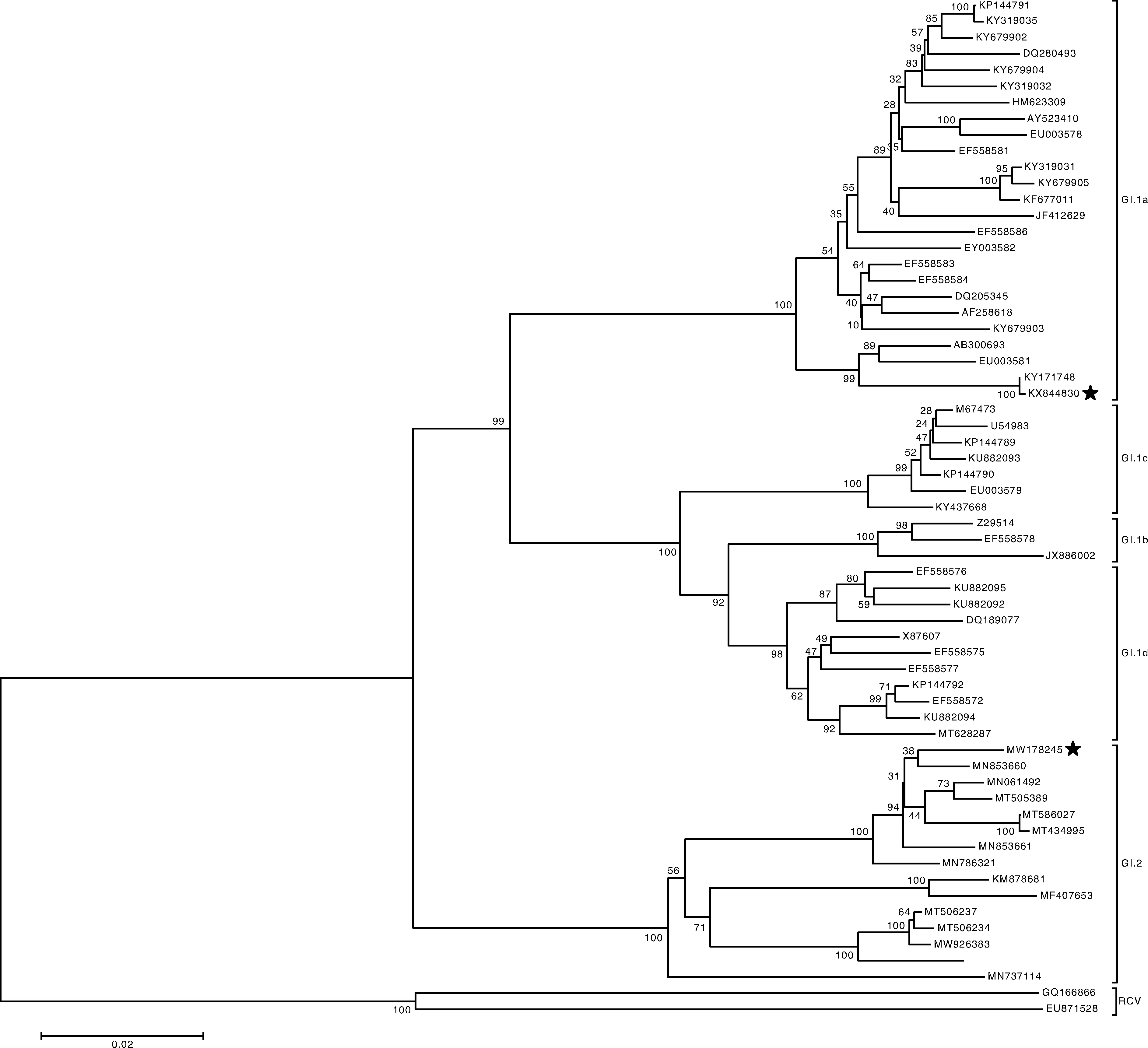
图中星号标注的分别为SCH04株与SCCN03株的序列号。The asterisks in the figure indicate the sequence numbers of SCH04 and SCCN03 strains.图2 基于RdRp基因核苷酸序列构建的系统进化树Fig.2 Phylogenetic tree based on RdRp gene nucleotide sequence
结果显示,基于RdRp基因序列,GI.1a型RHDV各毒株间变异性为0.1%~5.7%;GI.1b型RHDV各毒株间变异性为1.6%~3.4%;GI.1c型RHDV各毒株间变异性为0.5%~2.2%;GI.1d型RHDV各毒株间变异性为0.5%~4.7%,GI.1所有亚型RHDV毒株间序列相似性为86.9%~99.9%,变异范围为0.1%~13.1%。GI.2型RHDV毒株间序列相似性为91.3%~99.9%,变异范围为0.1%~8.7%;GI.1型和GI.2型RHDV毒株间序列相似性为84.3%~88.3%,变异范围为11.7%~15.7%。
从系统进化树可以看出,SCH04株属于GI.1中的GI.1a亚型,在该亚型中与其RdRp基因遗传距离最近的是2007年分离的Sch07株(0.1%),遗传距离最远的是2005年分离的WHNRH株(5.9%),SCCN03株属于GI.2型,与其RdRp基因遗传距离最近的是2016年分离的RHDV2-NL2016株(1.5%),遗传距离最远的是2016年分离的16PLM1株(8.1%)。与1987年分离的参考毒株V-351的RdRp基因序列相比,SCH04株的核苷酸变异率为12.0%,SCCN03株的核苷酸变异率为13.4%。
2.3 RdRp基因序列分析
对SCH04株和SCCN03株的RdRp的核苷酸序列和氨基酸序列用DNAMAN进行比较分析显示,SCH04株RdRp基因编码区长1 548 bp,其中A、G、C、T含量分别为25%、26.74%、24.03%、24.22%,A+T含量(49.22%)略小于G+C含量(50.78%);SCCN03株RdRp基因编码区长1548 bp,其中A、G、C、T含量分别为24.74%、27.67%、24.74%、23.45%,A+T含量(48.19%)略小于G+C含量(51.81%)。两株RdRp的核苷酸序列相似性为84.95%。推导的氨基酸序列相似性为96.71%,分别在第45、71、109、366、373、385、390、395、397、430、442、447、469、472、476、480和485位氨基酸存在差异(图3)。

图3 RdRp氨基酸序列比对结果Fig.3 RdRp amino acid sequence alignment results
2.4 RHDV RdRp蛋白理化性质分析
使用ProtParam在线软件分析显示,SCH04株和SCCN03株RdRp基因序列均编码516个氨基酸,由20种氨基酸组成,其中占比最大的是亮氨酸(Leu),为9.5%;占比最小的是色氨酸(Trp),为1.4%。SCH04株分子量略小于SCCN03株,蛋白质等电点、脂溶系数、平均亲水系数和不稳定系数均略高于SCCN03株(表2)。
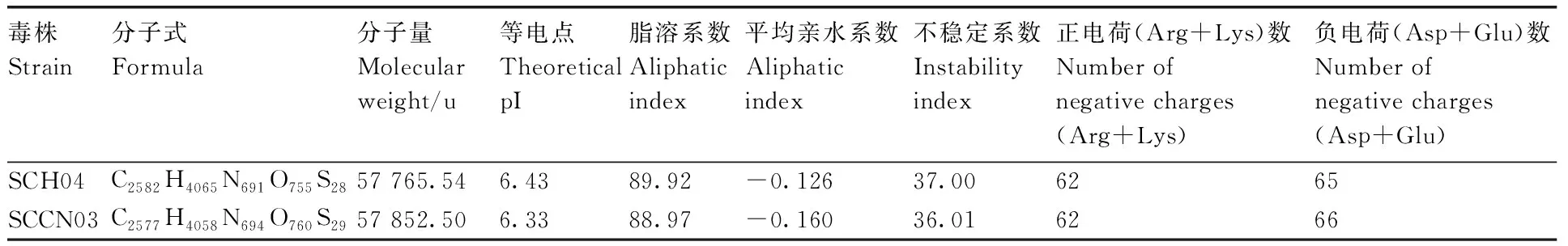
表2 RdRp蛋白质理化性质分析
2.5 RHDV RdRp蛋白信号肽和跨膜区域分析
经SignalP-5.0和TMHMM2.0在线软件预测结果显示,SCH04株和SCCN03株RdRp蛋白均不存在信号肽和跨膜结构。
2.6 RHDV RdRp蛋白二级结构分析
经SOPMA数据库分析,SCH04株二级结构包含216个α螺旋(占比41.86%),57个延伸链(占比11.05%),22个β转角(占比4.26%)和221个无规则卷曲(占比42.83%)。 SCCN03株二级结构则包含208个α螺旋(占比40.31%),66个延伸链(占比12.79%),18个β转角(占比3.49%)和224个无规则卷曲(占比43.41%)(图4)。相比SCH04株RdRp,SCCN03株RdRp的延伸链和无规则卷曲比例增加,而α螺旋和β转角的比例则有所降低。
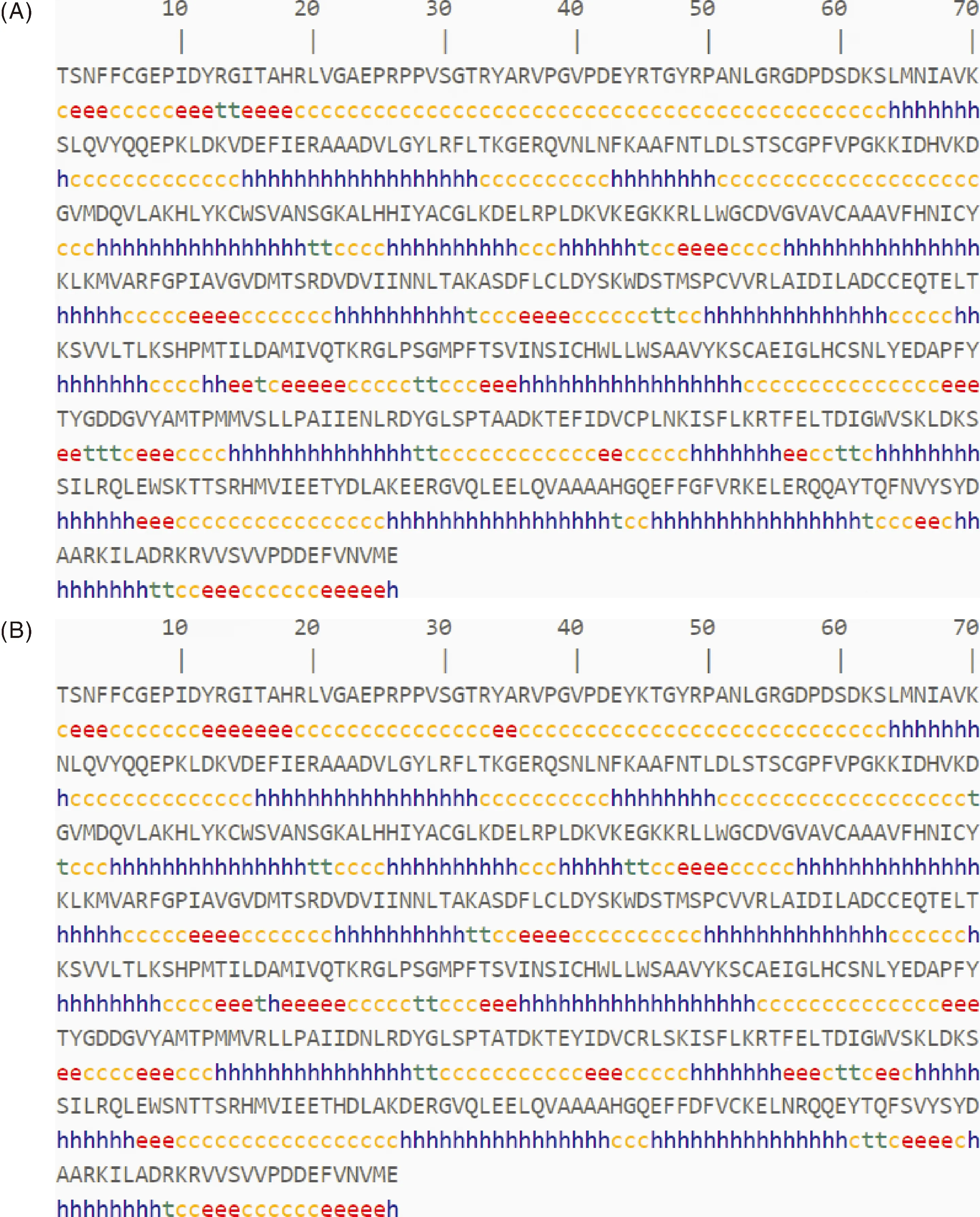
c,无规卷曲区域; h,α螺旋区域; e,延伸链区域; t,β转角区域。c,Random coil; h,α helix; e,Extended chain; t,β turn.图4 SCH04株RdRp(A)和SCCN03株RdRp(B)二级结构预测Fig.4 Secondary structure prediction of RdRp of strain SCH04 (A) and RdRp of strain SCCN03 (B)
2.7 RHDV RdRp蛋白磷酸化位点和糖基化位点分析
经NetPhos-3.1在线软件分析显示,SCH04株含有22个丝氨酸(Ser) 磷酸化位点,11个苏氨酸(Thr)磷酸化位点和9个酪氨酸(Tyr)磷酸化位点。SCCN03株含有23个丝氨酸(Ser) 磷酸化位点,13个苏氨酸(Thr)磷酸化位点和9个酪氨酸(Tyr)磷酸化位点(图5)。总体SCCN03株的RdRp蛋白比SCH04株多4个磷酸化修饰位点。
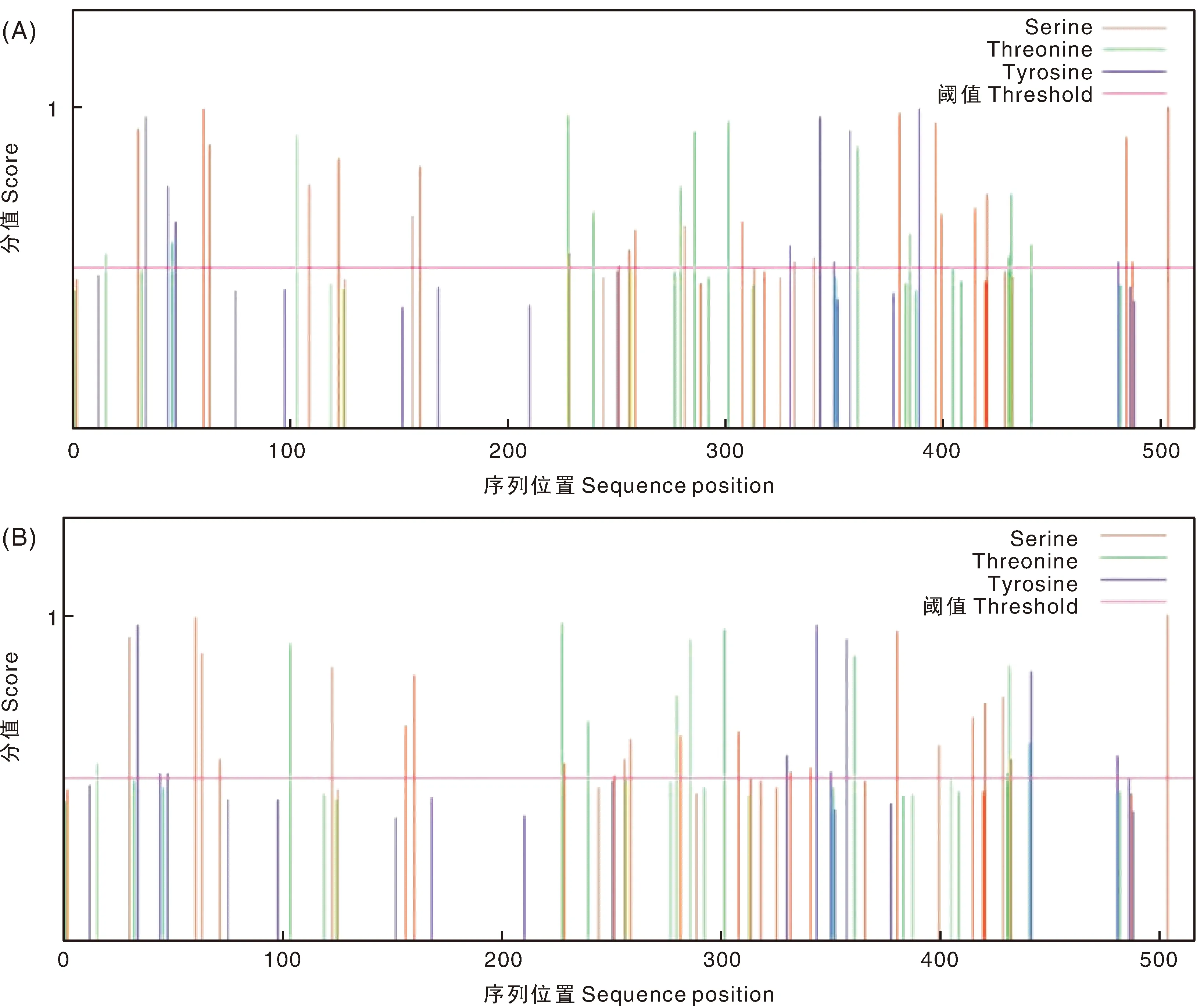
图5 SCH04株RdRp(A)和SCCN03株RdRp(B)磷酸化修饰位点预测Fig.5 Prediction of phosphorylation modification sites of RdRp of SCH04 strain (A) and RdRp of SCCN03 strain (B)
经NetNGlyc-1.0在线软件分析显示,SCH04株含有1个潜在的N-糖基化修饰位点(第238位氨基酸),SCCN03株含有2个潜在的N-糖基化修饰位点(第238位和第420位氨基酸)(图6)。总体SCCN03株的RdRp蛋白比SCH04株多1个N-糖基化修饰位点。
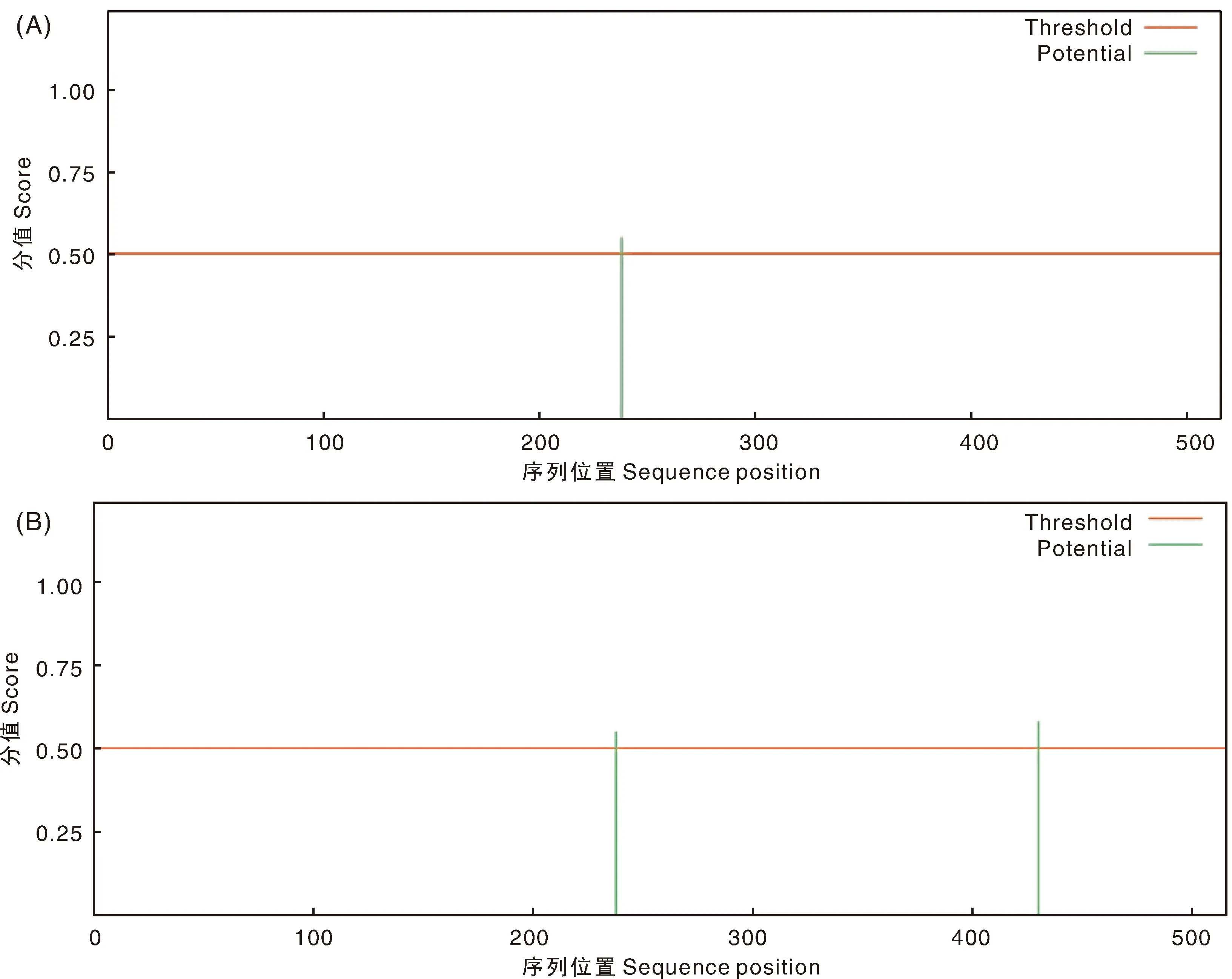
图6 SCH04株RdRp(A)和SCCN03株RdRp(B)糖基化修饰位点预测Fig.6 Prediction of glycosylation modification sites of RdRp of SCH04 strain (A) and RdRp of SCCN03 strain (B)
2.8 RHDV RdRp蛋白三级结构预测
使用SWISS-MODEL在线软件对SCH04株和SCCN03株RdRp进行同源建模,结果显示,SCH04株RdRp与SCCN03株RdRp模型GMQE值均为0.96、QMEANDisCo Global分值分别为0.92±0.05和0.91±0.05,模型置信度高(图7)。两种RdRp的结构相似性极高,无明显结构差异。
图7 SCH04株RdRp(A)和SCCN03株RdRp(B)三级结构预测Fig.7 Tertiary structure prediction of RdRp of SCH04 strain(A)and RdRp of SCCN03 strain (B)
3 讨论
RdRp作为RHDV的复制酶,在基因组复制过程中不能对突变的碱基进行校正,还有研究表明,RHDV RdRp还具有诱导高尔基体结构发生重排的独特能力,因此RdRp不仅是RHDV合成的关键酶,还可能与RHDV的毒力也有一定关系。2020年,Hukowska-Szematowicz[17]基于RHDV RdRp的基因序列对105株GI.1型和GI.2型毒株进行了系统发育分析,结果发现,这些毒株遗传距离在时间尺度和地理尺度上均有所增加,GI.2基因型毒株的RdRp基因具有比GI.1型毒株更高的突变潜力。本研究克隆了两株GI.1型和GI.2型RHDVRdRp序列,并将其与另外59株GI.1型和GI.2型毒株RdRp基因序列进行系统发育分析,结果显示:本研究中GI.1 RHDV各亚型毒株和GI.2型RHDV各毒株之间变异范围均处于Hukowska-Szematowicz[17]研究所得的变异范围内。SCH04株RdRp和SCCN03株RdRp的核苷酸变异性位于GI.1与GI.2的变异范围内,符合遗传变异规律。GI.2各毒株RdRp之间同源性高于GI.1,而与原始毒株相比,GI.2各毒株则比GI.1具有更高的变异性,与Hukowska-Szematowicz等[17]的研究结果相一致。随着时间的推移,GI.2型RHDV是否会产生更多变异株应引起更多的关注。
据报道,重组诺如病毒GII.P16-GII.2毒株比之前的GII.P16-GII.2毒株的差别在于5个位于RdRp的氨基酸发生突变,从而导致了重组毒株在粪便中的载量更高,传播速率也显著增加[18-19],这表明RdRp中氨基酸的突变可能影响酶的活性或者复制时的保真度。目前,相关研究已鉴定了杯状病毒的RdRp具有7个高度保守的氨基酸序列基序——基序A(250~259)、基序B(308~318)、基序C(353~355)、基序D(373~376)、基序E(400~404)、基序F(173~191)和基序G(123~134),RdRp功能的发挥都是由各基序相互配合实现的。基序D和酶与核苷酸识别和配位的效率以及与复制的保真度密切相关[20]。Smertina等[21]对RdRp进行分析,认为澳大利亚的RHDV2是获得了一种相对快速的聚合酶从而具有较高的毒力和进化特征。Neimanis等[22]对成年及幼龄家兔进行RHDV2攻毒实验,结果显示与经典RHDV一样,RHDV2最先攻击肝脏并以肝脏病变最为明显,不同的是幼龄家兔还会发生急性肾炎且在肾脏中亦可检测出病毒。将两株RdRp的序列进行对比后发现,两株RdRp的氨基酸序列在17个位置存在差异。A、B、C、E、F、G基序所在氨基酸的位置高度保守,唯独位于基序D的第一位氨基酸存在差异,SCH04株的第373位氨基酸为Glu,而SCCN03株的第373位氨基酸则是Asp。SCCN03株RdRp的第373位氨基酸的变化能否导致其基序D与核苷酸配位的效率发生变化进而影响病毒生物合成有待进一步研究。
磷酸化和糖基化等是蛋白质重要的翻译后修饰过程,对蛋白质的生物学活性有显著影响[23]。糖基化修饰对蛋白的折叠尤为重要,例如不同亚型RHDV的VP60可能因发生不同的N-糖基化修饰从而引起致病性的不同,有研究学者对非致病性RCV的潜在N-糖基化修饰位点进行预测,发现其相对于致病性RHDV缺失多个潜在N-糖基化修饰位点,证明N-糖基化修饰可能影响RHDV的致病性[24]。而RHDV2是一个可以跨物种感染的兔病毒属成员[25],宿主范围广,本研究通过比较分析发现,SCCN03株RdRp比SCH04株多4个磷酸化位点和1个潜在N-糖基化位点,这也可能与其蛋白质的结构和与宿主的相互作用相关。
综上所述,SCH04株与SCCN03株RdRp的核苷酸序列差异性较大,而氨基酸序列同源性却高达96.71%,大部分的碱基差异为同义变异,并且通过二级结构和三级结构预测的结果表明二者的空间结构相似度极高,综合生物信息学分析结果,推测二者功能差异不显著。这为基于RdRp进行RHDV分子病原学研究提供了科学参考与理论依据。

