纸荚豆不定根不同溶剂提取物的抗氧化活性研究
王 淼, 刘亮亮, 叶玮琦, 于 硕, 张宏妍, 廉美兰, 朴炫春
(延边大学 农学院,吉林 延吉 133002)
纸荚豆(Lessertiafrutescens)属豆科多年生灌木植物,产于非洲南部炎热干旱的地区,是南非重要的药用植物之一[1]。纸荚豆富含三萜皂苷、多糖、松醇、氨基酸、黄酮等多种活性物质[2-4],可用于治疗创伤、感染、发热、消化不良、癌症及糖尿病、胃病等各类疾病[5-6]。由于纸荚豆具有如此丰富的药理活性,使其在南非地区作为常用植物药使用,且需求量巨大[7]。然而,现阶段纸荚豆自然资源仅生长于非洲南部区,同时由于人为过度采集导致纸荚豆自然种群数量不断下降,加上人工栽培过程中种子发芽率低等原因,使纸荚豆植物材料满足不了社会需求[6]。生物反应器培养是由植物组织培养技术发展而来的一种新兴技术,能够不受季节、时间、环境因素的限制实现周年化快速生产植物材料及其目标产物。Shaik等[8]使用生物反应器尝试进行纸荚豆组培苗培养,但在培养过程中极易产生玻璃化现象,不利于大规模工厂化生产。相比之下,不定根培养具有明显的稳定性和高效性,可以在短期内大量获得与母体植株活性物质含量相似的植物材料,可作为改善传统材料来源获取的有效途径。该研究团队利用生物反应器进行纸荚豆不定根培养并发现这种方法可行。
现代医学研究表明,过量自由基的产生往往与许多的慢性病和衰老紧密相关[9-10],抗氧化可以有效减轻自由基对人体的危害程度,因此,抗氧化相关产品的研发已然成为了医疗、保健、化妆品产业的热点之一[11]。目前针对抗氧化作用的相关研究机制主要包括清除自由基、形成金属离子配合物、消除活性氧等[12]。该研究通过测定纸荚豆粗提物及其5种萃取物的(1,1-二苯基-2-三硝基苯肼)DPPH自由基清除能力、(2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸)ABTS自由基清除能力、羟基自由基清除能力、铁离子螯合能力及铁离子还原能力,并利用优劣解距离法(TOPSIS)对它们的综合抗氧化能力进行比较,为今后纸荚豆不定根应用于相关抗氧化产品的开发生产提供理论依据。
1 材料与方法
1.1 植物材料及提取
参照刘懿萱等[13]的方法培养纸荚豆不定50 d后,收获不定根,洗去表面培养基后在45 ℃恒温烘干箱中烘干,收集不定根干品作为试验材料。
1.2 方法
1.2.1 纸荚豆不定根粗提物和不同萃取物的制备
1) 粗提物的制备:将100 g不定根干品浸泡在60%乙醇[液料比为40∶1 (mL∶g)]中,同时添加3 g纤维素酶,pH值调为5,55 ℃热水提取1 h后,于90 ℃水浴中灭活5 min,抽滤,收集滤渣,滤渣使用60%乙醇[液料比为42.53∶1 (mL∶g)]闪式提取1 min,提取2次,将每次抽滤的滤液进行合并,真空冷冻至干燥,即得不定根粗提物,用于后续试验。
2) 萃取物的制备:将上述所得不定根乙醇粗提物,取40 g 用蒸馏水定容至400 mL,倒入体积为2 000 mL的分液漏斗,并加入800 mL石油醚,震荡24 h后,充分摇匀,静止分层后取上层溶液即为石油醚萃取液;继续收集下层溶液并倒入200 mL分液漏斗中,加入800 mL二氯甲烷,震荡24 h后,充分摇匀,静止分层后取上层溶液即为二氯甲烷萃取液;继续收集上层溶液,倒入2 000 mL分液漏斗中,加入400 mL乙酸乙酯,震荡24 h后,充分摇匀,静止分层后取上层溶液即为乙酸乙酯萃取液;继续收集下层溶液,加入400 mL正丁醇溶液,震荡24 h,充分摇匀,静止分层后取下层溶液即为正丁醇萃取液,并收集上层水溶液(以上萃取过程重复2次)。分别将石油醚萃取物(PET-F)、二氯甲烷萃取物(DCM-F)、乙酸乙酯萃取物(EtOAC-F)、正丁醇萃取物(n-BuoH-F)以及水层萃取物(AQ-F)置于真空冷冻干燥机,干燥至恒重后,置于-20 ℃冰箱保存。
1.2.2 DPPH自由基清除能力测定
参考田文等[14]的方法,测定不定根不同提取物对DPPH自由基的清除能力,依次配置样品浓度为0.063、0.13、0.25、0.5、1和2 mg/mL,分别吸取0.1 mL上述样品至96孔板中,加入0.1 mL浓度为0.1 mmol/L的DPPH(北京索莱宝科技有限公司,中国)溶液,避光反应30 min,以甲醇溶液作对照组,利用酶联免疫检测(Multiskan FC,赛默飞,上海,中国)在517 nm处测定吸光度,计算DPPH自由基清除能力。
1.2.3 ABTS+自由基清除能力测定
参照高原等[15]的方法测定不定根不同提取物对ABTS自由基的清除能力。配置2.45 mmol/L过硫酸钾(北京索莱宝科技有限公司,中国)和7 mmol/L的ABTS(上海源叶生物科技有限公司,中国)混合溶液。避光静置16 h,使用前须将ABTS工作液稀释吸光值至0.700(±0.02)(734 nm)。配置浓度为0.063、0.13、0.25、0.5、1和2 mg/mL 的样品2 mL,取样品溶液 0.1 mL和3.9 mL ABTS工作液于试管中,对照组用3.9 mL去离子水代替ABTS工作液,以加入3.9 mLABTS工作液和0.1 mL无水甲醇为空白组。避光反应6 min,使用紫外分光光度计在吸光度为734 nm下测得吸光值,计算ABTS自由基清除能力。
1.2.4 羟基自由基清除能力研究
根据刘荣等[16]的方法,配置浓度为0.25、0.5、1、2、4和8 mg/mL样品30 μL于96孔板中,依次加入30 μL 10 mmol/L水杨酸,2.5 mmol/L盐酸,3.6 mmol/L硫酸铁,0.88 mmol/L过氧化氢,空白组用蒸馏水替代,避光反应20 min,510 nm处测吸光值,计算羟基自由基清除能力。
1.2.5 Fe2+螯合能力测定
参照马文芳等[17]的方法,对不定根不同提取物的铁离子螯合能力进行测定。配置浓度为0.13、0.25、0.5、1、2和4 mg/mL的待测样品溶液。配置浓度为2 mmol/L的FeCl2溶液和浓度为5 mmol/L的菲洛嗪(上海源叶生物科技有限公司,中国)溶液。在96孔板中分别加入 50 μL待测样品,加入137.5 μL蒸馏水,2.5 μL的FeCl2溶液,在震荡速度为300 r/min下摇匀后加入10 μL的菲洛嗪溶液,室温下静置10 min。对照组以2.5 μL 蒸馏水代替FeCl2溶液,空白组以50 μL蒸馏水代替样品,利用酶联免疫检测仪在562 nm 处测吸光值,计算铁离子螯合能力。
1.2.6 Fe3+还原能力研究
根据吴夏青[18]的方法,配置浓度0.031 25、0.062 5、0.125、0.25、0.5和1 mg/mL的样品溶液,取0.5 mL于试管中,配置pH值为6.6的0.2 mol/L PBS缓冲液0.5 mL和1%K3[Fe(CN)6]溶液0.5 mL,充分混匀,37 ℃条件下孵60 min,冷却至室温后加10%氯乙酸(TCA)溶液0.5 mL,混匀后,于700 nm处使用分光光度计测量吸光值,随后加入0.1% Fecl3溶液0.5 mL,混匀后,于700 nm处测量吸光值,空白对照组即为将样品替换为相同体积的PBS,根据吸光值计算铁离子还原能力。
1.2.7 抗氧化能力综合评价
为了综合评价6种不同提取物的抗氧化能力,利用5种抗氧化评价方法(DPPH、ABTS、羟基自由基清除能力,铁离子还原、螯合能力)中得到的提取物的半最大效应浓度(EC50)进行了TOPSIS分析[19]。具体步骤为:
1) 建立初始矩阵(X):利用6种提取物(a)的5种抗氧化活性(b)的EC50值,建立5×6的初始矩阵(图1A)。
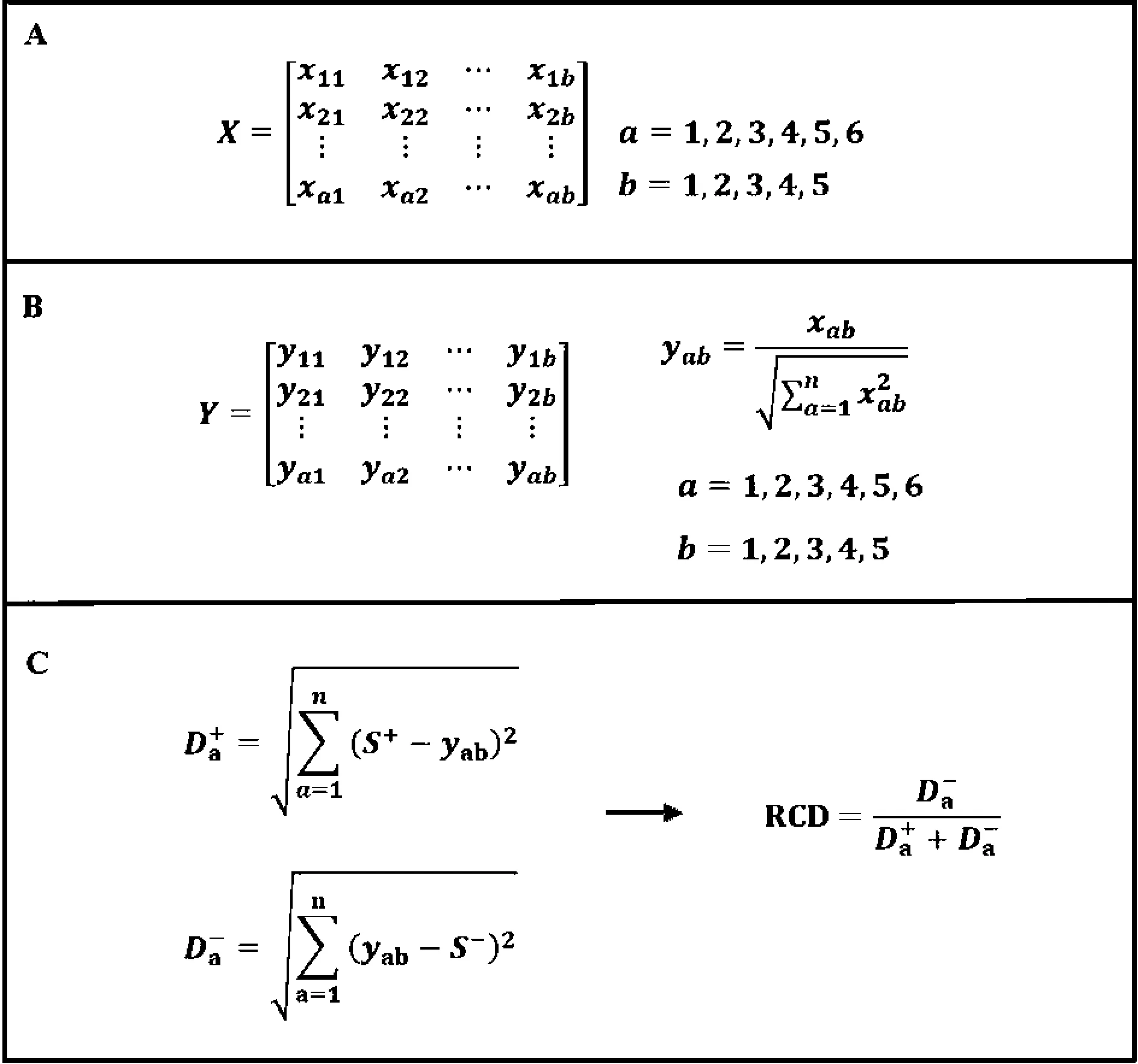
图1 TOPSIS分析
2) 建立标准化矩阵(Y):将X归一化处理,即得Y(图1B)。
1.3 数据分析
所有试验处理均采用3次重复。试验数据使用SPSS 22.0 (SPSS Inc., Chicago,IL, USA) 进行方差分析,采用邓肯式新复极差法进行多重比较,显著水平P<0.05。
2 结果与分析
2.1 纸荚豆不定根粗提物和不同萃取物对DPPH自由基清除能力的影响
纸荚豆不定根粗提物及5种萃取物均对DPPH自由基有显著的清除能力,并且提取物与萃取物的浓度与DPPH自由基清除能力呈正相关(图2)。其中,DCM表现出最高的清除能力,在浓度为2 mg/mL时,清除率达到86%,浓度同为2 mg/mL,DCM-F效果是清除率表现较弱的AQ-F的1.28倍。
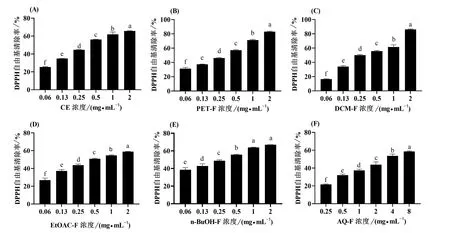
注:CE=粗提取,PET-F=石油醚萃取层,DCM-F=二氯甲烷萃取层,EtOAC-F=乙酸乙酯萃取层,n-BuOH-F=正丁醇萃取层,AQ-F=水层。不同字母表示P<0.05水平的显著性差异,下同。
2.2 纸荚豆不定根粗提物和不同萃取物对ABTS自由基清除能力的影响
由图3可知,不同提取物清除ABTS自由基的能力, 在一定浓度范围内 (0.062 5~2 mg/mL) 存在量效关系。DCM-F清除效果最强,在浓度为2 mg/mL时,清除率达到了75%,AQ-F清除效果较弱,DCM-F是AQ清除效果的1.68倍。

图3 不同提取物对ABTS自由基的清除率
2.3 纸荚豆不定根粗提物和不同萃取物对羟基自由基清除能力的影响
对不定根羟基自由基清除能力进行测定后发现(图4),6种提取物均对羟基自由基有一定的清除能力,并且清除能力与提取物浓度呈依赖性增加。经分析对比可知,PET-F对羟基自由基清除的能力最优秀,当浓度为2 mg/mL时,对羟基自由基的清除能力为56%,显著高于同等提取物浓度下的其他5种提取物对羟基自由基的清除能力,浓度为2 mg/mL时,DCM-F的清除能力为53%,AQ-F为47%,而n-BuOH-F与EtOAC-F清除效果相似,分别为42%和43%,在提取物浓度为2 mg/mL时,CE的效果较差,清除率为31%。
2.4 纸荚豆不定根粗提物和不同萃取物对铁离子螯合能力的影响
由图5可知,纸荚豆不定根粗提物和5种萃取物均是良好的铁离子螯合剂,随着萃取物浓度的升高,铁离子螯合能力也逐渐增强。螯合能力最好的是DCM,当浓度达到4 mg/mL时,其铁离子螯合率为98%,EtOAC-F及PET-F在相同浓度下,铁离子螯合率略弱于DCM-F,分别为95%和94%。n-BuOH-F、AQ-F、CE在4 mg/mL浓度下的螯合能力与其他3种萃取物的螯合能力具有一定差距,螯合率分别为88%、83%和63%。

图5 不同提取物的铁离子螯合力
2.5 纸荚豆不定根粗提物和不同萃取物对铁离子还原能力的影响
由图6可知,粗提物和5种萃取物均表现出良好的铁离子还原能力,且还原能力与样品浓度呈正相关。经对比可知,对铁离子还原能力最好的是EtOAC-F,当样品为最大浓度1 mg/mL时,还原力为80%,显著高于其他5种样品,样品浓度相同时,EtOAC的清除效果分别是DCM-F、PET-F、AQ-F、CE-F和n-BuOH-F的1.11、1.22、1.23、1.30和1.54倍。
2.6 纸荚豆不定根提取物抗氧化综合能力评价
由半最大效应浓度(EC50)可知(表1),纸荚豆不定根粗提取物及5种萃取物均有一定程度的抗氧化活性,DCM-F在清除DPPH自由基和ABTS自由基均表现出较强的清除能力,具有较强的铁离子螯合能力。而EtOAC-F的铁离子还原能力最强,对羟基自由基的清除能力指标评测中可以看出,PET-F表现较好。
TOPSIS综合评价是对原始矩阵进行标准化处理,确定最优解与最劣解,计算得到贴近度,根据贴近度的大小,对各提取物综合抗氧化能力排序,明确抗氧化效果最佳的提取物,根据TOPSIS综合评价结果(表2)可以明显看出,二氯甲烷萃取物的综合抗氧化能力更贴近于正理想解,与正理想解的距离0.119 5,贴近度C为0.933 5,相反正丁醇萃取物与水萃取物的综合抗氧化能力更远离于正理想解,贴近度C分别为0.587 3和0.262 3,并根据其贴近度对6种提取物的抗氧化综合能力进行排序。由此表明,在抗氧化综合能力上,DCM-F的综合抗氧化能力较高,其次是PET-F。
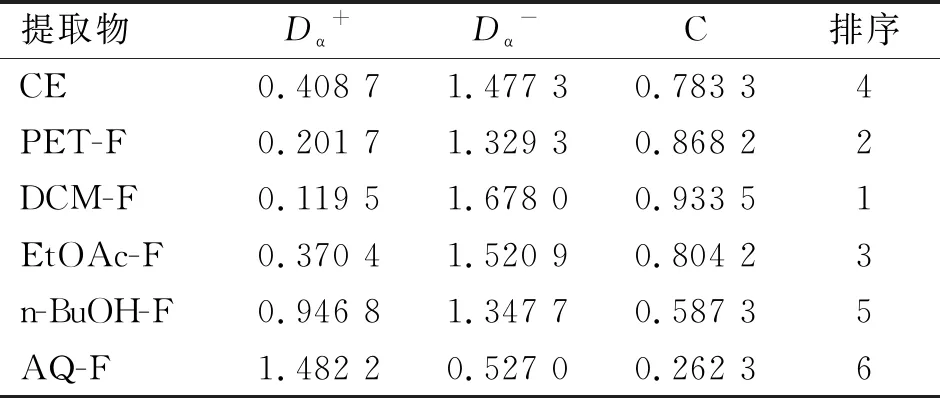
表2 TOPSIS法综合评价不同提取物的抗氧化能力
3 讨论与结论
天然抗氧化剂可络合促氧化的金属离子,有效抑制自由基的产生,促进抗氧化酶和抗氧化因子的产生,植物提取物可以作为一种绿色高效的抗氧化剂[20-25]。但有研究发现,不同有机溶剂逐级萃取的萃取层的抗氧化活性有很大差异,如谭亮等[26]研究发现,黄秋葵乙酸乙酯萃取物清除DPPH自由基能力明显强于黄秋葵水层萃取物,甄兆孟等[27]研究发现,非洲白参二氯甲烷萃取物清除ABTS自由基能力显著强于非洲白参水层萃取物。
对于纸荚豆而言,其不定根抗氧化能力的研究至今尚未报道,该试验研究发现,生物反应器培养的纸荚豆不定根粗提物及5种萃取物的抗氧化能力均随着提取物浓度的升高而增强,并且DCM-F在DPPH自由基清除能力,ABTS自由基清除能力,铁离子螯合能力上具有较好的效果,EtOAC-F在铁离子还原力上具有较好的效果,而在羟基自由基清除能力中表现较好的则是PET-F。这可能是由于在萃取过程中纸荚豆不定根中的活性物质在不同的萃取剂中溶解度不同使其表现出不同的抗氧化能力,且有研究表明,培养的纸荚豆不定根含有三萜皂苷和多糖等生物物质[13],而三萜皂苷类物质已被证实具有抗氧化活性,如周静等[28]研究表明,铁破锣中3种三萜皂苷均具有较强的体外抗氧化活性,根据先前研究,纸荚豆不定根粗提物及萃取层中DCM-F的三萜皂苷含量最高,达到了356.47 mg/g,因此,推测该研究结果DCM-F综合抗氧化活性最好的原因可能是由于三萜皂苷类物质主要集中在DCM-F中。
在抗氧化研究中不同的抗氧化指标可能会存在不同的评价结果,面对这种情况选择一种综合评价的方法来进行选择,而TOPSIS是多个目标决策分析时的一种高效方法,它通过对评价因素与最优解、最劣解的贴近度来进行排序分析,若某因素最贴近最优解的同时又远离最劣解,则判断该因素为最好;否则不为最优,与同样常用于解决多属性决策问题的方法相比,TOPSIS较为客观[29-30]。使用该方法应用于抗氧化能力的综合分析则可以清晰明了地比较判断出样品间的优劣情况。该试验采用TOPSIS综合分析纸荚豆不定根粗提取物和5种萃取物的抗氧化综合能力,得到的贴进度最终排序为DCM-F>PET-F>EtOAC-F>CE>n-BuOH-F>AQ-F,表明DCM-F的抗氧化能力较强,并且通过分析可知,TOPSIS法也可以在评价抗氧化综合能力时作为一种有效的技术手段,为后续抗氧化试验的开展及理论依据提供新思路。

