B超特征预测甲状腺乳头状癌统计学模型应用价值分析
郭建康 王毅 陈文杰
甲状腺癌在全球范围内的发病率和检出率均呈上升趋势,甲状腺结节恶性率>10%[1-2]。目前,临床指南建议所有疑似患者均需应进行超声检查,结合细针穿刺活检(fine needle aspiration biopsy,FNAB)可提高疾病检出率[3-4]。有研究表明,恶性肿瘤风险与以下特征存在关联:低回声(hypoecho,HE)、高宽比(aspect ratio,AR)、不规则边缘(irregular edges,IRE)、微钙化(microcalcification,MCAL)、甲状腺囊被膜侵犯(thyroid cyst invasion,TCI)[5],但是上述特征均无法用作识别甲状腺恶性肿瘤的单一可靠因素。根据欧洲甲状腺协会(European Thyroid Association,ETA)发布甲状腺影像报告和数据系统(thyroid imaging and reporting data system,TIRADS)的分级标准建议,包括ECHO、AR、IRE、MCAL和TCI在内的高风险特征的数量增多可能表明甲状腺肿瘤恶化的风险存在显著升高趋势[6]。但TIRADS未充分考虑每个超声特征的权重因子和组合模式。目前,FNAB被认为属于临床上最具决定性的诊断方法,但首先要怀疑恶性方可建议穿刺[7]。此外,FNAB在临床实施中也存在一定的局限性,结节大小、位置、质地等因素均可对FANB的操作过程产生影响,因此进一步提高超声评估准确性具有非常重要的现实意义[8-9]。本研究旨在通过建立模型的方式使当前显示的具有高风险的超声特征和结节大小评估甲状腺结节恶性风险,为甲状腺乳头状癌临床诊断提供有科学医学证据。
1 资料与方法
1.1 一般资料
选取2015年1月—2022年8月福建省福清市第二医院和福建省福清市医院诊治1385例甲状腺乳头状癌(papillary thyroid carcinoma,PTC)患者作为研究对象。按照随机方法选择PTC患者500例及良性病变患者193例用于开发预测模型。随机选择PTC患者500例及良性病变病例192例进行验证,即病例诊断恶性1000例,良性385例;其中女性患者1102例,构成比为79.6%;年龄15~74岁,平均年龄(46.3±11.6)岁,中位年龄47岁。本研究经医院医学伦理委员会审查批准。
纳入标准:(1)所有患者术前均经超声检查,全部PTC组患者经PTC甲状腺切除术后均经病理诊断确诊为PTC,良性病例经甲状腺切除术后经FNAB或病理诊断证实。(2)患者临床资料完整。排除标准:(1)合并其他恶性消耗性疾病者;(2)合并多脏器功能异常者;(3)影像学资料缺失者;(4)参与其他研究或试验者。
1.2 方法
由两家医院≥2名B超科医生进行超声检查,运用彩色多普勒超声仪(荷兰飞利浦IU22型)检查,探头频率为6~10 MHz。取患者的仰卧位,将颈部垫高并充分暴露,利用探头在患者颈部做横、纵、斜切面探查。对患者甲状腺结节超声特征进行一下内容评估:(1)HE;(2)IRE;(3)AR>1;(4)回声焦点(echo focus,EF);(5)TCI;(6)彩色多普勒血流成像(color doppler flow imaging,CDFI)的血流情况;(7)MCAL;(8)圆形(round,R);(9)光环标志(aura flag,AUR);(10)上位(upper upl,UPL)。根据2015年美国甲状腺学会(American Thyroid Association,ATA)指南和TIRADS标准[10]对结节是否为恶性肿瘤进行判断。根据(1)~(5)超声特征数量将PTC患者分为4A(1个)、4B(2个)、4C(3个或4个)和5(5个)等4个等级。临床特征与5种超声特征相匹配,同时对单一指标诊断恶性的参数进行计算和分析。
1.3 观察指标
分析患者超声特征指标和病理检诊断的结果;分析结节超声特征与PTC的关系;分析PTC结节大小与超声特征关联;分析预测模型和受试者工作特征(receiver operating characteristic,ROC)曲线;分析不同结节大小患者模型的曲线下面积(area under curve,AUC);根据超声特征的数量模型进行概率计算。
1.4 统计学方法
采用SPSS 23.0统计学软件进行数据分析。计量资料用(±s)表示;计数资料采用n(%)表示,比较采用χ2检验。单因素和多因素Logistic回归分析结节超声特征与PTC的关系,以确诊PTC作为因变量,以超声特征为自变量,评估自变量有效性的显着性水平设定为P<0.05,针对训练和测试数据集的OR及95%CI进行计算。通过PTC的概率的方程式分析验证组数据。对确诊PTC组中将测试推导预测模型(推导集)应用于随机选择的50%患者,为其余50%的数据提供验证集。应用ROC曲线对模型进行评估,通过计算AUC获取真实结果的比例。P<0.05为差异有统计学意义。
2 结果
2.1 超声特征指标和病理诊断对1385例甲状腺肿瘤良恶性的检出情况
不同超声特征指标对1385例甲状腺肿瘤患者良恶性的检出符合例数不同,排前五的超声特征分别是AR(1117例)、ECHO(1019例)、EF(808例)、IRE(648例)、TCI(598例)。见表1。
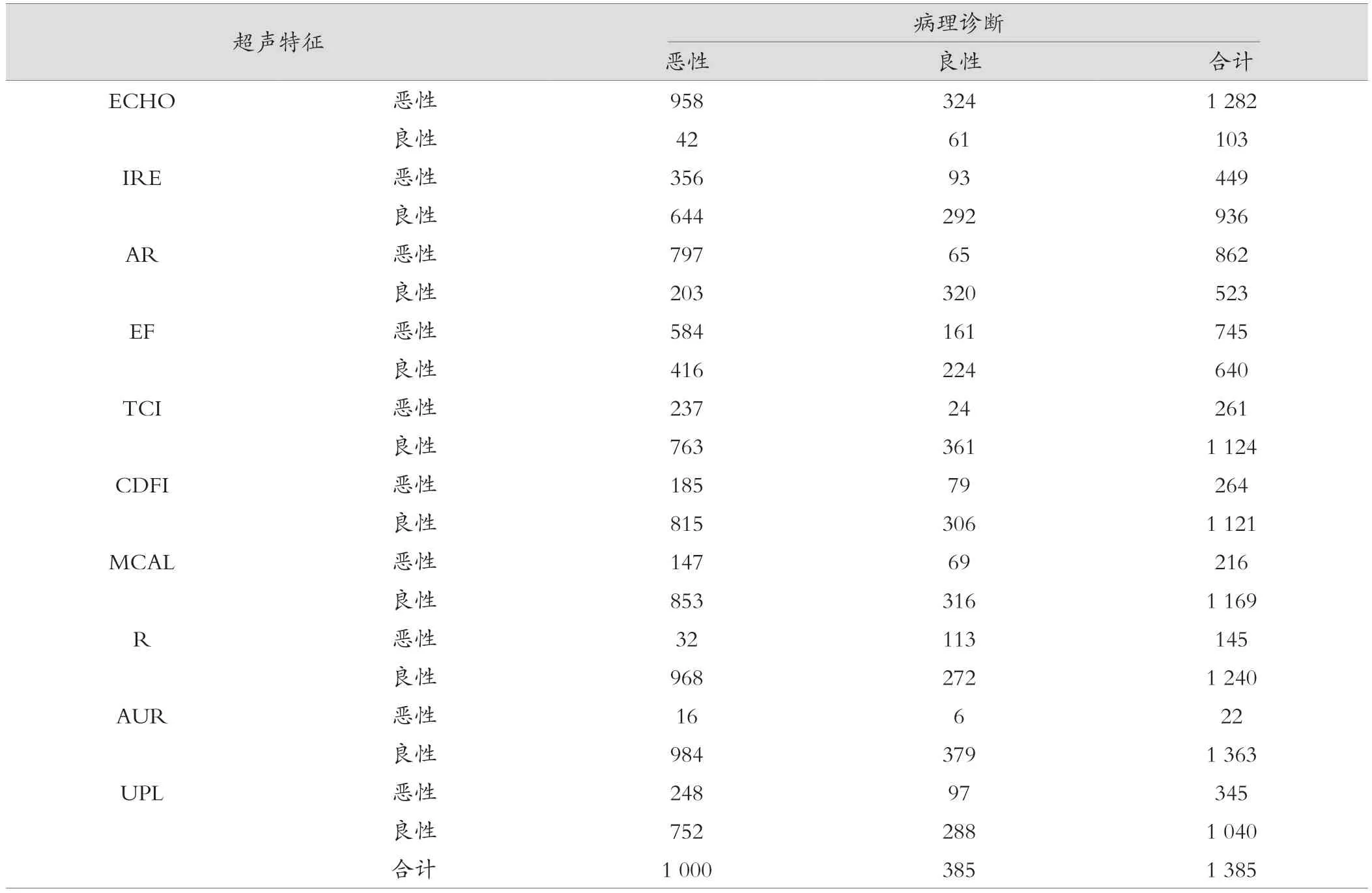
表1 超声特征指标对1385例甲状腺肿瘤良恶性的检出情况(例)
2.2 结节超声特征与PTC的相关性分析
对结节中10个PTC潜在超声预测因子进行单因素Logistic回归分析,ECHO(OR=4.294)、IRE(OR=1.736)、AR(OR=19.329),EF(OR=1.953)和TCI(OR=4.672),R(OR=0.800)6个特征与PTC存在相关性,具有预测甲状腺肿瘤的价值(P<0.05),其中以AR和TCI的OR水平较高。CDFI(OR=0.879)、MCAL(OR=0.789)、AUR(OR=0.944)、UPL(OR=0.979)不具备预测价值(P>0.05)。多因素Logistic回归分析显示ECHO、AR、MCAL,ITC 4个超声特征为PTC独立预测因子。见表2、表3。
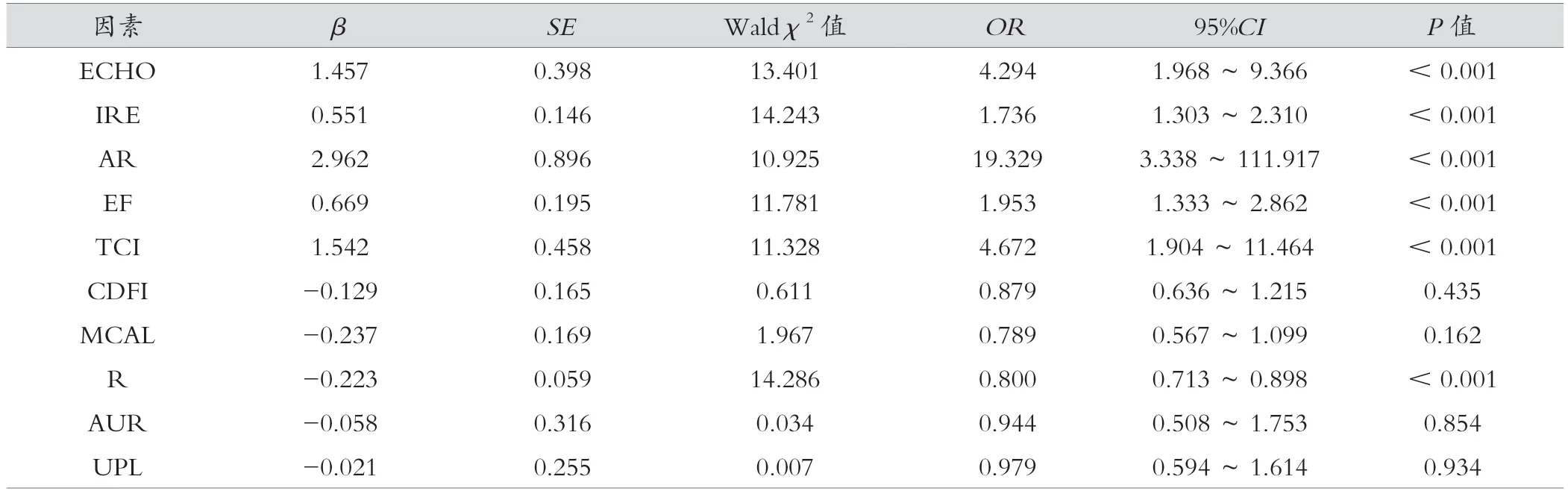
表2 结节超声特征与PTC的单因素Logistic回归分析
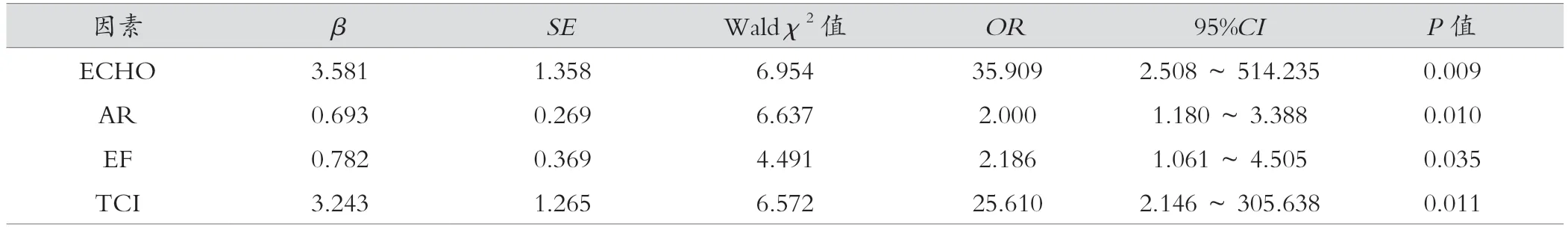
表3 结节超声特征与PTC的多因素Logistic回归分析
2.3 PTC结节大小与超声特征关系
对不同结节大小患者5项超声特征的OR值进行统计并根据结节大小[<0.3 cm、0.3~0.5 cm(不包含0.5 cm)、0.5~1.0 cm、>1.0 cm]将患者分为四组,分别为354例、393例、379例、259例;结果显示ECHO在四组中均具有动态OR值,其中0.5~1.0 cm组OR值最大,>1.0 cm组者OR值最小(图1A);≥0.3 cm组IRE模式随着结节大小的增加而减少(图1B);四组AR 的OR值相似(图1C);EF和TCI的OR值随着结节大小的增加而增加(图1D和1E)。见表4。

图1 超声特征的OR值与结节大小关联
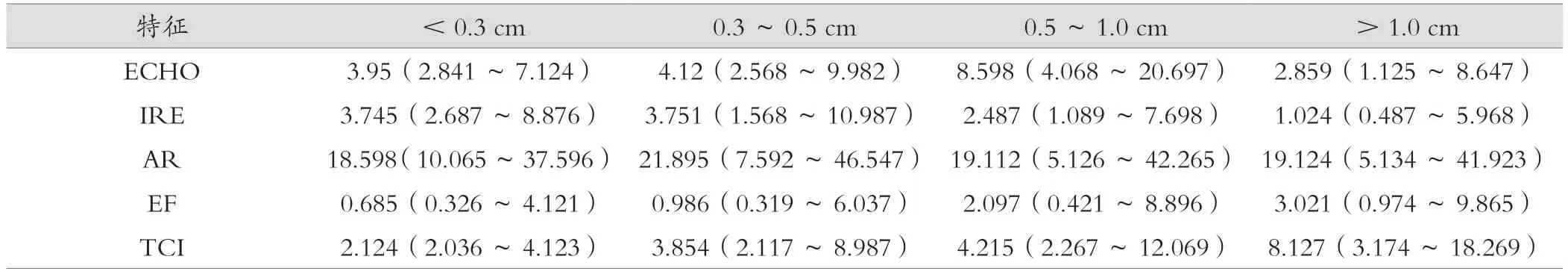
表4 PTC结节大小与超声特征关系
2.4 预测模型和ROC曲线
PTC在甲状腺结节中临床预测模型表达了恶性概率与所识别的超声特征和结节大小(≥0.5 cm,结节大小(nodule size,Ns))之间关联,如下:
(1)甲状腺恶性肿瘤概率=eχ/(1+eχ),其中e为自然对数之底;(2)χ=-2.06+3.581×ECHO+0.693×AR+0.782×EF+3.243×TCI-1.12×Ns。统计结果如表3所示。
为建模和验证数据集开发ROC曲线,预测模型可以区分良性和恶性。AUC在模型构建数据集中为0.856(图2A),在验证数据集中为0.828(图2B)。TIRADS之后的AUC被计算在建模和验证数据集中,分别为0.710和0.749(图2C和2D)。结果表明该模型预测PTC的准确性高于TIRADS(χ2=5.364,P<0.05)。
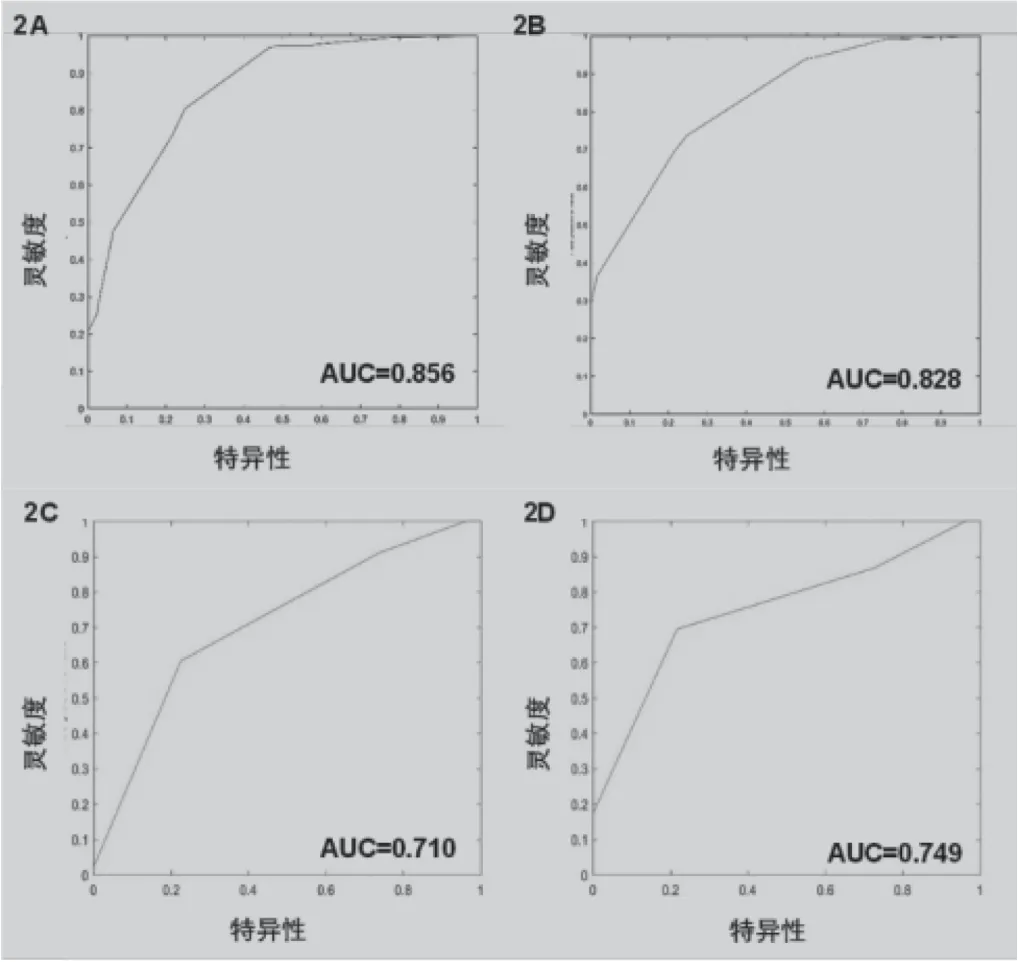
图2 甲状腺结节预测模型和TIRADS受试者工作特征曲线注:2A示模型曲线源自1000例患者的建模数据(AUC=0.856);2B示模型曲线源自经过验证的数据,包括385例患者(AUC=0.828);2C示TIRADS曲线源自1000例患者建模数据(AUC=0.710);2D示TIRADS曲线来自经过验证的数据,包括385例患者(AUC=0.749)。
2.5 不同结节大小患者模型的AUC分析
建模和验证数据集根据结节大小(<0.5 cm或≥0.5 cm)分为两组。ROC曲线基于建模及验证数据集开发,结果显示<0.5 cm 和≥0.5 cm的建模数据集组AUC分别为0.824和0.995(图3A和3B);对于验证数据集,<0.5 cm组及≥0.5 cm组中AUC分别为0.838和0.882(图3C和3D)。
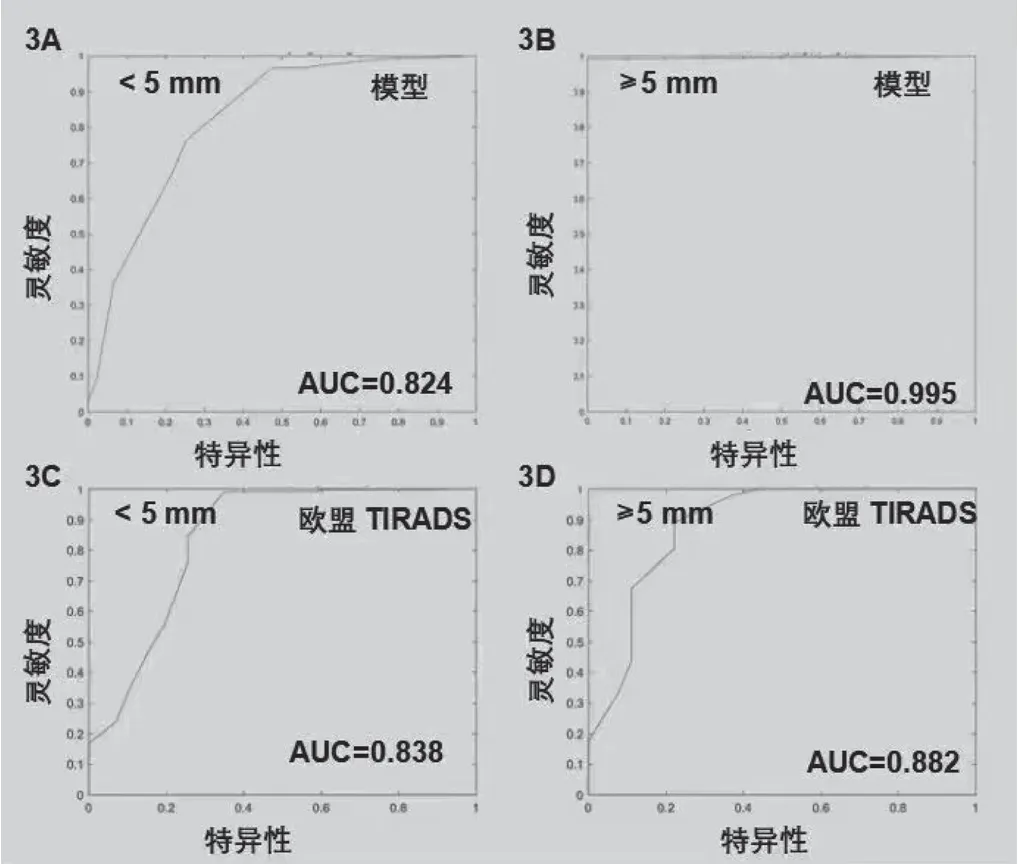
图3 不同大小甲状腺结节预测模型受试者工作特征曲线分析注:3A、3B分别示模型曲线源自1026例结节大小<5 mm、≥5 mm患者的数据(3A:AUC=0.824;3B:AUC=0.995);3C、3D来自535例患者验证数据曲线,结节大小<5 mm(3C:AUC=0.838)、≥5 mm(3D:AUC=0.882)。
2.6 不同结节特征联合检测恶性概率
根据2015ATA,具有ECHO加上一项或多项超声风险特征结节高度怀疑恶性肿瘤(70%~90%),但精准性较差。本研究中,ECHO加1个其他超声特征(AR)结节恶性概率达73.8%,ECHO加2个特征的结节(AR+EF)恶性概率为81.7%,具有ECHO加上3个特征的结节(EF+AR+TCI)恶性概率分别为92.2%(图4),3种不同结节特征联合检测恶性概率比较,差异有统计学意义(ECHO+1vs. ECHO+2:χ2=18.038,ECHO+1vs. ECHO+3:χ2=119.972,ECHO+2vs. ECHO+3:χ2=48.581,均P<0.001)。结果表明本次研究所用模块PTC指示风险优于2015ATA。
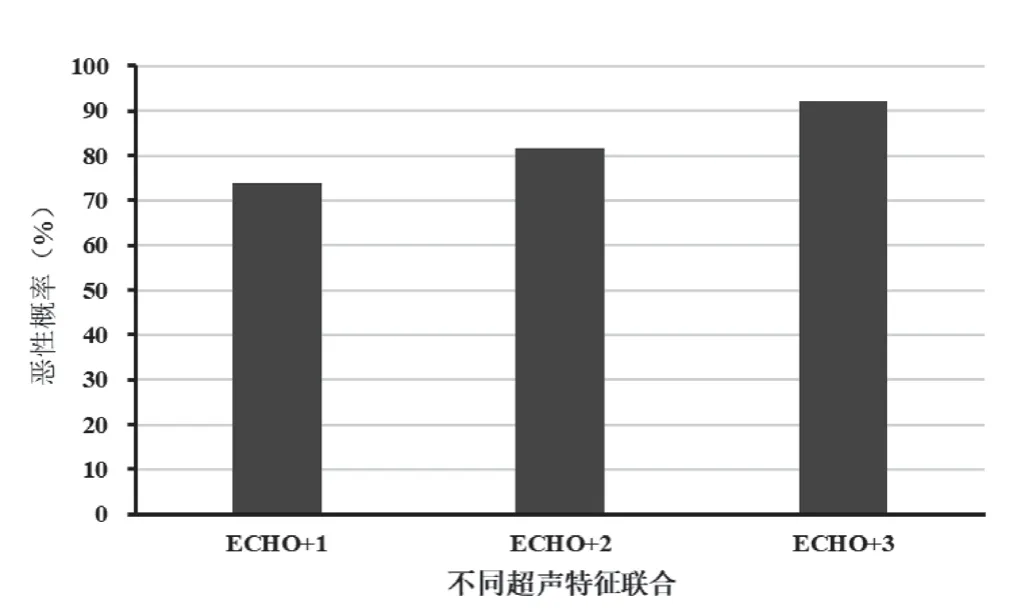
图4 模型预测具有不同超声特征数量的恶性结节的恶性概率
3 讨论
本研究分析了5种典型预测甲状腺恶性肿瘤的超声特征,提示5个特征中ECHO有最高奇数值,与大部分既往研究结果存在一致性[11-12]。此外,本次研究结果表明结节大小为影响ECHO准确性的重要影响因素。对于结节<0.5 cm患者,ECHO OR值明显大于结节大小≥0.5 cm患者(图1A),故而若低回声性的特异性较低时应建议在建模时将结节大小(≥0.5 cm)纳入考虑范畴。本研究建立的模型中,ROC显示不同结节大小的所有AUC>0.8(图3),表明即使在小结节(<0.5 cm)中,本研究建立的模型也可以很好地预测PTC。本研究发现不仅ECHO的OR,而且AR和MCAL的OR值在不同大小的结节中具有可变性(图1B、1C),只有当结节≥5 cm时,可检出显著的OR值。根据本研究的数据,IRE无法支持不同组中的重要OR;相反,结节大小对TCI的OR值影响有限。通常情况下,应用ECHO、AR和MCAL对PTC风险进行评估,需要考虑结节大小。
综合5种超声特征预测甲状腺恶性肿瘤的可靠度明显高于单一超声特征。本研究开发了用于预测PTC的逻辑模型,该模型可以将建模和验证数据集的AUC明显高于使用TIRADS的准确度。这可能是由于该模型考虑了超声特征和组合模式的权重因子,即使在小结节(<0.5 cm)中,该模型也能提供高水平的AUC(图3),可能有利于临床早期诊断。故而,本次研究模型PTC预测可靠度明显高于一种超声特征。本文内容体现了《甲状腺结节和分化型甲状腺癌诊治指南》[13]的临床参考或执行标准。
本研究的模型给出了各个超声特征的风险概率,且清楚地表明具有更多超声特征的结节具恶性概率更高(图4),应用ECHO、AR、EF、TCI和结节大小的建立的模型可以将AUC提高;对于提高疾病诊断准确率有非常重要的价值,可为临床制定抗癌方案提供指导,还能够根据超声特征变化情况对治疗方案进行相应的调整;能够使患者病情恶化或者进展风险得到抑制,有利于稳定和改善其病情,维护其生命安全。

