新疆盐碱地区盐爪爪内生菌群落组成与分布格局研究
王慧楠,唐琦勇,顾美英,张志东,朱 静
(1.新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,新疆 乌鲁木齐 830091;2.农业农村部盐碱土改良与利用(干旱半干旱区盐碱地)重点实验室,新疆 乌鲁木齐 830091;3.新疆师范大学生命科学学院,新疆 乌鲁木齐 830054)
土壤盐碱化是当今世界旱地农业面临的重大生态环境问题。新疆被称为世界盐碱地博物馆,该地区盐碱土面积占中国盐碱土总面积 (9 913万 hm2) 的22.01%;其中,受不同程度盐渍化危害的耕地面积占总耕地面积的30.12%。土地盐渍化已严重限制和阻碍了旱区农业开发及可持续发展[1]。盐爪爪 (Kalidiumfoliatum) 为藜科多年生灌木,多分布于南北新疆极端盐碱的荒漠沙土中。作为一种典型盐生植物,盐爪爪可在盐渍化环境中生长,能不断从外界吸收大量盐离子,具有改良盐碱地土壤性质、降低土壤含盐量和增加土壤有机质的作用[2],在干旱半干旱地区的水土保持、农作物的耐盐育种以及盐渍化土壤的改良等方面有重要的生态和经济价值。
植物内生菌是指存活于健康植物组织内部,不引发宿主植物表现出明显感染症状的微生物类群[3]。内生菌可改善植物生长状况,提高其抵抗盐碱、干旱和病虫害等环境胁迫的能力[4-5]。目前,关于盐爪爪的研究多集中于其形态解剖特点[6]、适盐特性以及耐盐分子机理等方面[7],新疆特殊环境微生物资源挖掘创新团队前期对新疆干旱荒漠及核辐射污染环境中的盐爪爪内生群落构成进行了初步研究[8-9],而新疆盐碱环境下盐爪爪内生菌的相关报道仍较为有限。因此,本研究采用高通量测序技术,通过研究新疆5个不同地区的盐爪爪内生群落结构组成与分布格局,以期阐明内生菌在生态系统的演替规律、生物多样性及其生态功能,旨在为开发和利用相关功能微生物提供理论依据。
1 材料与方法
1.1 样品采集地点及方法
于2019年10月分别对新疆克拉玛依市郊区(k)、吐鲁番地区艾丁湖沿岸(ad)、巴音郭楞蒙古自治州塔什店镇水库周边(ts)、巴音郭楞蒙古自治州轮台县野云沟乡荒漠盐碱地(yy)、巴音郭楞蒙古自治州轮台县城外盐碱地(lt)5个地区的盐爪爪进行采集。每个地区选择3个采样点,各采样点之间间隔约5 km(表1)。使用随机采样法,每个采样点采集1株完整植物样品,装入灭菌的牛皮纸袋内,编号记录,带回实验室于4℃储存。将每个采样点采集的植株分为地上部分(up:茎,叶)和根部(down)。5个地区,每区3株植物,每株植物分为地上部分和根部2个样本,由于ts采样点采集了4株植物,故共计32个样本。
植物采样的同时采集土壤样品,使用土钻从土壤表层0~15 cm钻取土芯,每份土壤样品由5份土芯混合而成,过2 mm筛,去除土样中的石块和植物根系等杂物,装袋封口并做好标记,运回实验室于4℃保存。
1.2 样品表面消毒
参照Sun等[10]方法进行样本表面消毒,将植物组织依次浸入75%乙醇1 min、3.3%次氯酸钠5 min、75%乙醇0.5 min,经无菌水冲洗后用滤纸吸干备用。
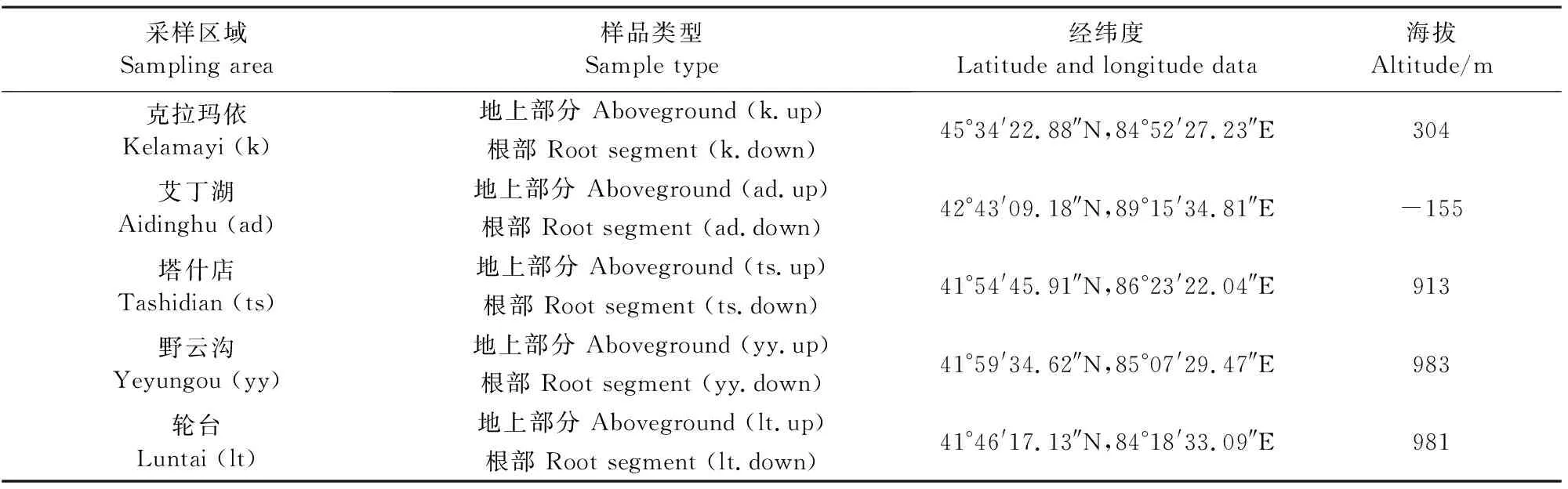
表1 不同盐碱地区采样信息
1.3 基因组DNA提取和PCR扩增
将样品的地上部分和根部分别研磨,采用CTAB方法提取样本的基因组DNA,使用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样本DNA于离心管中,用无菌水稀释至1 ng·μl-1。
以稀释后的基因组DNA为模板,对细菌16S rRNA基因V3-V4区、真菌ITS1区进行扩增,扩增产物经纯化回收,交由北京诺禾致源生物信息科技有限公司完成测序。
1.4 生物信息学分析
使用QIIME 1.9.1软件对Illumina MiSeq测序平台下机数据进行质控,利用Uclust(Uclust v1.1.579)软件对所有样品的全部Clean Reads进行聚类[11],默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational taxonomic units),用Mothur方法与SILVA132的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0)。使用QIIME软件计算Shannon、Simpson、Chao1等多样性指数。利用Bray-Curtis算法,使用R 3.6.1版本(R Development Core Team, 2016)的vegan软件包进行无度量多维标定(Non-metric multi-dimensional scaling,NMDS)分析群落之间的差异性。利用CANOCO 5.0软件,使用冗余分析(Redundancy analysis,RDA)评价植物内生菌群落结构与环境变量之间的相关性。使用诺和云平台(https://magic.novogene.com/)进行群落结构、物种多样性等数据分析并绘制相关图。使用IBM SPSS Statistics 27.0软件对Alpha多样性、土壤理化性质等数据进行单因素方差分析(One-way ANOVA)。
1.5 土壤样品理化性质测定
2 结果与分析
2.1 测序数据分析
由各样品测序信息结果(表2)可知,5个不同地区盐爪爪地上部分和根部样品总计测得内生细菌的原始序列664 331条,有效序列数616 931条;内生真菌的原始序列680 084条,有效序列数672 676条。以97%相似度将其聚类,内生细菌共产生366个OTUs,内生真菌共产生869个OTUs。如图1(见261页)所示,在内生细菌中,不同样品及组织间共有的OTUs数为61,占总OTUs的16.67%。在内生细菌的366个OTUs中,地上部分仅包含111个OTUs,且主要来源于共有部分,而根部包含316个OTUs,表明根部样品的OTUs更多。其中,地上部分样品OTUs以ad组最多,约占地上部分总数的35.14%;根部样品则以lt组OTUs最多,约占根部总数的24.05%。
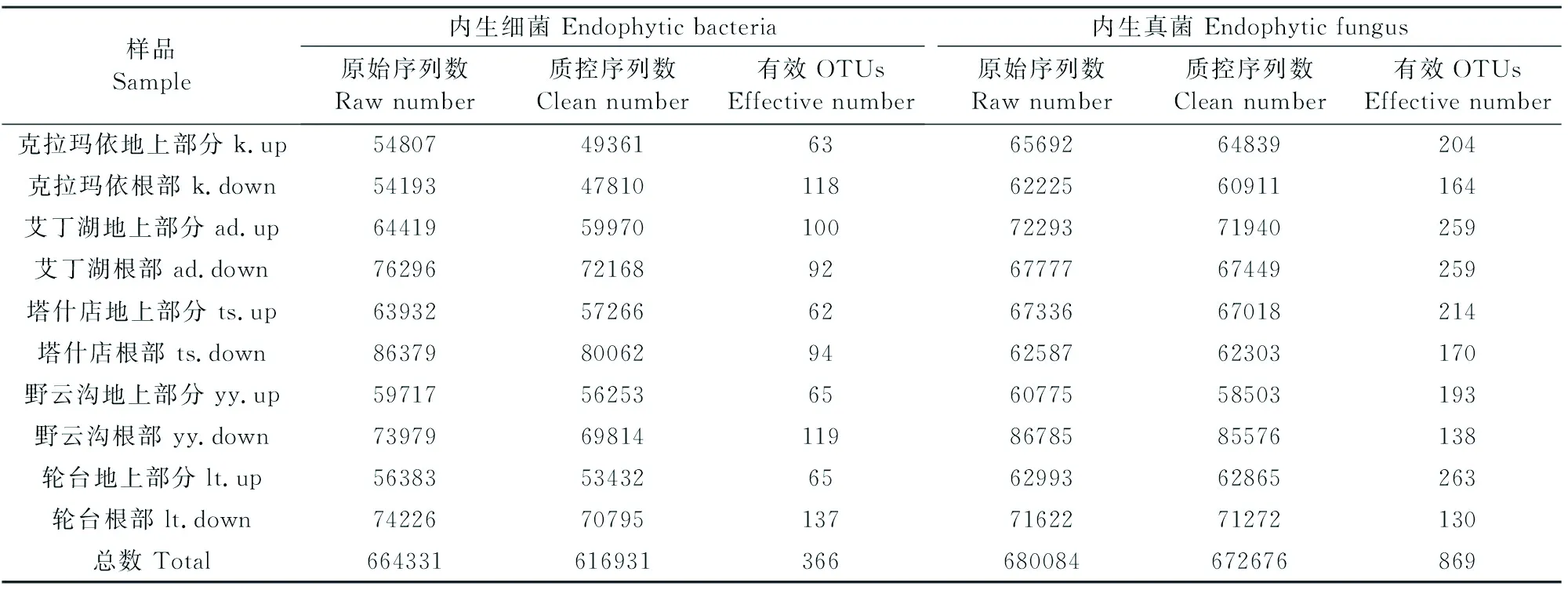
表2 内生细菌和真菌测序数据统计
如图2所示,内生真菌中,共有的OTUs为125,占总OTUs的14.38%。地上部分样品共包含633个OTUs,根部样品包含361个OTUs,可见在内生真菌群落中地上部分样品OTUs高于根部样品。其中,地上部分OTUs以lt组最多,约占地上部分总数的21.80%;其次为ad组,约占地上部分总数的21.17%。根部OTUs以ad组最多,约占根部总数的37.12%。以上结果说明,在不同地区的盐爪爪中,内生细菌和内生真菌群落结构组成存在显著差异。
2.2 多样性及群落结构差异分析
2.2.1 多样性分析 Alpha多样性指标中的香农指数、辛普森指数可反映群落的多样性,Chao1和ACE指数则反映群落的丰富度。由表3可以看出,测序深度指数coverage均在99.70%以上。在盐爪爪内生细菌及内生真菌群落多样性方面,不同地区及组织间香农指数及辛普森指数无显著差异。在群落丰富度方面,所有地区的内生细菌基本表现为根部丰富度大于地上部分;内生真菌则相反,表现为地上部分丰富度整体大于根部。其中,ad组地上部分、lt组根部内生细菌群落丰富度最高;k组地上部分、ad组根部内生真菌群落丰富度最高。方差分析表明,各地区盐爪爪的内生菌群落多样性之间差异不显著,而群落丰富度最高与最低组之间存在显著差异。可见,不同地区的盐爪爪内生菌群落多样性状况基本一致,但其群落丰富度在不同地区和不同组织间存在一定差异。
2.2.2 菌群结构分析 将OTU注释到各分类水平,细菌产生的366个OTUs共涉及16个门,70个目,321个属,以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)为主要菌门(图3A)。进一步分析盐爪爪样品中12个主要属发现(表4,见262页),不同地区、不同组织的盐爪爪内生细菌群落结构组成相近,但各样品间菌群所占比例则存在显著差异。其中,k地区的主要优势菌属为链霉菌属(Streptomyces),ad地区以芽孢杆菌属(Bacillus)、沉积物杆菌属(Sediminibacillus)和海球菌属(Marinococcus)为主要优势菌属,ts地区的优势菌属为芽孢杆菌属(Bacillus)、嗜盐单胞菌属(Halomonas)和沉积物杆菌属(Sediminibacillus),yy地区的主要优势菌属包括Kushneria属和链单孢菌属(Streptomonospora),lt地区相对含量较高的菌属主要有假单胞菌属(Pseudomonas)、嗜盐单胞菌属(Halomonas)和拟诺卡氏菌属(Nocardiopsis)。地上部分主要由嗜盐单胞菌属(Halomonas)、沉积物杆菌属(Sediminibacillus)、叶杆菌属(Phyllobacterium)、薄壁芽孢杆菌属(Gracilibacillus)组成;根部主要由芽孢杆菌属(Bacillus)、链单孢菌属(Streptomonospora)、嗜盐单胞菌属(Halomonas)、假单胞菌属(Pseudomonas)、Kushneria属、海球菌属(Marinococcus)、拟诺卡氏菌属(Nocardiopsis)、链霉菌属(Streptomyces)组成。

表3 内生群落多样性指数
真菌产生的869个OTUs共涉及14个门,86个目,291个属,以子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、油壶菌门(Olpidiomycota)为主要菌门(图3B)。对盐爪爪样品中12个主要真菌属作进一步分析发现(表5),与内生细菌的结果相同,不同地区、不同组织的盐爪爪内生真菌群落结构组成相近,但各样品间菌群所占比例也存在显著差异。其中,k地区的优势菌属主要为葡萄座腔菌属(Botryosphaeria)和格孢腔菌属(Pleospora),ad地区的主要优势属为链格孢菌属(Alternaria)和曲霉属(Aspergillus),ts地区中相对含量较高的菌属主要有链格孢菌属(Alternaria)和支顶孢属(Acremonium),yy地区的主要优势属为链格孢菌属(Alternaria)、Neophaeosphaeria属和茎点菌属(Phoma),lt地区的主要优势属有链格孢菌属(Alternaria)和粪壳菌纲未分类属(unidentifiedSordariomycetes)。地上部分主要由葡萄座腔菌属(Botryosphaeria)、链格孢菌属(Alternaria)、曲霉属(Aspergillus)、格孢腔菌属(Pleospora)、茎点菌属(Phoma)组成;根部主要由链格孢菌属(Alternaria)、Neophaeosphaeria属、支顶孢属(Acremonium)、粪壳菌纲未分类属(unidentifiedSordariomycetes)组成。此外,研究发现新疆盐爪爪中存在着大量未分类细菌属和真菌属。
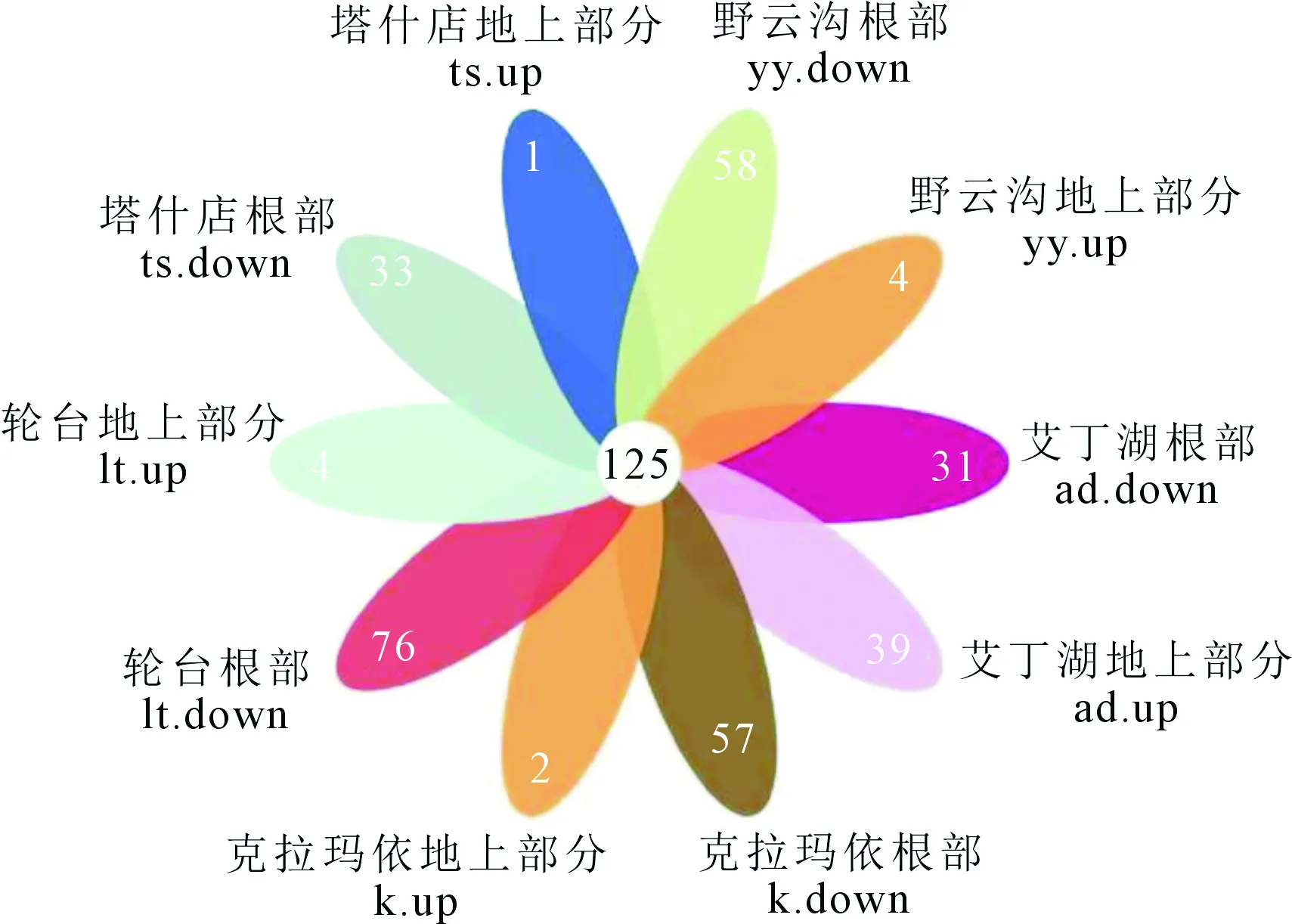
图1 各样本内生细菌群落韦恩图

图2 各样本内生真菌群落韦恩图
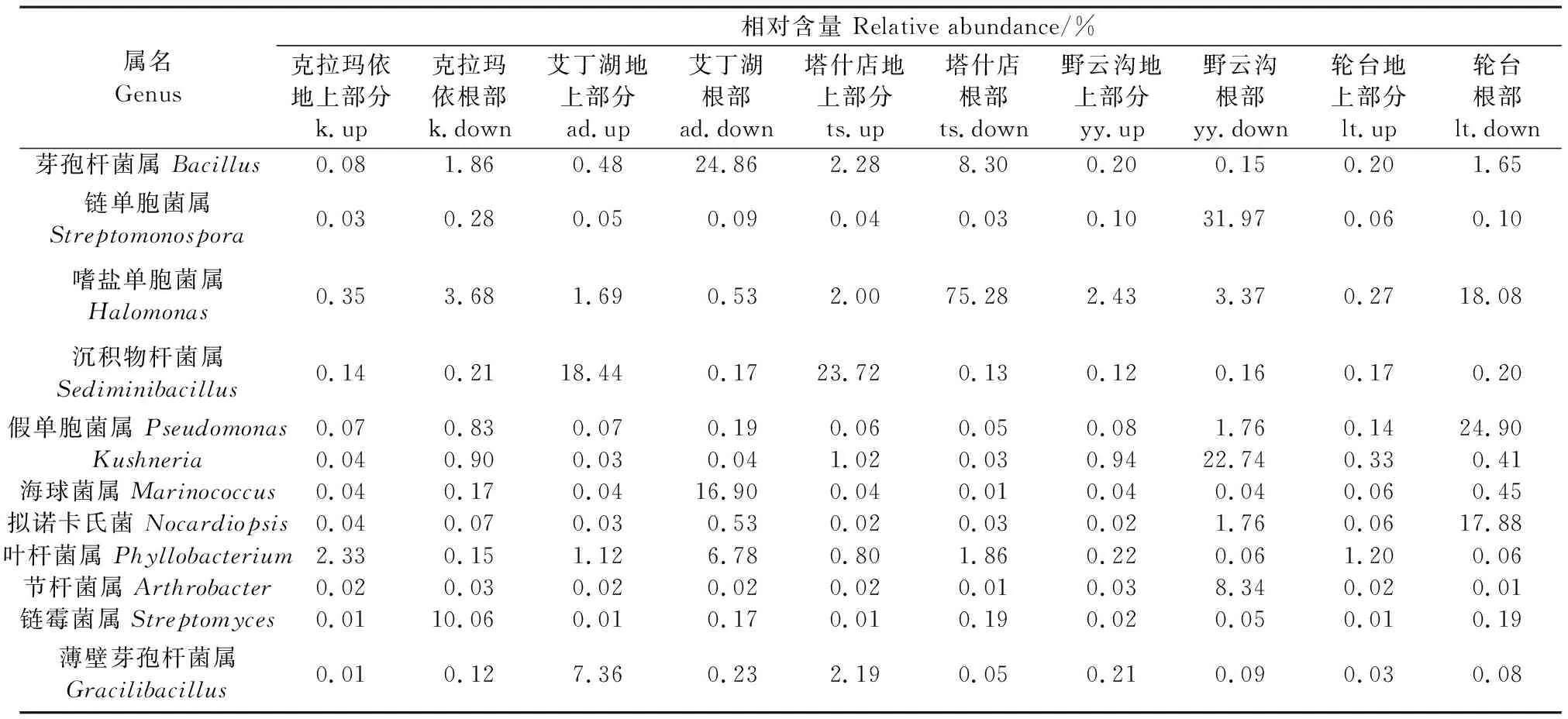
表4 属水平上主要的内生细菌群落组成
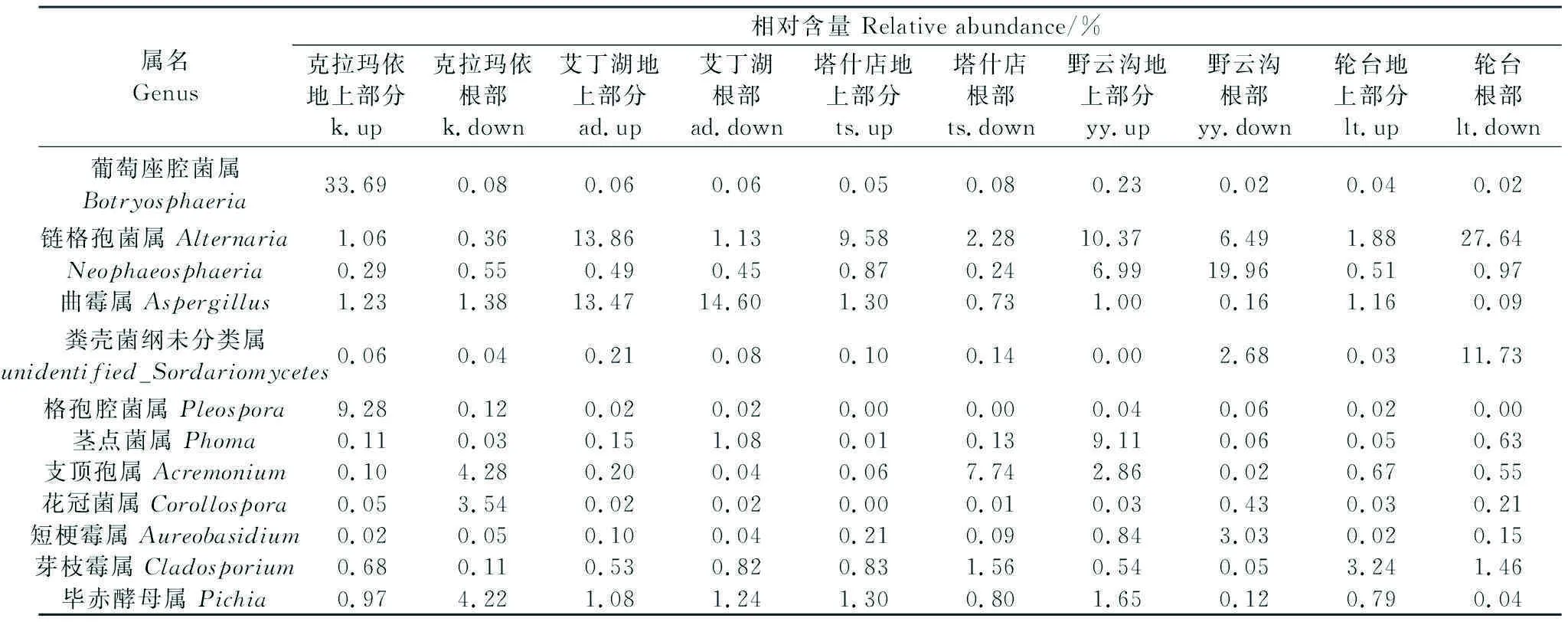
表5 属水平上主要的内生真菌群落组成
2.2.3 NMDS分析 基于OTU水平,对不同样本内生细菌和内生真菌群落进行非度量多维尺度(NMDS)分析,其结果以stress值评估,即观察到的距离和拟合距离的不一致性,stress值小于0.2时具有解释意义。如图4、图5所示,各地区不同组织的内生细菌群落(ANOSIM:R=0.1902,P=0.003)和内生真菌群落(ANOSIM:R=0.2756,P=0.001)组成差异显著。其中,5个样品根部的点比较分散,说明根部内生细菌群落差异较大(stress值为0.170);地上部分内生细菌群落相对集中,说明其共有的细菌类型较多,群落构成相似度高。可见,地上部分和地下部分两种不同的采样位点对内生细菌的群落组成影响显著。在内生真菌(stress值为0.165)中,yy组、lt组的根部以及k组的地上部分群落较分散,群落构成特异性高,而其他样本虽相对集中,但样品间真菌的群落构成依然差异显著。
2.3 不同地区土壤属性分析及其对群落组成的影响
土壤样品理化性质的测定结果表明 (表6):不同地区土壤pH值均呈碱性;全盐含量介于6.90~84.80 g·kg-1,属于盐碱土,其中ad地区的含盐量最高;有机质含量基本介于4.30~10.90 g·kg-1,属于荒漠土;地区间全氮含量差异不显著;ts地区可溶性氮、速效磷、硫酸根含量均最高;yy地区的速效钾含量最高,为563.00 mg·kg-1;lt地区钙离子含量最高,为3.53 g·kg-1;电导率、钠离子、氯离子与土壤全盐量随地区变化规律较一致,均为ad地区最高,yy地区最低。结果表明,除全氮含量外,不同地区间的土壤理化性质及含水量均存在显著差异。

图4 内生细菌群落NMDS分析(ANOSIM:R=0.1902 ,P=0.003 )
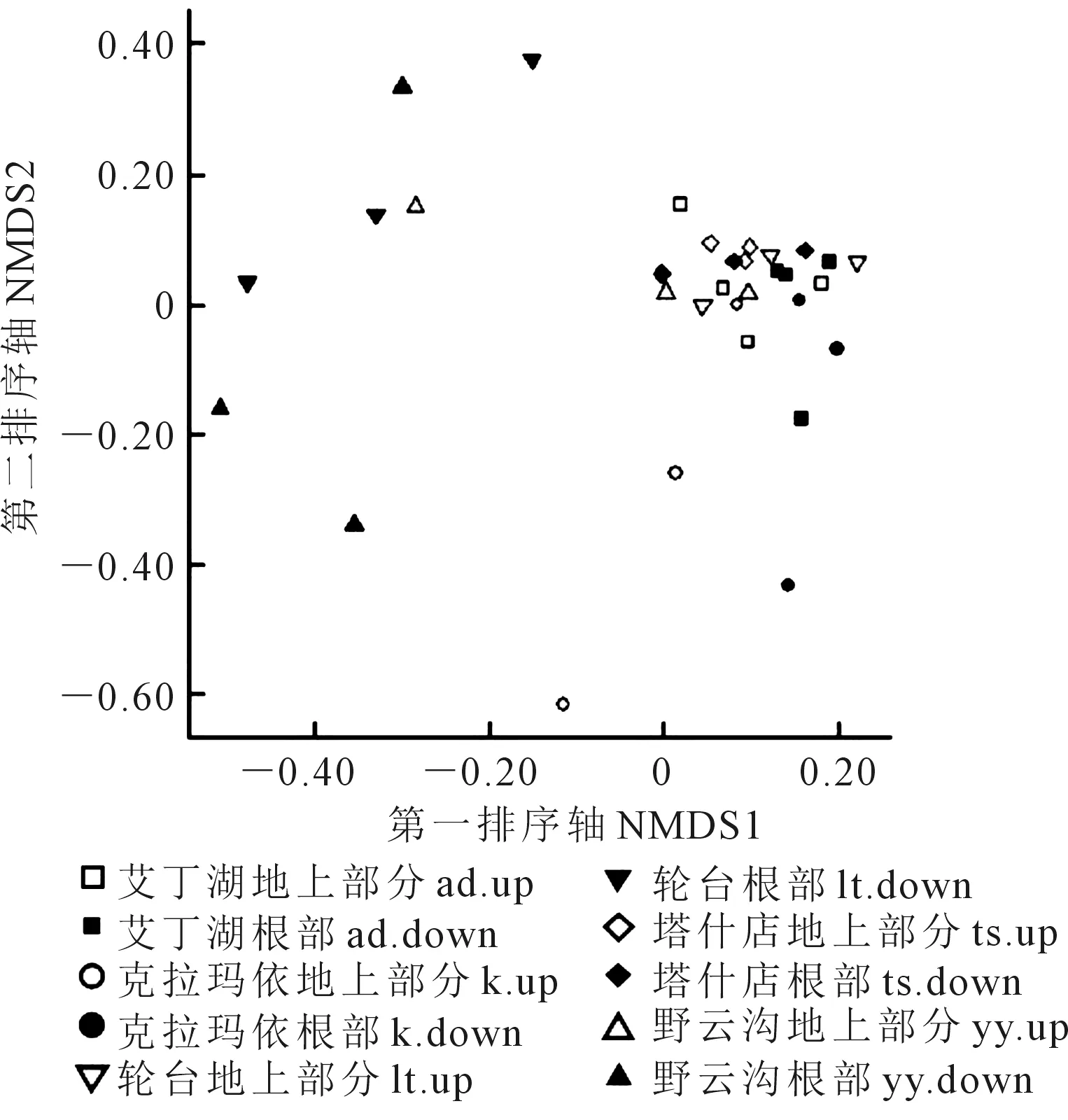
图5 内生真菌群落NMDS分析(ANOSIM:R=0.2756 ,P=0.001 )

表6 土壤样品理化性质
将各样本细菌群落的主要门(top 10)及环境因子进行冗余分析(RDA),发现第一排序轴(RDA-1)对所有环境因子的解释率为64.88%,第二排序轴(RDA-2)解释率为30.73%,钠离子(Na+)、速效磷(AP)、钙离子(Ca2+)、可溶性氮(SN)是影响细菌群落的主要因子;土壤理化性质间呈正相关关系。钠离子(Na+)与Firmicutes、Deinococcus-Thermus、Acidobacteria显著正相关;速效磷(AP)、钙离子(Ca2+)、可溶性氮(SN)与Firmicutes、Proteobacteria正相关(图6)。除钠离子(Na+)外(P=0.022),其他环境因子对优势细菌门水平的影响均不显著。
对各样本内生真菌主要门(top 10)及环境因子进行冗余分析(RDA),发现第一排序轴(RDA-1)对所有环境因子的解释率为95.87%,第二排序轴(RDA-2)解释率为4.00%,氯离子(Cl-)、可溶性氮(SN)、pH、电导率(EC)是影响真菌群落的主要因子。氯离子(Cl-)、电导率(EC)与Mortierellomycota、Mucoromycota、Glomeromycota以及其他门呈正相关关系,其中,氯离子(Cl-)的影响较显著(P=0.03)。pH除与Ascomycota呈正相关关系外,与其他门和环境因子均为负相关,但影响不显著(图7)。
3 讨 论
盐碱地因其含盐量高、碱化严重、养分贫瘠、易板结、透气性差等特点,使得大多数植物和微生物难以生存。盐生植物可在盐碱生境中不断吸收盐离子,降低土壤含盐量,增加土壤有机质,从而改良盐碱地土壤性质。然而,单独的植物修复方法存在很多不足,比如修复效率低、专一性不强、只适用于中低浓度环境胁迫等。植物-微生物联合修复成功弥补了单独修复方法存在的缺陷,是一种更加有效的盐碱地修复方式[12]。Bu等[13]研究表明,将从盐地碱蓬中分离到的内生真菌接入水稻(OryzaSativa)后,水稻在Na2CO3胁迫情况下的生长能力和抗氧化性特征显著增强。在盐角草(Salicorniaeuropaea)应对盐胁迫的研究中发现,内生菌可通过增强代谢活性显著提高植物对盐碱条件的适应能力[14]。因此,研究盐生植物内生菌的群落结构及其与植物的共生互作机制,对于盐渍化土壤的改良以及生物资源的开发利用具有重要的实际应用价值。

图6 内生细菌群落组成 (门水平) 与环境因子的冗余分析
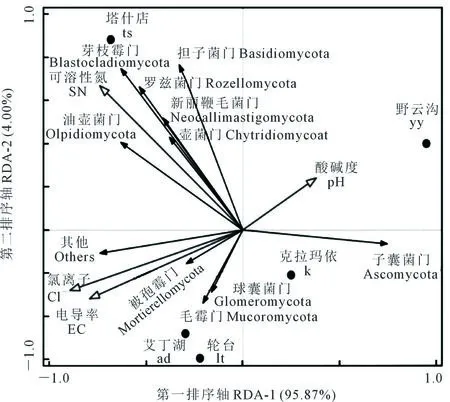
图7 内生真菌群落组成 (门水平) 与环境因子的冗余分析
现有研究表明,植物的根和地上组织之间内生菌群落组成存在显著差异。Dong等[15]通过对三七的内生菌进行研究,发现其根部的内生细菌α多样性显著高于茎和叶,且不同生长阶段根部群落的特有成员数量明显多于叶层群落。Chen等[16]的研究也发现,白首乌叶部内生真菌丰富度及多样性均最高。Da Silva等[17]通过对菜豆的内生菌研究发现,不同品种菜豆内生真菌多样性在器官和根际之间存在差异,根际最高,茎最低。以上研究表明,除了根和地上组织之间生化环境的差异外,二者的定植、共存机制以及组织间的流通限制也是造成群落差异的主要原因[18-19]。本研究通过高通量测序技术对新疆5个不同地区盐生植物盐爪爪进行分析,发现其地上部分的真菌多样性和丰富度明显高于根部,细菌多样性和丰富度则明显低于根部,这一结果与前期对新疆核辐射污染区盐爪爪内生菌群落的报道一致[20]。本研究还发现,不同地区盐爪爪地上部分内生细菌群落相对集中,群落构成相似度高,而根部内生细菌群落较为分散,特异性更高;内生真菌中,yy组、lt组根部及k组地上部分群落较分散,其他地区相对集中,但样品间仍有差异,表明不同采样部位对内生细菌群落构成影响显著,对内生真菌群落影响不显著。Zhang等[21]对极端环境下的穗状双针、苦艾、短柄白珠树及毛梗霉植物进行了研究,指出土壤中的微生物种类通常多于地上组织。因此,根部细菌群落可能是通过土壤迁徙大量聚集形成的,而内生真菌的群落组成则受宿主和环境的限制更大[9]。
优势菌能影响微生物群落的组成和结构,是决定微生物群落平衡的重要因素之一[22]。如Behairi等[23]指出高盐生态系统拥有一个特定的微生物群,可以被盐生植物招募,盐碱干旱土壤中生长的盐角草对招募的微生物群的多样性产生了强烈的影响,其亲和力强归因于内生优势菌嗜盐单胞菌属(Halomonas)。目前多数盐生植物中的主要菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、子囊菌门(Ascomycota)、担子菌门(Basidiomycota)及接合菌门(Zygomycota)[24-25]。本研究中,内生细菌门以变形菌门、厚壁菌门、放线菌门为主,内生真菌门则以子囊菌门、担子菌门为主;属水平上分别以嗜盐单胞菌属(Halomonas),链格孢菌属(Alternaria)为主要优势属。此外,内生细菌和内生真菌中存在的大量未知类群也占据了较大比例。这与大部分藜科植物内生菌的研究结果相似[8,26]。前期对新疆和硕县乌什塔拉乡周边干旱荒漠地区地区的盐爪爪内生真菌群落进行研究,发现炭角菌属(Xylaria)为盐爪爪内生真菌群落的绝对优势种属,这与本研究结果有所不同,因此推测不同区域、不同组织的盐爪爪内生真菌群落组成存在一定差异,可能与菌群的选择偏好性有关[9]。盐单胞菌属(Halomonas)属于中度嗜盐菌,该属的成员大多对环境适应能力强,具有较高的耐盐性能;Kearl等[27]研究发现将该菌接种于苜蓿幼苗后,在1.0% NaCl胁迫的情况下能刺激植株生长,使其恢复正常生长水平。此外盐单胞菌属的菌株还具有特殊的生物化学功能,如产胞外多糖、降解苯酚、降解原油、高产四氢嘧啶等,在工农业生产中发挥了重要作用。链格孢菌(Alternaria)在多种植物中存在,也有促进植株生长和提高盐耐受性能的作用[28];除了具有酶促活性外,该菌还具有多种对抗人类病原微生物的抗菌活性,并能产生氨和吲哚乙酸(IAA)。Khalil等[29]的研究已将链格孢菌用作玉米的生物抑制剂,并取得了良好效果。这表明盐爪爪内生菌中存在具有特殊功能的微生物资源,有很大的发掘和利用潜力。
土壤理化因子是微生物群落结构和组成的主要决定因素。相关研究发现,土壤pH、有机质、含盐量是影响植物内生菌的主要因素[30],但在较高的分类层级上,植物的含盐量及生长阶段对盐生植物内生菌群落组成影响不显著[26]。本研究也发现,钠离子(Na+)、氯离子(Cl-)和电导率(EC)与内生菌中的主要门呈正相关关系。与其他4个地区相比,艾丁湖地区(ad)的钠离子(Na+)、氯离子(Cl-)含量最丰富,群落丰度最高,这可能是因为对耐盐植物而言,盐胁迫可增加根际土壤细菌多样性和生物量[31],而该地区土壤盐分含量显著高于其他地区,盐分的升高促进了耐盐或嗜盐细菌的增殖。土壤内生真菌大部分属于好氧型,土壤含水量过高会抑制其生长与繁殖[32],这可能是造成轮台地区(lt)真菌丰度偏低的主要原因。可见大多数植物内生菌群落组成除受宿主植物的影响外,还受到土壤理化特性的影响[19],两者共同作用导致不同地区盐爪爪内生菌群落组成的差异。此外,盐爪爪是典型的盐生植物,Na是其生长必需元素,盐胁迫可以提高植物中钠离子的含量。Akhter等[33]研究也发现种植盐草能显著降低土壤盐分及pH,有效改善土壤环境及土壤肥力。由此可见,种植盐生植物是盐碱地生物改良的有效方法。
4 结 论
通过对新疆5个盐碱地区的盐爪爪根部和地上部分样品的内生细菌及内生真菌进行分析发现,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)为主要细菌门,属水平上,嗜盐单胞菌属(Halomonas)的相对丰度最高;子囊菌门(Ascomycota)、担子菌门(Basidiomycota)为主要真菌门,属水平上,链格孢菌属(Alternaria)相对丰度最高。土壤中的钠离子(Na+)与细菌Firmicutes、Deinococcus-Thermus、Acidobacteria呈显著正相关关系,氯离子(Cl-)、电导率(EC)与真菌Mortierellomycota、Mucoromycota、Glomeromycota和其他门呈显著正相关关系。不同地区、不同组织的盐爪爪内生群落结构存在显著差异,且与土壤盐碱化相关。研究结果初步揭示了新疆盐碱地区盐爪爪内生菌群落结构组成与分布格局,对深入阐明内生菌在生态系统的演替、生物多样性及其生态功能具有重要的科学意义。

