压力及粪肠球菌上清液对人牙周膜细胞骨吸收相关因子表达的影响研究
孟磊 王占宙 路瑶 林玉红 王法程 卢志山
难治性根尖周炎是牙髓病临床治疗的难点,临床常表现为牙槽骨进行性破坏和根尖周炎性肉芽组织形成。众所周知,粪肠球菌及其产物是难治性根尖周炎的主要致病因素。在根尖周炎的初始阶段,炎症仅限于根尖牙周膜间隙,不伴有骨吸收。然而,长期存在的细菌挑战可能导致骨吸收最终发展为慢性根尖周炎[1]。
核因子κ B受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)/骨保护素(osteoprotegerin,OPG)通路被认为是骨吸收的中枢调节系统[2],在骨重塑调控中发挥重要作用。已有研究表明,骨吸收相关因子RANKL和OPG在大鼠根尖周病变中与牙槽骨吸收高度相关[3]。根管再治疗后的根尖周病变被归类为存在根内感染或可能影响愈合的根外因素的持续性病变,持续存在的根尖周病变中RANKL和OPG基因水平较高,且RANKL表达高于OPG[4]。王琛玮等[5]研究表明咬合控制与牙周病治疗关系密切,虽然咬合不是牙周炎发病始动因素,但大量临床证据提示创伤性咬合力是导致牙周病发展加重的危险因素。目前,关于粪肠球菌和咬合力诱导人牙周膜细胞(humanperiodontal ligament cells,hPDLCs)产生骨吸收效应的研究较少,本研究通过体外加压模拟咀嚼受力状态下粪肠球菌上清液诱导的hPDLCs的骨吸收过程,探讨压力及粪肠球菌上清液在难治性根尖周炎形成中的作用。
1 材料与方法
1.1 主要试剂与设备
I型胶原酶(Sigma,美国);低糖DMEM细胞培养液、胎牛血清FBS(HyClone公司,美国);反转录试剂盒(PrimeScript®RT reagent Kit Perfect Real Time)、SYBR®Premix Ex TaqTMII(Perfect Real Time) (TaKaRa,日本);人sRANKL、OPG酶联免疫吸附试验试剂盒(R&D Systems,美国);Spectra Max M2酶标仪(Molecular Devices,美国);Eppendorf PCR扩增仪(Eppendorf公司,德国);Rotor Gene 3000型实时荧光定量PCR仪(Corbett公司,澳大利亚)。
1.2 粪肠球菌上清液的制备
将粪肠球菌标准株ATCC29212复苏24 h后接种于BHI液体培养基中,在37 ℃恒温培养箱培养至A600=0.5时停止培养。用5 000×g离心力在4 ℃下离心15 min,并应用0.2 μm孔径滤器过滤获取粪肠球菌上清液,将该上清液在细胞培养基中稀释,最终稀释度为5%、10%、20%和40%。
1.3 hPDLCs细胞株的培养
本项研究已通过滨州医学院附属烟台市口腔医院伦理委员会的审批(批号:2019-001)。选择2019 年5~9 月期间在烟台市口腔医院口腔颌面外科门诊就诊的11~15 岁患者,征得患者本人及家属同意的情况下,收集其因正畸需要而拔除的健康前磨牙。无菌手术刀片刮取牙根中1/3 处的牙周膜,采用酶消化联合组织块法培养原代细胞,取4~6 代用于后续实验。
1.4 细胞增殖抑制试验
采用CCK-8法测定不同浓度粪肠球菌上清液对hPDLCs细胞增殖活性的影响。取第4~6 代对数生长期的hPDLCs,用含10% FBS的DMEM培养液制备细胞悬液并在计数板上调整细胞浓度为5×104/mL。将100 μL的细胞悬液等份接种到96 孔板中。设1 个对照组和4 个实验组,培养24 h细胞贴壁后弃去上清液,分别加入浓度为0%、5%、10%、20%、40%的粪肠球菌上清液,每组设5 个复孔。继续培养12和24 h时,每孔加入10 μL CCK溶液并孵育4 h。用酶标仪测定在450 nm处的吸光度值,计算每组均值,比较不同浓度的粪肠球菌上清液对hPDLCs增殖活性的影响。
1.5 压力状态下hPDLCs的形态观察
将4~6 代hPDLCs以5×105/mL浓度接种于6 孔板,每孔 2 mL培养液,培养 24 h贴壁,使用加力附件与圆形盖玻片放于hPDLCs上,调节细胞的受力分别为0、49、196、392 Pa,然后再置于CO2培养箱中孵育24 h,倒置显微镜下观察每组细胞形态。
1.6 RT-PCR检测压力状态下hPDLCs RANKL和OPGmRNA的表达
hPDLCs贴壁培养24 h后,弃培养液PBS冲洗后,加入不含粪肠球菌上清液的培养液1 mL作为对照组,加入含10%粪肠球菌上清液作为诱导组,加载加力装置,调节细胞的受力分别为0、49、196、392 Pa,每组设置3 个复孔,于CO2培养箱中孵育24 h,收集细胞,使用TRIzol法提取细胞总RNA,紫外分光光度计测定RNA质量与浓度,反转录成cDNA。以GAPDH为内参,所有引物设计合成均由上海Sangon公司完成(表1)。按照实时荧光定量PCR说明书,进行PCR反应扩增。

表1 内参基因和目的基因引物序列
1.7 ELISA检测hPDLCs RANKL和OPG蛋白的表达
收集各组细胞上清液,按照ELISA操作规程,各组取100 μL细胞培养液,测定sRANKL和OPG蛋白含量。
1.8 统计学分析
实验数据采用SPSS 13.0统计软件对结果数据进行统计学分析。选用单因素方差系统分析后,SNK-q检验比较各组之间的差异,以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度粪肠球菌上清液对hPDLCs的细胞增殖活性的影响
CCK-8法测定结果显示,培养12 h后,20%和40%的粪肠球菌上清液使hPDLCs增殖速率减慢,与对照组相比差异具有统计学意义(P<0.05)。培养24 h后,10%、20%和40%的粪肠球菌上清液均使hPDLCs增殖速率减慢,差异具有统计学意义(P<0.05)(图1)。
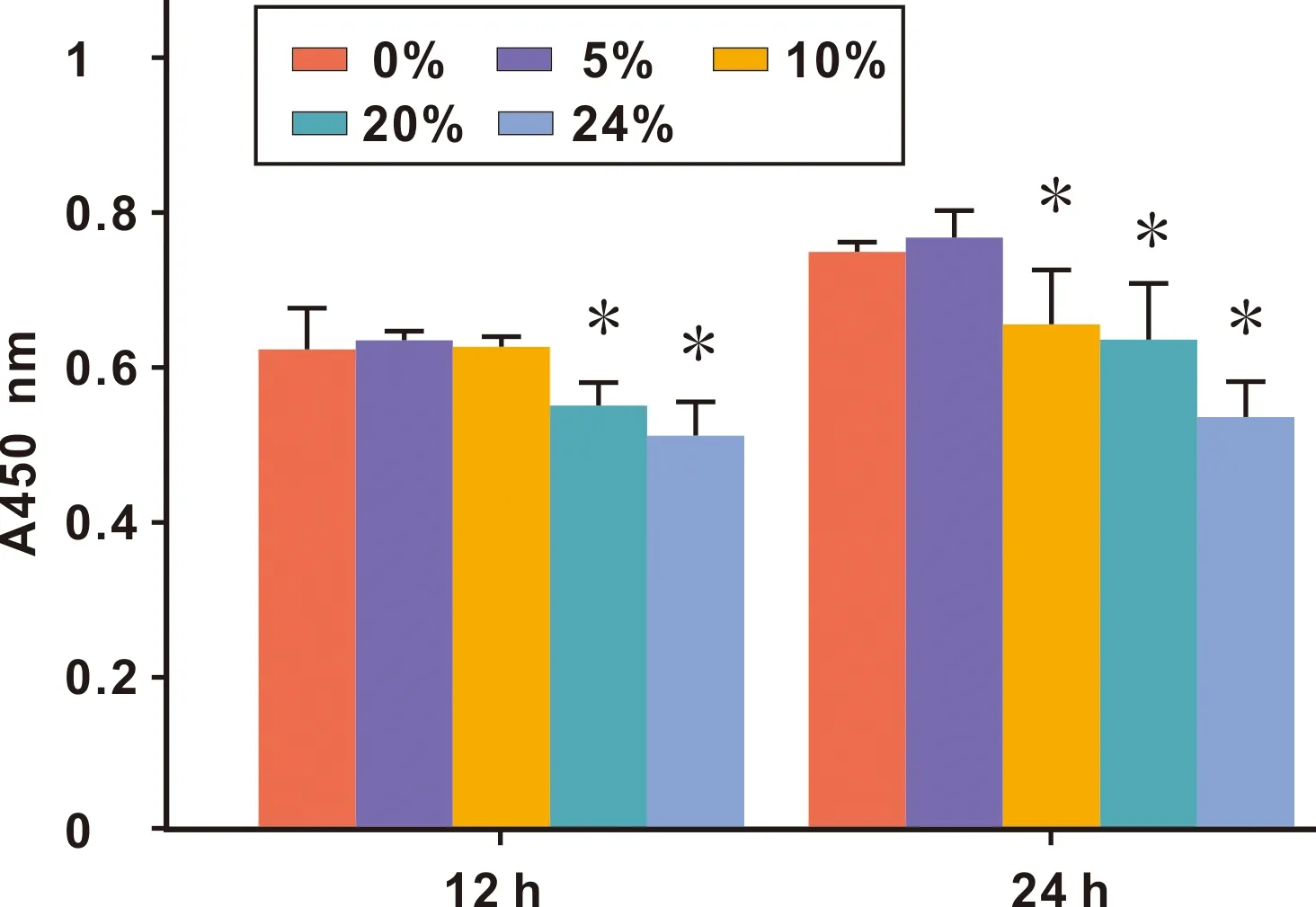
图1 不同浓度的粪肠球菌上清液对hPDLCs增殖水平的影响 与相同时间点0%组相比,P<0.05)
2.2 压力状态下hPDLCs的形态观察
倒置显微镜下细胞紧密贴附于6 孔板底,生长状态良好,hPDLCs细胞胞体较小,呈长梭形,分布较均匀。施加49 Pa压力后,hPDLCs无明显形态改变,施加196 Pa压力后,hPDLCs胞体变大,突起增多。施加392 Pa压力后,hPDLCs胞体明显变大,呈突起的纺锤形或星形的扁平分布(图2)。

图2 hPDLCs受压后的形态变化 (倒置显微镜,×100)
2.3 RT-PCR检测各组RANKL和OPG基因表达
RT-PCR结果显示,施加压力大于等于196 Pa时,hPDLCs RANKL mRNA表达会增多,与对照组相比差异有统计学意义(P<0.05);压力392 Pa或者粪肠球菌上清液+196 Pa压力,可致hPDLCs OPG mRNA表达明显减少,差异均具有统计学意义(P<0.05)(图3)。

图3 各组hPDLCs RANKL和OPGmRNA表达变化 与相同时间点0 Pa组相比,P<0.05) (RT- PCR)
2.4 ELISA检测各组sRANKL和OPG蛋白表达
ELISA结果显示,施加压力392 Pa或者粪肠球菌上清液+196 Pa压力,可致hPDLCs RANKL蛋白表达明显增多,差异具有统计学意义(P<0.05)。压力392 Pa或者粪肠球菌上清液+196 Mp压力,可致hPDLCs OPG蛋白表达明显减少,差异具有统计学意义(P<0.05)(图4)。
3 讨 论
Shearer等[6]研究表明,粪肠球菌上清液具有细胞毒性,可抑制病毒生长。本实验将不同浓度的粪肠球菌上清液与hPDLCs共培养,发现粪肠球菌上清液可降低hPDLCs的增殖速率,在培养24 h后,粪肠球菌上清液浓度≥10%对hPDLCs的抑制作用显著。因此,选用10%的粪肠球菌上清液参与后期的骨吸收相关研究。
牙周膜作为根尖区天然免疫系统的第一道防线,其增强的血管密度、干细胞能力和对炎症做出反应的常驻细胞使其能够更有力地抵御生物威胁[7]。牙周膜能承受生理性咀嚼,机械应力对健康牙周组织的生理功能至关重要,牙周膜通过机械感觉信号系统和牙齿支持在调节骨重建、咬合负荷分布方面起着重要作用[8]。虽然悬吊式PDL的作用是调节对骨的中等负荷,但PDL自身较高的压应力和应变可以启动破骨活性的生物序列,从而影响邻近骨的变化[9]。
hPDLCs是根尖区最重要的细胞之一,是在根尖周局部炎症过程中发挥着关键的作用。体外研究表明,在一定的生理应激范围内,健康hPDLCs能发生成骨分化[10]。然而,更高的牙齿负荷和PDL中相关的应力增加会导致局部缺氧和液体流动,从而引发无菌性炎症反应[11],诱发破骨细胞因子,引起牙周组织和骨组织损伤[12]。本实验参照Nakajima等[13]的二维重力加载加压培养模型,选择49、196和392 Pa作为加载压力大小。通过倒置显微镜观察发现hPDLCs受到196 Pa和392 Pa压力后细胞形态发生改变,突起增多,这提示细胞分泌能力增强,可能与细胞受力后炎症、骨吸收等各种因子高表达有关。
破骨细胞的形成主要受RANK/RANKL通路激活的控制。RANKL负责破骨细胞的分化、激活和存活,通过增加功能性破骨细胞的数量和活性来促进骨吸收[14]。这一过程可以被其可溶性拮抗剂骨保护素(OPG)所抑制,OPG可通与过RANKL结合来抵消RANKL的作用,因此,OPG可以阻止破骨细胞的分化和活化[15]。本研究结果显示细胞在受压力过大(≥196 Pa),RANKL表达增加,OPG表达减小,且在有细菌上清液存在情况下趋势更明显。
RANKL有两种不同的形式:可溶性RANKL(sRANKL)和膜结合RANKL(mRANKL)。sRANKL和mRANKL的主要区别在于,mRANKL是在细胞膜上以结合的形式被发现的,并通过细胞-细胞接触发挥作用,而sRANKL从细胞的细胞膜上分离出来,在细胞外环境中被发现,它通过扩散参与破骨细胞的形成,而不需要细胞间的沟通[16]。mRANKL和sRANKL都有助于破骨细胞的形成[17]。有报道称sRANKL不像mRANKL那样在破骨细胞形成中起主要作用,但它是破骨细胞成熟和正常功能[18]所必需的。尽管这两种形式都具有生物活性,但膜结合蛋白似乎是一种稳态形式,而sRANKL的产生则是病理/非生理条件下的信号[19]。因此,本研究在蛋白表达着重检测sRANKL,研究发现蛋白表达趋势与mRNA基本一致,在196 Pa压力组,sRANKL的增加无统计学意义,可能与sRANKL的延时分泌有一定关系。本研究采用重物静压力加载装置,此方法在加力大小的控制上较精准。但在实际咀嚼过程中,牙周膜所承受的力是不连续的,并非不可改变。因此本实验采用的加力装置存在一定不足。
研究表明过大压力可显著增加骨吸收因子的释放,粪肠球菌上清液可进一步加重这种作用。这为难治性根尖周炎治疗过程中临床调以及愈合期的其他治疗(例如正畸、修复等)提供临床参考。

