霉菌对棉织物的生物腐蚀特性
陶娅妃 任泽华 王梦娣 朱博 刘建立


摘 要:为了研究霉菌对棉织物的腐蚀特性,从真实霉变的棉T恤衫、衬衫和毛巾上分离纯化霉菌微生物。根据形态学和ITS序列分析将分离纯化的5种霉菌鉴定为黑曲霉、土曲霉、桔青霉、芽枝状枝孢霉和杂色曲霉。并将纯化后的霉菌微生物制成孢子悬浮液接种到纯棉漂白织物上,在富集营养培养基上进行霉菌生物腐蚀实验。采用扫描电镜(SEM)、傅里叶红外(FT-IR)和X射线衍射(XRD)对腐蚀前后棉织物的微观形貌、分子结构和结晶度进行表征,讨论5种霉菌微生物对棉织物的生物腐蚀特性。结果表明:5种霉菌均使棉纤维上出现腐蚀造成的纵纹和孔洞,其中桔青霉、土曲霉和芽枝状枝孢霉对棉织物的生物腐蚀较严重。研究结果可为阐明霉菌对棉织物的生物腐蚀机理提供支持,为抑制棉织物生物腐蚀提供参考。
关键词:棉织物;菌株形态学;ITS序列;霉菌;微生物腐蚀;
中图分类号:TS107.4
文献标志码:A
文章编号:1009-265X(2023)04-0164-09
收稿日期:2022-11-30
网络出版日期:2023-02-21
作者简介:陶娅妃(1998—),女,重庆酉阳人,硕士研究生,主要从事纺织品微生物技术方面的研究。
通信作者:刘建立,E-mail:jian-li.liu@hotmail.com
棉纤维主要组成成分是纤维素,纤维素是由葡萄糖小分子通过β-1,4糖甙键组成的大分子多糖,除此之还包括可溶性糖、蜡质、蛋白质、脂肪、灰分等伴生物[1],含有丰富的碳源,为微生物的生长繁殖提供了能量来源。因此,棉衣物在存储时,容易发生霉变。霉菌在生长过程中会分泌有机酸和一系列胞外酶,为自己创造适宜的生长环境。这些分泌物会引起纤维素大分子之间的键断裂,在纤维素系列酶的协同作用下形成葡萄糖小分子,成为霉菌的营养物质,使得霉菌在棉织物上快速生长定殖,在织物表面形成霉斑,造成有色织物褪色和引起织物机械性能降低[2]。因此从微生物对棉织物的腐蚀现象出发,阐明腐蚀机理是至关重要的。
纺织品的生物腐蚀主要是由霉菌微生物导致[2-3],Kavkler等[4-5]将从博物馆纺织品文物上分离纯化后的霉菌微生物接种到毛织物和棉织物上,研究选定的霉菌对人工老化和未老化纺织品的生物腐蚀特性。Abdelrahman等[6]将具有纤维素分解活性的4种真菌接种到不同老化条件下的亚麻织物上,得出真菌对亚麻织物腐蚀机制主要表现为水解、氧化、解聚和再结晶过程。曾渊[7]将丝绸文物上分离出的霉菌接种到现代丝绸织物上,探究霉菌微生物对丝织品结构性能的影响,得出米曲霉对丝织物的影响较大。目前,国内外对于棉纺织品上的霉菌种类及其对棉织物的生物腐蚀现象研究较少,因此本文从真实霉变棉织物分离纯化霉菌,采用显微形态学观察与 ITS序列分析相结合的方法對纯化后的菌株进行鉴定,并将纯化的霉菌菌株制成孢子悬浮液接种到棉织物上,进行生物腐蚀实验,通过仪器分析技术对腐蚀前后棉织物的微观形貌、分子结构等进行表征,研究霉菌对棉织物的生物腐蚀特性。
1 实 验
1.1 实验材料
以肉眼可见的霉变为标准,收集霉变棉织物,其中包括棉T恤衫1件、棉衬衫1件和棉毛巾2条。
用于接种的纯棉漂白织物试样:25 tex×25 tex平纹织物(中恒大耀纺织科技有限公司),经向密度为524根/10 cm,纬向密度为283根/10 cm,克重为120 g/m2;将其裁剪成2.5 cm×5.0 cm大小的长方形试样若干。
富集营养培养基:称取固体无机盐琼脂培养基干粉(杭州百思生物技术有限公司)27.8 g,葡萄糖(中国医药集团有限公司)5.0 g,加入蒸馏水1000 mL后加热溶解。
马铃薯葡萄糖琼脂培养基:40.1 g马铃薯葡萄糖琼脂培养基干粉(中国医药集团有限公司),1000 mL蒸馏水,加热溶解。
无菌水:0.05 g吐温80(中国医药集团有限公司),1000 mL去离子水,充分混匀。
PBS缓冲液:10.0 g磷酸盐缓冲液速溶颗粒(上海沃凯化学试剂有限公司),1000 mL去离子水,加热溶解。
上述棉织物试样、培养基及试剂均采用 121 ℃高压蒸汽灭菌 20 min后待用[8]。
1.2 实验设备
DZF-6050型真空干燥箱(上海曼仪科学仪器有限公司)、YXQ-LS-75G型立式压力蒸汽灭菌锅(上海博讯实业有限公司)、NU-425-400S型生物安全柜(美国Nuair公司)、MJ-1608-Ⅱ型霉菌培养箱(上海跃进医疗器械有限公司)、AX4202ZH/型电子天平、VHX-500超景深三维数码显微镜(基恩士公司)、Su1510 型扫描电子显微镜(日本日立化学仪器有限公司)、Nicolet iS10型傅里叶红外光谱仪(美国赛默飞世尔科技(中国)有限公司)、D2PHASER X型射线衍射仪(德国布鲁克AXS 有限公司)、BCD-312WDPV冰箱(青岛海尔股份有限公司)。
1.3 霉变菌株的分离和鉴定
1.3.1 霉变菌株分离纯化
参照GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》中霉菌分离纯化的方法。从收集到的霉变纺织品上各取5 g,剪碎后加入装有180 mL PBS缓冲液的摇瓶中,(28±2)℃、180 r/min振荡培养24 h制成菌悬液,稀释不同梯度后在PDA培养基平板中划线,于(28±2)℃、85% RH霉菌培养箱中恒温培养5~7 d。根据菌落的形态、大小及颜色,挑选不同的单菌落接种于PDA培养基中纯化3次,得到形态单一的菌落,最后接种试管斜面,于4 ℃冰箱保存备用[9]。
1.3.2 菌落形态学鉴定
采用点植法将纯化后的菌株接种到PDA培养基平板上,28 ℃下于霉菌培养箱中倒置培养7 d,记录菌株的生长情况和形态特征。根据透明胶带镜检法制样,并在超景深三维数码显微镜下观察霉菌的菌丝形态和孢子形状,根据《真菌鉴定手册》[10]进行初步鉴定。
1.3.3 PCR扩增及测序
扩增真菌ITS序列使用引物ITSl (5'-TCCGTA GGTGAACCTGCGG-3')和ITS4 (5'-TCCTCCGCTTAT TGATATGC-3')[11~13]。PCR反应体系为50 μL,组分为水35.5 μL,模板引物1 μL,引物ITS1和ITS4各1 μL,dNTP(10 mMol/L) 1 μL,Taq缓冲液 5 μL,MgCl2(25 mMol/L) 5 μL,Taq酶(5 U/μL)0.5 μL。PCR反应条件: 95 ℃时预变性3 min;94 ℃时变性20 s;50~60 ℃时退火20 s; 72 ℃时延伸20~50 s;35个循环;在72 ℃时延伸5 min。委托天霖生物科技(上海)有限公司对霉变菌株进行序列测定。测序得到的菌株基因序列输入NCBI的核酸序列数据库,使用在线序列比对搜索工具BLAST进行同源性比对分析,选取与比对菌株序列同源性超过90%且已知分类地位的真菌菌株[14-15]。
1.4 生物腐蚀实验
1.4.1 孢子液制备
参照GB/T 24346—2009《纺织品 防霉性能的评价》在生物安全柜操作台上,将纯化后的霉菌接种于PDA培养基,霉菌培养箱中( 28±2) ℃下培养至培养基表面长出成熟的霉菌孢子。用移液枪多次吸取少量无菌水,不断冲洗菌落表面从而得到新鲜的孢子原液。以4000 r/min离心孢子原液,倒掉上层清液,用无菌水洗涤沉淀,再离心,重复洗涤3次。最后用无菌水稀释,漩涡振荡器振荡,使孢子在无菌水中分散均匀,用血球计数板测定孢子含量,使孢子液浓度为1×106~5×106个/mL。
1.4.2 接种孢子液
参照杨弢[16]的方法,在无机盐培养基中加入5%葡萄糖作为碳源的富集营养培养基(模拟织物中常见的污染,例如灰尘、皮脂等)。将冷却至50 ℃的富集营养培养基倒入直径为9 cm的无菌培养皿中,培养基冷却凝固后制得富集营养培养皿。将已灭菌的棉织物试样放置于富集营养培养皿中,250 μL霉菌孢子液接种到试样表面(每个试样4个平行),封口后放入培养箱中( 28±2 ) ℃下恒温培养,使霉菌在样品上生长,4周后将生霉棉织物取出作为实验组,不添加培养基直接接种孢子液作为对照组,不做任何处理的棉织物作为空白样。所有样品通过去离子水冲洗掉表面菌丝,与空白样一起于灭菌锅内灭菌15 min,以终止真菌生长,避免污染分析设备的风险,随后将其风干用于分析测试。
1.4.3 测试与表征
形態观察:通过SEM观察棉纤维的微观结构,将样品裁剪成0.5 cm×0.5 cm,通过导电胶固定到工作台上后喷金,工作电压10 kV,高真空模式下放大不同倍数观察霉菌微生物对样品的腐蚀情况。
傅里叶变换红外光谱:在ATR附件上对样品进行测试,波数扫描范围为4000~400 cm-1,共扫描32次,对输出的数据作图处理,用于分析棉纤维化学结构变化。
X射线衍射:在X射线衍射仪对样品进行X射线衍射,测试条件为仪器管电压30 kV,管电流10 mA,扫描速度为4(°)/min,在2θ为5°~50°范围内读取数据,步宽为0.1,用于分析棉纤维结晶度变化。
2 结果与分析
2.1 霉变鉴定实验结果分析
2.1.1 菌株形态学观察
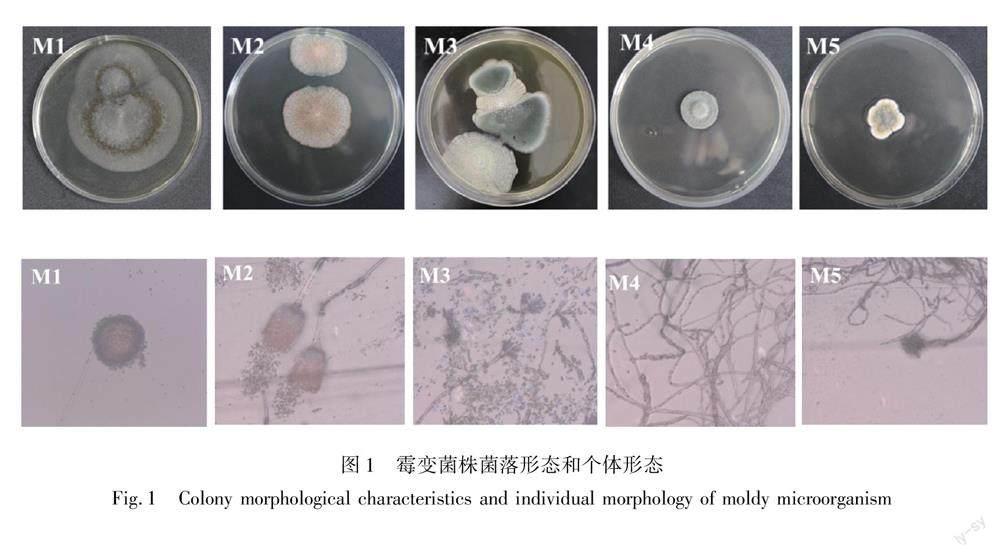
通过PDA分离纯化,从霉变毛巾上共分离出5种霉菌,分别编号为M1、M2、M3、M4、M5,其菌落形态和个体形态描述如表1所示。根据霉菌生长特征,共分离得到5种霉菌。各菌株在PDA培养基上的菌落形态和个体形态(超景深显微镜放大1000倍观察)如图1所示。
编号菌落形态描述个体形态描述
M1培养基上快速蔓延生长,气生菌丝呈厚绒状,表面生成黑色的孢子。菌落呈绒状,表面有稀疏的黑色颗粒,培养基反面无色培养基内菌丝细长有横隔,分生孢子梗无横隔,分生孢子头呈菊花状
M2生长先快后慢,一段时间后菌落大小不再增大。菌落表面呈粉末状,背面呈褐色,中间颜色较深,以树枝状向外辐射生长培养基内透明菌丝有横隔和足细胞,分生孢子头大
M3生长初期呈白色菌落,随着时间的延长,菌丝中间慢慢呈绿色。菌落表面呈粉末颗粒状,菌落背面呈黄色菌丝透明有横隔,未观察到足细胞,分生孢子头着生在扫帚状分枝上,孢子彼此之间连成串
M4培养基表面生长较缓慢,菌落大小有限。菌落表面呈绒毛状,中间较高隆起菌丝细长有横隔,有足细胞,菌丝交错形成菌落,分生孢子未着生在特殊分生孢子梗上
M5菌落大小有限,且萌发速度比较缓慢。菌落呈绒毛状,中间隆起,菌落表面颜色有三种,从里至外分别为绿色、黄色和白色菌丝透明细长,有横隔,分生孢子着生在顶囊的小梗上
2.1.2 分子生物学鉴定结果
根据委托公司的测序结果,将得到的序列按照1.3.3的方法进行比对分析鉴定霉菌微生物种类,鉴定结果如表2所示,提交序列与数据库中参照序列的同源性大于90%,可视为同一种。
2.2 微生物腐蚀实验结果分析
2.2.1 腐蚀试样表面形态分析
肉眼观察接种霉菌4周后的无营养培养基试样如图2所示,对照组试样表面没有观察到霉菌生长。但是通过SEM,可以观察到桔青霉和土曲霉的孢子在纤维之间生长,可能是由于霉菌在棉织物上不能直接获取所需的营养物质,生长萌发速度较慢,短时间内不能在织物上大量繁殖生长,但由于纤维形成的微环境通常较温暖,湿度稳定,且曲霉属和青霉属
霉菌具有寡营养性,对环境湿度要求低,因此其孢子能在纤维之间小范围生长繁殖[2]。富集营养培养基上试样表面霉菌生长茂盛,如图3所示,其中接种土曲霉、桔青霉和芽枝状枝孢霉菌的试样表面被霉菌完全覆盖,形成明显的菌落,可见成熟的孢子。接种杂色曲霉的试样表面长满了白色的绒毛,未形成明显的菌落。接种黑曲霉的试样表面清晰可见,霉菌生长主要集中在试样4周,且霉菌生长的地方出现明显的颜色变化。
在不提供培养基的对照组样品中,接种桔青霉和土曲霉试样中孢子在纤维之间生长,但对棉纤维表面未造成明显损伤,如图4所示。未接种霉菌的试样表面光滑,而在接种霉菌的试样中观察到纤维表面出现纵纹的机械损伤,是由于微纤维之间的键断裂造成,如图5(放大1000倍)所示。通过SEM观察,5种霉菌微生物对棉纤维表面都造成一定的损伤,其中接种桔青霉的纤维表面存在明显的机械损伤,纤维表面出现大量纵纹和孔洞;接种土曲霉的纤维出现原纤散开的现象,且有明显的孔洞。研究表明,曲霉属、青霉属等霉菌在生长过程中会分泌胞外酶,其中的纤维素酶会造成棉纤维降解成葡萄糖小分子被霉菌利用,因此造成纤维的缺失,即孔洞的形成[2-3]。接种芽枝状枝孢霉的织物也受到了严重的破坏,肉眼观察到棉织物表面几乎被霉菌完全覆盖,其形态已经无法辨认,SEM下观察到纤维表面存在许多颗粒状物质,可能是由于棉纤维的主要成分纤维素被霉菌代谢分泌的有机酸分解,造成其中的β-1,4糖苷键遭受不同程度破坏并流失,被分解的物质重新在纤维材料表面聚集。接种杂色曲霉的织物在扫描电镜下观察到纤维部分表面被膜状物质覆盖,部分纤维表面出现纵纹,菌丝在纤维缝隙之间广泛存在。接种黑曲霉的纤维表面存在大量孢子,但表面损伤较轻微。
2.2.2 红外光谱分析
红外光谱常用于分析有机化合物结构,不同的化学基团在红外谱图上都有其特定的吸收区域,从而提供了纤维素的官能团信息。因此,可以通过微生物腐蚀前后棉纤维的红外光谱变化,来反映微生物腐蚀导致的纤维素纤维分子结构的变化。
从红外光谱图图6中看出,霉菌腐蚀织物前后具有相似的红外光谱,但在纤维素纤维的特定波数段存在差异,其中分子内羟基—OH伸缩振动谱带在波数3400~3500 cm-1处,空白织物在该波段的吸收峰比较强(对照样织物变化极微,这里不做讨论),表明其羟基基团比较多;碳水化合物中C—O—C不对称伸缩振动的吸收峰位于1040~1060 cm-1处,实验组在该波段吸收峰比空白样的低,表明棉纤维部分1,4-苷键断裂。
接种桔青霉、芽枝枝状孢霉和杂色曲霉试样的红外谱图中观察到2350~2360 cm-1处出现吸收峰,可能是由于霉菌微生物分泌的羧酸之间形成的氢键而缔合形成的羰基;接种土曲霉的试样在1738 cm-1处出现吸收峰,属于羰基带的指纹区域,可能是由于纤维素纤维解聚导致的[5]。接种芽枝枝状孢霉的试样的红外谱图在1538 cm-1处出现吸收峰,可能是水分子羟基的弯曲振动[17];所有试样与空白样相比,在1640 cm-1处吸收峰均变强,这是水分引起的吸收峰,因为霉菌微生物生长过程中会分泌胞外酶和有机酸等物质,协同作用下破坏纤维的结晶区,导致纤维结晶度下降,使得无定形区增加,纤维素纤维含水增多[2,18]。
2.2.3 XRD分析
图7表明接种不同霉菌的棉织物的特征衍射峰基本没发生变化,但衍射强度出现了明显的变化。经验结晶指数CrI用Segal经验法[19]式(1)计算,未接种霉菌的棉纤维结晶度为86.37%,实验组样品的结晶度都有一定程度的下降,其中接种桔青霉的棉纤维结晶度下降到81.65%、接种土曲霉的棉纤维结晶度下降至82.75%,接种芽枝状枝孢霉的棉纤维结晶度下降为83.59%,3种霉菌导致棉纤维的结晶度损失率较高,接种黑曲霉和杂色曲霉的棉纤维结晶度变化不明显,结合SEM和红外光谱分析可知桔青霉、土曲霉和芽枝状枝孢霉对棉织物的生物腐蚀腐蚀比较严重,可针对该类霉菌微生物生长特性开发高效的防霉试剂,抑制其在棉织物上生长繁殖。
CrI%=I002-IamI002×100(1)
式中:I002为002面的最大衍射强度,Iam为2θ为18°时的衍射强度,对应无定形区的衍射强度。
3 结 论
本文从真实霉变纺织品上分离纯化霉菌微生物,得到 5种霉菌,利用形态学和ITS序列分析鉴定为黑曲霉、土曲霉、桔青霉、芽枝状枝孢霉和杂色曲霉。将5种霉菌制成孢子悬浮液并接种到棉织物上,
进行了生物腐蚀实验。通过仪器分析接种试样前后表面形态和化学结构的变化,从而研究5种霉菌微生物对棉织物的生物腐蚀特性。通过SEM观察棉纤维表面形态结构,发现5种霉菌均在纤维间生长,且对纤维表面造成了不同程度的机械损伤,其中接种桔青霉和土曲霉对纤维表面腐蚀严重,试样纤维表面出现大量纵纹和孔洞,而黑曲霉对纤维破坏较小。傅里叶红外光谱表明接种霉菌的棉纤维部分1,4-苷键断裂,这会引起纤维素结晶度的下降,而X射線衍射结果也验证了这一点。接种5种霉菌的棉均纤维素结晶度出现了下降,其中桔青霉和土曲霉对棉纤维的结晶度影响较大,使得棉纤维结晶度从86.37%分别下降到81.65%和82.75%。
参考文献:
[1]张海泉.纺织材料学[M].北京:中国纺织出版社,2013:27-41.
ZHANG Haiquan. Textile Materials[M]. Beijing: China Textile & Apparel Press, 2013:27-41.
[2]GUTAROWSKA B. Moulds in biodeterioration of technical materials[J]. Folia Biologica et Oecologica, 2014, 10: 27-39.
[3]WALENTOWSKA J, KOZOWSKI R M. Prevention of Fungal Growth in Natural Fibres[M]. Handbook of Natural Fibres. Amsterdam: Elsevier, 2012: 532-549.
[4]KAVKLER K, DEMAR A. Impact of fungi on contemporary and accelerated aged wool fibres[J]. Polymer Degradation and Stability, 2012, 97(5): 786-792.
[5]KAVKLER K, GUNDE CIMERMAN N, ZALAR P, et al. Deterioration of contemporary and artificially aged cotton by selected fungal species[J]. Polymer Degradation and Stability, 2015, 113: 1-9.
[6]ABDELRAHMAN E, KOSUKE T, YASUNORI MATSUD-AFUNGAL, et al. Biodeterioration of artificial aged linen textile: Evaluation by microscopic, spectroscopic and viscometric methods[J]. Mediterranean Archaeology and Archaeometry, 2018, 18 (3): 103-120.
[7]曾渊.丝织品生物老化以及结构性能研究[D].杭州:浙江理工大学,2017:31-42.
ZENG Yuan. Biodegradation of Silk Fabrics and Their Structure and Properties[D]. Hangzhou: Zhejiang Sci-Tech University, 2016: 31-42.
[8]王志惠.纺织品抗真菌性能评价方法的研究与改进[D].上海:东华大学,2015:21-23.
WANG Zhihui. Research andImprovement of Evaluation Methods on Anti-fungal Activity of Textile[D]. Shanghai: Donghua University, 2015: 21-23.
[9]陶娅妃,张嫄,周椿浩,等.纺织品霉变微生物的分离纯化与鉴定[J].丝绸,2022,59(3):40-44.
TAO Yafei, ZHANG Yuan, ZHOU Chunhao, et al. Isolation, purification and identification of moldy microorganisms on textiles[J]. Journal of Silk, 2022, 59(3): 40-44.
[10]魏景超遗.真菌鉴定手册[M].上海:上海科学技术出版社,1979:1-781.
WEI Jingchaoyi. Fungal Identification Manual[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1979: 1-781.
[11]唐欢,王春,范文奇,等.馆藏纸质书画文物上霉菌的分离与鉴定[J].文物保护与考古科学,2015,27(2):40-46.
TANG Huan, WANG Chun, FAN Wenqi, et al. Isolation and identification of molds from ancient Chinese calligraphy and paintings in museums[J]. Sciences of Conservation and Archaeology, 2015, 27(2): 40-46.
[12]宋賢冲,张照远,刘媛,等.广西南宁纤维板霉变微生物的分离及鉴定[J].林业工程学报,2016,1(1):78-82.
SONG Xianchong, ZHANG Zhaoyuan, LIU Yuan, et al. Isolation and identification of microorganisms causing mildew of fiberboard in Nanning, Guangxi[J].Journal of Forestry Engineering, 2016, 1(1): 78-82.
[13]雷声,杨乾栩,师艳萍,等.成品卷烟霉变微生物的分离纯化与鉴定[J].食品与机械,2019,35(9):98-101.
LEI Sheng, YANG Qianxu, SHI Yanping, et al. Isolation, purification and identification of microorganisms in moldy cigarettes products[J]. Food & Machinery, 2019, 35(9): 98-101.
[14]樊壬水,何贤蓉,叶伟,等.纤维板霉变微生物的分离鉴定及生长抑制方法[J].林业工程学报,2020,5(5):84-89.
FAN Renshui, HE Xianrong, YE Wei, et al. Isolation, identification and growth inhibition of microorganisms mildew of fiberboard[J]. Journal of Forestry Engineering, 2020, 5(5): 84-89.
[15]LANDEWEERT R, LEEFLANG P, KUYPER T W, et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiology, 2003, 69(1): 327-333.
[16]楊弢.狮子山楚王陵土壤中丝绸腐蚀微生物的分离与抑制[D].合肥:中国科学技术大学,2013:39-52.
YANG Tao. Isolation and Inhibition of the Silk Spoilage Bacteria from the Soil of the Chu King's Mausoleum in Shizishan[D]. Hefei: University of Science and Technology of China, 2013: 39-52.
[17]汤菲菲,姚燕,邵玉涛,等.基于理论吸收光谱的棉纤维波长筛选方法[J].江苏农业科学,2019,47(7):207-209,219.
TANG Feifei, YAO Yan, SHAO Yutao, et al.Study on wavelength screening method for cotton fiber based on theoretical absorption spectra[J]. Jiangsu Agricultural Sciences, 2019, 47(7): 207-209, 219.
[18]张俊,许超,张宇,等.纤维素酶降解机理的研究进展[J].华南理工大学学报(自然科学版),2019,47(9):121-130.
ZHANG Jun, XU Chao, ZHANG Yu, et al. Research progress on cellulase biodegradation mechanism[J]. Journal of South China University of Technology (Natural Science Edition), 2019, 47(9): 121-130.
[19]马晓娟,黄六莲,陈礼辉,等.纤维素结晶度的测定方法[J].造纸科学与技术,2012,31(2):75-78.
MA Xiaojuan, HUANG Liulian, CHEN Lihui, et al. Determination methods for crystallinity of cellulose[J]. Paper Science & Technology, 2012, 31(2): 75-78.
Biologicalcorrosion characteristics of molds on cotton fabrics
TAO Yafei, REN Zehua, WANG Mengdi, ZHU Bo, LIU Jianli
(College of Textile Science and Engineering, Jiangnan University, Wuxi 214122, China)
Abstract:
The main component of the cotton fiber is cellulose. Cellulose is a macromolecular polysaccharide composed of small molecules of glucose through β-1,4 glycosidic bonds. In addition, it also includes soluble sugar, wax, protein, fat, ash, and other companion organisms. It is rich in carbon sources and provides an energy source for the growth and reproduction of microorganisms. Therefore, cotton clothes are prone to mildew when stored. During the growth process, molds secrete organic acids and a series of extracellular enzymes, creating a suitable growth environment for themselves. These secretions will cause the bond between cellulose macromolecules to break, and then form small glucose molecules under the synergistic effect of cellulose series enzymes, which become the nutrients of molds, so that molds can grow and colonize rapidly on cotton fabrics and form mold spots on the surface of fabrics. At the same time, the organic acids and pigments secreted during the growth of molds will cause the fading of colored fabrics and the decrease of mechanical properties of fabrics, thus shortening the service life of textiles. Therefore, it is necessary to identify the types of molds on textiles and study the biological corrosion characteristics of molds on cotton fabrics in order to better protect textiles and prolong their service life.
In order to study the corrosion characteristics of molds on cotton fabrics, mold microorganisms were isolated and purified from real moldy cotton T-shirts, shirts, and towels, and streaked and purified on the PDA medium suitable for mold growth to obtain a single strain. According to morphology and ITS sequence analysis, the five isolated and purified molds were identified as Aspergillus niger, Aspergillus terreus, Penicillium citrinum, Cladosporium cladosporioides, and Aspergillus versicolor. The purified mold microorganisms were made into spore suspension and inoculated onto pure cotton bleached fabrics. The mold biocorrosion experiment was carried out on the enriched nutrient medium. After the experimental period, the microstructure, molecular structure and crystallinity of cotton fabrics before and after corrosion were characterized by scanning electron microscopy (SEM), Fourier transform infrared (FT-IR), and X-ray diffraction (XRD). The SEM results showed that the five molds grew between the fibers and caused different degrees of mechanical damage to the fiber surface. Specifically, the inoculation of Penicillium citrinum and Aspergillus terreus caused serious corrosion on the fiber surface, and a large number of longitudinal lines and holes appeared on the fiber surface of the sample, while Aspergillus niger caused less damage to the fiber. Fourier transform infrared spectroscopy showed that the 1,4-glycosidic bond of the cotton fiber inoculated with mold was broken, which caused a decrease in cellulose crystallinity, and the X-ray diffraction results also verified this. The crystallinity of cotton cellulose inoculated with the five kinds of molds decreased, among which Penicillium citrinum and Aspergillus terreus had a great influence on the crystallinity of cotton fibers, which decreased the crystallinity of cotton fibers from 86.37% to 81.65% and 82.75%, respectively. The experiment provides support for elucidating the mechanism of biological corrosion of cotton fabrics by molds and inhibiting cotton fabrics.
Keywords:
cotton fabrics; strain morphology; ITS sequence; mold; biological corrosion

