新型杨梅素衍生物S2-1-5的合成及抗肿瘤活性研究
周红玲,薛 伟,黄银久
肝癌是一种常见的恶性肿瘤,严重威胁着人类的生命健康。肝癌在我国尤其高发,是2020年第5位的常见恶性肿瘤和第2位的肿瘤致死病因[1]。化疗是肝癌的主要治疗手段之一,但由于个体差异性和耐药性,相当一部分肝癌病人并不能达到理想的治疗效果,因此有必要筛选出更加敏感、高效的新型抗肝癌药物。杨梅素是一种广泛存在于植物界的天然生物活性物质,因最早从杨梅树皮中提取而得名,其化学式为C15H10O8。杨梅素对多种癌细胞如结肠癌[2]、卵巢癌[3-4]、乳腺癌[5-6]、肺癌[7-8]、肝癌[9-10]等均有很好的抗肿瘤活性。但杨梅素的水溶性和脂溶性较差,这限制了杨梅素类药物的开发及临床应用[11]。为了弥补这一不足,研究者们对其结构改造得到了各种类型的杨梅素衍生物。本课题组以杨梅素为母体合成一种新型杨梅素衍生物S2-1-5,之后通过体外细胞实验进一步验证该化合物的抗肿瘤活性,以期为杨梅素衍生物的结构优化和抗肝癌药的进一步研发提供理论和实验依据。现作报道。
1 材料与方法
1.1 S2-1-5的合成 S2-1-5化学名称是2-氟苄基4- ((3- ((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4H-色烯-3-基)氧基)丙基)(甲基)氨基)哌啶-1-二硫代羧酸,化学式为C37H43FN2O8S2,具体合成办法分为以下5个步骤:(1)在250 mL烧瓶中加入杨梅苷(10 mmol)4.64 g、DMF 120 mL、K2CO3·1/2H2O (16 mmol)22.09 g,常温下搅拌0.5~1.0 h后,缓慢滴加碘甲烷(120 mmol)7.50 mL,继续搅拌48 h,TLC跟踪反应(甲醇:乙酸乙酯=1∶4,V/V)。反应停止后,过滤沉淀,用二氯甲烷洗涤滤渣,合并滤液,用100 mL水稀释,用二氯甲烷萃取3次,合并有机层,减压浓缩,然后将浓缩物溶于30 mL无水乙醇中,升温至回流,待溶液澄清后,回流下加入16 mL浓盐酸,随后有黄色固体析出,继续反应2 h,冷却,过滤,得到粗产物3-羟基-3′,4′,5′,5,7-五甲氧基杨梅素(中间体a)(见图1A),产率:54.4%。(2)在100 mL烧瓶中加入中间体a(3 mmol)1.17 g、DMF 30 mL、K2CO3(12 mmol)1.66 g,常温搅拌0.5~1.0 h后,加入1,3-二溴丙烷(12 mmol)2.42 g,继续反应12 h,TLC监测反应(乙酸乙酯)。反应停止后,反应液用50 mL的水分散,有白色固体析出,抽滤,再将固体加入装有30 mL溶液(乙酸乙酯:正己烷=3∶1)的烧瓶中常温搅拌4~5 h,抽滤,减压柱层析分离提纯(石油醚:乙酸乙酯=2∶1,V/V)得到白色固体3-(3-溴丙氧基)-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4H-色烯-4-酮(中间体b)(见图1B),产率:78.9%。(3)在100 mL烧瓶中加入K2CO3(3.57 mmol) 0.5 g、4-(N-甲基)氨基-N-Boc哌啶(1.78 mmol)0.38 g、乙腈40 mL,常温搅拌0.5~1.0 h后加入中间体b(1.96 mmol)1 g,随后升温至80 ℃,继续搅拌4~6 h,TLC跟踪反应。反应结束后,冷却至室温,抽滤除去碳酸钾及固体杂质,减压除去溶剂,得到酒红色油状粗产物4-((3-(5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4H-苯并吡喃-3-基)氧基)丙基)(甲基)氨基叔丁基)哌啶-1-羧酸叔丁酯(中间体c)备用(见图1C),产率:91.7%。(4)中间体c用约30 mL甲醇溶于100 mL的烧瓶中,再加入盐酸甲醇溶液(6 mol/L)10 mL,常温搅拌约2 h,TLC跟踪反应。反应结束后,减压除去溶剂后加入少量甲醇溶解,再加入乙酸乙酯20 mL,不断搅拌至有黄色固体析出,抽滤,再分别用乙酸乙酯,二氯甲烷洗涤,自然风干得到黄色固体5,7-二甲氧基-3-(3-(甲基(哌啶-4-基)氨基)丙氧基)-2-(3,4,5-三甲氧基苯基)-4H-色烯-4-酮的盐酸盐(中间体d)(见图1D),产率:93.2%。(5)在50 mL烧瓶中加入中间体d(0.92 mmol)0.5 g、K2CO3(1.84 mmol)0.25 g、乙腈20 mL,常温搅拌1 h后在冰浴条件下滴加二硫化碳(9.21 mmol)0.7 g,继续搅拌20 min后缓慢滴加邻氟苄氯(0.92 mmol)0.15 g ,继续冰浴搅拌2 h,TLC跟踪反应。反应结束后将混合物倒入100 mL冰水中,用二氯甲烷萃取(3×20 mL),合并有机层,用饱和食盐水洗涤(3×20 mL)、无水硫酸钠干燥、减压除去溶剂,得粗产物,经柱层析(乙酸乙酯:甲醇=5:1~1:5,V/V)提纯得到目标化合物2-氟苄基4- ((3- ((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4H-色烯-3-基)氧基)丙基)(甲基)氨基)哌啶-1-二硫代羧酸(e)(见图1E),产率:76.9%。
1.2 获得化学式和分子量数据 将上述合成的目标化合物S2-1-5(e)作为样品,以DMSO为溶剂,用核磁共振(NMR)测定并获得其在1H NMR(400 MHz)、13C NMR(101 MHz)、19FNMR(376 MHz)的谱图数据,再用高分辨质谱(HRMS)测定并获得该目标化合物的化学式和分子量数据。
1.3 细胞株及主要试剂 人肝癌SMMC-7721细胞;DMEM高糖培养基;胎牛血清(FBS);二甲基亚砜(DMSO);青-链霉素混合液(双抗);0.25%胰酶;MTT溶液;细胞周期与细胞凋亡检测试剂盒。
1.4 细胞培养与药物作用 人肝癌SMMC-7721细胞于37 ℃、5%CO2的培养箱中用配成的含10%胎牛血清和1%青-链霉素混合液的完全培养基培养。S2-1-5和吉西他滨先用DMSO稀释成40、20、10、5、1 mmol/L的贮存液,加药时再用完全培养基或无血清培养基稀释成工作液,吉西他滨作为阳性对照组,DMSO作为阴性对照组。
1.5 MTT实验检测抑制率 对数生长期细胞0.25%胰酶消化后加入完全培养基终止消化,离心,弃上清液,用完全培养基重悬细胞沉淀。取96孔板,板的前10列作为药物处理组,板的后2列作为对照组(分别是阴性对照组和空白对照组),前11列的中间6行每孔各加入200 μL(含3 500个细胞)的细胞悬液,最后一列及板四周未加细胞悬液的每孔加入PBS 200 μL以保证板的饱和湿度,将96孔板置于37 ℃、5%CO2的培养箱中培养24 h。
24 h后等细胞完全贴壁进行加药处理,即取出96孔板,弃去培养基,前10列每列的中间6个孔按顺序分别加入稀释好的浓度分别为S2-1-5 1 μmol/L、吉西他滨1 μmol/L、S2-1-5 5 μmol/L、吉西他滨5 μmol/L、S2-1-5 10 μmol/L、吉西他滨10 μmol/L、S2-1-5 20 μmol/L、吉西他滨20 μmol/L、S2-1-5 40 μmol/L、吉西他滨40 μmol/L的药物,每孔100 μL,最后2列除了第一个和最后一个孔外阴性对照组每孔加入用完全培养基稀释好的DMSO 100 μL,空白对照组每孔加入完全培养基100 μL,板四周其余未加任何液体的各孔则分别加入PBS 200 μL以保证板的饱和湿度,再将板置于37 ℃、5%CO2的培养箱中培养。
72 h后,在倒置显微镜下观察药物作用效果并拍照,然后弃去板内药液,板的12列的中间6行每孔各加入100 μL 0.5 mg/mL的MTT溶液,加完轻轻晃动一下板使MTT充分混匀,再将板置于培养箱中培养4 h。
4 h后96孔板内生成紫色结晶甲瓒再弃去板内MTT,原先加MTT的每孔加入DMSO 100 μL以溶解甲瓒结晶,之后将板置于摇床振荡器中摇板10~15 min,用酶标仪测定在490 nm处的吸光度值并计算抑制率。抑制率(%)=1-(处理组吸光度值-空白对照组吸光度值)/(阴性对照组吸光度值-空白对照组吸光度值)×100%。用GraphPad Prism软件绘制细胞抑制率与对数浓度之间的非线性回归图,并用Log Pad Prism软件测定半抑制浓度(IC50)。
1.6 形态学观察 上述96孔板在加药后于培养箱中培养72 h后拍照,比较S2-1-5组和吉西他滨组的细胞在形态学上的差异。
1.7 划痕实验检测细胞迁移能力 (1)对数生长期细胞,0.25%胰酶消化后加入完全培养基终止消化,离心,弃上清液,用完全培养基重悬细胞沉淀。取一块6孔板,其中3个孔设为对照组,另外3个孔设为S2-1-5 2.04 μmol/L(IC50值)组,6个孔都加入细胞悬液(含5.0×105个细胞/孔),然后将6孔板置于37 ℃、5%CO2的培养箱中培养。(2)等6孔板内细胞密度达到95%时,用20 μL枪头在6孔板每孔内划出一道伤口,再小心吸去6孔板内细胞悬液,用PBS清洗干净每孔,然后阴性对照组加入用无血清培养基稀释的DMSO每孔2 mL,S2-1-5组加入用无血清培养基稀释的S2-1-5 2.04 μmol/L,每孔2 mL。(3)加完在倒置显微镜下拍划痕0 h(划痕即时)的照片,然后将板置于37 ℃、5%CO2的培养箱中继续培养,24 h后再对板进行拍照,最后用Photoshop软件计算划痕前后细胞之间空白处面积差(单位:像素),取平均值,计算迁移率。迁移率=(划痕0 h空白处面积-划痕后24 h空白处面积)/划痕0 h空白处面积。
1.8 碘化丙啶染色检测细胞周期 (1)对数生长期细胞,0.25%胰酶消化后加入完全培养基终止消化,离心,弃上清液,用完全培养基重悬细胞沉淀。取一块6孔板,其中3个孔设为对照组,另外3个孔设为S2-1-5 2.04 μmol/L组,6个孔都加入细胞悬液(含2.0×105个细胞/孔),然后将板置于37 ℃、5%CO2的培养箱中培养24 h。(2)24 h后等细胞完全贴壁进行加药处理,即阴性对照组加入用完全培养基稀释的DMSO每孔2 mL,S2-1-5组加入用完全培养基稀释的S2-1-5 2.04 μmol/L每孔2 mL,加完将板置于37 ℃、5%CO2的培养箱中培养,72 h后按照碧云天细胞周期与细胞凋亡检测试剂盒操作说明处理细胞,用BECKMAN CytoFLEX流式细胞仪和Flow Jo软件检测细胞周期分布情况。
1.9 Annexin V-FITC/碘化丙啶双染检测细胞凋亡 种板及加药步骤同上,加完药后将6孔板放入置于37 ℃、5%CO2的培养箱中培养,72 h后按照碧云天细胞凋亡检测试剂盒操作说明处理细胞,用BECKMAN CytoFLEX流式细胞仪和Flow Jo软件检测细胞凋亡情况。
1.10 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 NMR和HRMS检查结果 1H NMR (400 MHz,DMSO):δ 7.51 (td,J = 7.7,1.6 Hz,1H,Ph-H),7.38-7.31 (m,3H,Ph-H),7.23-7.14 (m,2H,Ph-H),6.83 (d,J = 2.1 Hz,1H,Ph-H),6.49 (d,J = 2.2 Hz,1H,Ph-H),5.26 (d,J = 10.8 Hz,1H,Piperidinyl-H),4.51 (d,J = 5.6 Hz,2H,-S-CH2-),4.41 (d,J = 12.5 Hz,1H,Piperidinyl-H),3.98 (t,J = 6.1 Hz,2H,-O-CH2CH2CH2-N-),3.90 (s,3H,Ph-OCH3),3.87 (s,6H,Ph-OCH3),3.84 (s,3H,Ph-OCH3),3.75 (s,3H,Ph-OCH3),3.28-3.09 (m,2H,Piperidinyl-H),2.57 (d,J = 11.0 Hz,1H,Piperidinyl-H),2.41 (t,J = 6.8 Hz,2H,-O-CH2CH2CH2-N-),2.06 (s,3H,N-CH3),1.76-1.65 (m,4H,-O-CH2CH2CH2-N-,Piperidinyl-H),1.38-1.25 (m,2H,Piperidinyl-H);
13C NMR (101 MHz,DMSO):δ 193.51,172.68,164.19,160.74,159.70,158.63,153.14,152.00,140.47,139.80,132.02,131.98,130.27,130.18,126.14,124.99,124.96,123.61,123.46,115.94,115.73,108.93,106.28,96.38,93.54,70.73,60.67,59.85,56.55,56.50,50.58,49.40,37.32,34.93,28.54,27.63;
19F NMR (376 MHz,DMSO):δ -116.89;
HRMS (ESI)[M+H]+ calcd for C37H43FN2O8S2:727.2518,found:727.2500;White solid;m.p.:84-85 oC;yield,77%;
通过对上述数据解析,我们确定了S2-1-5的化学式(C37H43FN2O8S2),相对分子量(727.25)。
2.2 MTT实验结果 S2-1-5和吉西他滨的抑制率都具有浓度依赖性,但相同浓度下S2-1-5组的抑制率高于吉西他滨组,差异均有统计学意义(P<0.05~P<0.01)(见表1)。S2-1-5组的IC50值明显低于吉西他滨组,分别为2.04 μmol/L 和27.97 μmol/L(见表2)。后续实验利用2.04 μmol/L这个浓度进一步验证S2-1-5对SMMC-7721细胞的抗肿瘤活性。
表1 不同浓度S2-1-5对7721细胞的抑制率

表2 S2-1-5和吉西他滨作用7721细胞72 h的IC50(μmol/L)
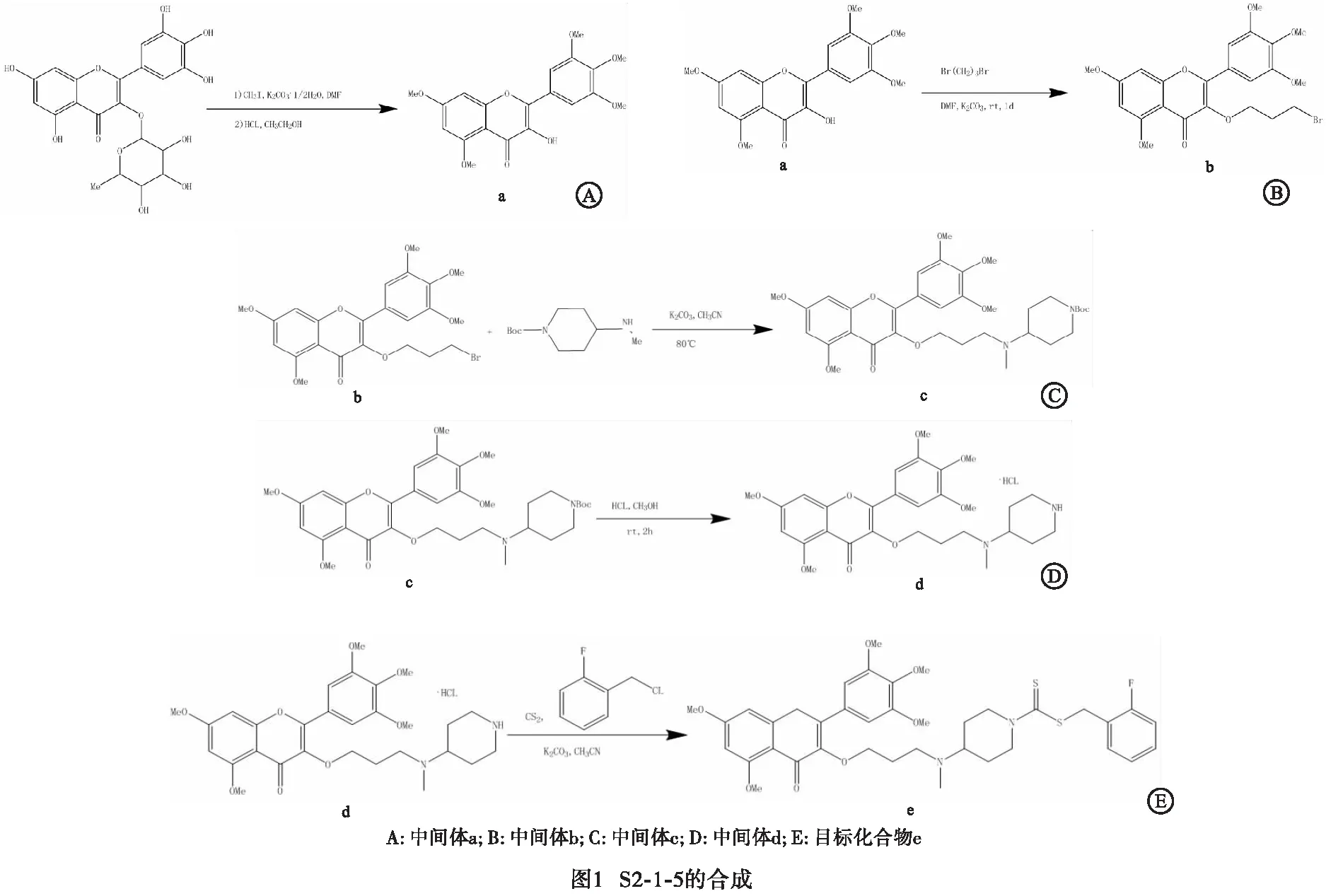
2.3 形态学观察结果 从72 h形态学观察来看,与DMSO组和吉西他滨组相比,S2-1-5在5 μmol/mL浓度时7721细胞形态发生变化,细胞变小变圆;在10 μmol/mL浓度时出现核碎裂,细胞死亡;随着S2-1-5浓度的增加,细胞出现大面积死亡,大量核碎裂并从细胞膜溢出。说明S2-1-5具有更显著的细胞毒作用(见图2)。
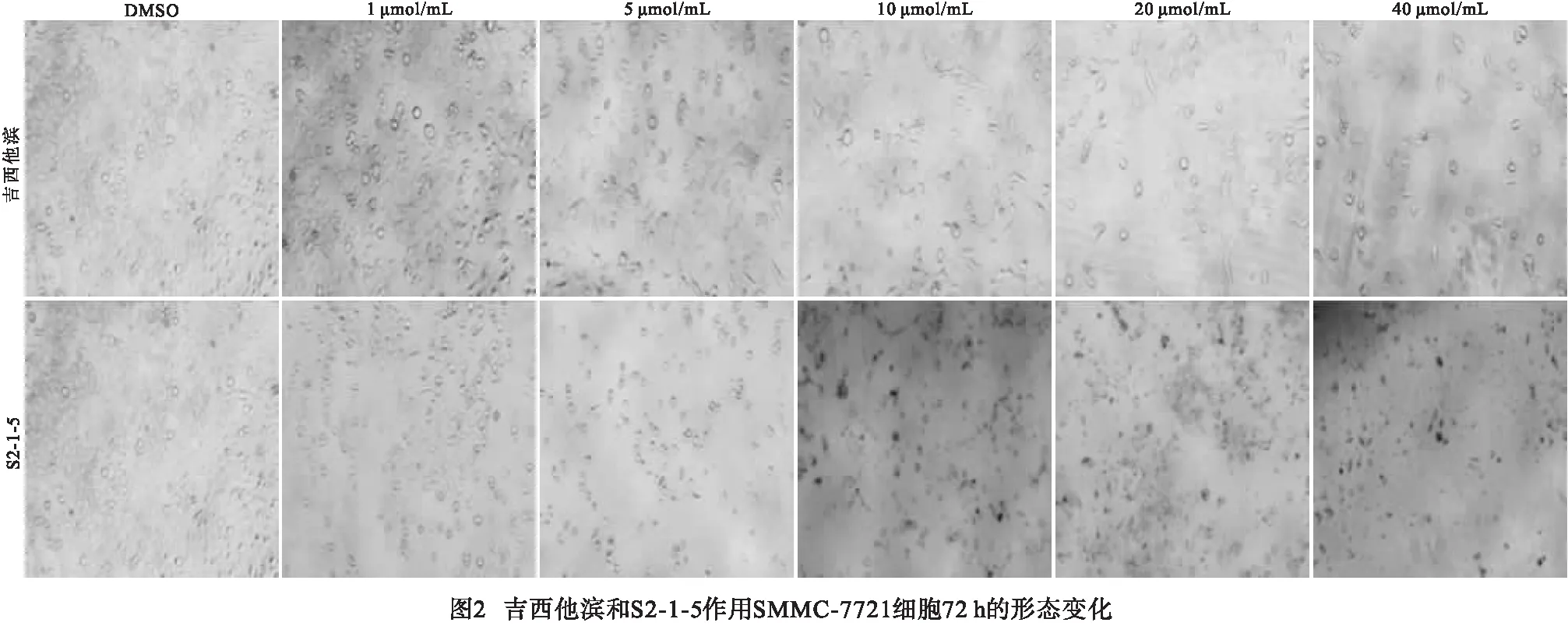
2.4 划痕实验结果 与对照组(16.82±2.67)相比,S2-1-5处理组(9.73±1.02)细胞迁移率较低(t=4.30,P<0.05 ),说明S2-1-5处理组具有更强抑制SMMC-7721细胞迁移的作用(见图3)。
2.5 细胞周期检查结果 与对照组相比,S2-1-5处理后,G0/G1期平均细胞比例略有上升,由49.30%上升至51.01%,G2/M期平均细胞比例由16.99%下降至10.44%,S期平均细胞比例由33.70上升至38.55%,S2-1-5能使SMMC-7721细胞阻滞在S期(见表3)。
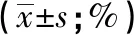
表3 对照组和S2-1-5处理组在不同细胞周期的细胞分布比例
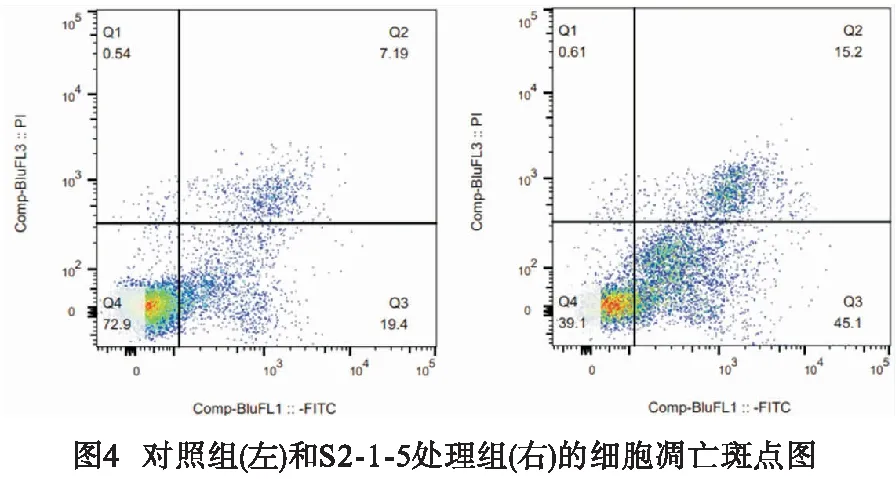
2.6 细胞凋亡检查结果 与对照组(27.14±0.43)相比,S2-1-5组(60.70±0.71)细胞凋亡率更高(t=57.09,P<0.01)(见图4)。
3 讨论
肝癌作为一种发病率和死亡率均较高的恶性肿瘤,已成为全球性健康问题[12]。化疗是目前肝癌的主要治疗手段之一,但相当一部分肝癌病人由于个体差异和耐药而不能达到理想的治疗效果。杨梅素是一种具有广泛抗肿瘤活性的天然产物,但天然产物的水溶性和脂溶性较差[13],这限制了杨梅素类药物的开发及临床应用。S2-1-5是以杨梅素为母体合成的化合物,在结构设计上以多个甲氧基取代杨梅素结构式中的羟基,另外还加入哌啶、氟基和二硫代羧酸基团,其设计的意义在于:多甲氧基黄酮具有抗肿瘤作用并能增加化疗药的敏感性[14-15];哌啶环具有抗肿瘤作用并能增加药物的水溶性[16];氟基具有抗肿瘤作用并能提高药物的亲脂性、靶向性和生物利用度,促进药物代谢[17];二硫代羧酸基团也具有抗肿瘤活性[18]。
本研究中,我们还通过一系列细胞实验初步验证了S2-1-5的抗肿瘤活性和作用机制,结果表明S2-1-5是一种抗肿瘤活性较强的浓度依赖性药物,随着浓度的增加其抑制率不断增加,在40 μmol/mL浓度时,S2-1-5的抑制率高达95.05%,远高于吉西他滨54.45%。为了进一步验证这种体外抗肿瘤活性作用机制,我们研究了S2-1-5对人肝癌细胞SMMC-7721细胞周期的影响,结果表明S2-1-5作用7721细胞48 h后能使细胞周期阻滞在S期。有研究[19]表明细胞周期发生阻滞后,随着阻滞时间的延长细胞就有可能进入程序性死亡即凋亡阶段,因此,我们利用流式细胞术进一步验证了S2-1-5对7721细胞的凋亡诱导作用,结果表明S2-1-5能显著促进7721细胞凋亡。为了更全面地探索S2-1-5的体外抗肿瘤作用机制,我们还利用划痕实验验证了S2-1-5对7721细胞迁移的影响,结果表明目标化合物作用细胞24 h与对照组相比,能显著抑制7721细胞迁移(S2-1-5组迁移率为9.73%,对照组迁移率为16.82%,P<0.05)。
综上,S2-1-5作为新型杨梅素衍生物对人肝癌细胞SMMC-7721细胞具有显著的体外抗肿瘤活性,在结构上我们引入哌啶环以增加药物的水溶性,引入氟基以提高药物的亲脂性[16-17],S2-1-5是否比杨梅素具有更好的水溶性和脂溶性,我们将在未来的研究中进一步验证。S2-1-5可以通过细胞周期阻滞和诱导细胞凋亡发挥抗体外肿瘤作用,且能够抑制细胞迁移。细胞的增殖、迁移、周期和凋亡既是相互独立,又是相互联系和制约的动态过程,增殖、迁移、周期任一环节的改变都会使细胞走向凋亡。S2-1-5如何影响细胞周期,如何诱导细胞凋亡?我们的猜想是:S2-1-5作为一种具有较强抗肿瘤活性的氮氧化合物,在作用7721细胞时很可能会造成细胞氧化应激和/或DNA损伤,DNA一旦损伤,细胞就会通过P53的调节诱导周期阻滞和凋亡维持自身基因遗传的稳定性。其具体作用机制可能为DNA损伤后,细胞启动修复系统,P53蛋白表达水平大大提高,P53蛋白表达增加会促进下游P21蛋白的表达,P21蛋白表达增加会抑制细胞周期蛋白CDK2和Cyclin A的表达,从而将细胞周期阻滞在S期[20-21];而当细胞损伤到无法修复的程度时,P53则主要通过线粒体途径最终诱导细胞凋亡[22]。因此,在后续的研究中我们将从蛋白和核酸水平对此作用机制进行进一步验证。

