钛种植体表面构建成骨细胞特异性识别多肽缓释系统的实验研究
王 刚,李 思,吴雨峰,吴明月
钛金属及合金由于其优良的生物相容性和机械性能,已被广泛应用于口腔种植领域,但是钛金属表面属于生物惰性材料,影响了临床骨结合的速度和质量[1]。研究[2]显示,对钛种植体表面进行生物化改性,可使其获得更好的骨诱导性,植入机体后能主动与周围骨组织特异结合,促进骨结合,实现早期良好的种植体稳定性。
缓释系统,是指通过一定方法将生物因子与种植体表面缓释载体结合并植入体内时,可使该生物因子持续释放延长其作用时间。层层自组装( layer-by-layer self-assembly,LbL) 是 Decher et al[3]于20世纪90年代所提出的一种在材料表面通过交替吸附带相反电荷的聚电解质以形成自组装多层聚电解质复合物(polyelectrolyte complex, PEC)薄膜的方法,通过LbL技术所形成的多层膜结构可作为生物因子的缓释载体[4]。该研究通过LbL技术将海藻酸钠、壳聚糖交替吸附沉积于钛种植体表面,形成聚电解质多层膜结构并装载成骨细胞特异性多肽,构建其缓释系统,评价其缓释效应,为钛种植体表面生物化改性研究提供新的思路和方法。
1 材料与方法
1.1 材料与仪器
1.1.1实验材料 钛片(陕西省宝鸡市泰宇鑫金属材料有限公司);氢氧化钠(合肥诺一生物科技有限责任公司);异硫氰酸(fluorescein isothiocyanate,FITC)荧光标记的成骨细胞特异性识别多肽(上海科肽生物科技有限公司);羟甲基壳聚糖、藻酸钠、赖氨酸(合肥苗茁生物科技有限公司);其余一般试剂均购于国药集团化学试剂有限公司,且试剂均为分析纯。
1.1.2实验仪器 Sirion-500场发射扫描电子显微镜(美国FEI公司FESEM);X射线光子能谱仪、傅里叶红外光谱(美国Thermo-VG Scientific 公司);接触角测量仪(成德市成慧实验机器有限责任公司);UV-1800可见光分光光度计(日本岛津公司)等。
1.2 实验过程
1.2.1钛表面碱热处理 将纯度99.99%、厚度0.3 mm、直径15 mm圆形成品钛片经400、600、800、1 000、1 200目金刚砂纸打磨光滑后,依次放入丙酮、75%乙醇溶液、去离子水中,各超声清洗20 min。干燥后放入浓度为5.0 mol/L氢氧化钠溶液中,烘箱中60 ℃恒温浸泡24 h,取出钛片,用去离子水清洗、烘干;再将钛片加热到200 ℃保温2 h,自然冷却,获得碱热处理钛片,备用。
1.2.2钛表面组装PEC多层膜结构 将碱热处理后的钛片放入浓度为2.5 mg/ml多聚赖氨酸溶液中浸泡30 min,0.9%生理盐水漂洗3次,60 ℃恒温箱烘干10 min,从而在钛表面获得一层稳定的带正电荷薄膜,并以此作为层层自组装的启动基础;将烘干后钛片放入浓度为5 mg/ml海藻酸钠溶液中浸泡30 min,取出钛片漂洗干燥,使其表面吸附一层带负电荷的薄膜;随后将其浸入5 mmol/L的氯化钙溶液10 min,对海藻酸钠进行交联,漂洗干燥;最后将钛片置入1 mg/ml壳聚糖溶液10 min,漂洗干燥,钛表面再次吸附一层正电荷薄膜。以上步骤循环操作10次,最终获得理想的多层聚电解质复合物多层膜,最外层为壳聚糖。
1.2.3实验分组 实验分为3组:光滑钛片组(Ti组),碱热处理组(PTi组),碱热处理-海藻酸钠/壳聚糖组(PTi/PSC组)。
1.2.4复合特异性多肽缓释结构的制备 将上述3组样品完全浸入浓度为10-5mol/L成骨细胞特异性识别多肽溶液中,浸泡 2 h后,取出钛片,去离子水冲洗,干燥,备用。
1.2.5样品表征及缓释检测 SEM观察各组样品表面形貌;测量材料表面接触角分析亲水性;FTIR、XPS及荧光显微镜对样品表面成分进行分析;紫外分光光度计检测样品表面成骨细胞特异性识别多肽的释放曲线(将上述3组样品置于12孔板中,并分别加入1 ml PBS缓冲液,将孔板固定于恒温摇床,温度恒定为37 ℃,于1、2、4、8、12、24 h和2、3、4~7 d分别取出200 μl释放液以检测特异性多肽浓度,然后向孔板中重新加入200 μl PBS缓冲溶液)。

2 结果
2.1 钛表面形貌特征扫描电镜显示:Ti组表面呈光滑镜面状,见图1A;碱热处理后PTi组表面呈粗糙多孔状,见图1B;构建多层膜结构后PTi/PSC组表面呈多孔状,且部分孔隙被充填,形成一层不均匀膜性结构,见图1C,该膜性结构放大至60 000倍显示为类似立体网状结构,见图1D。

图1 钛表面形貌
2.2 材料表面亲水性分析Ti组接触角较大,显示出一定疏水性能,见图2A;相较于Ti组,PTi组材料表面接触角明显减小,亲水性增强,见图2B;加载多层膜后,PTi/PSC组接触角较PTi组大,小于Ti组,亲水性相较于PTi组有所下降,但较Ti组仍明显改善,差异均有统计学意义(F=162.38,P<0.05),见图2C。各组样品接触角角度见表1。
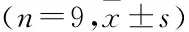
表1 样品表面接触角角度

图2 接触角测量图片A:Ti组;B:PTi 组;C:PTi/PSC组
2.3 X射线光电子能谱分析结果显示经过碱热处理后 Ti 的特征峰强度下降,表明钛表面形成二氧化钛薄膜,见图3A、3B;PTi/PSC组可见 Ti 2p减少和 N1s峰出现,表明海藻酸钠和壳聚糖已成功修饰钛表面,见图3C;在400 eV,多肽修饰组N1s峰升高表明特异性多肽已成功搭载至壳聚糖-海藻酸钠聚合多层膜内,见图3D。
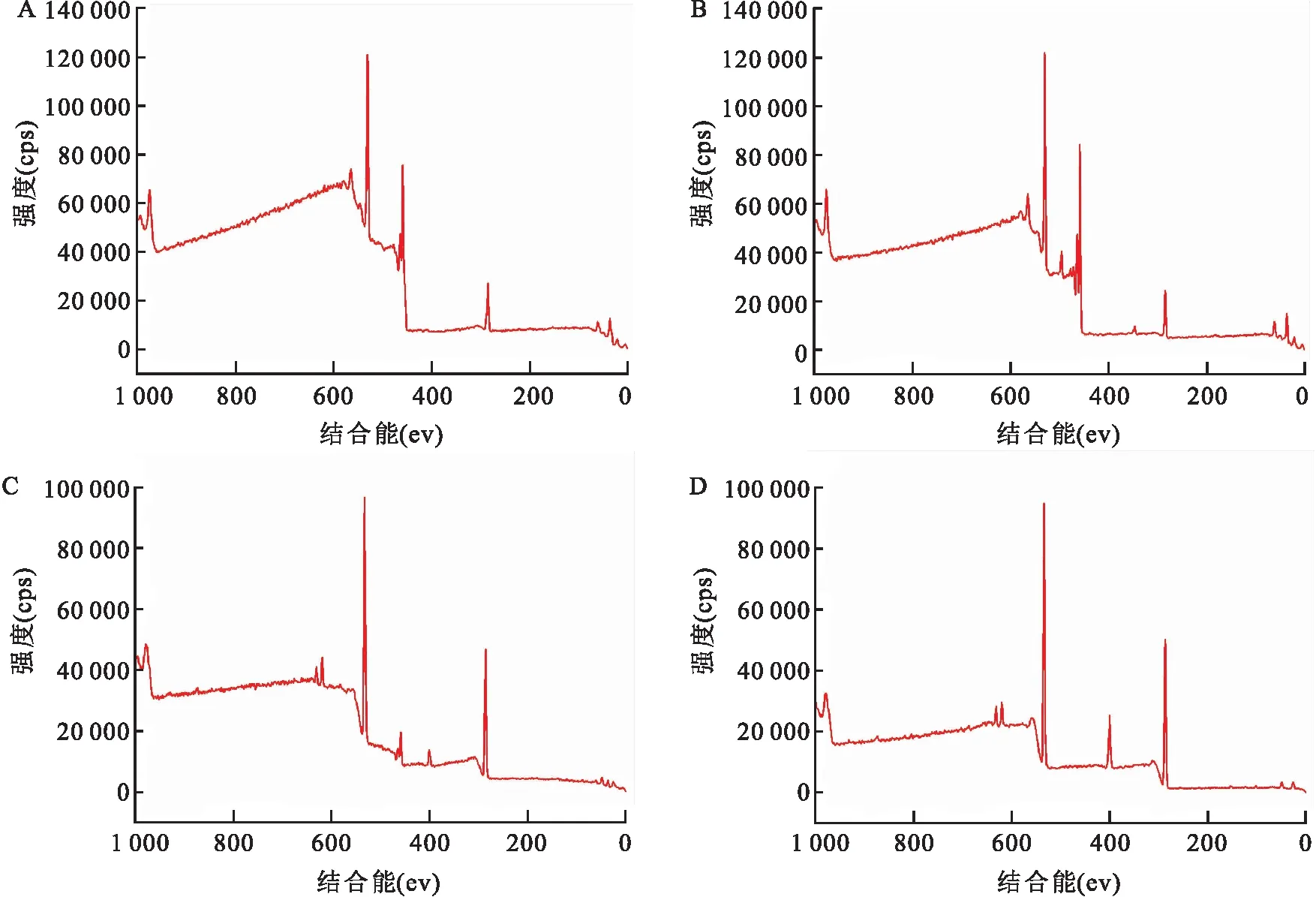
图3 XPS分析图谱A: Ti组;B: PTi 组;C: PTi/PSC组;D: 多肽修饰组
2.4 傅里叶红外光谱检测结果与Ti组相比,PTi组FTIR光谱于3 000~3 500 cm-1处出现宽峰,该吸收峰是钛片碱热处理后所形成的弱碱性钛酸盐上羟基伸缩震动造成的,表明碱热处理后钛表面出现了-OH特征官能团;PTi/PSC组在1 620 cm-1、1 403 cm-1处出现吸收峰,见图4A,表明在钛表面已成功构建壳聚糖-海藻酸钠多层膜结构。搭载特异性多肽后,当吸收波为1 630 cm-1时,PTi/PSC组的波峰与标准多肽基本一致,证实特异性多肽已成功搭载于钛基材表面,见图4B。
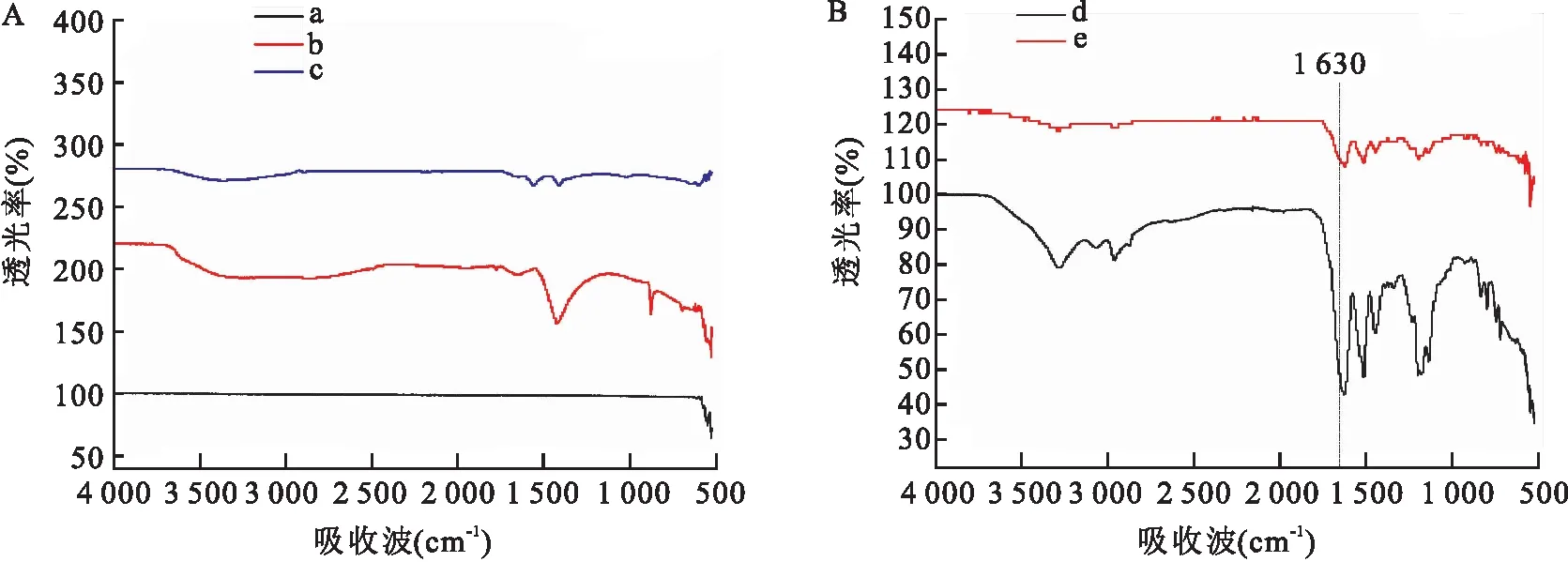
图4 FTIR检测结果A-a:Ti组;A-b:PTi 组;A-c:PTi/PSC组; B-d:多肽修饰组;B-e:多肽标准光谱
2.5 免疫荧光分析3组材料表面均可见不等量的荧光,Ti组材料表面见极少量荧光分布;PTi组及PTi/PSC组表面荧光分布量较Ti组明显增多,其中PTi/PSC组表面荧光分布量最多且均匀,证实已成功于钛表面固定目的多肽,见图5。
图5 荧光分析图片 ×200A: Ti组;B: PTi 组;C: PTi/PSC组
2.6 多肽释放量分析由释放曲线可见:多肽的释放量随着时间延长逐渐增加,释放速度逐渐减慢。最初24 h时内,多肽释放量迅速增加,其中Ti组最少且后续未见明显上升,表明24 h基本完全释放;PTi组多肽释放速度及释放量介于Ti组与PTi/PSC组之间,持续释放至第4天;PTi/PSC组多肽释放过程持续时间最长,至第7天释放量仍持续增加,缓释效果较其他两组更为理想,见图6。
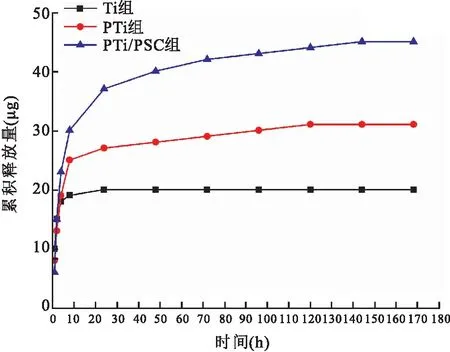
图6 特异性多肽释放曲线
3 讨论
钛种植体表面改性的方法主要有物理方法、化学方法和生物学方法,其中运用生物学技术对种植体表面进行生物化改性成为当前的研究热点[5]。概括而言,生物化改性就是通过组织工程学方法,将具有特异性识别功能的生物活性因子吸附到材料表面,形成一个与生物活体相适应的材料表面过渡层以控制骨整合的过程,该方法具备如下优点:① 可利用的生物活性分子有多种,包括胶原、生长因子、细胞自分泌胞外全基质、细胞识别短肽、釉原蛋白等;② 通过一定的方法,采用生物可降解材料在钛表面构建载负生物活性分子的微结构,形成具备较好骨诱导性的种植体表面结构,促进骨结合[2,6]。本研究所选择的生物活性分子为人成骨细胞特异性识别多肽,是通过噬菌体展示技术及噬菌体随机肽库筛选方法,获得的特定多肽结构,为课题组前期研究成果,且经体内、体外系列研究均证实该多肽结构可以显著促进骨结合[7-9]。
如何将生物活性分子与种植体结合,在钛种植体表面构建目的因子的缓释系统并充分发挥其活性,是钛种植体表面生物化改性研究的重要环节。缓释系统可以模拟体内环境,将活性因子与缓释载体结合后植入体内以持续保持其活性并延长其作用时间,维持生物活性分子最佳的生物学功能。缓释系统的功能有如下三个方面:① 可载负生长因子并使之与周围组织均匀接触;② 对周围细胞的增殖分化具备诱导功能;③ 作为支架结构以促进组织生长[10]。目前,在钛种植体表面吸附和释放生物大分子的方法主要包括:物理吸附法、化学固定法、载体法[11]以及层层自组装法。其中,层层自组装法是目前在材料表面构建生物因子缓释系统应用较多较为成熟的方法,已成功应用于有机材料及金属无机材料的表面改性研究[12]。该方法具有如下优点:① 不受基材形状的限制,制备条件简单温和且缓释薄膜具有较高的热力学稳定性;② 缓释效果显著,可通过调节涂层循环次数以控制涂层的量并由此实现对目的因子载负量的可控。因此,本研究采用LbL技术在钛种植体表面构建聚电解质多层膜结构。钛片经过碱热处理后,表面富含带负电荷的Ti-OH基团的钛酸钠凝胶,由此可作为层层自组装的启动基础[13],聚赖氨酸溶液浸泡后,在Ti-OH基团的作用下,使钛表面获得一层稳定的正电荷薄膜,此时再将海藻酸钠、壳聚糖在钛表面进行交替吸附沉积,最终获得理想的聚电解质复合物多层膜,在此多层膜基础上搭载多肽,如此成功实现钛种植体表面对特异性多肽良好的缓释效应。由释放曲线可见:光滑钛片组多肽突释明显,释放速度最快,在24 h内几乎释放殆尽;碱热处理组样品所吸附多肽释放较光滑组变慢且持续时间也较长;相比之下,层层自组装组样品在3组中对多肽的缓释效果最为理想,其释放速度明显慢于前两组,虽然在前24 h内也有部分突释,但后续释放随之减缓且持续时间较长,延续至第7天仍可见多肽释放,由此可见,层层自组装组样品对多肽的缓释效果最为理想。究其原因,主要是层层自组装样品的制备有别于前两组,首先是在碱热处理的基础上,形成多孔的钛表面结构,相较于光滑表面,该多孔结构可吸附一定量的多肽;其次,因层层自组装样品制备的多个循环,可以尽可能多的将多肽吸附在多层膜内;再者,层层自组装的多层膜结构具备良好的热力学稳定性以及半透膜性,由此,可实现载负多肽量较好的稳定性及可控性,且3组样品中其缓释效果最佳。
研究[14]表明,生物因子的缓释系统应该具备以下标准:缓释系统载体及其降解产物应为生物可吸收材料,可抑制各种病理过程,便于使用且无菌半透,有利于愈合与再生且可以作为新生组织的结构支撑。壳聚糖、海藻酸钠是天然多糖类高分子聚合物,具备良好的生物相容性、易生物降解性及可加工成型性,目前被广泛应用于骨组织工程领域支架材料的制备[15]。由于海藻酸钠的分子链上有大量的羧基,壳聚糖分子链上有大量的伯氨基,因此,可以通过正负电荷的吸引形成壳聚糖和海藻酸钠相互吸附的聚电解质膜结构[16],此类膜结构可作为生物因子的释放载体,因此,本研究采用壳聚糖和海藻酸钠作为构建缓释系统的基本材料。 SEM结果显示:PTi/PSC组表面形成一层不均匀的膜性结构,经放大后显示为类似立体网状结构;XPS结果也证明海藻酸钠-壳聚糖多层膜已成功修饰钛表面(图3C)。以此多层膜结构作为载体,构建载负成骨细胞特异性识别多肽的缓释系统,XPS图谱见400 eV处多肽组N1s峰明显升高(图3D),同时FTIR光谱显示,吸收波为1 630 cm-1时多肽修饰组波峰与标准多肽基本一致,均表明特异性多肽已成功复合至壳聚糖-海藻酸钠多层膜内(图4B)。综上所述,本实验结果证实在钛种植体表面成功构建具备良好缓释效应的多肽缓释系统。
本研究依据生物材料表面改性理论,运用静电自组装技术,选择天然可生物降解材料海藻酸钠以及类似于细胞外多糖的天然氨基多糖壳聚糖作为生物涂层的基本成分,在活化(碱热处理)的钛种植体表面进行细胞外基质化的构建,形成多层膜结构,同时利用此多层膜装载成骨细胞特异性识别多肽,由此构建成骨细胞特异性多肽的缓释系统,实现对生物涂层量的可控和生物活性分子的缓释,本研究构建的钛种植体表面缓释涂层的生物学效应尚有待相关的体外体内系列实验进一步验证。

