IL-17 及其受体调控DLL4-Notch信号通路影响甲状腺乳头状癌新生血管生成
宋 杨,杨见明
甲状腺癌是内分泌系统常见的恶性肿瘤,依据病理组织特征,甲状腺癌有以下几种类型:甲状腺乳头状癌、甲状腺髓样癌、滤泡状甲状腺癌、甲状腺未分化癌。在所有甲状腺癌病理类型中甲状腺乳头状癌是所有最为常见的一种[1]。部分甲状腺乳头状癌患者会发展到侵入邻近组织,预后较差。因此,阐明部分甲状腺乳头状癌侵袭转移的分子机制具有重要意义[2-3]。在肿瘤侵袭转移的进程中,新生血管生成是一个关键因素,也是甲状腺乳头状癌局部颈淋巴结转移和复发的主要因素[4-5]。白细胞介素(interleukin,IL)-17 主要是17型T辅助细胞(Th17 细胞)表达的一种细胞因子。研究[6]显示IL-17及其受体介导的信号通路参与血管生成和肿瘤的恶化。DLL4-Notch信号传递途径参与诱导和挑选顶端细胞,在血管发生中扮演着重要角色[7-8]。然而,甲状腺乳头状癌中 IL-17/白介素-17受体(interleukin-17 receptor,IL-17R)以何种方式介导DLL4-Notch信号通路,对甲状腺乳头状癌新生血管生成产生影响尚不清楚。该研究构建共培养体系模型模拟肿瘤微环境,观察TPC-1对共培养体系中人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的影响,探讨TPC-1与HUVECs 之间的作用机制,为甲状腺乳头状癌的临床诊断和治疗提供依据。
1 材料与方法
1.1 细胞培养甲状腺乳头状癌细胞(TPC-1)、HUVECs购自中国科学院上海生科院细胞资源中心。TPC-1、HUVECs用含15%的胎牛血清(fetal bovine serum,FBS)、100 U/ml青霉素链霉素的RPMI 1640培养基于5% CO2、37 ℃ 培养箱中培养。待细胞生长约80%融合度时进行相关实验。
1.2 试剂与仪器
1.2.1主要试剂 DMEM高糖培养基(美国 HyClone 公司);FBS(浙江天杭生物科技有限公司);重组人 IL-17A (美国 Peprotech 公司);抗 DLL4、抗 Notch多克隆抗体(美国 Immuno Way 公司);GAPDH 抗体(北京中杉金桥生物技术有限公司);抗 IL-17R多克隆抗体(英国Abcam公司);HES、HEY、VEGFR-1、VEGFR-2(美国Cell Signaling 公司);山羊抗兔二抗(美国 ABclonal 公司);PMSF、RIPA 裂解液(强)、BCA 蛋白浓度检测试剂盒、5×SDS-PAGE蛋白上样缓冲液、SDS-PAGE 凝胶配制试剂盒、胰酶、一抗稀释液、二抗稀释液(上海碧云天生物有限公司);Matrigel Basement Membrane Matrix、Transwell 小室(美国 Corning 公司);CCK-8试剂盒、结晶紫(江苏碧云天生物技术研究所)。
1.2.2主要仪器 NAPCO-8800 型恒温细胞培养箱(美国 SHELLAB 公司);Olympus IX-71 型光学显微镜(日本奥林巴斯株式会社);Western blot 电泳仪(上海天能科技有限公司)。
1.3 实验方法
1.3.1建立肿瘤-内皮细胞共培养体系 将5×104个密度的TPC-1细胞接种在Transwell小室的6孔板底部,1×105个密度的HUVECs细胞接种在 Transwell 小室的上层,上、下室分别加入2 ml和3 ml含有FBS的DMEM细胞培养液, 于5% CO2、37 ℃细胞培养箱中培养过夜。利用Transwell将HUVECs和TPC-1细胞置于同一培养体系中, 构建肿瘤细胞与肿瘤血管内皮细胞共培养模型。
1.3.2迁移实验检测IL-17 刺激剂对共培养体系中HUVECs迁移能力的影响 该研究分为2组:NC-HUVECs组(对照组)、IL-17A-HUVECs组。制备细胞悬液,使用24孔Transwell系统(嵌套膜孔径8 μm)。先于下层小室接种TPC-1细胞,12 h后,于上层接种HUVECs,2种细胞接种密度均为1×105个。以50 ng/ml的重组人 IL-17A干预细胞,在37 ℃、5% CO2条件下培养6 h。培养完成后,取出小室,用4%的多聚甲醛固定、结晶紫染色,显微镜下观察并拍照,随机选择3个视野进行比较,实验重复 3 次。
1.3.3体外成管实验检测IL-17 刺激剂对共培养体系中 HUVECs成管能力的影响 该研究分为2组:NC-HUVECs组(对照组)、IL-17A-HUVECs组。HUVECs与TPC-1共培养24 h,铺基质胶,模拟体内HUVECs迁移并形成血管的微环境。将RPMI-1640培养基与Matrigel基质胶以体积1 ∶9的比例均匀混合,以每孔50 μl的量加入96孔板中,96孔板在37 ℃细胞培养箱内过夜备用,在基质胶中加入HUVECs,取 3×103/ml HUVECs 接种于96孔板中,设3个平行复孔。观察基质胶上HUVECs形成的小管并计数,3 d后观察并照相,在倒置显微镜下任取10个视野计数成管数(个)。
1.3.4CCK-8 法检测IL-17 刺激剂对共培养体系中HUVECs增殖的影响 选用TPC-1细胞与HUVECs共培养,该研究分为2组:NC-HUVECs组(对照组)、IL-17A-HUVECs组。使用96孔Transwell系统(嵌套膜孔径0.4 μm)。下层接种4×103个TPC-1细胞,12 h后于上层接种2×103个HUVECs。50 ng/ml重组人IL-17A干预细胞,共培养6 h,每种处理设3个复孔。培养结束后,弃下层培养基,在上层每孔中加入10 μl CCK-8 溶液,在细胞培养箱内孵育1 h 后用酶标仪检测450 nm处吸光度值。
1.3.5IL-17R基因载体构建 本研究遵循设计原则,根据人IL-17R 基因编码序列,设计干扰慢病毒及相关阴性对照,PCR 扩增得到目的基因IL-17R cDNA片段。纯化后经Age I酶切消化,对载体质粒进行酶切、线性化载体片段回收获得。酶切后连接产物利用 PCR 凝胶电泳鉴定,并对序列进行检测。
1.3.6细胞转染 选取对数生长期的TPC-1细胞,胰酶消化,接种于6 孔板中,设pLKO.1-EGFP-Puro-IL-17R 组、pLKO.1-EGFP-Puro 空载体组及对照组。以感染复数(multiplicity of infection,MOI)等于10的指数转染细胞,继续培养24 h后,将2 μl的5 μg/ml poly-brene加入转染细胞,根据细胞状态10 h换液1次。转染72 h后,GFP荧光的时间和表达强度采用GFP 荧光计数法观察来确定转染情况。转染成功后将各组细胞转移至细胞瓶中继续培养,得到稳定的细胞。6 h后更换新鲜培养基,24~48 h后观察IL-17R表达情况。Western blot法、RT-PCR法检测IL-17融合基因的表达。
1.3.7RT-PCR法检测IL-17R的表达情况 该研究分为4组:GFP-NC组(对照组)、GFP-IL-17R-sh1组、GFP-IL-17R-sh2组、GFP-IL-17R-sh3组。按试剂盒说明书步骤提取转染后各组细胞的总 RNA,将RNA逆转录成cDNA。设计引物序列,将以含有扩增序列的cDNA为模板进行PCR反应。反应结束后记录各组实验结果,以GAPDH为内参,分析各组IL-17R的表达。
1.3.8pLKO.1-EGFP-Puro-IL-17R转染的TPC-1细胞和HUVECs体外双层共培养模型的建立 将5×104个密度的HUVECs接种在Transwell小室的6孔板底部,将1×105个密度的pLKO.1-EGFP-Puro-IL-17R转染的TPC-1细胞接种在Transwell小室的上层,上、下室分别加入2 ml和3 ml含有FBS的DMEM细胞培养液, 于5% CO2、37 ℃细胞培养箱中培养过夜。利用Transwell 将 HUVECs 细胞和TPC-1细胞置于同一培养体系中, 构建肿瘤细胞与肿瘤血管内皮细胞共培养模型。
1.3.9Western blot法检测共培养体系中DLL4-Notch信号通路和血管新生蛋白表达水平 选用转染后的TPC-1 细胞与HUVECs共培养,加入50 ng/ml 的IL-17刺激剂。选用TPC-1 细胞与HUVECs共培养,加入50 ng/ml的IL-17刺激剂和DLL4-Notch 通路抑制剂 DAPT。收集各组细胞,每组约5×105个,离心弃培养液,沉淀用PBS洗涤2次,弃上清液。按1×106个细胞加入100 μl RIPA蛋白裂解液+1 μl PMSF蛋白酶抑制剂的比例裂解细胞。4 ℃倾卧30 min 后,4 ℃、14 000 r/min离心15 min,收集上清液,-80 ℃保存备用,需在冰上完成以上操作。BCA 法蛋白定量,每泳道20 μl蛋白上样进行SDS-PAGE电泳,在转移缓冲液中,以 200 mA 的电流转移到 PVDF 膜上。后封闭2 h,再加入抗DLL4、Notch、HES、HEY、VEGFR-1、VEGFR-2抗体,均按照 1∶1 000进行稀释,4 ℃孵育过夜。洗涤后,以辣根过氧化物酶结合的二抗按照 1 ∶5 000进行稀释,室温孵育2 h,ECL 试剂盒显色。用 Image-Pro plus 图像处理系统分析计算灰度值。

2 结果
2.1 IL-17刺激剂促进共培养系统中HUVECs迁移的能力迁移实验结果显示,IL-17A-HUVECs组细胞穿过小室底的细胞数高于NC-HUVECs组(t=5. 428,P<0.01)。可以发现与NC-HUVECs组比较,经IL-17刺激剂诱导后HUVECs的迁移能力得到显著增强,见图1。
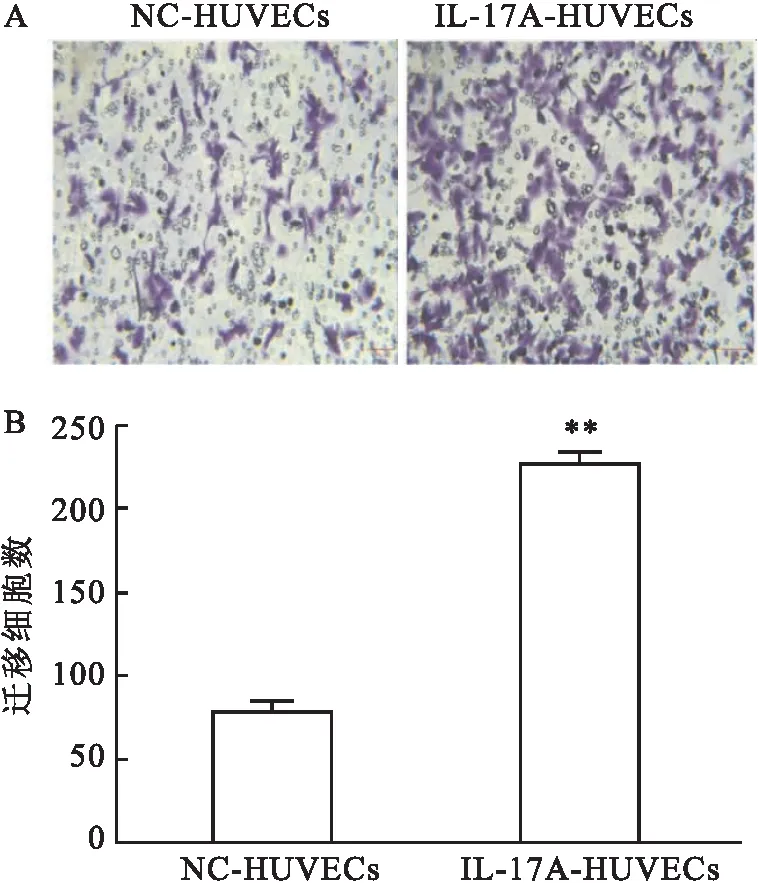
图1 重组人IL-17A对共培养系统中HUVECs 迁移的影响 ×200
2.2 IL-17刺激剂促进共培养系统中HUVECs 管腔生成的能力管腔生成实验显示,IL-17A-HUVECs组将加入50 ng/ml IL-17刺激剂的TPC-1细胞和HUVECs共培养后,IL-17A-HUVECs组、NC-HUVECs组管腔生成率为(120.92±8.75)%,(30.71±6.37)%,管腔生成能力得到显著增强,与NC-HUVECs组比较,差异有统计学意义 (t=8.758,P<0.01) 。提示IL-17能够促进HUVECs的管腔生成能力,见图2。
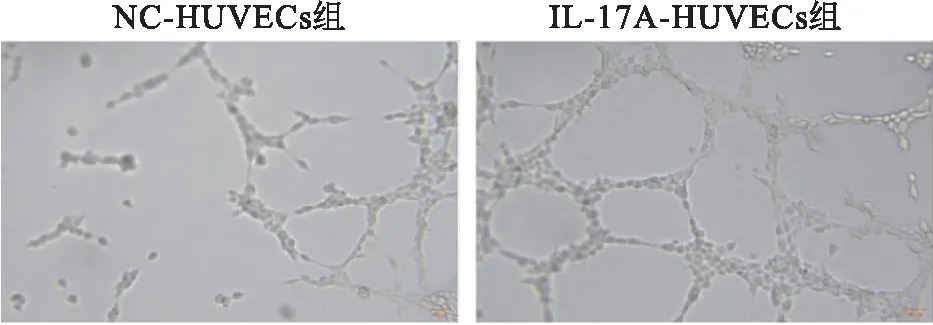
图2 重组人IL-17A对共培养系统中HUVECs 管腔生成能力的影响 ×200
2.3 IL-17刺激剂促进共培养体系中HUVECs的增殖能力CCK-8 法检测显示,IL-17刺激剂干预浓度为50 ng/ml时,与TPC-1细胞共培养的HUVECs 增殖能力显著增强,IL-17A-HUVECs组与NC-HUVECs组比较,差异有统计学意义 (t=6.542,P<0.01) 。IL-17刺激剂干预可显著促进共培养体系中 HUVECs 的增殖能力,见图3。
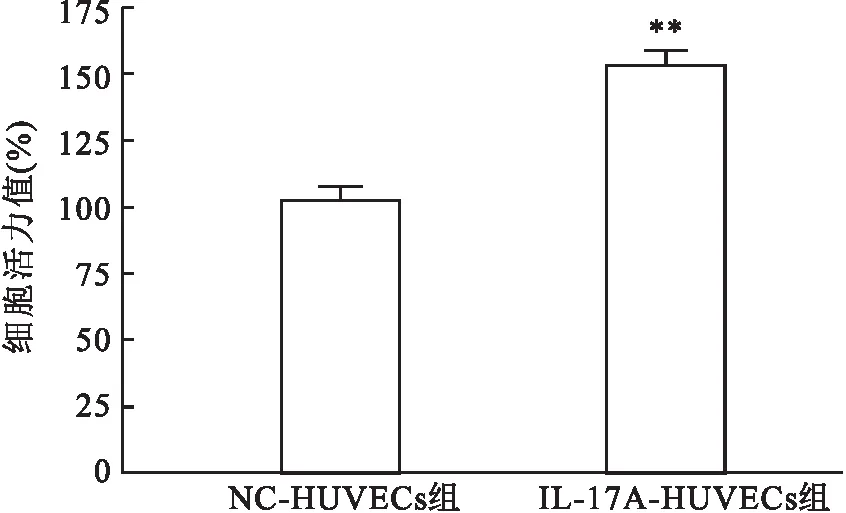
图3 重组人IL-17A对共培养系统中HUVECs增殖的影响与NC-HUVECs组比较:**P<0.01
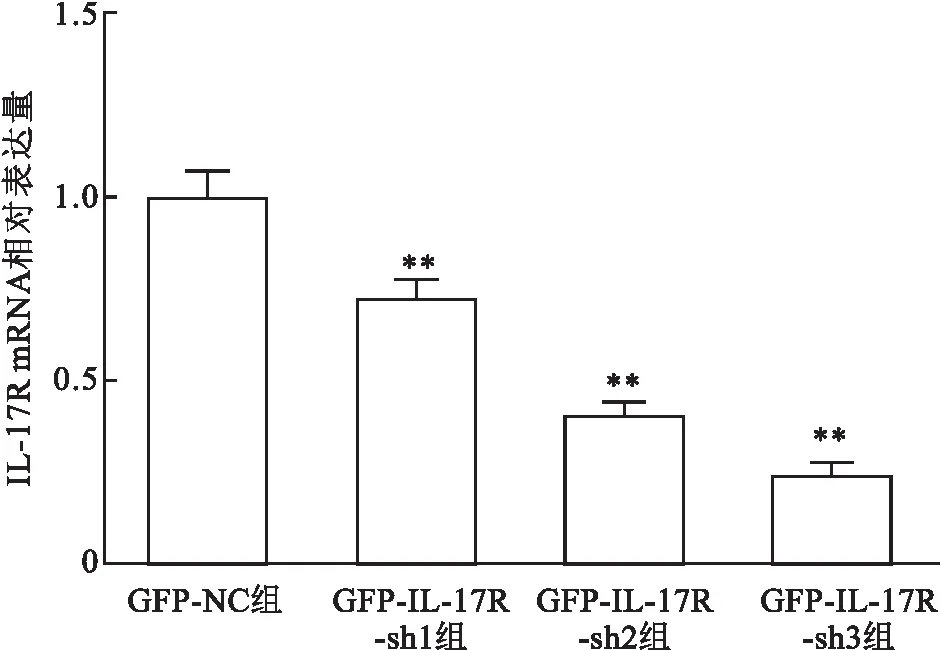
图4 TPC-1细胞转染pLKO.1-EGFP-IL-17R后IL-17R mRNA 的表达量与GFP-NC组比较:**P<0.01
2.4 RT-PCR验证稳定细胞株中 IL-17R的表达采用 RT-PCR实验观察 pLKO.1-EGFP-Puro-IL-17R转染后的甲状腺乳头状癌TPC-1细胞株中IL-17R mRNA 表达水平变化情况,结果显示: 各组中IL-17R mRNA表达水平明显降低,差异有统计学意义(t=7.197,P<0.01),其中 GFP-IL-17R-sh3干扰效果最明显(P<0.01),效率最高,见图 4。
2.5 Western blot法验证IL-17R蛋白的表达采用 Western blot法检测pLKO.1-EGFP-Puro-IL-17R转染后的甲状腺乳头状癌TPC-1细胞株中 IL-17R 蛋白表达变化,结果显示: 与GFP-NC组比较,GFP-IL-17R-sh2、 GFP-IL-17R-sh3沉默组中 IL-17R蛋白表达降低,差异有统计学意义(t=7. 268,P<0.01),其中 GFP-IL-17R-sh3组沉默效率最高,见图5。
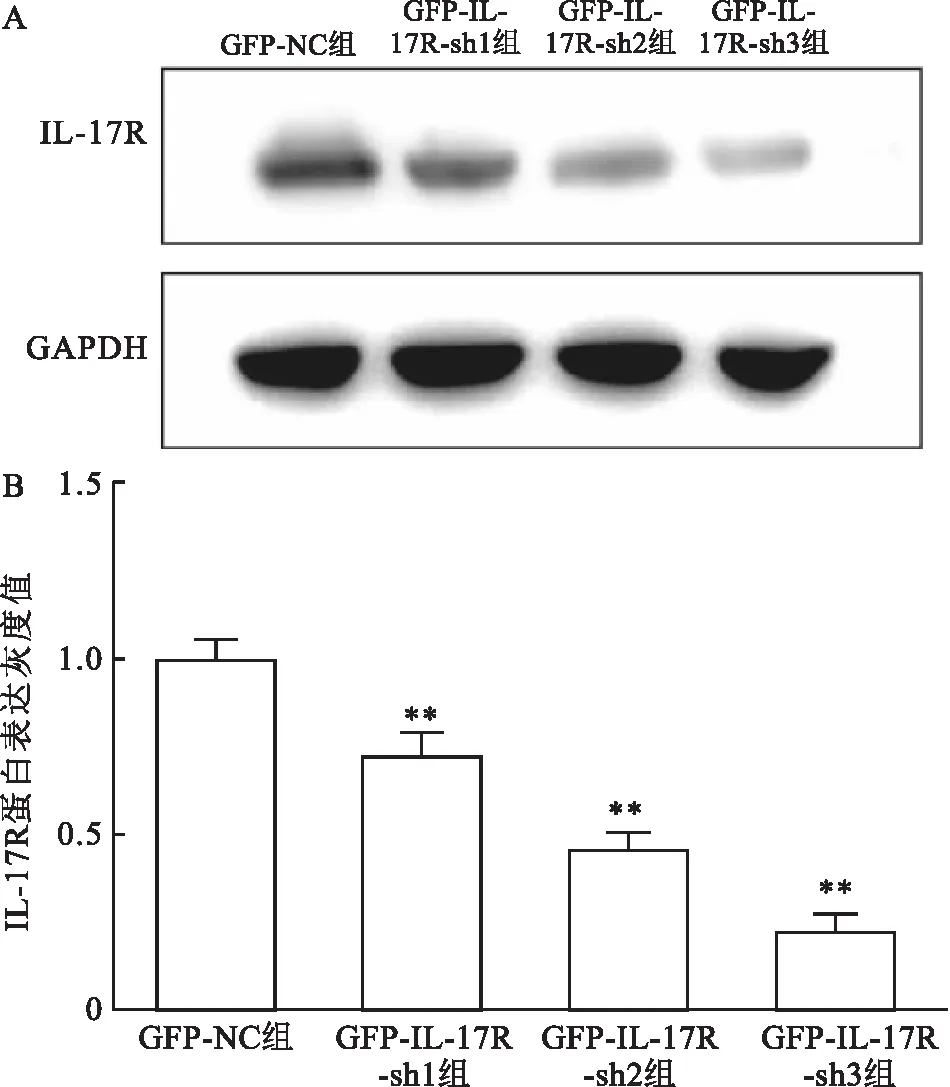
图5 Western blot检测人甲状腺乳头状癌TPC-1细胞株转染pLKO.1-EGFP-Puro-IL-17R后IL-17R蛋表达
2.6 调控TPC-1细胞IL-17R对甲状腺乳头状癌新生血管生成的影响为了明确IL-17/IL-17R对甲状腺乳头状癌血管生成的影响,该研究采用 Western blot 实验观察pLKO.1-EGFP-Puro-IL-17R转染后的TPC-1细胞株共培养体系中HUVEC的VEGFR-1、VEGFR-2和DLL4/Notch信号通路中关键蛋白表达水平的变化情况。该研究分为三组:TPC-1+HUVECs组(对照组)、TPC-1+HUVECs+sh-IL-17R组、TPC-1+HUVECs+sh-IL-17R+IL-17A组。结果显示: sh-IL-17R组中 DLL4、Notch、HES、HEY和 VEGFR-1、VEGFR-2蛋白表达降低,差异有统计学意义(t=5.758,P<0.01); sh-IL-17R+IL-17组经 50 ng/ml重组人IL-17A干预6 h后,细胞中DLL4、Notch、HES、HEY和 VEGFR-1、VEGFR-2的表达水平得到不同程度的上调,与TPC-1+HUVECs+sh-IL-17R组比较,差异有统计学意义 (t=8.285,P<0.01),见图6。
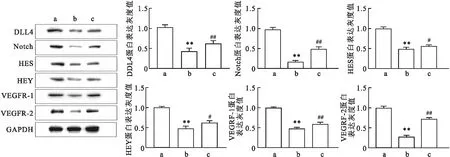
图6 Western blot法检测pLKO.1-EGFP-Puro-IL-17R转染后的TPC-1细胞株共培养HUVEC体系中的DLL4/Notch信号通路相关分子蛋白表达
2.7 IL-17/IL-17R可能通过激活DLL4/Notch信号通路促进甲状腺乳头状癌的血管生成为了明确DLL4/Notch信号通路在IL-17/IL-17R促进甲状腺乳头状癌的血管生成的作用,在IL-17 刺激剂下TPC-1细胞和HUVECs共培养体系中加入 DLL4-Notch 通路抑制剂 DAPT,分为3组:TPC-1+HUVECs组(对照组)、TPC-1+HUVECs+IL-17A组、TPC-1+HUVECs+IL-17A+DAPT组。Western blot检测结果显示,与对照组比较,TPC-1+HUVECs+IL-17A组HUVECs中DLL4、HES、HEY和VEGFR-1、VEGFR-2蛋白表达均上调,差异有统计学意义(t=4.852,P<0.01), TPC-1+HUVECs+IL-17A+DAPT组HES、HEY和 VEGFR-1、VEGFR-2蛋白表达均低于 TPC-1+HUVECs+IL-17 组,差异有统计学意义(t=8.329,P<0.01),见图7。
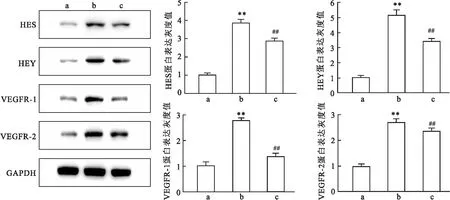
图7 Western blot检测在IL-17刺激剂下TPC-1细胞和HUVECs共培养体系中加入 DLL4-Notch 通路抑制剂 DAPT相关分子蛋白表达
3 讨论
研究[9]表明,血管生成在甲状腺乳头状癌的生长和转移中具有重要作用,与甲状腺癌发病密切相关。在肿瘤进展过程中,血管及淋巴管生成是最基本的因素,也是肿瘤微环境的重要组成部分。肿瘤的生长与转移需要血管生成提供必要的营养[10]。很多研究在胰腺癌、乳腺癌、肺癌等恶性肿瘤中发现,在肿瘤致病和侵袭转移中,IL-17及其受体介导的信号通路发挥重要作用。研究[11]显示IL-17可以诱导肿瘤的新生血管生成,促进肿瘤细胞增殖,抑制细胞凋亡。本研究结果显示,在TPC-1-HUVECs共培养系统中,加入50 ng/ml IL-17刺激剂的TPC-1细胞与HUVECs共培养6 h后,可以发现经IL-17刺激剂诱导后HUVECs的迁移能力显著增强。CCK-8法检测显示共培养体系中内皮细胞迁移能力显著高于共培养对照组,管腔生成实验发现,50 ng/ml的IL-17刺激剂促进共培养体系中HUVECs的管腔生成能力。本研究通过细胞功能学实验观察到以重组人IL-17A(50 ng/ml)为刺激剂可以促进 HUVECs的迁移、增殖和管腔生成能力。多种信号通路参与调控肿瘤的血管生成,除最重要最典型的VEGF信号通路外,研究[12]显示DLL4-Notch信号通路在这其中也发挥了重要作用。研究[13]表明IL-17刺激诱导少突胶质细胞的NOTCH1活化,导致炎性基因表达增强伴随着细胞增殖和成熟受损。IL-17单克隆抗体 Secukinumab联合IL-35可阻断Notch信号通路,与未治疗组比较,治疗用 IL-17单克隆抗体 Secukinumab联合IL-35可有效抑制Notch的下游基因信号通路(HES和HEY)的表达,同时还原肝癌细胞的侵袭性迁移能力[14]。DLL4是通过与Notch受体结合来完成肿瘤血管新生的调控。HES、HEY是 Notch 信号通路的靶基因。在人类动脉血管内皮细胞的研究中,发现 HES、HEY是Notch信号通路的脉管系统中下游效应因子,HES、HEY的激活可以促进血管生成细胞芽生,还能诱导血管形成模式的改变,很多研究[15]表明调控肿瘤新生血管形成过程中HES、HEY可能发挥重要作用。为了明确IL-17/IL-17R对甲状腺乳头状癌血管生成的影响,该研究通过慢病毒pLKO.1-EGFP-Puro-IL-17R转染TPC-1细胞共培养HUVECs,通过转染后PCR和Western blot检测验证转染是成功的,Western blot检测pLKO.1-EGFP-Puro-IL-17R转染后的TPC-1细胞共培养HUVECs体系中的DLL4-Notch信号通路和血管新生蛋白表达水平,结果显示: sh-IL-17R+IL-17A组经50 ng/ml重组人IL-17A干预6 h后,细胞中DLL4、Notch、HES、HEY和 VEGFR-1、VEGFR-2的表达水平得到不同程度的上调,IL-17可以逆转由于IL-17R沉默所导致DLL4、Notch、HES、HEY和 VEGFR-1、VEGFR-2表达水平降低。提示IL-17/IL-17R可能激活TPC-1细胞共培养HUVECs中DLL4/Notch信号通路,促进甲状腺乳头状癌新生血管生成。为了明确DLL4/Notch信号通路在IL-17/IL-17R促进甲状腺乳头状癌的血管生成的作用,本研究在IL-17刺激剂下TPC-1细胞和HUVECs共培养体系中加入DLL4-Notch 通路抑制剂DAPT,Western blot 检测结果显示: TPC-1+HUVECs+IL-17A+DAPT组HES、HEY和 VEGFR-1、VEGFR-2蛋白表达均显著低于TPC-1+HUVECs+IL-17组。提示DLL4/Notch信号通路可能在IL-17/IL-17R促进甲状腺乳头状癌新生血管生成中起到重要作用。
综上所述,在TPC-1-HUVECs共培养系统中,IL-17/IL-17R可以激活DLL4/Notch信号通路,然后诱导靶基因HES、HEY和VEGFR-1、VEGFR-2表达增加。IL-17可以促进TPC-1-HUVECs共培养系统中HUVECs的迁移、增殖和管腔生成能力。所以,IL-17/IL-17R可能通过DLL4/Notch 信号通路促进甲状腺乳头状癌新生血管生成。

