荜茇酰胺调控STAT3/HIF-1α通路抑制三阴性乳腺癌细胞增殖
白芙婷,姜 怡,郭宇航,张藏烨,王博韬,剡雨彤,周怡菲,孙 卓,陈 镝
三阴性乳腺癌(triple-negative breast cancer,TNBC)因高转移、高侵袭、高复发等特点导致预后较差[1]。TNBC因缺乏有效靶点而主要依赖化疗,然而化疗药物毒副作用大且易产生耐药,导致患者预后不佳[2]。信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)/缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)通路是调控肿瘤细胞的关键通路。STAT3在恶性肿瘤中异常激活,是肿瘤治疗的重要分子靶点。HIF-1α是STAT3的靶分子,可促进肿瘤增殖、血管生成和耐药等。研究[3]显示,白细胞介素-6通过激活STAT3诱导HIF-1α上调,抑制化疗药物产生的细胞毒和促凋亡作用,导致耐药发生。上述研究提示,抑制STAT3/HIF-1α通路的活性将有望改善TNBC化疗现状。荜茇酰胺(piperlongumine,PL)可抑制不同类型癌细胞增殖并诱导凋亡。研究[4]显示,PL通过降低STAT3磷酸化抑制TNBC增殖,而对HIF-1α的调控尚不明确。探究PL对STAT3/HIF-1α通路的调控机制,将为PL应用于TNBC的临床治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株 三阴性乳腺癌MDA-MB-231细胞来源于西安交通大学第一附属医院。
1.1.2实验动物 12只5周龄SPF级雌性裸鼠购于北京华阜康生物科技股份有限公司,体质量(18.4±0.54)g。生产许可证号:SCXK(京)2019-0008。使用许可证号:SYXK(陕)2022-004。
1.1.3主要药物与试剂 PL购于美国APExBIO公司;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、青链霉素、Accutase购于美国GIBCO公司;胰蛋白酶购于美国MP公司;MTT试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)购于美国Sigma公司;Annexin V-FITC/PI双染试剂盒购于美国BD公司;BCA蛋白定量试剂盒、特超敏ECL化学发光试剂盒购于上海碧云天生物技术有限公司;一抗:增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体、细胞周期依赖性蛋白激酶抑制因子1A(cyclin dependent kinase inhibitor 1A,CDKN1A/p21)抗体、STAT3抗体、磷酸化信号转导与转录激活因子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)抗体、HIF-1α抗体、存活素(Survivin)抗体购于美国CST公司;小鼠抗β-actin一抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠/兔二抗购于上海碧云天生物技术有限公司。
1.1.4主要仪器 Epoch酶标仪(美国BioTek公司);Accuri C6流式细胞仪(美国BD公司);Mini Pro TEAN Tera cell电泳仪、Chemi Doc凝胶成像系统(美国BIO-RAD公司)。
1.2 方法
1.2.1细胞培养 MDA-MB-231细胞用DMEM高糖培养液(含10%胎牛血清和1%青链霉素)培养,置于37 ℃、5% CO2饱和湿度的培养箱。细胞密度达70%以上时,用胰蛋白酶消化传代。
1.2.2细胞增殖实验 取对数期的MDA-MB-231细胞消化接种于96孔板,100 μl/孔过夜培养。药物分别作用24、48、72 h后再吸出。加MTT工作液100 μl/孔培养4 h后吸出。加DMSO 100 μl/孔振荡10 min。酶标仪测定各孔490 nm波长处吸光度值(absorbance,A),计算细胞存活率及半抑制浓度(half maximal inhibitory concentration,IC50)。细胞存活率(%)=A(PL组-空白组)/A(PL 0 μmol/L组-空白组)×100%。
1.2.3细胞凋亡实验 取对数期的MDA-MB-231细胞消化接种于12孔板,2 ml/孔过夜培养。药物作用48 h后,用Accutase消化并收集各孔细胞于100 μl缓冲液中。每管分别加5 μl AnnexinV-FITC和5 μl PI,混匀后室温避光孵育15 min。加400 μl binding buffer,以流式细胞仪检测细胞凋亡率。
1.2.4Western blot RIPA裂解液冰上裂解细胞30 min,4 ℃、12 000 r/min离心20 min收集上清液。用BCA蛋白定量试剂盒测定浓度,以等体积loading buffer和不同体积PBS混合至浓度相同。采用SDS-PAGE电泳,湿转蛋白至PVDF膜。5%脱脂牛奶室温封闭1 h,加入PCNA、Bcl-2、p21、STAT3、p-STAT3、HIF-1α、Survivin、β-actin抗体(1 ∶1 000)4 ℃孵育过夜,PBST漂洗5次。二抗(1 ∶1 000)室温孵育1 h,重复漂洗步骤。加ECL发光液显色,凝胶成像仪检测灰度值。
1.2.5裸鼠荷瘤实验 12只雌性裸鼠饲养于西安医学院SPF级动物饲养单元。将100 μl MDA-MB-231细胞悬液(5×106个)注射于每只裸鼠的乳腺处。待裸鼠肿瘤体积达到约50 mm3时,将12只裸鼠随机均分为PBS组和PL组,PBS组6只裸鼠编号为PBS-1至PBS-6,PL组6只裸鼠编号为PL-1至PL-6。隔天经腹腔注射给药,PBS组注射100 μl PBS,PL组注射100 μl PL溶液(4 mg/kg,溶于PBS)。隔天记录裸鼠体质量,并以游标卡尺测量肿瘤的长径和短径,计算肿瘤体积。肿瘤体积=(长径×短径2)/2。给药结束后处死所有裸鼠,取出肿瘤称重,提取肿瘤总蛋白。

2 结果
2.1 PL对MDA-MB-231细胞增殖的影响MTT结果显示,不同浓度PL处理后,MDA-MB-231细胞存活率逐渐降低。PL作用24、48、72 h的IC50值分别为(17.73± 0.41)、(9.81± 1.21)、(6.77± 1.24)μmol/L,呈现量效和时效关系,见图1。
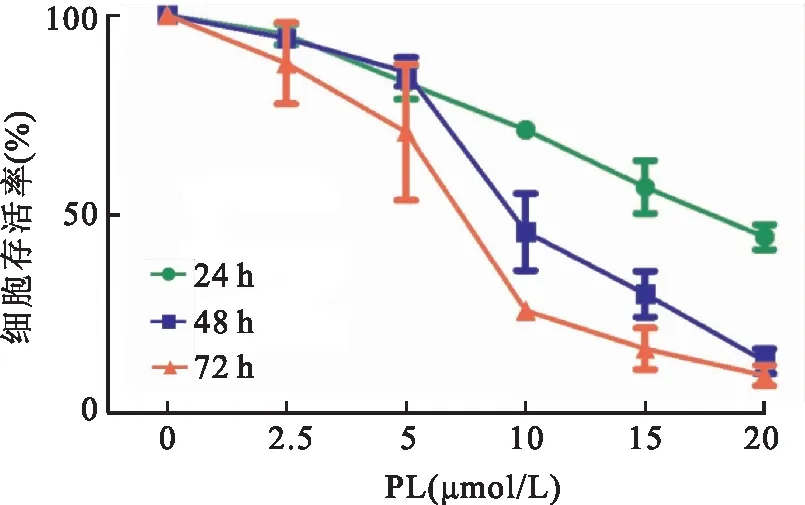
图1 PL对MDA-MB-231细胞增殖的影响(n=3)
2.2 PL对MDA-MB-231细胞凋亡的影响流式细胞术检测结果显示,不同浓度PL处理后,MDA-MB-231细胞凋亡率逐渐升高(F= 47.20,P<0.01),且呈量效关系,见图2。

图2 PL对MDA-MB-231细胞凋亡的影响(n=3)
2.3 PL对MDA-MB-231细胞增殖与凋亡信号通路的影响Western blot结果显示,在MDA-MB-231细胞中,PL处理后,PCNA和Bcl-2蛋白表达水平降低(F=24.87,P<0.01;F=17.54,P<0.05),p21蛋白表达水平升高(F=27.74,P<0.01),见图3。
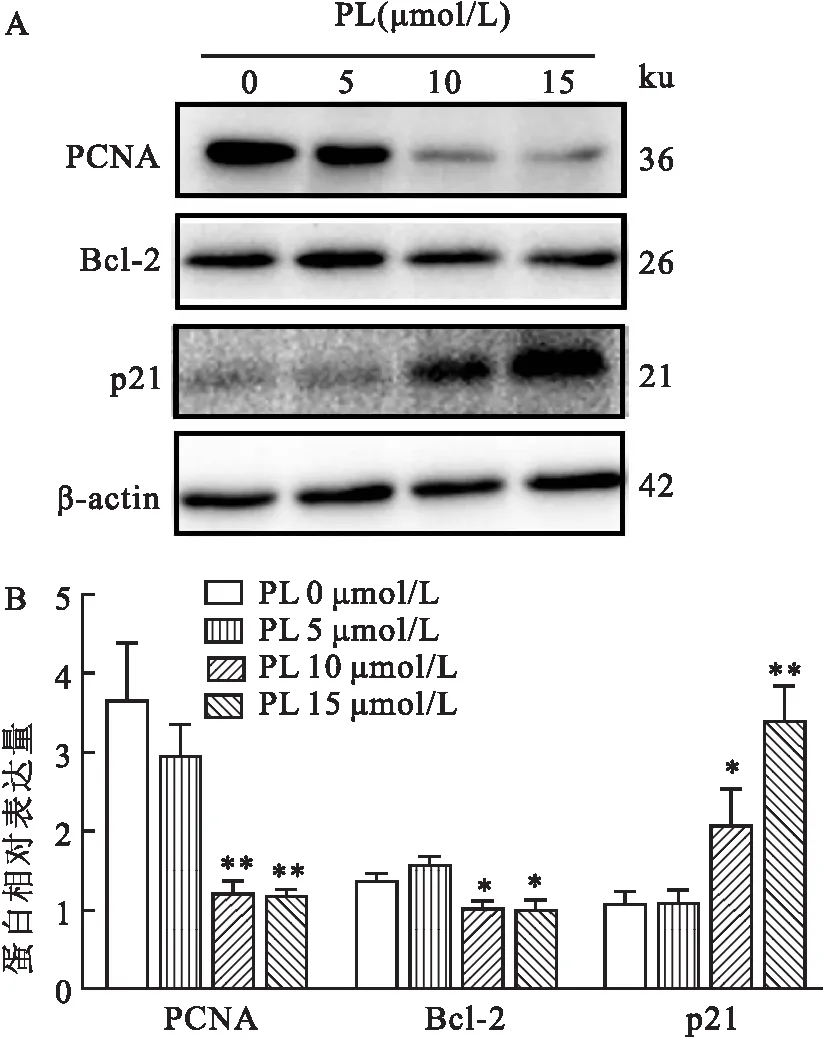
图3 PL对MDA-MB-231细胞增殖与凋亡信号通路相关蛋白表达水平的影响(n=3)
2.4 PL对MDA-MB-231细胞STAT3/HIF-1α信号通路的影响Western blot结果显示,在MDA-MB-231细胞中,PL处理后,p-STAT3、HIF-1α、Survivin 蛋白表达水平降低(F=26.65,P<0.01;F=50.54,P<0.01;F=41.08,P<0.01),STAT3蛋白表达水平无显著变化(F=1.26,P>0.05),见图4。
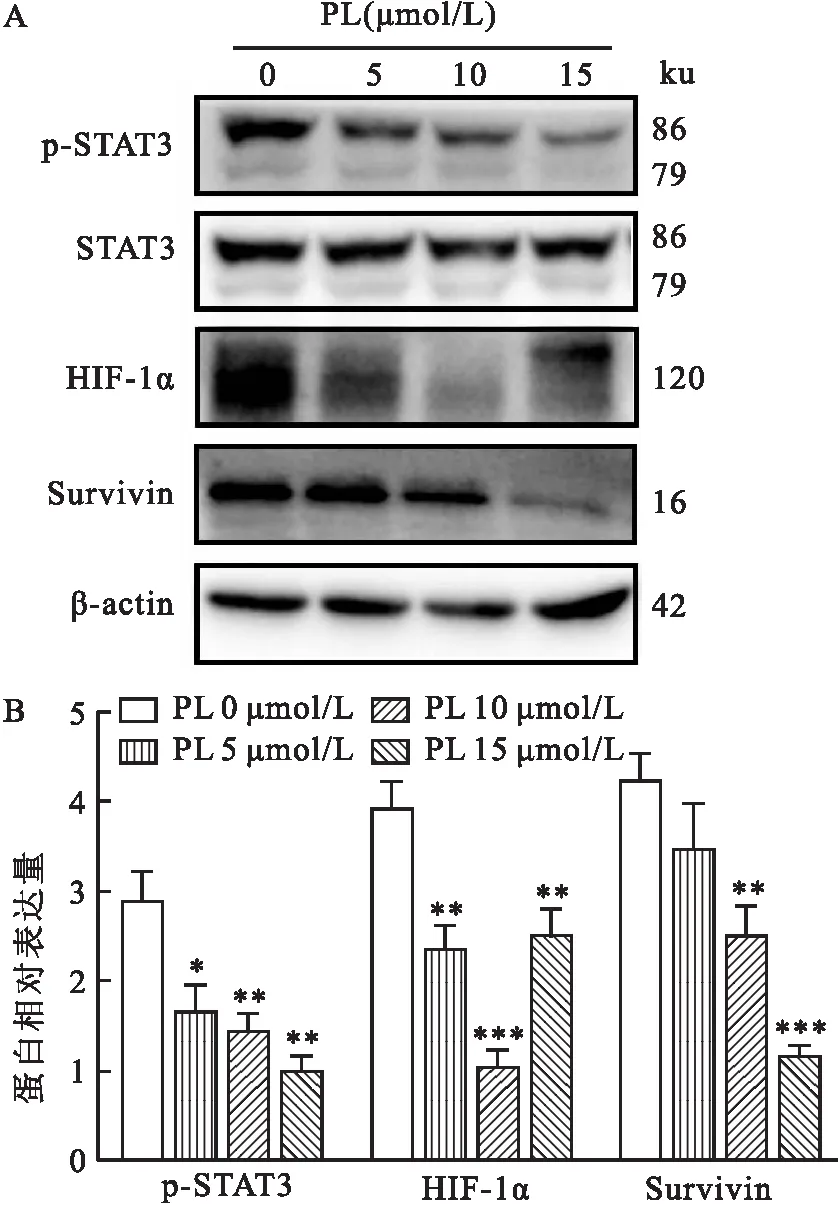
图4 PL对MDA-MB-231细胞STAT3/HIF-1α信号通路相关蛋白表达水平的影响(n=3)
2.5 PL对裸鼠肿瘤增殖的影响终止给药后,PBS组和PL组肿瘤体积分别为(867.68± 156.27)mm3和(590.70± 109.76)mm3,肿瘤质量分别为(0.895± 0.236)g和(0.560± 0.124)g。相较于PBS组,PL组肿瘤体积减小(F=12.62,P<0.01),肿瘤质量减轻(F=9.50,P<0.05)。两组裸鼠体质量间差异无统计学意义(F=0.49,P>0.05),见图5。

图5 PL对裸鼠肿瘤增殖的影响(n=1)
2.6 PL对裸鼠肿瘤中STAT3/HIF-1α信号通路的影响终止给药后,以液氮研磨提取裸鼠肿瘤组织总蛋白,Western blot法检测PBS组和PL组肿瘤组织中PCNA、p-STAT3、STAT3、HIF-1α、Survivin蛋白的相对表达量。两组的STAT3蛋白表达水平无显著变化(F=1.35,P>0.05)。相较于PBS组,PL组的PCNA、p-STAT3、HIF-1α、Survivin蛋白表达水平均降低(F=21.82,P<0.01;F=6.44,P<0.05;F=149.88,P<0.001;F=36.57,P<0.01),见图6。
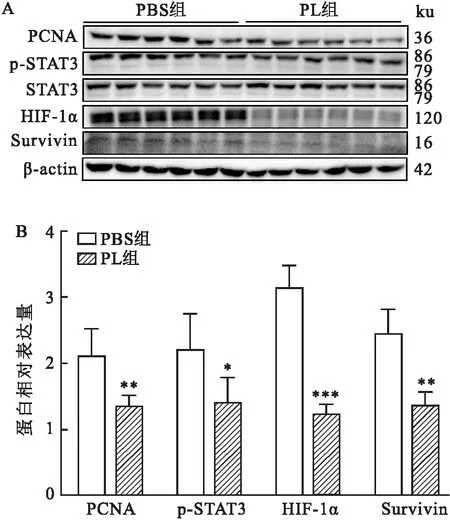
图6 PL对裸鼠肿瘤中STAT3/HIF-1α信号通路的影响(n=1)
3 讨论
TNBC在乳腺癌各种类型中恶性程度最高,且化疗预后不佳,患者的5年内生存率仅为60%[5]。STAT3是肿瘤早期诊断标志物,与乳腺癌恶变密切相关,其异常活化后调控HIF-1α等信号分子使癌细胞增殖活跃,并导致多脏器转移和多药耐药。PL被报道具有广泛的抗癌活性,能够抑制包括TNBC在内的多种肿瘤细胞增殖,而对正常细胞毒性较小。PL的抗癌机制涉及不同信号通路,其是否通过调控STAT3/HIF-1α通路介导对TNBC的抑制增殖和促凋亡作用目前尚不明确。
PL通过调控凋亡相关分子介导肿瘤细胞的凋亡和增殖。Kim et al[6]研究发现,p21通过直接靶向Bcl-2调节癌细胞的侵袭和凋亡。Bcl-2则通过线粒体凋亡途径控制细胞凋亡,当其表达水平升高时可促进乳腺癌细胞增殖。Chen et al[4]发现,PL通过下调Bcl-2的表达诱导MDA-MB-231细胞凋亡。此外,PCNA与Bcl-2的表达具有相关性,Bcl-2被抑制可导致PCNA表达下调[7]。本研究显示,PL对MDA-MB-231细胞的抑制增殖和诱导凋亡作用具有浓度依赖性。Western blot结果显示,PL上调了p21蛋白表达水平,下调了Bcl-2和PCNA蛋白表达水平,提示PL可能通过阻滞细胞周期诱导癌细胞凋亡。此外,裸鼠荷瘤实验结果表明,PL可在动物体内抑制MDA-MB-231细胞增殖,且未造成动物体质量异常变化。
STAT3/HIF-1α通路异常激活对于肿瘤的发展至关重要。STAT3持续激活促进肿瘤细胞快速增殖,导致缺氧微环境的形成,而HIF-1α是响应缺氧诱导的关键转录因子,两者共同介导肿瘤细胞的生物活性调控。STAT3是HIF-1α的原始调控分子,在缺氧条件下发生自身磷酸化[8]。p-STAT3通过激活HIF-1α的启动子,提高HIF-1α的转录和翻译活性。STAT3/HIF-1α通路异常激活可导致乳腺癌细胞的增殖、迁移、侵袭以及抗凋亡能力增强[9]。STAT3/HIF-1α通路还参与肿瘤细胞化疗耐药的形成。Wang et al[10]研究发现,miR-183通过抑制STAT3/HIF-1α通路增强了多药耐药肝癌细胞对5-氟尿嘧啶等化疗药物的敏感性。值得关注的是,HIF-1α或许发挥了更为关键的作用。Shi et al[11]在对多种乳腺癌细胞株的研究中发现,HIF-1α在MDA-MB-231细胞中表达最高,且该细胞在同等培养条件下增殖最快。Xiong et al[12]发现,HIF-1α激活将导致TNBC耐药以及化疗失败。此外,研究[13]显示HIF-1α通过调控下游凋亡抑制蛋白Survivin来增强胃癌细胞的抗凋亡能力。在胰腺癌中,联合阻抑HIF-1α和Survivin产生了比阻抑其一更强的抑制增殖作用[14]。这些研究提示,HIF-1α可能是改善TNBC化疗的关键因素。此前,PL对癌细胞HIF-1α的影响无明确报道,本研究显示PL可降低MDA-MB-231细胞HIF-1α的表达水平。随着PL浓度升高,体外和体内均检测到p-STAT3蛋白和Survivin蛋白表达水平降低。提示PL很可能通过抑制STAT3和HIF-1α的活性而降低Survivin蛋白表达水平,导致MDA-MB-231细胞增殖能力降低、凋亡率升高。
综上所述,本研究表明PL在体外和体内抑制MDA-MB-231细胞增殖,其分子机制可能与负调控STAT3/HIF-1α信号通路有关。PL抑制TNBC中HIF-1α表达的调控作用,但仍需在其他类型癌细胞中进行验证,裸鼠荷瘤实验还需要在更多剂量下检测PL的有效性和安全性。在未来的研究中,将选用耐药TNBC细胞探究PL抗耐药的机制,为PL应用于TNBC的临床治疗提供更为充分的理论依据。

