TLR4/RhoA信号通路调控连续血液滤过治疗引起脓毒症内皮细胞通透性变化的机制
余慧林,王建丰,刘 义,刘玉尧,蒋 薇,孟承颖,王 欢,胡德林
脓毒症是由于机体对感染的反应失调引起的危及生命的多器官功能衰竭[1]。烧伤患者由于皮肤屏障功能被破坏,以革兰阴性菌为主的病原体更易入侵机体造成感染引发脓毒症[2]。大部分革兰阴性菌的致病力与其细胞壁最外层的脂多糖相关。目前脓毒症的病理生理机制尚不明确,而内皮细胞屏障功能障碍在脓毒症的多器官损伤和死亡中起着重要作用[3]。血管内皮细胞钙黏蛋白(VE-cadherin)的水平与脓毒症病情严重程度有一定相关性[4]。内皮屏障功能的破坏往往伴随着VE-cadherin酪氨酸磷酸化的增加和细胞连接处聚合肌动蛋白丝(F-actin)聚合的减少[5]。目前脓毒症的治疗主要是通过连续血液滤过清除炎症细胞因子,减轻炎症反应,从而改善预后,尚无针对分子水平的治疗。该研究旨在通过检测连续血液滤过治疗前后炎症细胞因子及内皮通透性相关基因表达变化,探讨脓毒症内皮细胞通透性的调节作用及其机制。
1 材料与方法
1.1 脓毒症患者血清收集及连续血液滤过处理根据脓毒症诊断标准,收集5例行连续血液滤过治疗前后的脓毒症患者血清,并进行无菌处理,-80 ℃保存备用。应用 ELISA 法检测滤过前后血清中Toll样受体4(Toll-like receptor 4,TLR4)、Ras同源基因家族成员A (Ras homologue A, RhoA)、白细胞介素1(interleukin-1,IL-1)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的水平,严格按照试剂盒说明书操作,应用酶标仪于450 nm波长检测各样品吸光度(optical density,OD)值,所得数据进行统计分析。
1.2 主要试剂和仪器DMEM细胞培养基、胎牛血清购于Gibco公司,RNA提取试剂盒购于Invitrogen公司,反转录试剂盒购于Thermo Fisher公司,Real-time PCR试剂盒购于TaKaRa 公司,DEPC水、一抗稀释液购于碧云天生物技术研究所,蛋白提取及定量试剂盒购于北京索莱宝科技有限公司,Western blot聚丙烯酰胺凝胶试剂盒购于上海雅酶生物医药有限公司,广谱彩虹预染蛋白 Marker、ECL超敏发光试剂盒购于Thermo Fisher 公司,VE-cadherin 抗体、F-actin 抗体购于 Abcam 公司,山羊抗小鼠 IgG(HRP)、山羊抗兔 IgG(HRP)购于 Bioworld 公司,酶标仪Multiskan GO 1510购于美国Thermo Fisher 公司,细胞培养箱 MCO-18AC 购于日本松下公司,普通 PCR 仪器2720购于美国ABI公司,-80 ℃超低温冰箱 8950086A 购于美国 Thermo Fisher公司,荧光定量 PCR 仪 7500购于美国ABI公司。
1.3 方法
1.3.1细胞培养 常规复苏冻存的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),于DMEM 完全培养基中吹打混匀,放入37 ℃、5%CO2细胞培养箱中进行培养。培养细胞至汇合度为 80%时,根据实验设计进行后续实验。应用 10%的滤过前后血清干预HUVEC 24 h,检测脓毒症血清对 HUVEC通透性的影响;同时,应用Real-time PCR、Western blot 和免疫荧光法分别检测其对VE-cadherin 和 F-actin mRNA 及蛋白表达的影响。
1.3.2构建 TLR4 低表达株 根据TLR4(NM_138557)基因序列设计、合成 3 条干扰序列,干扰序列片段如下,TLR4-RNAi-I:5′-TATTCAAAGATACA-CCAGCGG-3′;TLR4-RNAi-Ⅱ:5′-ATATTAAGGTAG-AGAGGTGGC-3′;TLR4-RNAi-Ⅲ:5′- AAATTCTCCC-AGAACCAAACG-3′。并将其构建至质粒载体(GV298)上。Lipofectamine 3000进行细胞转染,检测分析各序列的干扰效率。选取干扰效率最高的序列(shRNA-Ⅰ),应用浓度为 1.0 μg/ml嘌呤霉素筛选6周,构建 TLR4 低表达稳转细胞株(TLR4-shRNA)。检测TLR4低表达对VE-cadherin、F-actin 和RhoA 表达的影响及其对血管内皮细胞通透性的影响。
1.3.3Real-time PCR检测VE-cadherin、F-actin 和TLR4 mRNA表达变化 遵照Real-time PCR试剂盒说明书,以cDNA为模板,采用 SYBRGreen 染料法进行实时荧光定量 PCR,检测各目的基因的表达,见表1。

表1 Real-time PCR 引物序列
1.3.4Western blot法检测VE-cadherin 和 F-actin、TLR4、RhoA蛋白表达变化 RIPA 裂解液(强)提取细胞总蛋白,采用BCA 法测量样品在 562 nm波长附近的吸光度值,测定蛋白浓度,调整合适后进行蛋白变性处理(100 ℃,5 min)。根据待检测蛋白分子量制备合适浓度的分离胶(GAPDH,10%;TLR4,7.5%;RhoA,15%;VE-cadherin,8%;F-actin,10%),经 SDS-PAGE 电泳分离后,分别进行转膜、封闭、一抗孵育[TLR4 (1 ∶400),RhoA(1 ∶500),VE-cadherin(1 ∶500),F-actin(1 ∶400)]、二抗孵育(1 ∶10 000)及 ECL发光、显影,以 GAPDH 为内参,进行灰度扫描及相对表达量分析。
1.3.5单层细胞通透性实验 制备单细胞悬液,细胞计数后调整细胞浓度至1×104/ml,然后将100 μl的HUVEC接种于Transwell小室,待单层内皮细胞层形成,测定跨上皮电阻(trans-epithelial electrical resistance,TER)至稳定后,无牛血清培养基培养12 h。双层小室的顶室加入FITC-albumin(溶于D-Hank液),底室加入D-Hank液。继续培养45 min,吸取双层小室的顶室和底室液体,应用荧光分光光度计,设定激发波长488 nm,发射波长525 nm,检测各样品荧光强度值,分析细胞通透性系数。
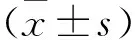
2 结果
2.1 血液滤过前后血清中相关细胞因子含量变化ELISA法检测结果显示:与滤过前相比,滤过后血清中 TLR4、RhoA、IL-1、IL-6 和 TNF-α含量均降低(t=4.722,P<0.01;t=4.168,P<0.01;t=6.623,P<0.01;t=8.141,P<0.01;t=6.372,P<0.01)。见图1。
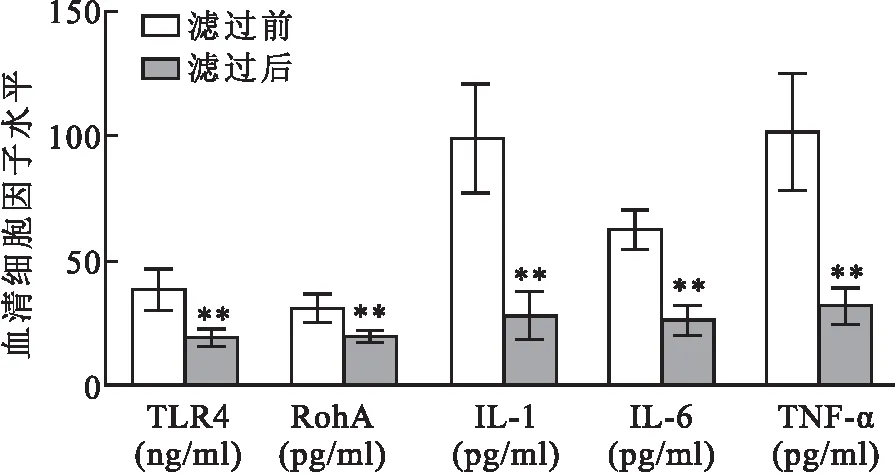
图1 滤过前后血清中细胞因子含量变化与同一指标滤过前比较:**P<0.01
2.2 滤过前后血清干预对细胞通透性的影响细胞通透性检测分析结果表明,与正常组相比,滤过前血清干预组荧光强度明显增强,单层细胞通透性系数明显升高(t=6.999,P<0.01);与滤过前血清干预组相比,滤过后血清干预组细胞通透性明显降低(t=5.195,P<0.01)。见图2。
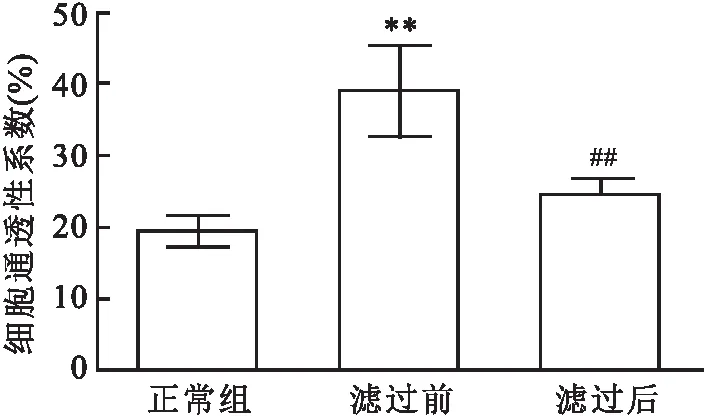
图2 滤过前后血清干预对血管内皮细胞通透性的影响与正常组比较:**P<0.01;与滤过前比较:##P<0.01
2.3 滤过前后血清干预对 VE-cadherin 和 F-actin 表达的影响分析结果表明,与正常组相比,滤过前血清干预组 VE-cadherin 和 F-actin mRNA 表达水平均降低(t=9.996,P<0.01;t=9.524,P<0.01),同时其蛋白表达也明显降低(t=6.849,P<0.01;t=12.340,P<0.01)。与滤过前干预组相比,滤过后血清干预组 VE-cadherin 和 F-actin mRNA表达水平均升高(t=3.237,P<0.01;t=4.605,P<0.01),见图3。同时其蛋白表达也明显升高(t=4.744,P<0.01;t=2.667,P<0.01),见图4。
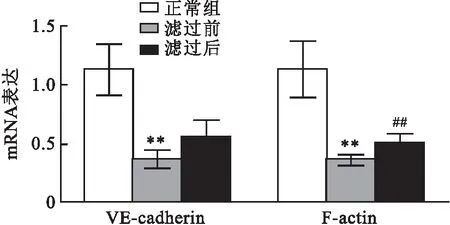
图3 滤过前后血清干预对VE-cadherin和 F-actin mRNA 表达的影响与正常组比较:**P<0.01;与滤过前比较:##P<0.01
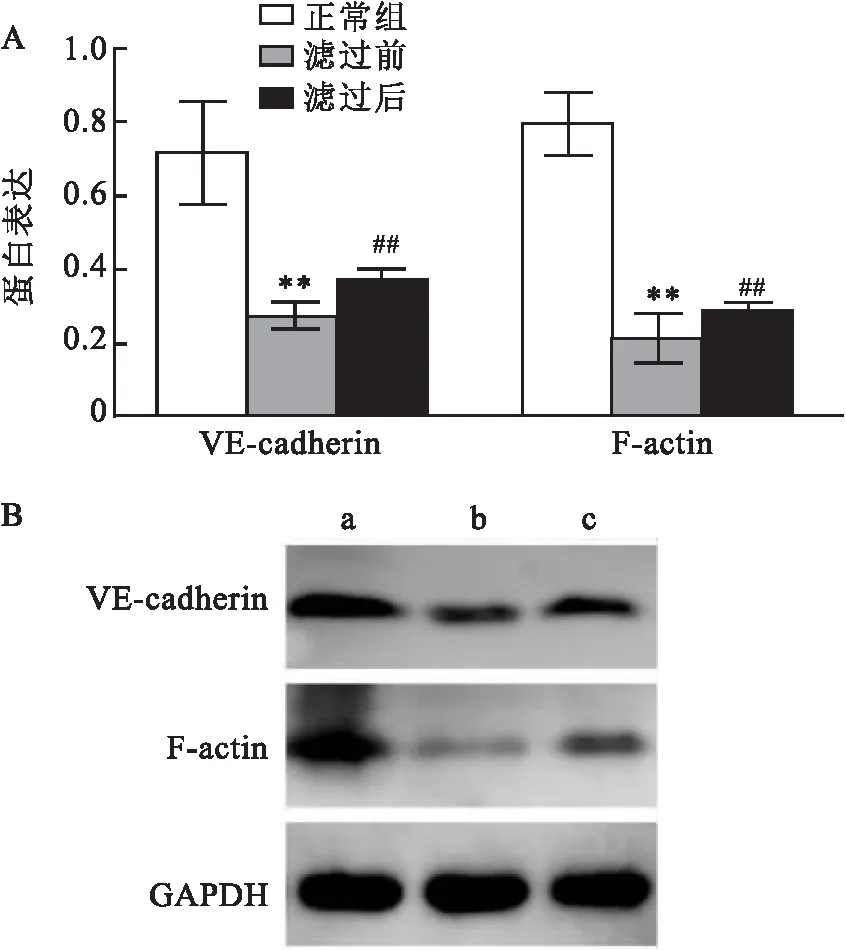
图4 滤过前后血清干预对 VE-cadherin 和 F-actin 蛋白表达的影响
2.4 滤过前后血清干预对TLR4 mRNA 表达的影响与正常组相比,滤过前血清干预组 TLR4 mRNA 表达显著升高(t=12.110,P<0.01);与滤过前血清干预组相比,滤过后血清干预组 TLR4 mRNA 表达显著降低(t=8.825,P<0.01)。见图5。
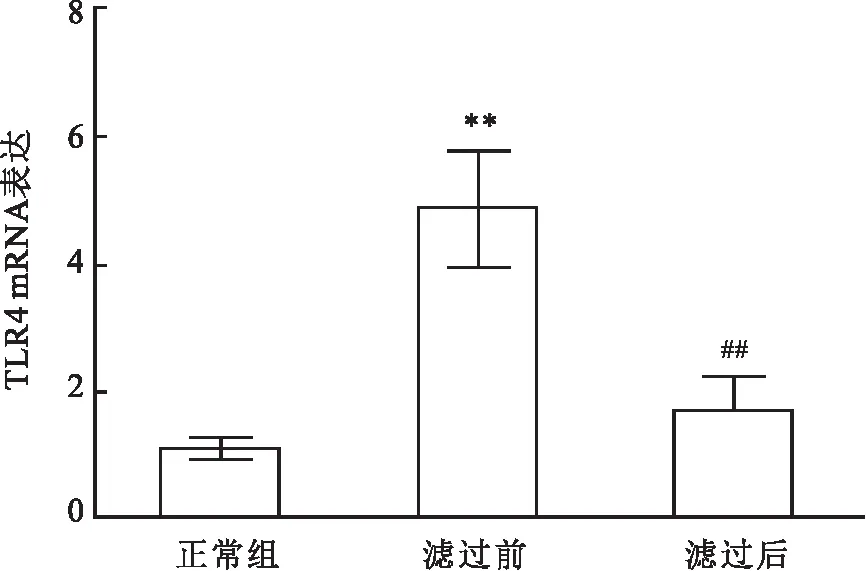
图5 滤过前后血清干预对 TLR4 mRNA 表达的影响与正常组比较:**P<0.01;与滤过前比较:##P<0.01
2.5 滤过前后血清干预对 TLR4 和 RhoA 蛋白表达的影响与正常组相比,滤过前血清干预组 TLR4 和 RhoA 蛋白表达升高(t=8.117,P<0.01;t=6.037,P<0.01);与滤过前血清干预组相比,滤过后血清干预组 TLR4 mRNA 表达降低(t=6.909,P<0.01;t=3.266,P<0.01)。见图6。
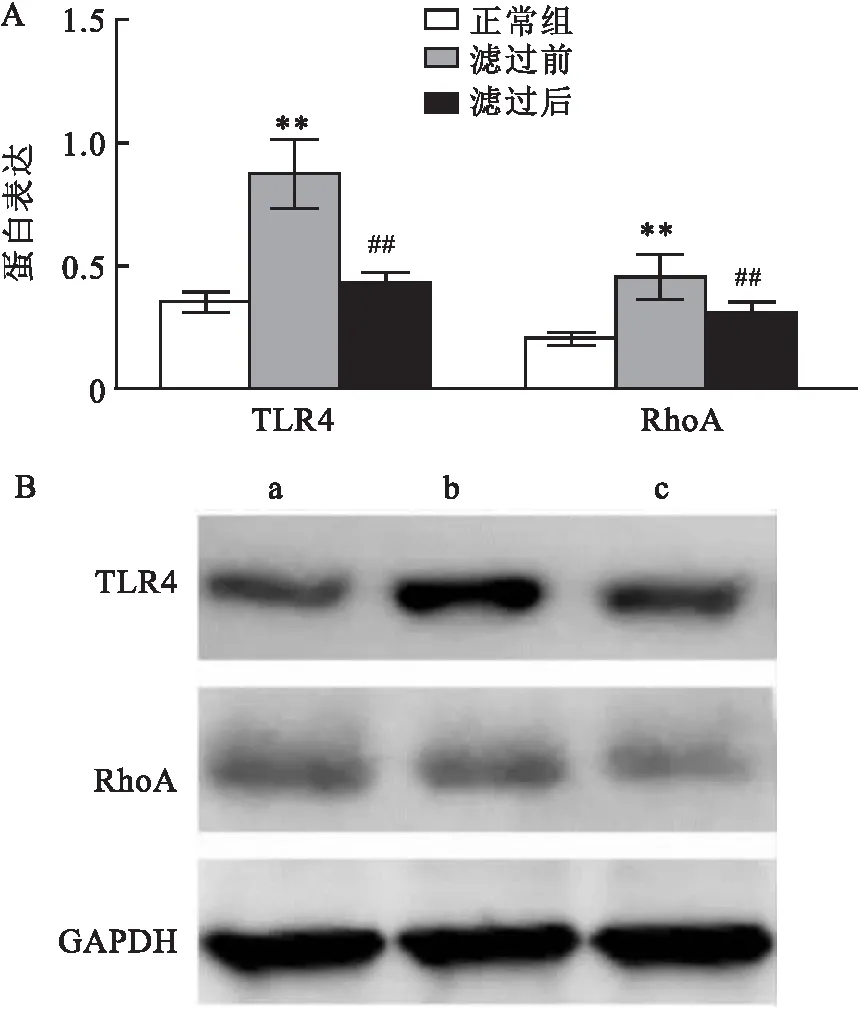
图6 滤过前后血清干预对 TLR4 和 RhoA 蛋白表达的影响
2.6 TLR4 低表达对 RhoA 及 VE-cadherin 和 F-actin 表达的影响Real-time PCR 分析结果表明,TLR4 低表达可明显促进 VE-cadherin 和 F-actin的 mRNA 表达,与正常组相比,差异有统计学意义(t=11.590,P<0.01;t=13.050,P<0.01)。同时,Western blot结果也表明,TLR4 低表达可抑制 RhoA 蛋白的表达(t=4.289,P<0.01),促进 VE-cadherin 和 F-actin 蛋白的表达(t=13.278,P<0.01;t=3.781,P<0.01)。见图7。
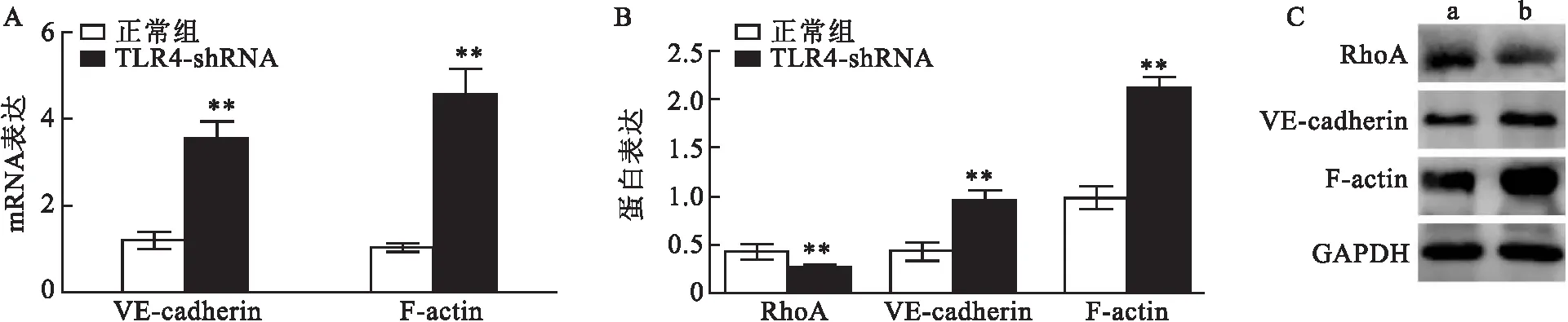
图7 TLR4 低表达对 RhoA、VE-cadherin 和 F-actin 表达的影响
3 讨论
连续血液滤过治疗对于清除炎症因子,改善脓毒症患者预后方面有着积极作用,但其在脓毒症病理生理过程中发挥作用的机制尚不明确。该研究中,经连续血液滤过治疗后,脓毒症患者血清中 TLR4、RhoA、IL-1、IL-6和TNF-α含量均显著降低,表明该疗法能够有效清除炎症因子。使用经连续血液滤过治疗前后的脓毒症血清干预HUVEC,结果显示滤过后血清干预组VE-cadherin、F-actin mRNA和蛋白表达明显升高,细胞通透性明显降低。提示通过连续血液滤过治疗可以保护血管内皮组成相关基因VE-cadherin 和 F-actin的表达,通过保护其结构功能,改善血管内皮细胞骨架结构,进而稳定血管内皮通透性。内皮细胞高通透性是脓毒症病理生理过程中的重要一环,这对于改善脓毒症预后有着重要意义。同时在该研究中还伴随着TLR4 和 RhoA 表达的显著降低。
RhoA是属于GTPases的Rho亚家族。研究[6]表明RhoA可通过调节细胞骨架的重组,降低紧密连接蛋白的表达,引起血管内皮屏障功能障碍。Rho蛋白是细胞骨架、细胞形态和运输的关键调节因子,能够在多种信号通路发挥作用。Amado-Azevedo et al[7]发现在脓毒症患者的肺微血管内皮细胞中,RhoA通过以Rho GTPase依赖性方式参与了增加黏附连接和细胞基质黏附的动力学来促进细胞回缩和间隙形成的过程。Rho家族的小GTPases在肌动蛋白细胞骨架动力学的控制中发挥关键作用[8]。Rho GTPase及其下游效应物Rho激酶(Rho associated kinase,ROCK)介导的Rho/ROCK信号通路已被证明参与细胞黏附、运动和收缩,参与调节内皮通透性[9]。研究[10]显示经脂多糖处理可降低肺微血管内皮细胞中紧密连接蛋白和VE-cadherin的表达水平,RhoA激活剂的应用能使连接蛋白表达减少,引起内皮屏障功能受损,RhoA是脂多糖诱导的内皮细胞功能障碍信号通路中的关键蛋白质。
脂多糖作为一种典型的病原体相关分子模式,可以被天然免疫系统中模式识别受体识别,模式识别受体能使它们将自身组织和外来病原微生物区分开,从而针对入侵的病原体产生防御性炎症反应[11]。这些受体中就包括Toll样受体,其在脓毒症中能够驱动内皮细胞释放细胞因子、趋化因子和促凝因子,并表达促黏附分子,引起内皮通透性增加致间质渗漏,最终导致微循环血流受损、组织灌注不足和危及生命的器官衰竭[12]。TLR4是Toll样受体家族成员,参与先天免疫并通过识别脂多糖介导炎症反应。TLR4的过度激活触发各种炎症因子的产生,在炎症反应的诱导中起着关键作用[13]。
该研究进一步构建了TLR4 低表达细胞株,结果显示TLR4低表达可明显促进VE-cadherin 和 F-actin的 mRNA和蛋白质表达,同时可抑制 RhoA 蛋白的表达,内皮通透性随之降低。TLR4/RhoA 信号通路能够影响细胞通透性相关基因VE-cadherin 和 F-actin的表达在脓毒症内皮细胞调节中发挥作用,而经过连续血液滤过治疗能够有效降低血液中 TLR4、RhoA 等细胞因子含量,从而影响脓毒症形成过程中的信号通路的正常转导,通过保护内皮细胞 VE-cadherin 和 F-actin 等结构以协助血管内皮功能的稳定,同时能够清除过多的IL-1、IL-6和TNF-α等炎症因子以减轻对免疫功能的破坏,从而改善脓毒症患者预后,为脓毒症的治疗提供了新思路。

