肥大细胞调节巨噬细胞极化在炎症性肠病中的作用
余畋余,刘道利,汪朝晖,胡霜久,刘 斌
炎症性肠病(inflammatory bowel disease, IBD)是一组病因未明的累及全肠道的慢性非特异性炎症疾病,主要包括溃疡性结肠炎和克罗恩病。IBD主要病理特征为肠黏膜的损伤[1],现主流研究观点认为其致病因素为免疫功能紊乱和上皮细胞屏障受损[2-3]。肥大细胞(mast cell, MC)是源自骨髓前体细胞的先天免疫细胞,在干细胞因子(stem cell factor, SCF)的影响下成熟,并最终在肠道上皮内间隙中定居。作为前哨免疫细胞群的一员,MC是抵抗攻击的一线防御细胞,与肠道炎症活动密切相关[4]。然而,MC在炎症性肠病过程中的作用和调节机制仍未有报道。该研究通过右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的IBD模型,构建野生型小鼠(以下简称WT小鼠)、MC缺陷小鼠(以下简称C-kit小鼠)和MC重建小鼠相关炎症癌症序列演变模型,探究MC在IBD过程中的作用和调节机制。
1 材料与方法
1.1 材料
1.1.1实验动物 WT型小鼠:雌性C57BL/6小鼠,6~8周龄,20~24 g,购于北京Vital River实验动物中心,饲养于同济大学SPF级动物房。C-kit小鼠: 6~8周龄雌性C57BL/6 KitW-sh/W-sh小鼠购于美国Jax实验室,繁殖于同济大学SPF级动物房。MC重建小鼠[4-5]:雌性5周龄C57BL/6 KitW-sh/W-sh小鼠,通过腹腔注射体外培养的WT小鼠来源的骨髓来源的MC(约5×106个)。5周后可获得MC重建小鼠,使用肠道甲苯胺蓝染色切片观察重建效率。
1.1.2主要试剂和仪器 葡聚糖硫酸钠(dextran sulphate sodium,DSS)购自美国MP Biomedicals公司;胎牛血清购自美国Gibco公司;BB515 Rat Anti-CD11b、PE Rat Anti-mouse F4/80、Alexa Fluor 647 Rat Anti-mouse CD206、PE-Cy7 Rat Anti-mouse CD86、Fixation/Permeabilizati Kit破膜染色剂、APC-Cy7通道死活细胞染料均购自美国BD Science公司;Percp/cy5.5 Anti-mouse CD45、PE-Cy7 Rat Anti-mouse CD117、FITC Rat Anti-mouse FcεRI均购自美国Biolegend公司;Ki67抗体购自美国Abcam公司;小鼠mRNA引物购自上海生工生物工程有限公司;TRIzol用于提取总RNA,购自Invitrogen公司;Light Cycler RNA Master SYBR Green试剂盒购自瑞士Roche公司,使用购自Roche公司的LightCycler仪器进行进一步分析;单核细胞分离试剂盒购自德国Miltenyibiotec公司。
1.1.3小鼠mRNA引物 表1中所涉及的引物均为IBD期间参与炎症形成的关键细胞因子。

表1 引物序列(5′-3′)
1.2 方法
1.2.1小鼠IBD模型构建 配制浓度为2.5%的DSS(分子量36 000~50 000)水溶液。小鼠连续饲喂DSS水溶液7 d,随后更换为正常水连续饲喂7 d。每天观察小鼠的炎症特征,包括腹泻、便血、体质量和存活率的变化,综合这类特征计算活动疾病指数(disease activity index,DAI)。具体公式如下:体质量下降百分率(体质量不变为0,1~5为1分,5~10为2分,10~15为3分,大于15为4分)、大便黏稠度(正常为0,松散的大便为2分,腹泻为4分)和大便出血(正常0分,隐血阳性为2分,显性出血为4分),3项结果的总分除以3即得到DAI值。即DAI=(体质量指数+大便形状+出血情况)/3。
1.2.2组织HE、甲苯胺蓝染色和免疫组化染色 在前期的研究[5]中已具体描述。
1.2.3实时定量PCR检测小鼠结肠mRNA 使用TRIzol方法提取RNA,并使用RNeasy柱对其进行纯化。通过PCR仪以及特异性引物对基因的表达量进行检测。扩增完成后,进行DNA解链曲线分析以确认单个扩增子的存在。GAPDH是用于标准化转录水平的内部参考基因。每个基因转录水平的相对表达量用2-ΔΔCt法分析。
1.2.4结肠固有层单核细胞分离及MC流式分析 按照单核细胞分离试剂盒制造商的说明从小鼠结肠中分离单核细胞。然后使用前文方法[4-5]标记单核细胞中的MC。使用BD FACSCanto仪器进行采集,使用FlowJo软件进行数据分析。
1.2.5M1和M2型巨噬细胞染色和流式分析 M1型巨噬细胞染色:将BB515 Rat Anti-CD11b、PE Rat Anti-mouse F4/80、PE-Cy7 Rat Anti-mouse CD86、Percp/cy5.5 Anti-mouse CD45抗体加入样品中,4 ℃条件下孵育30 min。M2型巨噬细胞染色:先将BB515 Rat Anti-CD11b、PE Rat Anti-mouse F4/80、Percp/cy5.5 Anti-mouse CD45抗体加入样品中,4 ℃条件下孵育30 min染表面Marker。使用固定破膜液进行表面Marker固定及破膜作用后,加入抗体Alexa Fluor 647 Rat Anti-mouse CD206,4 ℃条件下孵育30 min,进行胞内染色。1×PBS洗涤后使用FACSCanto II仪器上机和FlowJo软件进行数据分析。

2 结果
2.1 MC在DSS诱导的肠炎恢复期浸润增加在DSS水溶液诱导的肠炎小鼠模型中,第3~7天为炎症的活动期,第10~14天为炎症的恢复期。如图1A所示,对不同时间节点的结肠进行实时定量PCR分析,与MC迁移和分化紧密相关的因子Scf的mRNA表达水平随着时间节点变化,可见炎症活动期结束的第7天ScfmRNA表达最高,且恢复期一直维持在较高的表达水平。可见肠上皮损伤后肠道在炎症期逐渐分泌了大量Scf因子。另一种与MC迁移及浸润有关的因子Mmp-9的表达也在恢复期上调。为了进一步探索MC是否受到分泌的Scf和Mmp-9因子的影响,用流式细胞术检测了不同时间点的MC在单核细胞中的占比(图1B),可见在恢复期MC比例升高,差异有统计学意义(FDay10=79.75,P<0.001)(FDay12=13.00,P<0.001)。此外,一种反映MC数量和功能的类胰蛋白酶基因Mcpt7的表达也在恢复期上升(图1C)。同时,在第3、7天炎症期,Mmp-9、Scf和Mcpt7的表达量与第0天比较,差异无统计学意义。最后,本研究使用甲苯胺蓝对不同时间节点的结肠进行染色,结果显示炎症活动期的MC较少,恢复期可见MC大量浸润于肠组织中(图1D)。
2.2 DSS诱导的肠炎模型中MC缺陷鼠结肠黏膜损伤较重且黏膜修复受限用WT小鼠和C-kit小鼠构建肠炎模型。较WT组而言,C-kit组体质量损失较大(图2A)。小鼠生存曲线表明C-kit组肠道炎症较重,生存率较低(图2B)。小鼠DAI指数通过综合评估小鼠便血(图2C)、腹泻、体质量减轻等体征获得。可见C-kit组不同时间节点DAI指数均低于WT组(图2D)。结肠受炎症程度的影响会缩短,长度越短则代表肠道炎症越重。C-kit组结肠长度整体较WT组缩短更多(图2E),WT组和C-kit组结肠长度分别为(10.3±1.17)cm和(7.9±0.91)cm,差异有统计学意义(F=1.06,P<0.01)。HE染色反映肠道黏膜的结构完整性。如图2F所示,WT组绒毛可见,结构较完整,肠道恢复较好。然而,C-kit组未见完整的绒毛结构,组织破坏严重,肠道恢复较差。Ki67免疫组化染色反映组织的增生和修复能力(图2G),WT组和C-kit组Ki67(+)细胞百分比分别为(64.2±5.89)%和(27.2±10.23)%, Ki67(+)细胞百分比WT组较高,差异有统计学意义(F=3.017,P<0.001)。
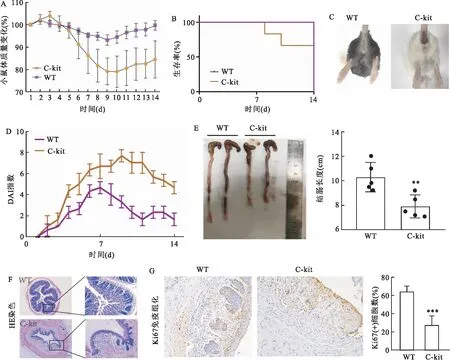
图2 WT组和C-kit组第14天的肠炎损伤和恢复对比
2.3 MC缺陷鼠重建MC后炎症减轻且恢复了修复能力利用WT小鼠、MC小鼠和MC重建小鼠构建肠炎模型。MC重建组体质量损失介于WT组和C-kit组之间(图3A)。MC重建组结肠长度为(8.04±0.59)cm,与WT组比较,差异无统计学意义,与C-kit组比较,差异有统计学意义(F=1.526,P<0.05),MC重建组结肠长度大于C-kit组(图3B)。MC的重建一定程度上抑制了肠道炎症。NC组和MC重建组Ki67(+)细胞百分比分别为(6.4±2.07)%和(49.4±8.32)%。MC重建组Ki67(+)细胞百分比低于WT组(F=1.997,P<0.05),高于C-kit组(F=1.511,P<0.01),见图3C、3D。

图3 MC缺陷鼠重建MC后第14天的炎症和黏膜恢复情况
2.4 在IBD过程中MC通过极化M1/M2型巨噬细胞发挥抑炎和促进黏膜修复的作用对结果2.2项中两组小鼠的结肠组织提取单核细胞并用流式细胞术标记和分析。C-kit组(0.53±0.02)的M1型巨噬细胞比例高于WT组(0.48±0.02),C-kit组(0.10±0.01)的M2型巨噬细胞比例低于WT组(0.20±0.03)。统计学分析C-kit组巨噬细胞M1/M2的比率较WT组增高(图4A),柱状图反映了两组小鼠M1/M2型巨噬细胞比例,使用非配对t检验进行分析(t=5.584),差异有统计学意义(F=1.183,P<0.01)。为探究这种比率差异对IBD过程的影响,用实时定量PCR检测了两组小鼠结肠组织中包含与M2巨噬细胞功能密切相关的抑炎因子基因和M1巨噬细胞功能相关的促炎因子基因(图4B)。分析其中差异有统计学意义(P<0.05)的多个基因,包括Il4、Il10、Il13、Ccl5、Cxcl9、Gata3、Inos等。基因Inos是反映炎症程度指标,WT组(0.62±0.43)相对表达低于C-kit组(2.25±0.94),差异有统计学意义(P<0.05)。基因Il4、Il10、Il13、Gata3是参与抑制炎症发展和促进组织重塑过程的指标,与M2巨噬细胞功能关系极为密切,WT组表达均高于C-kit组(图4C)。WT组基因Il4、Il10、Il13、Gata3的表达依次为(2.18±1.24)、(1.78±0.63)、(1.15±0.13)和(1.22±0.10),C-kit组依次为(0.46±0.35)、(0.81±0.41)、(0.34±0.26)和(0.47±0.44),差异均有统计学意义(P<0.05,P<0.01)。

图4 MC对巨噬细胞极化和肠组织环境的影响
3 讨论
本研究表明肠上皮受损后肠道可分泌Scf和Mmp-9诱导MC向炎症肠组织迁移和浸润。Scf和Mmp-9的表达上调可能是为炎症恢复期MC的聚集提供有利环境,以便于MC在炎症恢复期活化和发挥特定功能。在小鼠IBD模型中,MC缺陷小鼠的肠黏膜绒毛结构破坏较严重,肠道炎症较重且黏膜修复能力较差。然而,当在MC缺陷小鼠体内重建MC后,发现肠黏膜再生修复功能得以恢复,肠道炎症也得以减轻。这证实MC对于IBD的免疫调节和黏膜修复是至关重要且必不可少的。本研究用流式细胞术分析了炎症反应中至关重要的巨噬细胞,活化的巨噬细胞有两种亚型,即促炎M1型和抑炎M2型巨噬细胞[6]。M1型巨噬细胞在炎症过程中扮演着促炎的角色,其主要分泌肿瘤坏死因子(tumor necrosis factor,Tnf-α)、Il6、Il12和Il1β;M2型巨噬细胞在炎症过程中则扮演着抑炎的角色,其主要分泌Il4和Il10等因子,弱化免疫反应进而抑制炎症的发生发展,促进伤口愈合[7]。活化的巨噬细胞既能调节组织损伤也能促进修复[8]。结果显示WT野生型小鼠组的结肠内巨噬细胞M1/M2比率低于MC缺陷小鼠组。同时,类似M2型巨噬细胞,MC自身活化后也可以分泌Il4,除此之外,还可分泌Il13,共同起到抗炎作用[9]。显然,MC一定程度上富集了抗感染作用的M2型巨噬细胞,降低了促炎作用的M1型巨噬细胞,这种极化巨噬细胞的作用有利于肠炎恢复期的黏膜愈合和组织修复。32种抑炎和促炎因子基因的检测进一步证实了上述结论。
本研究仍存在一定局限性,小鼠肠组织环境中炎性多细胞因子的实时定量荧光PCR检测反映了mRNA基因水平的差异性,基因调控下游蛋白水平的差异性仍需在后续的研究中进一步补充。此外,MC可以分泌多种趋化因子,如Ccl3、Ccl4、Ccl5、Cxcl9等[10]。但笔者发现MC缺陷以后,这些趋化因子基因表达水平没有明显降低,说明MC并非唯一影响IBD过程的免疫细胞,将在后续工作中进一步剖析IBD过程中免疫细胞浸润和串扰的相关机制。
本研究阐述了MC是通过极化巨噬细胞在IBD过程中发挥抗炎和促进黏膜修复作用的,它为MC参与IBD调控提供了可靠的理论依据。如果临床研究进一步证实此理论的可靠性,未来MC数目和活性可能作为评价IBD患者结肠黏膜愈合功能的一项可靠指标。Il13、Gata3、Il4、Il10、Inos等指标也可能作为评价IBD患者肠道自愈功能的辅助指标。

