人牙源性间充质干细胞成骨分化潜能的比较
付贵强,邹多宏,2
骨缺损是一种骨质缺失导致骨不连或不愈合进而引起功能障碍疾病[1]。引起骨缺损常见的原因有创伤、炎症和肿瘤等[2]。一般轻微的骨缺损可以由自身组织修复再生,但是严重骨缺损超越了自身愈合的极限,必须采用骨移植或生物材料促进缺损修复。因此,开发一种新型骨移植系统,包括理想的支架材料及优异的种子细胞[3]等,在组织工程中尤为重要。间充质干细胞是组织工程中最有潜力的种子细胞。随着研究的深入,越来越多的口腔来源间充质干细胞被发现[4],这些干细胞与骨髓间充质干细胞有着类似的细胞表面标志物、克隆增殖能力和多向分化潜能,已被研究应用于骨、血管、神经等疾病。
人根尖乳头干细胞(human apical papilla stem cells,SCAPs)、牙髓间充质干细胞(dental pulp mesenchymal stem cells,DPSCs)和牙槽骨间充质干细胞(alveolar bone mesenchymal stem cells,ABMMSCs)取材便宜、易培养,能够稳定传代扩增,可以作为骨组织工程中优异的种子细胞库。为了研究三者之间的差异,该实验通过衰老检测、细胞增殖实验、成骨诱导后染色和成骨相关基因检测来研究3种细胞之间的异同。
1 材料与方法
1.1试剂与仪器Ⅰ型胶原酶(美国西格玛公司), 胎牛血清(中国赛默飞世尔科技有限公司),青-链霉素、ALP染色试剂盒(上海碧云天生物技术有限公司),0.25%胰蛋白酶(上海碧云天生物技术有限公司),CD24、CD90、CD34、CD73(美国博奥派克生物科技有限公司),RNAiso Plus(北京宝日医生物技术有限公司),CCK-8试剂(日本同仁化学研究所),成骨诱导培养基(苏州赛业生物科技有限公司),SYBR Green master mix(上海弈圣生物科技有限公司),LightCycler 96(瑞士罗氏公司),酶标仪(美国赛默世尔科技有限公司)。
1.2 细胞分离与培养供体年龄为14~20岁,采用来自第3磨牙的健康牙齿和牙槽骨。将牙根面牙髓组织、根尖乳头组织用磷酸盐缓冲液(PBS)冲洗后剪成小块,分离培养DPSCs和SCAPs。用3 mg/ml Ⅰ型胶原酶消化,在37 ℃下孵育40 min。1 200 r/min离心5 min,重悬于含20%胎牛血清和100 U/ml青-链霉素的α-MEM培养基中。随后将牙槽骨夹碎成小块,接种在上述培养基的培养皿中。将细胞在37 ℃含5% CO2的细胞培养箱中孵育。在约80%融合时,用0.25%胰蛋白酶消化分离细胞,并按1 ∶3传代。培养基每3 d更换1次,取第3代细胞进行实验。
1.3 流式检测用胰蛋白酶消化收集第3代细胞,1 200 r/min离心5 min,然后用PBS重悬细胞转移到测试管中。使用FITC偶联CD24、CD90和PE偶联CD34、CD73以及相应的同型抗体作为对照,避光孵育30 min,收集到流式细胞仪中,用CytExpert软件对结果进行分析。
1.4 细胞衰老检测当第2代细胞生长至90%时,胰酶消化离心。新鲜培养基重悬计数,按照2×105个/孔的密度将细胞接种在6孔板中。待细胞生长至90%时吸弃培养基,PBS清洗2次,加入RNAiso Plus裂解细胞,提取RNA。
1.5 细胞增殖当第2代细胞生长至90%时,胰酶消化离心。新鲜培养基重悬计数,按照1 500个/孔的密度将细胞接种在96孔板中,设置3个复孔,每孔加入10 μl的CCK-8试剂37 ℃孵育2 h,接种细胞24 h后用酶标仪检测450 nm波长下的吸光度,连续检测7 d,绘制生长曲线。
1.6 成骨分化在6孔板中以2×105个/孔接种3种细胞,用含10%胎牛血清的α-MEM培养,当细胞达到60%融合时,更换成骨诱导培养基,每3 d更换新鲜的培养基,诱导14 d。
1.7 ALP染色和茜素红染色成骨诱导7 d后,按照ALP染色试剂盒染色,PBS清洗2次,加入染色固定液固定15 min,PBS清洗2次,加入染色液,避光孵育10 min后PBS清洗2次。使用扫描仪捕捉数字图像。吸弃培养基,PBS清洗2次,加入RNAiso Plus裂解细胞,提取RNA。
1.8 茜素红染色诱导成骨14 d后,PBS清洗2次,加入染色固定液固定15 min,PBS清洗2次,加入染色液染色5 min,PBS清洗2次。使用扫描仪捕捉数字图像。吸弃培养基,PBS清洗2次,加入RNAiso Plus裂解细胞,提取RNA。
1.9 提取RNA和实时荧光定量PCR(qRT-PCR)用RNAiso Plus提取RNA。使用酶标仪检测RNA浓度和纯度。用Yeasen逆转录试剂盒合成cDNA,使用SYBR Green master mix和LightCycler 96进行qRT-PCR。引物序列在表1中列出。各基因的相对表达量以GAPDH RNA归一化得到的2-ΔΔCt值作为对照。

表1 qRT-PCR引物序列

2 结果
2.1 SCAPs、DPSCs和ABMMSCs的细胞形态提取3种细胞的原代,在培养基中传代扩增,用倒置显微镜观察P0和P3代细胞形态。P0代细胞从组织块中爬出,成放射状生长,细胞的形态类似成纤维细胞,长梭形,密度较高时表现为漩涡状。传代后细胞形态光滑,继续保持成纤维细胞样外观,3种细胞的形态无明显差异。见图1。

图1 SCAPs、DPSCs 和 ABMMSCs原代和P3代细胞的形态特征 ×40
2.2 流式结果分析数据显示内皮细胞和造血干细胞表面标志物CD24和CD34为低表达,而间充质干细胞表面抗原标志物CD73和CD90呈现高表达(图2)。该结果表明提取的3种细胞均为间充质干细胞,细胞免疫表型无明显差异。
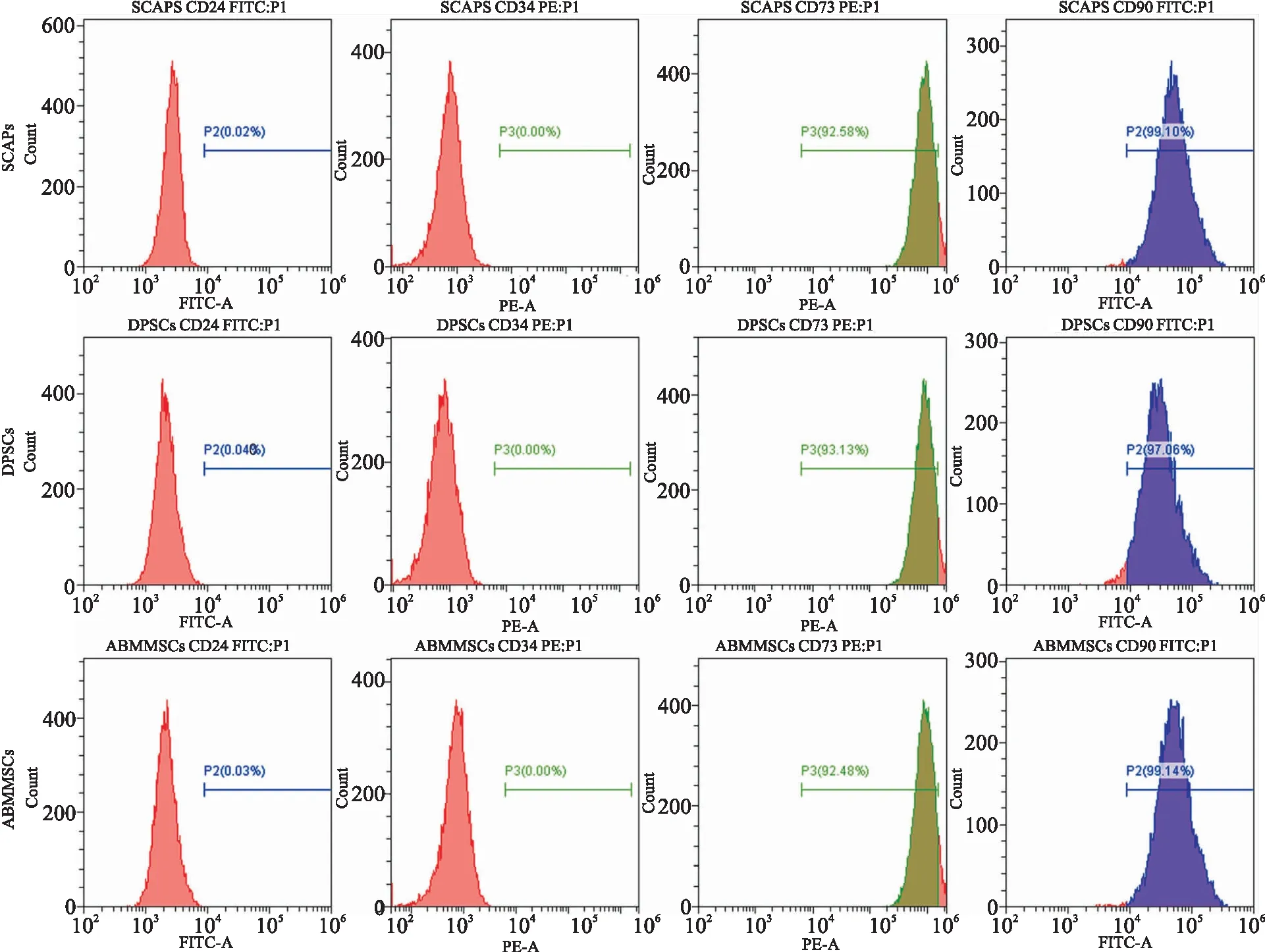
图2 SCAPs、DPSCs 和 ABMMSCs 表面抗原标志物的表达
2.3 衰老相关基因检测图3显示qRT-PCR检测结果表明,衰老相关基因p16(F=3.386,P=0.103 7)、p21(F=4.004,P=0.078 6)、p53(F=1.997,P=0.216 4)在3种细胞的表达差异无统计学意义。说明体外培养的P2代3种细胞状态良好,无衰老差异。
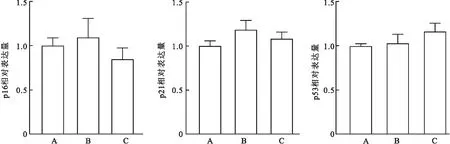
图3 3种细胞衰老相关基因的表达
2.4 患者SCAPs、DPSCs和ABMMSCs增殖能力曲线用P3代的SCAPs、DPSCs和ABMMSCs连续测量7 d的吸光度,如图4显示,3种细胞在前3 d的生长能力相似,但在5 d后DPSCs和SCSPs的增长能力明显高于ABMMSCs,且SCAPs的生长快于DPSCs,说明SCAPs具有很强的生长潜力,而ABMMSCs的增殖能力较弱,见图4。5 d(F=105.5,P<0.000 1),6 d(F=26.53,P<0.001),7 d(F=197.4,P<0.000 1)。
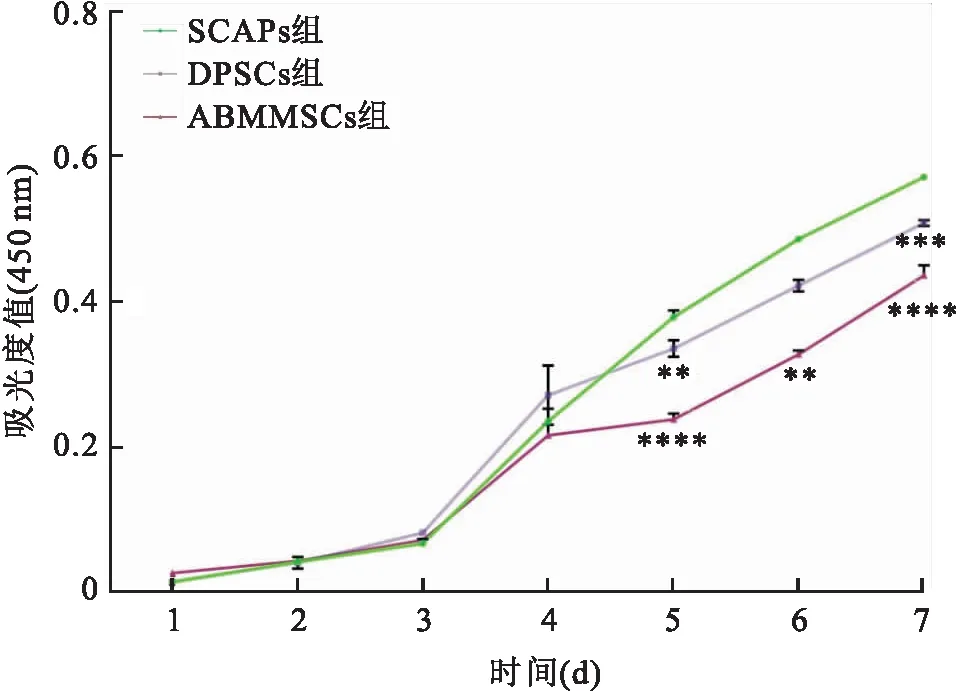
图4 第三代SCAPs、DPSCs和ABMMSCs的增殖曲线
2.5 成骨诱导和相关基因检测成骨诱导7 d后进行ALP染色,ABMMSCs的蓝色范围最广,染色最深,DPSCs次之,SCAPs染色最浅(图5A)。诱导3周后茜素染色与7 d的ALP 染色一致,ABMMSCs红色最深,SCAPs与其他2种细胞相比染色较少(图5B),且在显微镜下观察细胞形成红色矿物质结节,ABMMSCs明显多于SCAPs和DPSCs(图6)。qRT-PCR结果表明成骨诱导7 d和14 d后ALP、OSX、COL-1、OCN、OPN在ABMMSCs中的表达均高于其他2种细胞,DPSCs次之,SCAPs中上述成骨基因的表达在3种细胞中的表达最低(图7)。ALP(F=523.8,P<0.000 1),OSX(F=21.17,P<0.001 9),COL-1(F=51.35,P<0.000 2),OCN(F=638.6,P<0.000 1),OPN(F=2 659,P<0.000 1)。

图5 3种细胞成骨诱导7 d和14 d后ALP和茜素红染色A:ALP染色;B:茜素红染色
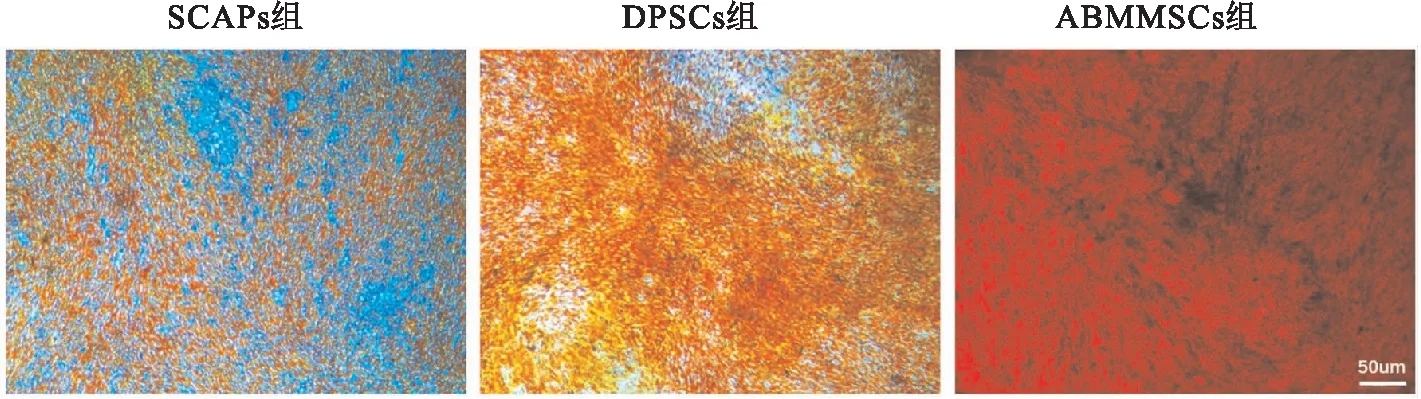
图6 茜素红染色镜下观察 ×40
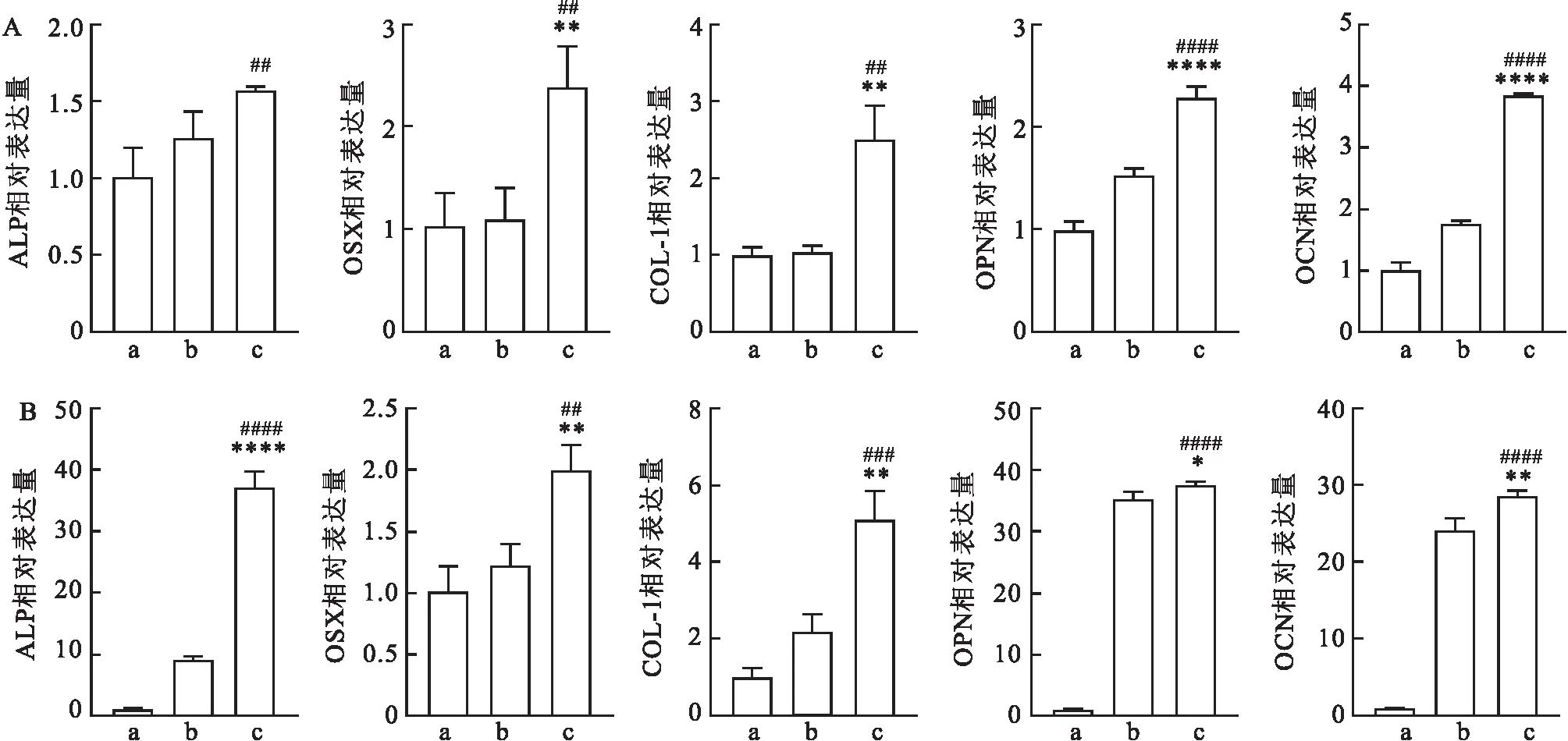
图7 qPCR定量检测成骨诱导7 d和14 d后成骨相关标志物表达
3 讨论
间充质干细胞在再生医学骨组织工程的相关研究中已得到了广泛的应用[5-10]。但不同的间充质干细胞有着不同的分化潜能和特性,因此挑选合适的干细胞作为种子细胞尤为重要。
该实验主要研究作为骨组织工程的种子细胞SCAPs、DPSCs和ABMMSCs 在体外生物学特性方面之间的不同。将来自14~20岁供体的牙齿和牙槽骨通过酶消化-组织块法提取原代SCAPs、DPSCs和ABMMSCs。经过体外传代培养后,细胞生长旺盛,类似成纤维细胞,形态均一稳定。流式细胞术检测造血干细胞表面标志物CD34阴性,CD90和CD73阳性率高达90%以上。说明此方法分离得到的细胞符合间充质干细胞的标准。
骨组织工程需要大量的细胞,因此,细胞状态和增殖能力关系到其在组织工程中的治疗效果。细胞衰老是指细胞出现持续性的周期阻滞[11],其中衰老相关标志物p53、p21、p16发挥重要的作用。肿瘤抑制因子p53介导的DNA损伤反应(DDR)通路在细胞对基因组不稳定性的内在反应中发挥重要作用,包括短暂的细胞周期阻滞、衰老和凋亡,p21和p16作为一种细胞周期依赖性激酶抑制剂阻碍细胞周期加速衰老进程[12-13]。该实验通过qRT-PCR检测了3种细胞的衰老相关标志物p53、p21、p16的表达,结果显示3者之间无显著差异,表明P2代的3种细胞之间状态一致。贴壁培养后连续7 d检测3种间充质干细胞的增殖能力。结果显示所有间充质干细胞在第3天均达到对数生长期,此后快速生长,SCAPs生长速度最快,DPSCs次之,ABMMSCs生长最慢。
作为骨组织工程的种子细胞,其成骨分化能力也发挥重要的作用。为了进一步探究SCAPs、DPSCs和ABMMSCs 3种细胞成骨能力的差异,该实验设计了体外成骨诱导实验。成骨诱导7 d后,ALP染色可见,ABMMSCs的染色范围最广,颜色最深,其次是DPSCs,SCAPs的染色最浅。诱导14 d后进行茜素红染色,与ALP染色一致,ABMMSCs染色最强,SCAPs染色最弱。镜下观察在成骨诱导过程中细胞外基质形成矿物质结节,其中ABMMSCs形成的钙结节最多,对成骨分化诱导最为敏感。ALP、OSX、COL-1、OCN、OPN是成骨分化过程中重要的调控因子[14-15]。通过在转录水平上分析这些标志物的表达进一步探究三者之间成骨分化的能力。ALP是成骨细胞合成矿化骨基质的早期经典标志物,是反映成骨分化程度的良好指标;成骨分化过程中的关键调节因子OSX特异性表达于成骨细胞,并调控成骨标志物的表达;Ⅰ型胶原COL-1是骨基质中主要的胶原成分;骨钙素(OCN)、骨桥蛋白(OPN)是成骨后期指标;这些因子可以相互协同共同促进成骨分化。qRT-PCR检测显示, 7 d成骨诱导后ABMMSCs中ALP 的表达水平最高,SCAPs最低,随着诱导至14 d,差异更加显著,OSX和COL-1也表现出类似的趋势。晚期指标OCN和OPN在14 d诱导后达到较高水平,且ABMMSCs和DPSCs中的表达量显著高于SCAPs。
以上研究结果表明,口腔来源的3种细胞体外培养扩增后状态良好,均可保持稳定的增殖能力。SCAPs相比DPSCs和ABMMSCs更容易生长扩增,但是体外成骨诱导后显示,ABMMSCs的成骨能力较强,表明该细胞治疗骨相关疾病更有效,是骨组织工程最为理想的种子细胞。该结果为临床上培养和选用种子细胞提供了理论支持,未来还需要开展更多的体内研究为最佳种子细胞的临床应用奠定基础。

