小鼠TDO2基因条件性敲除打靶载体的构建
许 媛,魏 伟,常 艳
色氨酸 2,3-双加氧酶(tryptophan 2,3-dioxygenase, TDO2)是犬尿氨酸代谢通路的限速酶之一,是调节系统色氨酸(tryptophan, Trp)水平的关键酶[1]。与对照组小鼠相比,TDO2基因敲除(TDO2 knockout, TDO2-KO)小鼠生长发育正常,血浆Trp浓度高于对照组小鼠8~9倍[2]。TDO2介导的犬尿氨酸代谢通路异常在癌症、中枢神经系统疾病和自身免疫病中发挥重要作用。研究[3]显示,TDO2代谢产物激活芳香烃受体,从而参与肿瘤免疫逃逸。TDO2-KO小鼠的海马体神经活动增强,表现出神经保护现象[4]。在实验性自身免疫性脑脊髓炎模型研究中发现TDO2缺失缓解了神经炎症[5]。研究[6-7]表明TDO2在佐剂诱导关节炎大鼠体内表达升高可能介导了滑膜炎症和关节破坏。为了进一步研究TDO2在特定组织和细胞类型上的生物学功能以及在疾病状态下所参与的分子机制,利用CRISPR/Cas9 技术构建敲除TDO2-201转录本外显子3的打靶载体,为进一步构建TDO2基因条件性敲除小鼠奠定基础。
1 材料与方法
1.1 实验动物选择C57BL/6小鼠,与南京集萃药康生物科技公司实验室合作,采用 CRISPR/Cas9 基因编辑技术构建TDO2基因条件性敲除打靶载体。实验动物饲养和繁育均符合安徽医科大学实验动物管理与伦理委员会相关规定,伦理批准号:PZ-2022-007。
1.2 主要试剂蛋白酶 K(批号: WXBD6886V)(美国 Sigma 公司);Marker I DNA标准分子量Ladder(批号:20220311)(北京索莱宝科技有限公司),50×TAE(批号:765782AA)(博迈德生物);Agarose(批号:EZ6789D112)(赛国生物科技);1× TE pH 8.0(批号:70105832)、核酸染料(批号:22116561)(biosharp生物科技公司);2×Rapid Taq Master Mix(批号:7E572H1)(诺唯赞生物科技股份有限公司)。
1.3 主要仪器台式梯度PCR仪Thermal Cycler(型号:T100TM)(美国 Bio-Rad公司);HH数显恒温水浴锅(常州国宇仪器制造有限公司);天能Tanon琼脂糖凝胶电泳仪(型号:EPS-300)、全自动数码凝胶图像分析系统(型号:Tanon-1600)(上海天能公司)。
1.4 CRISPR-Cas9 靶向位点和Donor载体的设计以及sgRNA的合成根据TDO2 Gene ID(56720)小鼠基因组序列信息,发现TDO2 基因有4个转录本,根据TDO2基因的结构,推荐选择敲除区为TDO2-201(ENSMUST00000029645.13)转录本的第3号外显子。该区域包含91 bp的编码序列,敲除后将破坏TDO2蛋白质功能。利用CRISPR/Cas9 技术对TDO2基因进行改造,在TDO2基因的打靶区域两侧各放置同向Loxp元件。设计针对TDO2基因的第3号外显子的寡聚核苷酸链序列sgRNA,sgRNA序列信息见表1。根据sgRNA序列设计并合成Donor载体。

表1 sgRNA 序列信息
1.5 Cas9 mRNA、sgRNA和donor片段混合体的受精卵显微注射和移植将Cas9 mRNA、sgRNA和纯化后的donor片段混合体显微注射到C57BL/6小鼠的受精卵中,移植受精卵到假孕的C57BL/6母鼠的子宫中,获得阳性F0小鼠,经PCR证实Loxp突变基因已经整合到小鼠染色体上。小鼠TDO2基因条件性敲除打靶载体构建策略见图1。Cas9蛋白被sgRNA诱导与靶位点结合,从而导致外显子3碱基序列缺失,并在断裂处插入Loxp位点修饰的靶基因序列。最后获得小鼠TDO2基因条件敲除打靶载体。
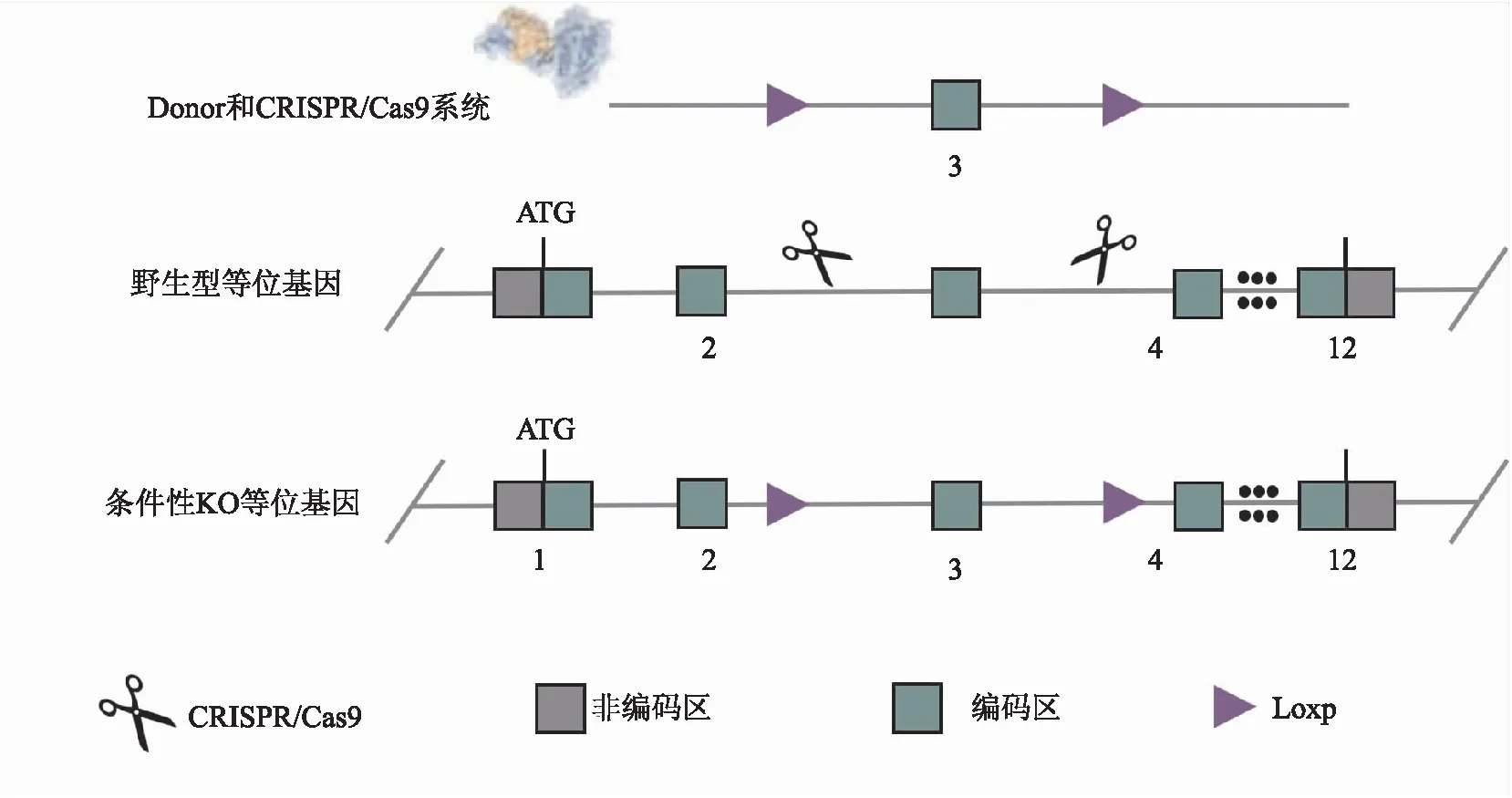
图1 小鼠TDO2基因条件敲除打靶载体的构建策略
1.6 TDO2基因条件性敲除打靶载体的PCR鉴定
1.6.1小鼠尾组织基因组DNA的提取 取鼠尾组织50~100 mg(1周龄鼠尾2~5 mm),加入鼠尾裂解液0.5 ml,在55 ℃下,轻微震荡混匀消化8~12 h至无肉眼可见块状或絮状物,采用乙醇沉淀提取法进一步提取基因组DNA。12 000 r/min离心1 min,将上清液0.450 ml移入新EP管中,留少许以免枪头接触残留组织或毛发。再加入0.9 ml无水乙醇,上下缓慢颠倒混匀5~10次,12 000 r/min 离心 15 min。弃上清液,加入1 ml 75%乙醇溶液,上下缓慢颠倒洗涤5~10次,12 000 r/min 离心5 min。弃上清液,保持离心管开盖状态,室温晾置5~10 min。加入0.3 ml DEPC水置于37 ℃下溶解 DNA,30 min后用无酶枪头吹打混匀。4 ℃冰箱保存备用。
1.6.2PCR鉴定
1.6.2.1 PCR体系 反应总体系25 μl,分别加入Taq Master Mix,Dye Plus 12.5 μl, ddH2O 9.5 μl,引物1 μl,模板基因组DNA 1 μl。PCR仪扩增,95 ℃预变性 5 min,95 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸30 s,35个循环,72 ℃ 5 min 终止反应。基因鉴定策略见图2,引物信息见表2。图2显示,基于sgRNA序列,设计携带靶位点同源区和Loxp位点的重组质粒,并在该靶区设计引物,用于小鼠后续基因鉴定。
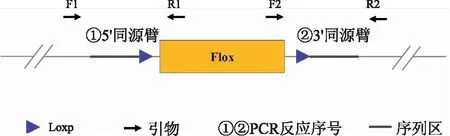
图2 小鼠TDO2基因条件敲除打靶载体基因型鉴定策略

表2 TDO2flox/flox小鼠引物信息
1.6.2.2 凝胶电泳 配置2%的琼脂糖凝胶,每孔点样10 μl,marker 5 μl,以140 V、400 mA的条件电泳30 min。电泳结束后,拍照观察。根据DNA marker,对比 PCR条带位置,判断是纯合子还是杂合子。
1.7 纯合突变小鼠(TDO2flox/flox)的生长和繁育
将PCR和测序鉴定的阳性F0代小鼠与C57BL/6小鼠交配获得F1代小鼠。利用PCR鉴定筛选出F1代杂合子,将其作为亲本。交配繁育后得到F2代,PCR鉴定后,选择最佳繁育路线,最终得到两条染色体均带有Loxp点的纯合突变小鼠(以下简称TDO2flox/flox)。
TDO2flox/flox小鼠饲养于 SPF 级环境中,饲养室内的温度保持在 22~28 ℃,相对湿度维持在 40%~60%。饲料为无菌全价营养颗粒料,饮用水为高压灭菌后的纯净水。定期观察登记小鼠体质量变化、精神状态等情况。孕鼠的妊娠期一般20 d左右;小鼠出生后5~7 d可进行剪尾操作;3周左右可将雌雄小鼠分开饲养。一般雄鼠性成熟为8周龄,雌鼠6周龄左右。同时观察TDO2flox/flox小鼠的饮食、活动、体质量变化等情况。
1.8 统计学处理数据均用Mean±SEM表示,采用SPSS 25.0 软件分析数据,采用单因素方差(One-way ANVOA)分析进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 TDO2flox/flox小鼠的鉴定结果以JS04371-Tdo2-5wt-tF1和JS04371-Tdo2-5wt-tR1为引物的情况下,PCR反应获得305 bp和407 bp双条带的为TDO2-flox杂合子小鼠;获得305 bp条带的为同窝WT小鼠;获得407 bp条带的为TDO2flox/flox小鼠,见图3A。以JS04371-Tdo2-3wt-tF1和JS04371-Tdo2-3wt-tR1为引物,PCR反应获得305 bp和408 bp双条带的为TDO2-flox杂合子小鼠;获得305 bp条带的为WT小鼠;获得408 bp条带的为TDO2flox/flox小鼠,见图3B。TDO2flox/flox小鼠之间进行杂交,最终得到大量TDO2flox/flox小鼠,为后续构建TDO2基因条件敲除小鼠模型奠定了基础。图3A采用JS04371-Tdo2-5wt-tF1PCR和JS04371-Tdo2-5wt-tR1为引物, Line1为阴性对照,Line2、3、4为阳性对照,分别为TDO2-flox杂合子小鼠、同窝WT小鼠、TDO2flox/flox小鼠。80、82号鼠为TDO2-flox杂合子小鼠,81、83、84、85、86、87均为TDO2flox/flox小鼠。图3B采用JS04371-Tdo2-3wt-tF1和JS04371-Tdo2-3wt-tR1为引物,结果同图3A。同时对基因鉴定结果阳性的引物扩增产物进行测序,检测Loxp位点信息(ATAACT TCGTAT AGCATA CATTAT ACGAAG TTAT),根据测序结果进一步证实小鼠TDO2基因条件性敲除打靶载体构建成功,测序结果见图4。
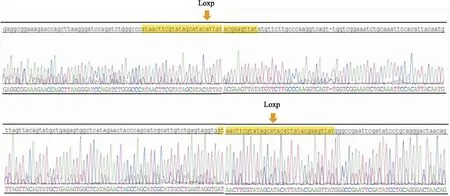
图4 TDO2flox/flox小鼠基因测序结果
2.2 TDO2flox/flox小鼠的生长和繁育情况与同窝WT小鼠相比,TDO2flox/flox小鼠的饮食、活动、体质量变化正常。对不同性别和基因型的 8~14周龄小鼠进行体质量分析(n=10)。结果显示,同一基因型小鼠,雌性小鼠的体质量低于雄性小鼠,差异有统计学意义(F=16.33,P<0.01);同一性别中,TDO2flox/flox小鼠与同窝WT小鼠相比,体质量无明显差异,雄性WT:(22.53±0.313 1) mg;雄性TDO2flox/flox:(22.28±0.423 7) mg;雌性WT:(19.88±0.258 1) mg;雌性TDO2flox/flox:(20.58±0.254 2) mg。TDO2flox/flox小鼠性成熟时间表现为:雄鼠 8 周,雌鼠6周左右;母鼠妊娠期为 19~21 d,每胎产5~6只幼鼠,成活率>95%,与同窝WT 小鼠繁殖情况无差异。
3 讨论
TDO2表达异常导致犬尿氨酸代谢通路紊乱,在中枢神经系统疾病、肿瘤和自身免疫病等多种疾病中发挥重要作用。研究[3,8]表明,在疾病状态下,TDO2介导免疫细胞功能异常,参与肿瘤细胞和各组织细胞的病理机制。课题组首次发现TDO2在免疫细胞中均有表达,如巨噬细胞、B细胞和T细胞等,提示TDO2在免疫调节和维持局部免疫稳态中具有潜在作用[9]。课题组为了进一步研究TDO2在靶细胞和靶组织中的病理机制,采用CRISPR/Cas9 技术构建了小鼠TDO2基因条件性敲除打靶载体。
本实验首先利用CRISPR Design工具(http://crispr.mit.edu/)[10],结合TDO2 Gene ID(56720)小鼠基因组序列信息,设计针对TDO2-201(ENSMUST00000029645.13)转录本的第3号外显子打靶位点的sgRNA,再根据sgRNA序列设计Donor载体。其次,制备Cas9 mRNA、sgRNA和Donor片段产物。将合成后的2条单链寡聚核苷酸sgRNA序列退火(95 ℃ 5 min后自然降至室温)形成双链DNA,经T7 RNA聚合酶合成sgRNA。Cas9表达质粒,经AgeⅠ酶切线性化,体外利用T7 RNA聚合酶合成Cas9 mRNA。然后将转录好的sgRNA和Cas9 mRNA以及纯化后的Donor载体片段显微注射到受精卵中,sgRNA的碱基与靶基因的序列特异性结合,进而诱导Cas9酶对第3号外显子进行切割,导致DNA双链断裂,在断裂处插入经Loxp位点修饰的第3号外显子基因序列,随后将胚胎转移到假孕动物中以产生F0代[11]。最后将阳性F0代小鼠与野生型C57BL/6小鼠交配获得稳定的F1代小鼠,通过F1代小鼠之间的杂交得到TDO2flox/flox小鼠。
通过PCR鉴定发现,小鼠TDO2基因条件性敲除打靶载体遗传稳定。与同窝WT小鼠相比,TDO2flox/flox小鼠在繁育过程中,生长发育正常。对不同性别和基因型的 8~14周龄小鼠进行体质量情况分析,结果表明,与同窝WT小鼠相比,TDO2flox/flox小鼠体质量无差异。利用CRISPR/Cas9技术成功构建小鼠TDO2基因条件性敲除打靶载体,不仅为构建TDO2基因条件性敲除小鼠模型奠定基础,也为进一步研究TDO2基因在靶组织和细胞上的功能和在疾病状态下的病理机制奠定了基础。

