象皮生肌膏对肛瘘术后模型大鼠创面修复及细胞凋亡的影响
刘颖 尹园缘 邹巍莹 黄静雯 程扬 宾东华 詹敏


〔摘要〕 目的 探討象皮生肌膏对肛瘘术后模型大鼠创面凋亡因子胱天蛋白酶(cysteine aspartic acid specific protease, Caspase)的影响。方法 36只SD大鼠建立肛瘘模型后,随机选取27只肛瘘大鼠构建肛瘘术后创面模型,随机分为象皮生肌膏组、湿润烧伤膏组、模型组,每组9只,剩余9只肛瘘大鼠为假手术组。象皮生肌膏组、湿润烧伤膏组使用生理盐水冲洗创面后外敷相应药物,模型组仅使用生理盐水冲洗创面,假手术组无特殊处理,每日1次,连续干预10 d。造模后3、5、7、10 d,观察创面愈合情况,计算创面愈合率。药物干预10 d后,从各组取创面组织,HE染色观察创面组织病理学变化,TUNEL法检测创面组织中细胞凋亡数目,免疫组织化学法检测创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白的表达。结果 与模型组相比,象皮生肌膏组在干预后3、5、7、10 d时创面愈合率均显著升高(P<0.05,P<0.01),湿润烧伤膏组在干预后5、7、10 d时创面愈合率均显著升高(P<0.05,P<0.01),而象皮生肌膏组创面愈合率在干预后7、10 d均明显高于湿润烧伤膏组(P<0.01)。与假手术组比较,象皮生肌膏组、湿润烧伤膏组、模型组细胞凋亡率均显著升高(P<0.01),创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平均显著升高(P<0.01);与模型组比较,象皮生肌膏组、湿润烧伤膏组细胞凋亡率均显著降低(P<0.01),Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平均显著下降(P<0.01);与湿润烧伤膏组比较,象皮生肌膏组细胞凋亡率均显著降低(P<0.01),Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平均显著下降(P<0.01)。结论 象皮生肌膏能通过抑制肛瘘术后创面组织细胞凋亡,抑制凋亡相关因子Caspase-3、Caspase-7、Caspase-9、Caspase-12的表达,促进创面愈合。
〔关键词〕 肛瘘;象皮生肌膏;创面;细胞凋亡;胱天蛋白酶;湿润烧伤膏
〔中图分类号〕R269 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.003
〔Abstract〕 Objective To explore the effects of Xiangpi Shengji Ointment (XPSJO) on cysteine aspartic acid-specific protease (Caspase) in wound surface of model rats after anal fistula operation. Methods After establishing the anal fistula models in 36 SD rats, 27 anal fistula rats were randomly selected to construct wound models after anal fistula operation, then they were randomly divided into XPSJO group, Moisture Exposed Burn Ointment (MEBO) group and model group, with 9 rats in each group. The remaining 9 ones were taken as sham operation group. The XPSJO group and MEBO group were applied with corresponding drugs externally after wound irrigation with normal saline. Wound irrigation with normal saline was performed on model group, while there was no special treatment for the rats in sham operation group. All the above interventions were performed once a day, for 10 consecutive days. On the 3rd, 5th, 7th, and 10th day after modeling, the wound healing was observed and the wound healing rate was calculated. After 10 days of drug intervention, wound tissue were taken from each group. The histopathological changes of wound tissue were observed by HE staining, the number of cell apoptosis in wound tissue was determined by TUNEL method, and the expressions of Caspase-3, Caspase-7, Caspase-9 and Caspase-12 proteins in wound tissue were measured by immunohistochemistry. Results Compared with model group, the wound healing rate of XPSJO group was higher on the 3rd, 5th, 7th, and 10th day after intervention (P<0.05, P<0.01), and that of MEBO group was significantly higher on the 5th, 7th and 10th day after intervention (P<0.05, P<0.01). Moreover, the wound healing rate of XPSJO group was significantly higher than that of the MEBO group on the 7th and 10th day after drug intervention (P<0.01). Compared with sham operation group, the apoptosis rate and expression levels of Caspase-3, Caspase-7, Caspase-9, and Caspase-12 proteins in wound tissue of XPSJO, MEBO and model groups were significant higher (P<0.01, P<0.01). Compared with model group, the apoptosis rate and expression levels of Caspase-3, Caspase-7, Caspase-9, and Caspase-12 proteins in XPSJO group and MEBO group were significantly lower (P<0.0, P<0.01). Compared with MEBO group, the apoptosis rate and expression levels of Caspase-3, Caspase-7, Caspase-9, and Caspase-12 proteins in XPSJO group were significantly lower (P<0.01, P<0.01). Conclusion XPSJO can promote wound healing by inhibiting the apoptosis of wound tissue after anal fistula operation as well as the expressions of apoptosis-related factors, including Caspase-3, Caspase-7, Caspase-9, and Caspase-12.
〔Keywords〕 anal fistula; Xiangpi Shengji Ointment; wound surface; apoptosis; cysteine aspartic acid specific protease; Moisture Exposed Burn Ointment
肛瘘又称肛管直肠瘘,是指因感染、损伤等因素所形成的与肛周皮肤相通的病理性通道,是临床最常见的肛门直肠疾病之一,80%以上因肛门直肠周围脓肿破溃或切开引流后所导致,临床表现为肛周肿痛、流脓、瘙痒等,具有反复发作及难以自愈的特点[1]。手术是治疗肛瘘的首选方法,但由于部位的特殊性,肛瘘术后切口多不缝合,创面易受污染,导致创面愈合缓慢,对患者的生理、心理、经济等均带来了负担[2]。因此,如何促进肛瘘术后创面愈合是肛肠外科亟待解决的重点问题。细胞凋亡是人体的一种重要生理现象,与组织细胞再生关系密切[3-4]。已有证据表明,细胞凋亡参与到伤口愈合的调节,在各个阶段均发挥重要作用,在伤口愈合过程中,细胞凋亡通过平衡细胞增殖,清除已发挥作用的炎症细胞、成纤维细胞等各类细胞,使得肉芽组织逐渐演变为瘢痕组织,以使伤口愈合[5-6]。细胞凋亡不仅决定着创面愈合的快慢,在创面异常愈合中也具有重要意义[7]。
象皮生肌膏最早见于《疡科纲要》,湖南中医药大学第一附属医院在其基础上结合现代工艺,进一步化裁,制作成中医外科常用膏剂,具有清热解毒、活血化瘀、祛腐生肌之功效。本课题组前期研究[8-11]已证实,象皮生肌膏能减轻肛瘘患者术后疼痛、水肿等,明显缩短创面修复时间,生肌效果显著。本研究以细胞凋亡为切入点,探讨象皮生肌膏对肛瘘术后创面及凋亡因子胱天蛋白酶(cysteine aspartic acid specific protease, Caspase)的影响,分析相关作用机制,为象皮生肌膏促伤口愈合提供实验证据。
1 材料
1.1 药物
象皮生肌膏(湖南中医药大学第一附属医院制剂室制备,批号:20211212);湿润烧伤膏(汕头市美宝制药有限公司,批号:2107403G)。
1.2 动物
36只SPF级健康SD雄性大鼠,体质量200~220 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。所有动物均饲养于湖南中医药大学第一附属医院实验动物中心。本研究方案获湖南中医药大学第一附属医院实验动物伦理委员会批准(伦理审批号:ZYFY20211104-04)。
1.3 主要试剂
Caspase-3抗体、Caspase-7抗体、Caspase-9抗体、Caspase-12抗体(湖南丰晖生物科技有限公司,批号分别为Fab1924、Fab1932、Fab1945、Fab1915);辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记的山羊抗大鼠IgG、山羊抗小鼠二抗、DAB显色试剂盒(武汉赛维尔生物科技有限公司,批号分别为GB23303、GB23302、G1214-100UL、G1212-200T);TUNEL试剂盒(上海碧云天生物技术有限公司,批号:C1090);HE染色液(广州维格斯生物科技有限公司,批号:3201121)。
1.4 主要仪器
生物组织摊烤片机(武汉俊杰电子有限公司,型号:JK-6);生化培养箱(上海一恒仪器公司,型号:LRH);石蜡切片机(德国莱卡公司,型号:RM2235);全自动病理切片扫描仪(匈牙利3DHISTECH公司,型号分别为Pannoramic MIDI Ⅱ)。
2 方法
2.1 肛瘘模型的建立
适应性喂养1周后,36只SD大鼠参照RS等[12]的造模方法,加以改进,进行肛瘘的造模。造模前禁食、禁水24 h,2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,使用脱毛膏将每只大鼠肛周毛发脱除,后使用0.1%强力碘溶液消毒肛周手术区域。大鼠以俯卧位,采用时钟定位法(以大鼠尾根部为12点位,会阴部为6点位)造模,将50 mL注射器针头由大鼠肛门内进入,穿过肛门括约肌,从肛门9点位距肛缘约1 cm皮肤穿出,随后退出针头,将直径2 mm的钢丝沿针头所致的通道穿入,将钢丝两端扭转固定,放置30 d,期间自由饮食。30 d后麻醉下取出大鼠肛周钢丝,于钢丝贯通位置可触及条索样物,证明造模成功。
2.2 肛瘘术后创面模型的建立
观察30 d后随机选取27只肛瘘模型大鼠,术前24 h禁食、禁水,2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,使用0.1%强力碘溶液消毒肛周手术区域,沿钢丝进行“瘘管切除术”,术后使用无菌棉球压迫止血10 min,创面不缝合,保持开放,将大鼠放回笼子,自由饮食。剩余9只肛瘘模型大鼠不予以特殊处理。
2.3 分组及给药
将27只肛瘘术后创面模型SD大鼠随机分为3组:象皮生肌膏组、湿润烧伤膏组、模型组,每组9只;剩余9只肛瘘模型大鼠为假手术组。肛瘘术后创面模型建立24 h后开始创面换药,每组给药前均使用生理盐水冲洗创面,象皮生肌膏组及湿润烧伤膏组分别使用象皮生肌膏、湿润烧伤膏外敷后盖上医用无菌敷料加以固定,模型组仅冲洗后盖上医用无菌敷料,假手術组无特殊处理。每日换药1次,连续干预10 d。
2.4 创面愈合率
造模后3、5、7、10 d,使用数码相机拍摄创面情况,采用0.5 cm×0.5 cm透明方格面积测量器测定创面面积,与造模后初始创面面积进行比较,获得各组创面动态愈合率。创面愈合率=(初始创面面积-造模后n天的面积)/初始创面面积×100%[10]。
2.5 动物取材
药物干预10 d后,次日在麻醉下从象皮生肌膏组、湿润烧伤膏组、模型组取创面组织,假手术组行“瘘管切除术”后取瘘管下组织,均用4%多聚甲醛固定。
2.6 HE染色检测创面组织病理变化
取固定的创面组织制作石蜡切片,切片经二甲苯脱蜡,乙醇水化,用苏木素和伊红染色,乙醇脱水,二甲苯透明,中性树胶封片,使用病理切片扫描仪对玻片进行扫描,Case Viewer软件查看玻片并采集图片,观察组织病理变化。
2.7 TUNEL法检测创面组织中细胞凋亡数目
将创面组织制作成的石蜡切片用二甲苯进行脱蜡,乙醇水化,滴加蛋白酶K,37 ℃孵育20 min,PBS洗涤3次,滴加配制好的50 μL TUNEL检测液,37 ℃避光孵育1 h,PBS洗涤3次,含DAPI的抗荧光淬灭封片液封片。使用病理切片扫描仪、Case Viewer软件对玻片进行扫描、观察并采集图片,采用Image J软件,计算细胞凋亡率。细胞凋亡率=凋亡细胞数÷细胞总数×100%。
2.8 免疫组织化学法检测创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白的表达
将创面组织制作成的石蜡切片使用二甲苯脱蜡至水、乙醇脱水,经过热修复抗原后,加入3% H2O2室温10 min灭活内源性酶,PBS冲洗3次。滴加5%羊血清,置于湿盒中室温孵育20 min,PBS洗涤3次。滴加稀释的一抗,4 ℃过夜,37 ℃温箱复温30 min,PBS冲洗3次,滴加二抗,37 ℃孵育30 min,PBS冲洗3次。滴加显色剂DAB工作液,室温孵育5 min,蒸馏水洗涤,苏木素复染3 min,蒸馏水冲洗,PBS洗涤返蓝,乙醇梯度脱水,二甲苯透明,中性树胶封片。经扫描仪扫描后,在Case Viewer软件进行观察及图像采集,以棕黄色为阳性染色,采用Image-Pro Plus 6.0软件分析图像的积分光密度(integrated optical density, IOD)平均值。
2.9 统计学分析
采用SPSS 25.0软件和GraphPad Prism 9.3软件进行数据分析及作图,符合正态分布及方差齐性的计量资料以“x±s”表示。组间比较采用单因素ANOVA检验,方差齐采用LSD检验。以P<0.05为差异有统计学意义。
3 结果
3.1 造模情况
肛瘘造模期间各组大鼠未见死亡,造模大鼠均造模成功。肛瘘术后创面模型造模期间各组大鼠未见死亡,故实验结束时每组大鼠均为9只。
3.2 各组创面愈合情况比较
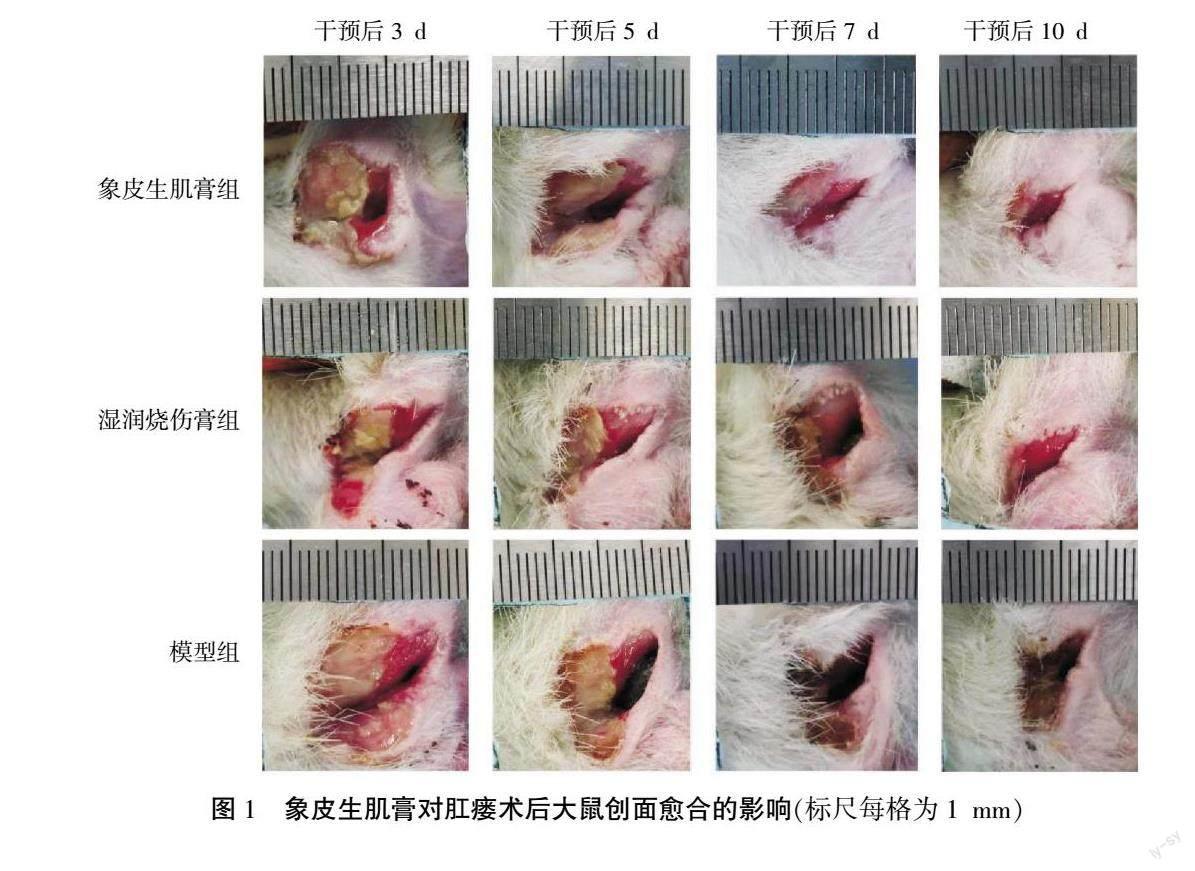
与模型组相比,象皮生肌膏组在干预后3、5、7、10 d时伤口愈合率均升高(P<0.05,P<0.01),湿润烧伤膏组在干预后5、7、10 d时愈合率显著升高(P<0.05,P<0.01);在药物干预后7、10 d,象皮生肌膏组创面愈合率明显高于湿润烧伤膏组(P<0.01)。详见图1、表1。
3.3 各组伤口组织病理学变化比较
模型组创面可见明显组织出血、血管扩张及炎性细胞浸润。象皮生肌膏组创面组织炎性细胞少,可见较成熟血管,胶原纤维和成纤维细胞排列较整齐,致密。湿润烧伤膏组大鼠创面组织较多炎性细胞浸润,新生肉芽组织形成。详见图2。
3.4 各组创面组织中细胞凋亡数目比较
与假手术组比较,象皮生肌膏组、湿润烧伤膏组、模型组细胞凋亡率显著升高(P<0.01);与模型组比较,象皮生肌膏组、湿润烧伤膏组细胞凋亡率显著降低(P<0.01);与湿润烧伤膏组比较,象皮生肌膏组细胞凋亡率显著降低(P<0.01)。详见图3—4。
3.5 各组创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白的表达水平比较
与假手术组比较,模型组、象皮生肌膏组、湿润烧伤膏组创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著升高(P<0.01);与模型组比较,象皮生肌膏组、湿润烧伤膏组Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著下降(P<0.01);与湿润烧伤膏组比较,象皮生肌膏组Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著下降(P<0.01)。详见图5—6。
4 讨论
肛瘘是结直肠外科的常见病、多发病,且随着生活习惯、饮食结构等的改變,发病率呈上升趋势[13]。手术是治疗肛瘘的首选方案,但因术后切口为开放性污染伤口,术后愈合缓慢,疼痛明显,严重影响患者生活。中医药促创面修复历史悠久,具有清热解毒、止痛化瘀、化腐生肌、调和气血等作用,有效促进术后创面愈合[14]。现代研究证实,中医药在临床创面修复中占据着独特优势,其作用的机制包括调控免疫炎症反应、促进生长因子分泌、调节胶原蛋白的合成等[15-16]。
象皮生肌膏出自清末医家张山雷的名方象皮膏,湖南中医药大学第一附属医院在其基础上制成院内制剂,将其用于急、慢性创面等多种创面修复,临床疗效显著[17-20]。象皮生肌膏主要组成包括象皮粉、生地黄、血余炭、当归、炉甘石、醋龟甲、生石膏等,其中,象皮粉敛疮止血;生地黄养阴生津、凉血止血;血余炭消瘀收敛止血;当归补血活血、生肌止痛;炉甘石解毒收湿敛疮;龟甲滋阴潜阳、益肾养血;生石膏清热解毒。诸药合用,共奏活血止痛、祛腐生肌之功效。本研究通过钢丝挂线留置及手术的方法构建肛瘘术后大鼠模型,采用象皮生肌膏或湿润烧伤膏外用10 d,观察其对创面愈合及凋亡调控因子的影响。本次研究显示,象皮生肌膏组在各个时间点创面愈合率均显著高于模型组(P<0.05,P<0.01),而湿润烧伤膏组在药物干预后5、7、10 d时创面愈合率较模型组显著升高(P<0.05,P<0.01),象皮生肌膏组在干预后7、10 d时创面愈合率明显高于湿润烧伤膏组(P<0.01),表明象皮生肌膏能显著促进肛瘘术后创面愈合。
创面修复是个复杂而有序的生理过程,涉及止血、炎症、增殖、重塑等阶段,而各阶段均有凋亡机制的参与[21]。在止血及炎症期,血小板、炎症细胞等大量聚集,通过消除微生物控制感染,随后炎症细胞通过凋亡被清除,避免损伤正常细胞与组织而引发进一步的炎症,进而进入关键的增殖期及组织重塑期[22]。成纤维细胞、角质形成细胞等各种细胞群迅速增殖,胶原蛋白开始沉积,细胞外基质合成,新生肉芽组织形成,伤口逐渐填平,最终通过调控细胞的清除,导致形成相对无细胞的瘢痕组织[23]。研究表明,创面愈合缓慢与创面细胞过度凋亡相关,而瘢痕疙瘩的形成与细胞凋亡减少关系密切[24-26]。由此可见,细胞凋亡影响着创面修复的进展及预后。
凋亡的调节涉及复杂的级联反映,其发生及发展包括起始期、整合期及执行期3个阶段,Caspase在执行期发挥着关键作用,是细胞凋亡的核心调节因子[27-28]。Caspase分子起初以无活性的酶原形式存在,在受到外部或内部的刺激下,凋亡启动子Caspase-9、Caspase-12被激活,进而蛋白水解剪切并激活效应子Caspase-3、Caspase-7,效应子Caspase进而作用于底物,导致细胞形态等发生变化,导致细胞凋亡[29-30]。本研究结果显示,干预10 d后,与假手术组比较,象皮生肌膏组、湿润烧伤膏组、模型组创面组织细胞凋亡率显著升高(P<0.01),Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著升高(P<0.01);与模型组比较,象皮生肌膏组、湿润烧伤膏组细胞凋亡率显著降低(P<0.01),Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著下降(P<0.01);与湿润烧伤膏组比较,象皮生肌膏组细胞凋亡率显著降低(P<0.01),Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白表达水平显著下降(P<0.01),表明象皮生肌膏能显著抑制创面肉芽组织细胞凋亡,从而促进伤口愈合,该作用效果可能与抑制创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白的表达相关。
综上所述,本研究证实象皮生肌膏能通过抑制肉芽组织细胞凋亡,从而显著促进创面愈合,其作用机制可能与抑制创面组织中Caspase-3、Caspase-7、Caspase-9、Caspase-12蛋白的表达相关。但本研究仅对凋亡相关因子进行研究,其涉及的凋亡相关通路有待后续更进一步的研究。
参考文献
[1] 中国医师协会肛肠医师分会临床指南工作委员会. 肛瘘诊治中国专家共识(2020版)[J]. 中华胃肠外科杂志, 2020, 23(12): 1123-1130.
[2] 马志琼, 黄小瑜, 何 娇. 肛周脓肿或肛瘘术后影响创面愈合质量的危险因素分析[J]. 临床误诊误治, 2020, 33(2): 76-80.
[3] KETELUT-CARNEIRO N, FITZGERALD K A. Apoptosis, pyroptosis, and necroptosis-oh my! the many ways a cell can Die[J]. Journal of Molecular Biology, 2022, 434(4): 167378.
[4] 董自梅, 王 静, 高 帅, 等. 细胞凋亡与动物再生[J]. 河南师范大学学报(自然科学版), 2020, 48(2): 87-93.
[5] GREENHALGH D G. The role of apoptosis in wound healing[J]. The International Journal of Biochemistry and Cell Biology, 1998, 30(9): 1019-1030.
[6] WU Y S, CHEN S N. Apoptotic cell: Linkage of inflammation and wound healing[J]. Frontiers in Pharmacology, 2014, 5: 1.
[7] 鄭 敏, 殷学利, 黄素群. 同一创面不同病程糖尿病足创面组织细胞凋亡率、Bcl-2、Bax及肿瘤坏死因子α的相关性[J]. 中国组织工程研究, 2020, 24(20): 3186-3190.
[8] 李 逵, 熊家青, 宾东华. 象皮生肌膏治疗糖尿病型肛瘘疗效观察[J]. 世界中西医结合杂志, 2018, 13(1): 131-134.
[9] 宾东华, 王爱华, 曹 晖. 象皮生肌膏促肛瘘术后创面修复的临床观察[J]. 世界中西医结合杂志, 2014, 9(3): 260-262, 296.
[10] 曾婷婷, 宾东华, 罗 曌, 等. 象皮生肌膏对肛瘘术后模型大鼠创面中白介素-8、肿瘤坏死因子-α蛋白表达的影响[J]. 世界中西医结合杂志, 2020, 15(4): 634-637.
[11] 陈凯迪, 严 建, 曹 晖, 等. 基于“卫气营血”理论探讨象皮生肌膏在肛瘘术后创面中的应用[J]. 中国中医基础医学杂志, 2021, 27(12): 1978-1980, 1994.
[12] RS A S, SANTOS C H M D, DOURADO D M, et al. Can Stryphnodendron adstringens extract improve the results of fistulotomy followed by primary sphincteroplasty in the treatment of transsphincteric fistulae[J]. Brazilian Archives of Digestive Surgery, 2020, 33(3): e1540.
[13] 佟铁钢. 肛周脓肿或肛瘘术后影响创面愈合质量的危险因素分析[J]. 中国医药指南, 2022, 20(31): 101-103, 107.
[14] 丁晓杰, 蒯 仂, 李 斌, 等. 从祛腐生肌到 “清、化、补” 动态序贯疗法辨治创面修复理论溯源及经验采撷[J]. 中华中医药杂志, 2021, 36(5): 2578-2580.
[15] 茹 意, 蒯 仂, 罗 楹, 等. 中医药促创面修复及改善瘢痕形成的研究进展[J]. 中国中西医结合杂志, 2020, 40(4): 508-512.
[16] 张 容, 刘少琼, 杨 芳, 等. 复方芙蓉花叶提取物对大鼠感染创面愈合的影响[J]. 湖南中医药大学学报, 2021, 41(10): 1540-1545.
[17] 刘梦竹, 宾东华, 赵 丹. 象皮生肌膏联合成纤维细胞生长因子对克罗恩病肛瘘患者瘘管切开术后创面及肉芽组织Bax、p53、Caspase-3水平的影响[J]. 中医药导报, 2022, 29(7): 101-105.
[18] 孙之中, 刘朝红, 陈其华, 等. 象皮生肌膏对糖尿病足溃疡大鼠创面组织内上皮-间质转化过程的影响[J]. 陕西中医, 2022, 43(12): 1664-1668.
[19] 雷 宇, 周忠志, 兰宏伟, 等. 象皮生肌膏对糖尿病皮肤溃疡修复的效果及其机理探究[J]. 中国美容医学, 2022, 31(1): 89-92.
[20] 谢心军, 张 博, 张 雄, 等. 象皮生肌膏对外伤创面修复及BFGF表达的影响[J]. 西部中医药, 2020, 33(4): 121-123.
[21] WILKINSON H N, HARDMAN M J. Wound healing: Cellular mechanisms and pathological outcomes[J]. Open Biology, 2020, 10(9): 200223.
[22] RIWALDT S, CORYDON T J, PANTALONE D, et al. Role of apoptosis in wound healing and apoptosis alterations in microgravity[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 679650.
[23] ARYA A K, TRIPATHI R, KUMAR S, et al. Recent advances on the association of apoptosis in chronic non healing diabetic wound[J]. World Journal of Diabetes, 2014, 5(6): 756-762.
[24] DESMOULI?RE A, REDARD M, DARBY I, et al. Apoptosis mediates the decrease in cellularity during the transition between granulation tissue and scar[J]. The American Journal of Pathology, 1995, 146(1): 56-66.
[25] MANZOUREH R, FARAHPOUR M R. Topical administration of hydroethanolic extract of Trifolium pratense (red clover) accelerates wound healing by apoptosis and re-epithelialization[J]. Biotechnic and Histochemistry, 2021, 96(4): 276-286.
[26] SHAIKH-KADER A, HOURELD N N, RAJENDRAN N K, et al. The link between advanced glycation end products and apoptosis in delayed wound healing[J]. Cell Biochemistry and Function, 2019, 37(6): 432-442.
[27] 黃文林, 朱孝峰. 信号转导与疾病[M]. 2版. 北京: 人民卫生出版社, 2012: 345-348.
[28] 张继红, 石孟琼, 陈茂华, 等. 基于PTEN/PI3K/AKT和线粒体凋亡信号通路探讨乳癖散结汤治疗乳腺增生大鼠作用机制[J]. 中药药理与临床, 2022, 38(5): 46-53.
[29] WANG Y, KANNEGANTI T D. From pyroptosis, apoptosis and necroptosis to PANoptosis: A mechanistic compendium of programmed cell death pathways[J]. Computational and Structural Biotechnology Journal, 2021, 19: 4641-4657.
[30] KESAVARDHANA S, MALIREDDI R K S, KANNEGANTI T D. Caspases in cell death, inflammation, and pyroptosis[J]. Annual Review of Immunology, 2020, 38: 567-595.

