Bartter综合征诊疗中国专家共识(2023)
中华医学会罕见病分会,中国研究型医院学会罕见病分会,中国罕见病联盟,北京罕见病诊疗与保障学会,Bartter综合征中国专家组
中国医学科学院北京协和医院 1肾内科 2疑难重症及罕见病国家重点实验室,北京 100730 3首都儿科研究所附属儿童医院肾脏内科,北京 100020
Bartter综合征(Bartter syndrome,BS)是一种罕见的遗传性肾小管疾病,由编码或调控肾小管髓袢升支粗段和远曲小管的相关转运蛋白基因变异所致,主要表现为盐重吸收障碍,其临床特点主要为继发性醛固酮增多症伴低血钾、低氯性代谢性碱中毒、血压正常或偏低[1]。BS根据基因型可分为5型,其中BS 1~4型的遗传方式为常染色体隐性遗传,BS 5型为X连锁隐性遗传。BS的临床表现存在显著异质性,可出现早产、低血容量、室性心律失常、横纹肌溶解、肾功能衰竭、生长发育迟缓等多种异常情况,对患者危害较大,因此早期诊断及合理治疗具有重要意义。2021年,欧洲罕见肾病参考网络肾小管疾病工作组制定了首个BS诊断和治疗共识[1]。近年来,国内BS研究也取得了长足进步。为进一步明确BS的临床表现,规范诊断、治疗和管理策略,中华医学会罕见病分会、中国研究型医院学会罕见病分会、中国罕见病联盟、北京罕见病诊疗与保障学会联合相关领域专家,基于最新循证医学证据,制订了本共识,旨在帮助临床医师制订规范化的BS诊疗策略。
1 共识制订方法
2022年6月20日,Bartter综合征中国专家组召开了“Bartter综合征诊疗专家共识研讨会”,多学科专家讨论了共识的总体框架,并进行具体任务分工;基于标准的疾病模式(临床表现、诊断、治疗),并结合BS研究最新进展,确定了共识拟解决的关键问题;在国际实践指南注册与透明化平台(http://www.guidelines-registry.cn)进行注册(注册号:PREPARE-2022CN486);组建了共识制订工作组,包括专家组和编写组,其中专家组成员分别来自肾内科、儿科、内分泌科、产科、麻醉科、耳鼻喉科、心内科、遗传学和临床流行病学领域。
共识编写组以“Bartter syndrome”“Bartter综合征”“巴特综合征”“巴特尔综合征”“巴特氏综合征”为主题词检索了PubMed、Embase、Cochrane Library、Clinical Trials、中国知网、万方数据知识服务平台和中国生物医学文献数据库,检索时间为建库至2022年6月30日。经去重处理后共获得相关文献4249篇,阅读文献摘要和/或全文,选取所有基因诊断符合BS的文献共303篇。依据牛津循证医学中心证据分级方法并参考国内外共识制订的方法学文献[2-3],将纳入的研究证据分为6个证据等级(1a、1b、2a、2b、3、4)(表1),并根据证据等级将推荐强度分为A(强)、B(中)、C(弱)(表2),以代表共识制订专家的建议。

表2 本共识推荐强度的定义
2023年1月,工作组基于国内外最新研究成果完成了共识意见初稿;2023年3月,专家组进行线上交流、沟通,逐条讨论、修改和完善共识意见;2023年4月,共识所有内容经专家组无记名投票,专家意见赞成人数在85%以上者被认为达成共识[4],最终形成共识终稿。
2 临床表现与诊断
2.1 临床表现
根据临床发病时间,BS可分为产前型(antenatal BS,aBS)、新生儿型(neonatal BS,nBS)和经典型(classical BS,cBS);根据基因型,BS可分为5型,其中4型又分为4a和4b亚型,具体分型及临床特点见表3[5]。
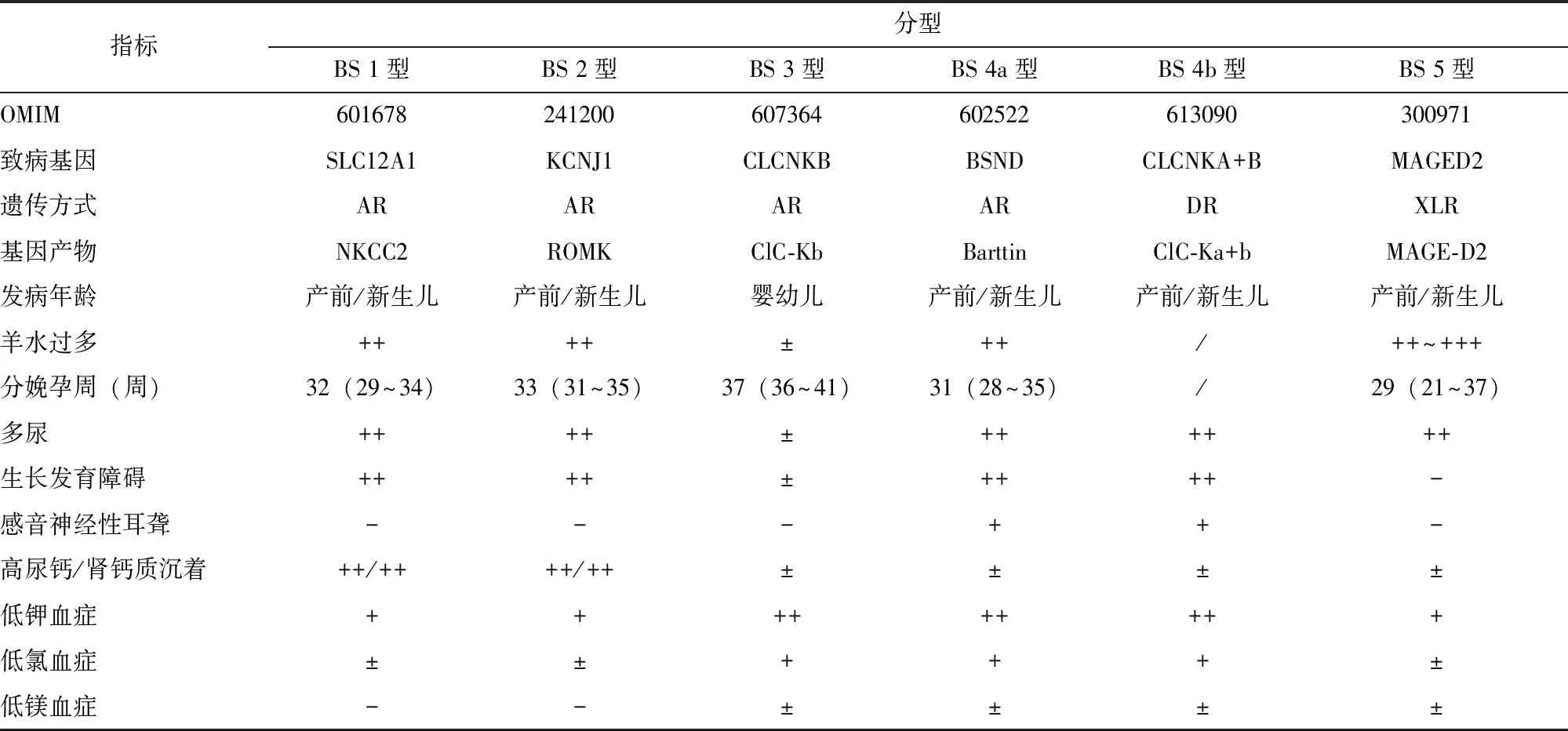
表3 BS分型及临床特点[5]
2.1.1 产前起病
患儿母亲通常在妊娠18~30周出现羊水过多,出现时间及严重程度因患儿遗传缺陷而异[6],其中BS 4型和BS 5型羊水过多出现时间最早,其次是BS 1型和BS 2型。BS 5型羊水过多最突出,羊水指数可达33~50 cm(羊水指数:以脐水平线和腹白线为标志,将腹部分为四个象限,超声测量各象限最大羊水池的垂直径线之和)[7]。
2.1.2 新生儿期起病
患儿常表现为血容量不足、多尿、早产及相关表现,未经治疗可死于脱水、电解质紊乱及感染等原因。患儿可出现大眼睛、三角脸、前额突出及招风耳等,亦可出现嘴角下垂和斜视等特殊面容[8]。BS 2型新生儿可出现一过性酸中毒和高钾血症,高钾血症主要在早产儿中出现,可能机制为与胎龄相关的Na-K-ATP酶活性降低,导致钾从细胞内转移至细胞外,出生后随着Na-K-ATP酶逐渐成熟而得到改善[9]。BS 4a型和BS 4b型患儿听力筛查可出现异常(感音神经性耳聋)[10-11]。部分BS 5型患儿出生后可出现一过性多尿和失盐表现,多尿一般持续0.5~6周左右自行缓解,故又称为暂时性产前型BS[12-13]。
2.1.3 婴幼儿期起病
50%~70%的BS 3型多在1岁后起病,最常见表现为烦渴、多尿等失盐症状和生长迟缓;可伴有肾钙质沉着和肾结石[14]。部分BS 2型患儿以低钙抽搐为首发症状[15];BS 4型可首先表现为感音神经性耳聋,后逐渐出现多饮、多尿[16]。
2.1.4 学龄期儿童和青少年起病
最常见表现为失盐、低钾症状和生长迟缓,可伴有青春期延迟[17],多见于BS 3型,BS 1型、BS 2型等亦有报道[18-20]。
2.1.5 成年起病
常见表现为低钾症状、夜尿增多和肾钙质沉着,轻者无明显不适或仅有乏力。多为个案报道,主要见于BS 2型和BS 3型[21-24]。
BS重症临床表现包括严重低血容量[25]、低钾伴或不伴低镁血症引起的QT间期延长(重者可导致心律失常甚至猝死)[26-28],严重低钾血症还可诱发横纹肌溶解[29]。参照2016年KDIGO根据WHO不良事件分级对Gitelman综合征(Gitelman syndrome,GS)低钾血症的分级方法[30],可将BS低钾血症分为4级,用于评价因电解质紊乱所带来的临床风险(表4)。

表4 BS低钾血症严重程度分级
2.2 辅助检查
BS不同分型间的实验室检查特点既有重叠,亦存在与不同分子缺陷相对应的特异表型。具体分型及辅助检查特点见表3。
2.2.1 低钾、低氯性代谢性碱中毒
低钾血症是BS的特征性表现。根据低钾血症严重程度分级,大多数BS患者为2级及以上[31]。低钠血症、低氯血症及代谢性碱中毒均较常见。BS 2型新生儿期可出现一过性酸中毒和高钾血症,数周后转为低钾血症[32],文献报道的比例为40%~48%[9,33]。
2.2.2 肾素-血管紧张素系统
肾素-血管紧张素系统(renin-angiotensin system,RAS)活化,但RAS活化继发于失盐及低血容量,患者血压正常或偏低。
2.2.3 尿渗透压低
BS患者髓袢升支粗段盐重吸收异常,导致肾髓质中渗透梯度下降,表现为肾脏浓缩功能障碍,尿液渗透压小于或等于血浆渗透压。
2.2.4 尿钙水平
不同类型的BS尿钙水平存在差异[5],可出现高尿钙或尿钙正常现象,部分BS 3型患者可出现低尿钙[17]。
2.2.5 低镁血症
部分BS 3型患者可合并低镁血症,需与GS进行鉴别[17,34];通常认为BS患者的低镁血症比GS更易纠正[14]。
2.2.6 心电图
可出现低血钾相关表现,如T波低平、u波、QT间期延长等,严重者可出现室性心律失常[35]。
2.2.7 影像学检查
超声可早期发现肾脏钙质沉着和/或肾结石[36]。BS 1型和BS 2型患儿可于出生后1~2个月出现肾钙质沉着症的典型特征[37]。
2.2.8 其他
部分BS 2型患者存在甲状旁腺功能异常及血清钙、磷水平异常[38],可出现蛋白尿[39]或肾功能异常[18];身材矮小患儿可存在骨龄落后、生长激素缺乏[40]。
2.3 临床诊断、基因诊断与功能诊断
推荐意见
(1)对于胎儿期羊水过多、早产的新生儿,出生后应注意监测尿量、体质量增长情况,并监测电解质和血气等,警惕aBS及nBS(证据等级:3;推荐强度:B)。
(2)对于出生后出现脱水/失盐表现、生长发育落后、低氯性代谢性碱中毒、低钾血症、血压正常,超声检查有肾钙质沉着或肾结石的患者,应高度怀疑BS(证据等级:3;推荐强度:B)。
(3)建议临床诊断为BS的患者行基因检测确认,可考虑行靶向基因包或全外显子组测序(证据等级:3;推荐强度:B)。
(4)根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)基因变异致病性解读指南对变异进行分类,必要时开展体内或体外功能试验,为确定致病性提供证据(证据等级:3;推荐强度:B)。
2.3.1 产前诊断
BS先证者的家庭需完善家系调查和遗传咨询。经评估后需行产前诊断者,胎儿基因检测最可靠,其次是羊水生化分析。无法完成上述有创检查者,可评估“巴特指数”[总蛋白(g/L)×甲胎蛋白(MoM),≤1.2为异常;MoM,中位数倍数][41-42]。回顾性研究发现,在84例羊水增多、无染色体异常、无严重胎儿畸形的巴特指数异常妊娠中,24例(28.6%)患儿出生后被确诊为BS[42]。
2.3.2 出生后临床诊断
符合以下条件应警惕BS:
(1)根据患者病史排除消化道钾摄入不足或腹泻、使用利尿剂、细胞内外钾分布异常等情况导致的低钾血症。
(2)存在持续肾性失钾,以及生长迟缓、低血钾、失盐相关临床表现。肾性失钾:血钾<3.0 mmol/L时,尿钾排泄量>20 mmol/24 h;或血钾<3.5 mmol/L时,尿钾排泄量>25 mmol/24 h;或跨小管钾梯度(transtubule potassium gradient,TTKG)>4(留取次尿,TTKG=尿钾/血钾×血渗透压/尿渗透压)。
(3)RAS激活(血浆肾素、血管紧张素、醛固酮水平增高或活性增强),但血压正常或偏低。
(4)低氯性代谢性碱中毒。
(5)排除结缔组织病、药物、单克隆丙种球蛋白病等导致的肾小管功能损伤。
2.3.3 与GS鉴别诊断
GS由编码位于肾远曲小管的噻嗪类利尿剂敏感的钠氯协同转运蛋白(sodium-chloride cotransporter,NCC)基因SLC12A3发生变异所致。患者多于青少年或成年发病,低镁血症和低钙尿症较为常见[43]。行氯离子清除试验,若患者对氢氯噻嗪试验无反应而对呋塞米试验有反应,有助于临床诊断GS,基因检测可行进一步鉴别。BS的鉴别诊断流程详见图1。
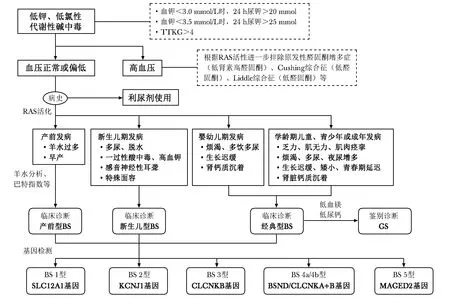
图1 BS鉴别诊断流程图
2.3.4 基因诊断
2.3.4.1 概况
BS根据基因型分为5种亚型,每种亚型涉及的基因和蛋白详见表5。BS相关基因在肾小管各段的分布及对应的BS亚型详见图2。截至2022年6月30日,人类基因变异数据库(http://www.hgmd. org)录入的SLC12A1、KCNJ1、CLCNKB、CLCNKA、BSND、MAGED2基因变异分别为117个、74个、198个、9个、30个和10个。
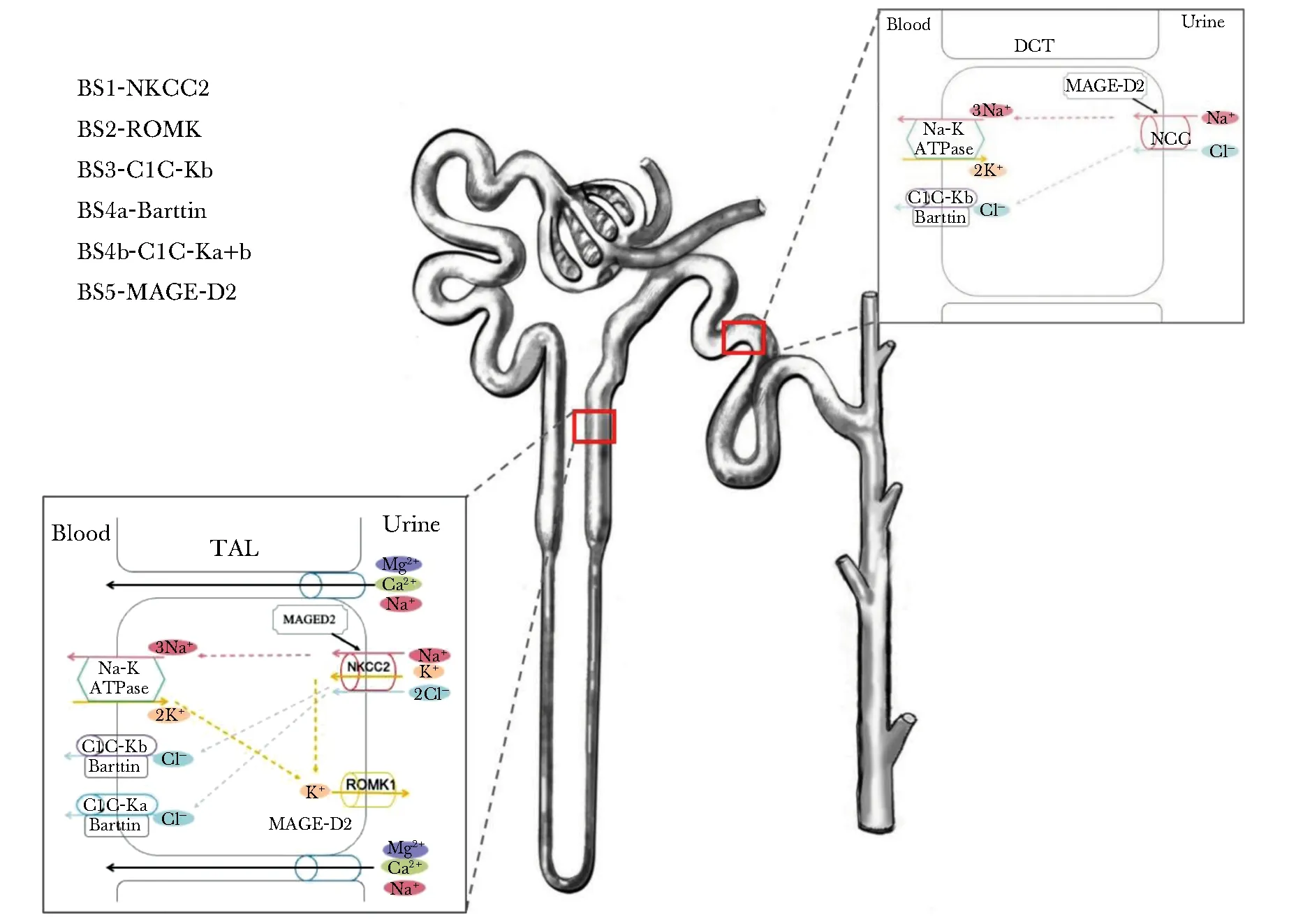
图2 BS相关基因在肾小管各段的分布及对应的BS亚型

表5 BS各亚型相关基因、蛋白的例数及占比(n=766)
2.3.4.2 基因检测方法
疑诊BS患者,建议完善至少包含以下基因在内的检测:SLC12A1、KCNJ1、CLCNKB、CLCNKA、BSND、MAGED2、SLC12A3、CASR、KCNJ10、SLC26A3、CLDN10、SCNN1A、SCNN1B、SCNN1G、NR3C2、HSD11B2、CYP11B1、CLCN2、KCNJ5和CACNA1H[1],可考虑行靶向基因包或家系全外显子组测序。如怀疑变异可能位于内含子区域,也可行全基因组测序;上述测序结果均需分析拷贝数变异(copy number variation,CNV)。对于发现的可能致病性CNV,可行多重连接依赖式探针扩增(multiple ligation dependent probe amplification,MLPA)或定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)进行验证。
2.3.4.3 基因变异的解读
SLC12A1、KCNJ1、CLCNKB、CLCNKA、BSND、MAGED2基因明确致病性的纯合变异或复合杂合变异可确诊BS,而单杂合变异患者需结合临床情况进行分析。遗传检测发现基因变异后,首先应在收录一般人群变异数据的最新遗传数据库中查询该变异在正常人群中出现的频率,在人类基因变异数据库查阅或检索文献以明确是否为已报道致病变异。然后,根据ACMG基因变异致病性解读指南对其进行分类,包括致病变异、可能致病变异、不确定意义变异、可能良性变异和良性变异[44]。必要时开展体内外功能试验(如氯离子清除试验、爪蟾卵母细胞表达体系验证蛋白功能试验等)为确定变异致病性提供证据[45-46]。
2.3.5 功能诊断——氯离子清除试验
呋塞米试验和氢氯噻嗪试验是检测髓袢升支粗段及远曲小管功能,用于临床鉴别诊断BS的生理功能试验。在BS患者中进行功能试验的数据非常有限,研究显示不同类型的BS对利尿剂的反应不同(表6)。疑似BS患者,首选呋塞米试验,但存在导致容量不足和血钾进一步降低的风险,应在有条件的医疗单位慎重开展,不常规推荐。试验前需将患者血钾水平纠正至3.0 mmol/L以上,试验结束后应尽早恢复补钾药物治疗[47]。

表6 不同类型BS对利尿剂的反应
3 治疗策略
推荐意见
(5)针对羊水过多,需产科、儿科、肾内科、心内科等围产期多学科团队会诊,权衡延长妊娠期的获益和对于胎儿的潜在风险(证据等级:3;推荐强度:B)。
(6)BS患者补充体液容量和电解质,建议通过饮食和药物口服,尽可能在1 d内分散补充,严重电解质紊乱者可予静脉补充(证据等级:3;推荐强度:B)。
(7)BS患者经电解质补充治疗后仍存在顽固性电解质紊乱及相关临床症状,依赖大剂量和/或静脉补钾、补镁治疗;或患者补钾、补镁不耐受,推荐联合使用环氧化酶抑制剂(如吲哚美辛),但需警惕胃肠道等不良反应的发生风险(证据等级:2b;推荐强度:B)。
(8)BS随诊的主要监测指标包括临床症状、患儿身高、体质量、生长速度、血压、血尿生化检查以及泌尿系超声检查。对于6岁以下患儿,建议随访时间间隔为3~6个月;经规范治疗且病情稳定的6岁及以上患儿或成人,建议每6~12个月随访1次(证据等级:3;推荐强度:B)。
3.1 产前治疗
患儿母亲于妊娠18~30周出现羊水过多,可导致早产及其相关并发症的发生风险增加。若考虑行产前干预,需产科、新生儿科、儿童肾脏病科、心内科(在环氧化酶抑制剂治疗的情况下)及遗传学的围产期多学科团队会诊。严重者可采取反复羊膜穿刺以减少羊水量和环氧化酶(cyclooxygenase,COX)抑制剂治疗[50-52],但尚无前瞻性证据支持其有效性和安全性,不作常规推荐。孕晚期使用COX抑制剂可能导致胎儿动脉导管提早闭锁、新生儿坏死性小肠结肠炎或肠穿孔等风险,需密切监测,包括定期胎儿超声心动图检查。
3.2 出生后治疗
3.2.1 电解质替代治疗
电解质补充剂应全天分次给予;严重呕吐或脱水的患儿应给予静脉补液;对于婴幼儿,可通过管喂方式将补充剂添加在食物中[53]。
3.2.1.1 饮食指导
建议BS患者多食用富含钾、镁的食物,如谷物、薯类、牛奶、蔬菜、坚果、黑巧克力等,避免可能加重代谢性碱中毒和低钾血症的含柠檬酸盐及碳酸盐的饮料[12,54];如患者未合并高血压,鼓励多进食富含钠盐的食物;可由营养师和肾内科医师共同随访[54]。
3.2.1.2 药物治疗
(1)补钾:建议补充氯化钾[32]。出现严重低钾血症时(如出现心律失常、软瘫、呼吸衰竭、横纹肌溶解等并发症),可予以静脉补钾。对于血钾的目标水平,目前尚无定论,可将3.0 mmol/L作为合理的目标水平[1,55]。
(2)补钠:推荐补充氯化钠。建议至少5~10 mmol/(kg·d)[即0.3~0.6 g/(kg·d)]。结合国人的饮食习惯(普遍钠摄入偏高,且BS患者多有嗜盐表现),大部分BS患者仅需注意饮食中适当增加盐的摄入即可,临床中仅对早发(婴儿期起病)、严重低氯血症且症状严重者进行口服或静脉补充氯化钠,以恢复细胞外体积和改善电解质异常;对于合并肾性尿崩的BS 1型和BS 2型患者,补充钠盐可能加重多尿及高渗性脱水的发生风险,应避免补钠[54]。
(3)补镁:合并低镁血症,首选口服有机酸镁盐制剂(生物利用度高于氧化镁或氢氧化镁)。当患者出现严重低镁血症伴手足抽搐或心律失常时,可静脉补镁治疗。对于BS患者血镁的确切目标水平,目前尚无定论,可将0.6 mmol/L作为合理的目标水平[1]。
3.2.2 基于发病机制的治疗
当电解质补充治疗效果不佳,患者仍存在严重电解质紊乱和相关症状(如生长迟滞或反复发生低血容量)或依赖大剂量和/或静脉补钾补镁治疗时,可联合用药以改善电解质紊乱、减少替代治疗药物剂量。联合用药主要包括COX抑制剂、保钾利尿剂及以血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂(angiotensin converting enzyme inhibitor/angiotonin receptor blocker,ACEI/ARB)为代表的RAS抑制剂。
3.2.2.1 COX抑制剂
COX抑制剂通过抑制前列腺素的合成发挥作用,可减轻BS患者的临床症状,改善儿童生长发育[56]。常用的COX抑制剂包括吲哚美辛、布洛芬、塞来昔布等;儿童常用剂量:吲哚美辛1~4 mg/(kg·d),分3~4 次口服;布洛芬15~30 mg/(kg·d),分3次口服;塞来昔布2~10 mg/(kg·d),分2次口服。以上药物建议从小剂量开始服用。对于成人患者,目前缺乏足够的研究数据,暂无推荐剂量。
应警惕药物副作用,主要包括胃肠道和心血管不良反应的发生风险,尤其对于早期新生儿,应警惕新生儿坏死性小肠结肠炎和肠穿孔等。此外,对于BS患者长期使用COX抑制剂是否导致慢性肾脏病(chronic kidney disease,CKD)风险增加,目前尚无定论。对于BS 4型患者,COX抑制剂治疗易出现肾功能损害,且效果欠佳,故应慎用[19,55,57-59]。当患者血容量不足或肾小球滤过率下降时,亦应慎用[34]。
3.2.2.2 保钾利尿剂
主要包括醛固酮拮抗剂类药物(如螺内酯)和非醛固酮拮抗剂类药物(如阿米洛利)[34,57]。该类药物可引起钠盐丢失,进一步造成低血容量风险,因此不建议常规使用[57],仅适用于通过补钾及COX抑制剂治疗难以纠正的严重低血钾患者,且在补钾及COX抑制剂基础上应用[55]。螺内酯具有抗雄激素活性,可出现男性乳房发育[32]、高甘油三酯血症[60]等副作用。
3.2.2.3 ACEI/ARB
ACEI/ARB 主要通过抑制激活的RAS发挥作用,用药期间需注意监测患者血压和肾功能水平[61],尤其警惕致死性低血容量,因此建议仅在已应用COX抑制剂及电解质补充剂而疗效欠佳的患者中作为个体化治疗手段(限制性推荐)。直接肾素抑制剂阿利吉伦也可用于治疗BS患者,但相关报道较少,仍需进一步探索[62-63]。
3.2.3 耳聋的治疗
BS 4型可表现为感音神经性耳聋。耳蜗外毛细胞的丧失和内耳电位的降低引起内毛细胞机械电传导电流下降,可能为导致耳聋的潜在机制。一项针对6例 BS 4型感音神经性耳聋患者的回顾性研究显示[64],相较于传统助听器,人工耳蜗植入可改善患者的语言发育。因此,应尽早将患者转诊至有条件的医院,尽早(2岁前)干预,术前应进行相应评估。
3.3 随访监测和预后
3.3.1 随访
BS临床表现复杂,目前尚无有效的根治方案,需长期随访监测。对于经规范治疗且病情稳定的6岁以下患儿,建议随访时间间隔为3~6个月;对于经规范治疗且病情稳定的6岁及以上患儿及成人患者,建议每6~12个月随访1次。随访内容包括:评估相关症状(肌无力、心悸、尿量、听力等)、生长发育情况、心理情绪状态和药物副作用等;定期监测尿常规、尿钙、肾功能、电解质、血气分析、类胰岛素样生长因子1、立位肾素-血管紧张素-醛固酮、泌尿系统超声、心电图等;调整治疗,疏导可能发生的情绪障碍。对于儿童患者,每次随访时均需评估其生长发育情况,包括身高、体质量、头围、生长速度及青春期发育情况。如出现发热、腹泻、呕吐等症状,应及时就诊复查血钾等指标。
3.3.2 预后
研究显示,不同基因型的BS患者临床表型存在差异,文献提示严重基因变异(如大片段缺失、移码变异、无义变异和关键剪接位点变异等)的临床表型可能更严重,但基因型与表型也不完全一致[6],大部分经规范治疗的BS患者预后良好[32]。早期诊断和干预可明显改善BS患儿的生长迟缓。尽管BS患者中高钙尿症和/或肾钙质沉着症比较常见,但症状性尿石症的患病率相对较低。在不同BS队列中,肾功能不全占比为4.8%~63%[6,32,55]。一项针对77例BS 3型患者的病例系列研究显示,中位随访时间为8年,19例(25%)患者发生肾小球滤过率下降,其中1例行血液透析,4例接受了肾移植[6]。
4 并发症管理
推荐意见
(9)生长发育落后是BS患儿常见的临床表现,纠正电解质紊乱、联合COX 抑制剂可改善部分患儿的身高增长速度(证据等级:2b;推荐强度:B)。
(10)如电解质紊乱纠正后BS患儿身高增长仍不理想,可行生长激素刺激试验,对于生长激素缺乏者可予以生长激素治疗(证据等级:3;推荐强度:B)。
(11)肾钙质沉着和结石是BS的常见表现,早期干预有助于改善症状和预后(证据等级:3;推荐强度:B)。
(12)肾功能不全和蛋白尿在BS中并不少见,建议在首次接诊及随访过程中定期复查尿蛋白、肾功能变化(证据等级:3;推荐强度:B)。
4.1 生长发育
4.1.1 生长发育评估
未经治疗的BS患儿常出现生长发育落后[6],尤其是BS 3型,可能与电解质紊乱、生长激素缺乏、反复脱水、营养不良、合并CKD等相关。通过积极纠正电解质紊乱等治疗,患儿生长速度可呈现不同程度的恢复[40]。建议长期规律监测患儿身高和体质量,绘制生长曲线图(参照首都儿科研究所《中国0~18岁 儿童青少年生长图表》),一旦发现生长迟滞,及时给予积极干预[1]。
每次规律随访的同时,评估患儿生长发育相关指标,包括身高、体质量等,计算生长速度,对于年长患儿还应关注青春期发育情况,必要时需完善骨龄及内分泌相关评估。
4.1.2 生长治疗
多项研究证实补充电解质联合COX抑制剂治疗后,患儿的生长速度可有不同程度恢复[55,65-68]。生长激素刺激试验提示,BS患儿(尤其是BS 3型)存在生长激素缺乏症(growth hormone deficiency,GHD)[34,38,69]。如常规补钾治疗后身高增长不理想,绝对身高在同年龄、同性别正常儿童身高均值-2SD以下,生理年龄≥2岁且≤14岁,女孩骨龄≤10岁或男孩骨龄≤11岁,青春发育期前儿童(Tanner Ⅰ期)可行生长激素刺激试验,对于生长激素缺乏者可予以补充生长激素治疗[34,38,69]。
4.2 肾钙质沉着、肾结石及其他肾小管功能异常
肾钙质沉着或肾结石是BS患者的常见症状,可能继发于BS的高钙尿症[70],肾钙质沉着与肾结石可损伤肾小管功能,影响肾脏长期预后[71-72],常见于BS 4型以外的BS患者[70,73-74]。其中BS 2型患者发病较早,常表现为早发肾钙质沉着或肾结石[75-76]。BS 3型患者出现肾钙质沉着的比例约为20%[17],其发病情况和症状差异可能与致病基因变异不同相关[40]。早期予以补钾、补盐、应用COX抑制剂治疗等可有效降低尿钙水平,有助于延缓肾钙质沉着和肾结石的发生及发展[24,77]。
个别BS患者还可合并氨基酸尿[68]、混合型肾小管性酸中毒[78]等其他肾小管功能损伤,与BS类型无关。
4.3 骨关节改变
少数BS患者可出现继发于甲状旁腺功能亢进的高钙血症,可能与患者的高钙尿症相关,临床可出现四肢变形、关节硬化、身材矮小,还存在骨去矿化、骨膜下骨吸收和骨变形等其他改变,应用西那卡塞治疗有效[79-81]。另有部分BS患者可出现骨量减少,甚至骨质疏松,而COX抑制剂可降低尿钙排泄,从而保持骨量稳定[81]。监测甲状旁腺激素水平有助于及时开展治疗,避免严重骨关节障碍[79-80,82]。
4.4 肾功能不全及蛋白尿
BS 1~5型均可出现蛋白尿和肾功能不全,蛋白尿可从少量至肾病范围[6,18,32,39,68,76,83-85]。肾功能损害常见于BS 1型和BS 4型[1,32]。病因较复杂,如早产/低出生体质量[86];RAS的长期激活可导致足细胞损伤和节段性肾小球硬化[32,39];因肾性失盐导致血容量不足,在腹泻、呕吐等诱因下易出现肾功能损害[87];肾钙质沉着或肾结石形成[88]等。长期使用COX抑制剂是否导致肾小球滤过率下降,目前尚有争议[32,89]。少数行肾穿刺的BS病例的肾脏病理可见球旁器增生和肾小管间质病变[1],个案报道亦存在局灶节段性肾小球硬化[6,32,39,84]、C1q肾病[68]、IgA肾病[85]等。故BS患者随诊时需定期复查尿蛋白和肾功能。
5 特殊情况的管理
推荐意见
(13)BS总体妊娠结局良好。妊娠可加重患者的低钾血症,应严格监测血电解质水平,并增加补钾量;分娩后患者血钾水平可改善,围产期应多学科协作(证据等级:3;推荐强度:B)。
(14)BS患者存在电解质、酸碱平衡紊乱、心律失常、血压偏低等风险,应充分评估围术期风险,强调多学科协作,制订个体化管理方案(证据等级:3;推荐强度:B)。
(15)BS存在重症风险,应注意定期监测血电解质和心电图,谨慎使用可抑制钠重吸收的药物、可减缓心率或影响QT间期的药物以及可能引起横纹肌溶解的药物(证据等级:3;推荐强度:B)。
5.1 合并妊娠
BS合并妊娠的文献均为个案报道,总体妊娠结局良好[90-96]。妊娠可加重患者的低钾血症,主要原因包括妊娠可导致肾小球滤过率升高,从而使尿钾丢失量增加;早孕反应导致胃肠道摄入减少且丢失增加;同时伴随胎儿的需求增加[97]。因此,妊娠期应严格监测血电解质水平,并增加补钾剂量;分娩过程中也应监测电解质水平,调整补钾剂量;分娩后血钾水平可逐渐改善。围产期多学科协作和密切监测病情非常重要,建议肾内科、营养科、产科、麻醉科和儿科医生共同参与患者的管理。妊娠期血钾的目标值尚不明确,通常认为至少达到3.0 mmol/L以上[1]。ACEI/ARB类药物存在致畸风险,妊娠期应禁用[30]。
5.2 围术期管理
BS患者围术期的麻醉管理基于个案报道汇总,虽然大部分患者能耐受全身麻醉和硬膜下麻醉[96,98-101],但围术期需重点关注以下方面:(1)术前血压。患者术前血压偏低且对血管活性药物反应较弱,麻醉诱导时应格外关注血压波动,应使用对血流动力学影响较小的药物。(2)术前血钾水平。据文献报道,患者术前血钾水平一般波动于3.0~4.0 mmol/L之间[96,99-100,102-103];同时根据英国国家健康与临床卓越研究所的指南推荐,血钾的最低安全阈值应为3.0 mmol/L[104],麻醉期间应注意低钾对麻醉药物药效的影响,避免血电解质和酸碱紊乱。(3)肾功能不全。减少使用经肾排泄的麻醉药物,以避免存在肾脏损伤的潜在风险[43]。(4)其他如容量管理以及凝血功能障碍也需特别关注,有学者提出应谨慎使用椎管内麻醉。
5.3 重症风险处理
为减少BS患者的低血容量风险,应谨慎使用可抑制钠重吸收的药物,如呋塞米、氢氯噻嗪等。对于存在低血钾的BS患者,应谨慎使用可减缓心率或影响QT间期的药物,如抗心律失常药物、质子泵抑制剂、大环内酯类、氟喹诺酮类、精神类药物、抗真菌药物、β2-肾上腺素能受体激动剂等。BS患者应定期监测血钾、血镁及心电图,当患者主诉心悸、晕厥,或低血钾、低血镁改善后心电图仍有异常,应行进一步检查,如24 h动态心电图检查,及时于心内科就诊。如出现反复呕吐、腹泻等症状,应警惕严重低血钾和低血镁风险。此外,大量饮酒、剧烈运动、加用他汀类降脂药物的BS患者,应警惕横纹肌溶解风险[29]。
6 小结
BS是一组罕见的遗传性失盐性肾病,由编码或调控肾小管髓袢升支粗段和远曲小管的钠、钾、氯转运蛋白基因变异所致,遗传方式包括常染色体隐性遗传和X连锁隐性遗传,致病基因包括SLC12A1、KCNJ1、CLCNKB、CLCNKA、BSND、MAGED2。通过全面的文献复习,基于最新循证医学证据,多学科领域专家在BS综合征的临床表现及分型、诊断、治疗和并发症管理方面达成一致共识,旨在为BS的临床诊治提供科学指导与帮助。未来随着更多BS高质量临床研究证据的出现,共识将不断更新和完善。
作者贡献:本专家共识由中华医学会罕见病分会、中国研究型医院学会罕见病分会、中国罕见病联盟、北京罕见病诊疗与保障学会发起,陈丽萌、陈朝英、张抒扬牵头成立共识制订工作组,编写组成员共同起草了共识初稿,专家组成员共同进行讨论和投票。
利益冲突:所有参与本共识制订的人员均声明不存在利益冲突
专家组成员(按姓氏首字母排序):
陈朝英(首都儿科研究所附属儿童医院肾脏内科),陈丽萌(北京协和医院肾内科),陈崴(中山大学附属第一医院肾内科),陈晓巍(北京协和医院耳鼻喉科),程虹(首都医科大学附属北京安贞医院肾内科),程庆砾(中国人民解放军总医院肾脏病科),高劲松(北京协和医院妇产科),韩飞(浙江大学医学院附属第一医院肾脏病中心),李月红(北京清华长庚医院肾内科),刘晓清(北京协和医院感染内科 临床流行病学教研室),刘小荣(首都医科大学附属北京儿童医院肾病科),刘雅萍(中国医学科学院基础医学研究所 医学遗传学系),马坤岭(浙江大学医学院附属第二医院肾脏内科),毛建华(浙江大学医学院附属儿童医院肾脏内科),毛永辉(北京医院肾脏内科),梅长林(上海长征医院肾脏病科),聂敏(北京协和医院内分泌科),童安莉(北京协和医院内分泌科),王墨(重庆医科大学附属儿童医院肾脏内科),王悦(北京大学第三医院肾内科),魏珉(北京协和医院儿科),许辉(中南大学湘雅医院肾脏内科),杨琼琼(中山大学孙逸仙纪念医院肾内科),姚丽(中国医科大学附属第一医院肾脏内科),易杰(北京协和医院麻醉科),张爱华(南京医科大学附属儿童医院肾脏科),张抒扬(北京协和医院心内科,疑难重症及罕见病国家重点实验室),郑亚莉(宁夏回族自治区人民医院肾脏内科),郑智华(中山大学附属第七医院肾脏病中心)
执笔者:张磊(北京协和医院肾内科),彭晓艳(首都儿科研究所附属儿童医院肾脏内科),杨宏仙(首都儿科研究所附属儿童医院肾脏内科),简珊(北京协和医院儿科),樊晓红(北京协和医院肾内科),蒋兰萍(中山大学附属第一医院肾内科),董源(北京协和医院肾内科),赵若环(北京协和医院肾内科),吕宁(北京协和医院肾内科),乐偲(北京协和医院肾内科),涂娟(首都儿科研究所附属儿童医院肾脏内科),陈朝英(首都儿科研究所附属儿童医院肾脏内科),陈丽萌(北京协和医院肾内科)

