新冠病毒嗜神经性致神经系统损伤及功能紊乱
姚金艳,关心,魏文娟,邹伟,刘晶,3
病毒感染在通常情况下从外周组织开始,很少会扩散到中枢神经系统(central nervous system,CNS),这是因为血脑屏障(blood brain barrier,BBB)可有效地保护CNS免受大多数病毒的感染[1]。戊型肝炎病毒(hepatitis e virus,HEV)是第一个被发现侵袭CNS的冠状病毒(1962年)[2],像这类具有神经毒力的病毒浸润CNS 影响神经元和神经胶质细胞的正常功能并诱发各种神经系统症状的现象被称为嗜神经性[3]。严重急性呼吸系统综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)导致2019 年新型冠状病毒肺炎(coronavirus diseas 2019,COVID-19)持续在世界范围肆虐,许多报道开始聚焦于COVID-19 患者神经系统表现[4-10]。Joost 等[11]综合了中国、英国、拉丁美洲等大量流行病学数据,总结了COVID-19 的病理生理学、诊断和治疗,其中出现的神经系统症状也在常见临床诊断症状之列,包括疲劳、肌痛(15%~44%),头痛、无力(25%),厌食、失语(3%)等,且伴随意识障碍(8%)、急性脑血管病(3%)、休克(6%)等。Zhou等[12]通过1 099例新冠肺炎患者的研究发现COVID-19 除全身性表现外,也可引起多种神经系统症状,且重症多集中在老年患者或有严重基础疾病的患者。已有相当多的研究证明SARS-CoV具有嗜神经性,因而推测SARS-CoV-2 也很有可能具嗜神经性。Rhea 等[13]利用放射性元素标记过的SARS-CoV-2刺突蛋白(S1)I-S1亚基可轻松越过小鼠BBB,进入大脑实质。有人从患者脑脊液中检测到SARS-CoV-2 mRNA,表明SARS-CoV-2 可穿过BBB[14]。病毒入侵神经系统以激活人体固有免疫应答的同时不可避免也利用某些信号通路加剧病毒的感染[15]。新近发现,受细胞因子风暴影响,SARS-CoV-2侵入机体产生的大量细胞因子可直接影响CNS 功能而无需透过BBB[16]。为更好地开展进一步研究,本文聚焦于新冠病毒的嗜神经性,探讨病毒嗜神经性可能引发的免疫应答机制,总结二者同时存在引发的一系列COVID-19相关神经系统损伤性功能紊乱,为未来寻找有效的防治方法及改善患者神经系统预后提供新思路。
1 SARS-CoV-2的嗜神经性及免疫应答机制
1.1 病毒与嗜神经性
BBB由脑微血管内皮细胞、周细胞和星形胶质细胞伪足等组成,是CNS免受感染的主要屏障。研究发现,有些嗜神经性病毒的成分如人类免疫缺陷病毒-Ⅰ型Tat蛋白能刺激星形胶质细胞释放基质金属蛋白酶9,导致BBB完整性受损。但也有些病毒可在BBB没有受损的情况下通过BBB。如一些病毒(α疱疹病毒)可通过与感觉神经元和自主神经元轴突末端的受体结合进入外周神经系统。通常,病毒粒子可通过与质膜直接融合穿透质膜或通过内吞作用进入细胞,而后顺行或逆行运输到神经元细胞体,感染神经元(图1)。
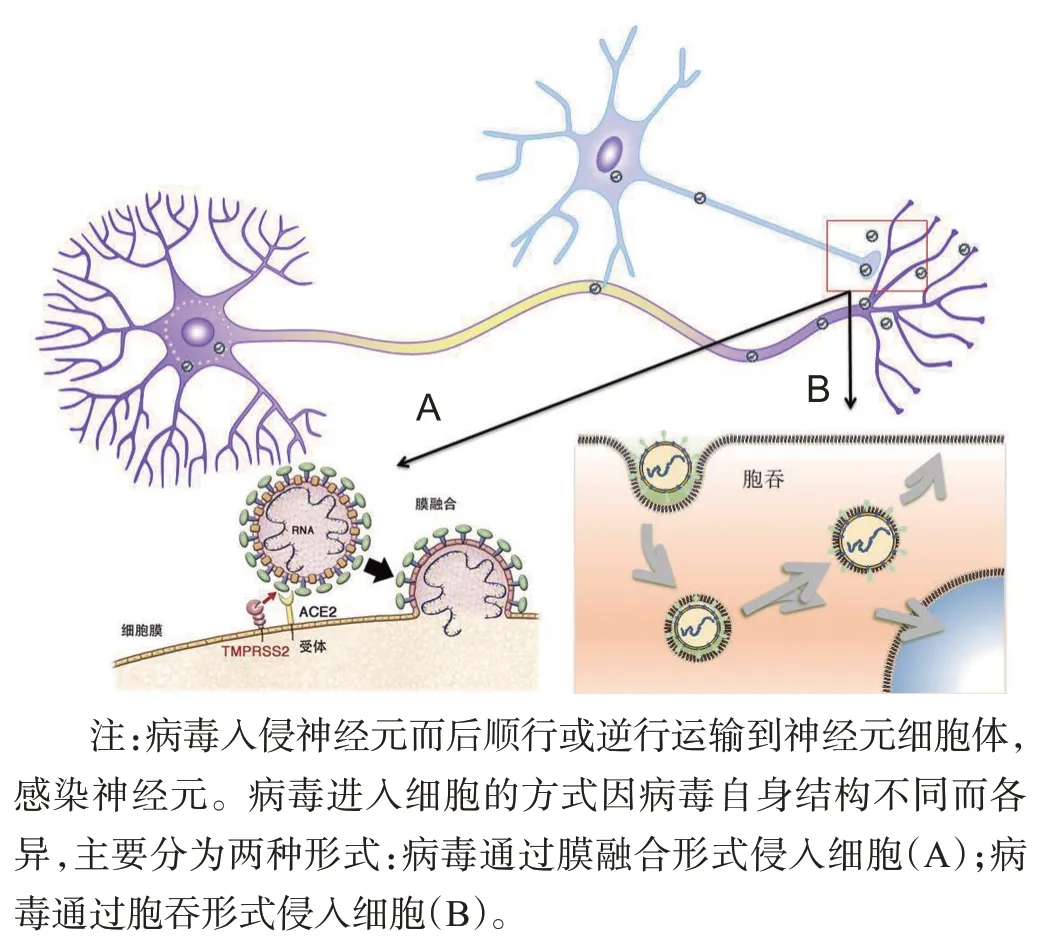
图1 病毒嗜神经性模式
1.2 SARS-CoV-2与嗜神经性
研究表明,SARS-CoV-2 为单股正链RNA(26~32 kb)包膜病毒。病毒整个蛋白质外壳由刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)组成。S 蛋白作为SARS-CoV-2 包膜表面最大的蛋白,在附着宿主细胞和膜融合方面起着至关重要的作用,因而S 蛋白通过影响病毒颗粒的溶解度进而决定病毒的感染性[17]。目前普遍公认的SARS-CoV-2入侵宿主细胞的方式为膜融合形式。在与宿主细胞融合前,SARS-CoV-2的S蛋白与血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)结合后诱导S蛋白构象变化,促进S1/S2裂解位点的跨膜蛋白酶丝氨酸2、组织蛋白酶L 或弗林蛋白酶水解S 蛋白,导致S1和S2亚基解离。新分离的S2亚基的构象变化促进用于膜融合进入宿主细胞的螺旋融合中间体的形成[18,19]。但最新研究发现,有些细胞(如小胶质细胞、周细胞等)表面未表达ACE2 受体,但依旧发现了SARS-CoV-2入侵的现象,提示病毒可能通过与其他受体结合进入宿主细胞[16]。Wang 等[20]发现除了ACE2,SARS-CoV-2 还可利用细胞表面蛋白(basignin,BSG)和神经纤毛蛋白1(neuropilin-1,NRP1)等非典型受体进入神经细胞。由于新冠肺炎疫情来的凶猛突然,病毒变异又快,临床提供的数据尚不完整,人们对SARS-CoV-2 嗜神经性的认识还不清楚。目前研究数据支持病毒可能通过血液途径或神经逆行途径侵入CNS(图2)。首先,SARS-CoV-2 通过BBB 进入CNS 的方式存在多种可能性。血液中可能存在携带SARS-CoV-2 的白细胞,可以迁移穿过BBB;此外因SARS-CoV-2 入侵引发的炎症反应破坏BBB,病毒通过内皮细胞间隙进入CNS。而后,病毒突破BBB 并传播到脑组织中可以与神经细胞膜上的受体识别直接损伤破坏神经元,也可激活CNS中的免疫应答机制。进入CNS中的病毒在脑内可能通过募集大脑中具有特定神经递质的通路来介导其传播,还可通过神经元顺行或逆行机制传播[5]。在外周病毒可能通过嗅觉神经元和迷走神经以神经元逆行途径进入CNS[21]。Heppner 等[22]认为SARS-CoV-2 可通过筛板在嗅球传播,SARS-CoV-2 通过筛板与神经元上的ACE2 结合。Esposito等[23]根据SARS-CoV-2从肺和上呼吸道的迷走神经传入CNS的推论结合COVID-19患者消化系统症状推测肠道神经系统可能成为SARS-CoV2 神经入侵的替代入口。无论病毒通过何种途径到达CNS,病毒感染引起的细胞因子会破坏BBB 的紧密连接,一方面病毒通过复制导致神经元病变,另一方面病毒激活免疫系统加速神经元的损伤[24]。
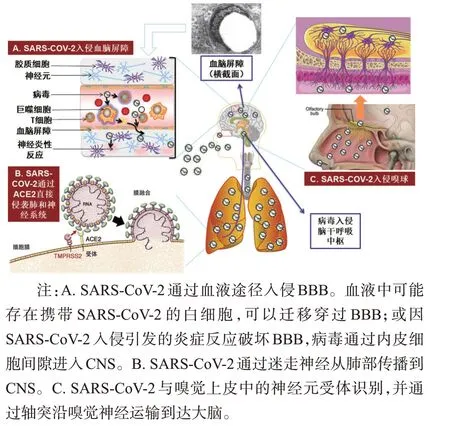
图2 SARS-CoV-2入侵神经系统可能路径
1.3 SARS-CoV-2与免疫应答失衡
众所周知,病毒侵入人体后,可引起固有免疫和适应性免疫反应,二者相互影响,相辅相成。首先启动宿主防御的固有免疫反应激活信号通路,然后适应性免疫反应进一步迅速高效地清除病毒。刘丽等[25]观察了中国猕猴在SARS-CoV-2急性感染过程中抗S-IgG对巨噬细胞造成的反应发现,一方面,病毒激活肺内静止的巨噬细胞,进而将单核细胞募集到损伤部位并释放炎症因子;另一方面,被激活的巨噬细胞产生基质金属蛋白酶、生长因子和抗炎因子(尤其是TGF-β)等来发挥抗炎功能。临床研究也表明,在最终恢复阶段,若抗炎功能占据优势,炎症反应迅速消退,病灶将恢复正常结构,意味着患者即可战胜病魔。反之,固有免疫与适应性免疫应答失衡、促炎性与抗炎性细胞因子水平失衡引发细胞因子风暴综合征(cytokine storm syndrome,CSS)。需要指出的是,急性坏死性脑病通常与颅内细胞因子风暴有关,这可能导致BBB 的破坏。已经发现,COVID-19 患者血中的促炎因子如IL-6、IL-1b、TNF、IL-17、IL-2、IL-8、G-CSF、GMCSF、IP10、MCP1、MIP1a2等水平升高,尤以IL-6水平与临床预后密切相关(其可能相关的信号通路见图3)。这些促炎细胞因子进入CNS可激活神经胶质细胞并改变其功能,从而导致神经胶质细胞的活化和增殖,这可进一步破坏BBB的结构和功能完整性[26]。
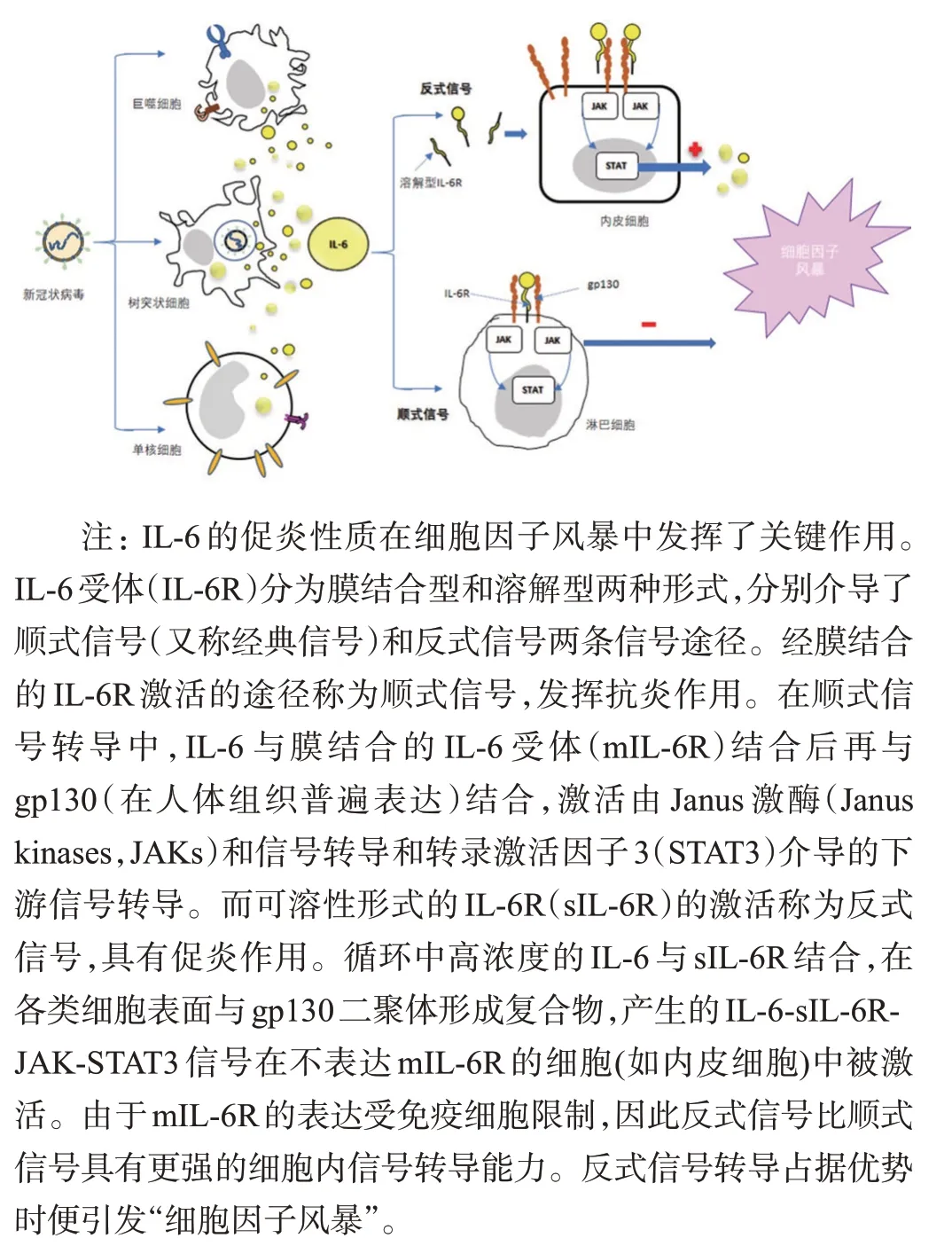
图3 细胞因子风暴模式
2 SARS-CoV-2致神经系统疾病损伤及功能紊乱
临床观察到,COVID-19 患者同时伴随着神经系统症状[27],其表现包括CNS 表现(图4)、周围神经系统(peripheral nervous system,PNS)表现和骨骼肌损伤。Mao 等[28]回顾了中国武汉市华中科技大学协和医院3个COVID-19指定专科中心已确诊的214例患者,其中至少1/3的患者具有某种神经系统表现。嗅觉味觉障碍、共济失调和精神状态改变等可能是SARS-CoV-2 嗜神经性的早期迹象[29],且随着患者的症状加重,COVID-19患者可出现肌痛、肌酸激酶水平升高、横纹肌溶解等骨骼肌损伤表现,症状严重者甚至死亡[30]。因而早期识别和发现微小神经系统症状,有针对性地进行干预治疗对改善预后具有极大的价值。
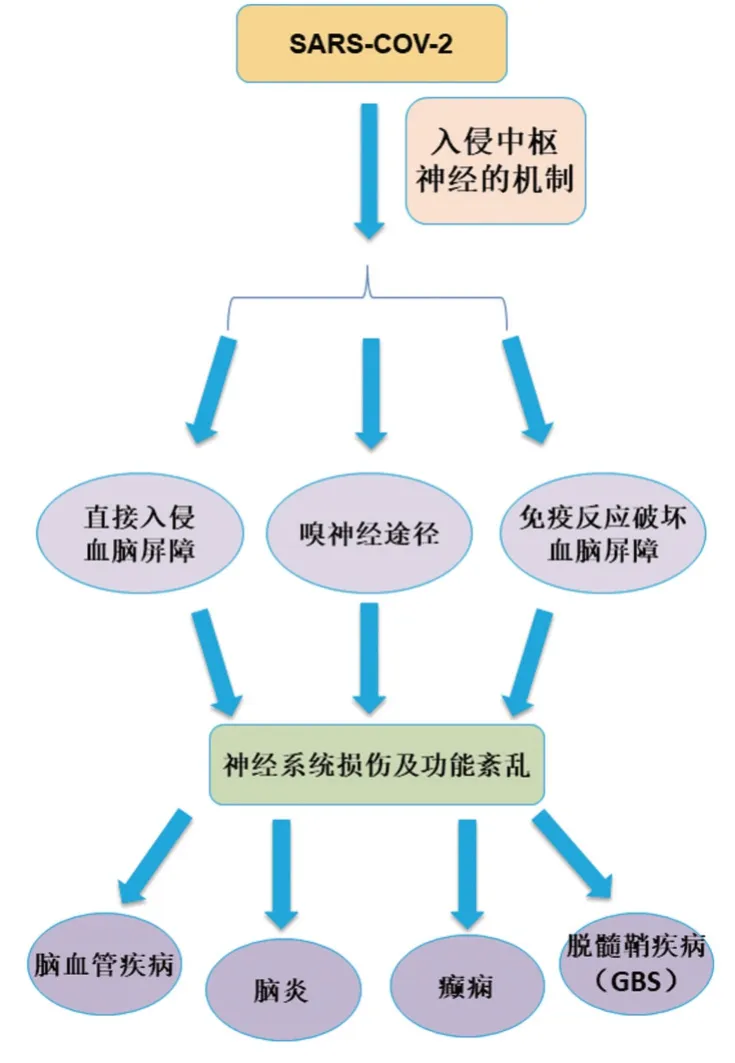
图4 SARS-CoV-2致神经系统损伤及功能紊乱
2.1 中枢神经系统疾病损伤及功能紊乱
2.1.1 脑炎 脑炎是一种急性、弥漫性、炎症性的大脑疾病。临床表现为发热、头痛、癫痫、局灶性神经功能缺损和意识改变。意识改变的范围可以从嗜睡到深度昏迷。脑脊液检查可以检测出脑炎的病原体。临床检测人员运用RT-PCR 技术从某些COVID-19患者脑脊液中检测出SARS-CoV-2的mRNA,得出脑炎的诊断[31,32]。Siahaan 等[21]从24 项研究中总结有33 例新冠肺炎患者出现脑炎并发症。SARS-CoV-2相关脑炎的临床表现与中东呼吸综合征冠状病毒相关脑炎相似,主要表现为上呼吸道感染(发热、咳嗽、乏力),精神状态下降,快速呼吸衰竭[21]。更有甚者在病情进展的过程中因严重缺氧诱发急性出血性坏死性脑炎[28,33],这很有可能是因为SARS-CoV-2在肺泡上皮细胞中复制和增殖,肺间质和肺泡弥漫性炎性渗出,大量炎症因子释放促进肺透明膜形成,影响肺泡气体交换引发缺氧,缺氧后则会导致脑水肿和脑循环缺血。相比较而言,COVID-19 重症患者比轻症患者更容易出现神经系统症状。联系上述病毒入侵CNS 的机制,在脑内ACE2除在血管内皮细胞上表达外,还在脑干和延髓头端腹外侧的神经元和胶质细胞表达,因而SARS-CoV-2 直接入侵脑干可能导致原发性中枢性呼吸衰竭[34]。然而某些患者脑脊液中并没有发现SARS-CoV-2,因此人们猜测,神经系统并发症可能是由细胞因子风暴引起,而非病毒直接入侵CNS所致[24]。确实如上所述,一些临床、实验室和影像学结果显示,COVID-19相关性脑炎造成脑损伤的原因是细胞因子免疫介导炎症,而非病毒的直接侵袭[21]。IL-6激活CD4+T淋巴细胞分化成Th17,促进细胞因子IL-17、IL-21 和IL-22 的产生,从而引发细胞因子风暴,同时造成血管内皮功能障碍,导致BBB受损,使炎症因子更易进入脑实质,进一步造成神经系统损伤[21]。即使在感染清除后,COVID-19 患者也有可能发展为神经退行性疾病或持续性认知障碍等不良预后。
2.1.2 脑血管疾病 脑血管疾病是由于各种原因导致脑器质性损伤类疾病的总称,以突发且迅速出现局限性或弥散性脑功能缺损为共同临床特征,主要临床类型为卒中(stroke),分为缺血性卒中和出血性卒中。有关新冠肺炎的早期病例报告描述了患有新冠肺炎的年轻健康个体出现脑梗死,但在随后的众多病例中,患者通常年龄较大,并有大量脑血管合并症。因此,目前还不清楚是SARS-CoV-2 引发卒中,还是这些脑血管疾病高危人群发病时恰好感染SARS-CoV-2。但一般来说感染会增加卒中风险,SARS-CoV-2 在机体内外都能感染血管并导致血管内皮损伤,一方面,内皮损伤激活凝血系统从而导致血栓性疾病[35];另一方面,SARS-CoV-2 与内皮细胞上的ACE2 受体结合,引起血压升高并伴有血小板减少征和出血性疾病。因此,病毒的直接侵袭、血管内皮功能障碍和血液的高凝状态都是导致COVID-19 患者卒中风险增加的因素[36]。卒中后引发的炎症进一步促进炎症因子在脑内大量聚集,正向促进CSS的发展[35,37]。综上所述,SARS-CoV-2 感染确实在导致卒中方面发挥了一定作用,最终导致脑血管损伤。
2.1.3 症状性癫痫及痫性发作 癫痫是各种病因所致的以反复发作为特征的神经元异常放电的临床综合征,发作形式多样,可表现一种或多种意识、行为、感觉、运动、精神和自主神经功能障碍。已明确病因(如病毒感染CNS)的CNS 损伤或功能紊乱所致癫痫称为症状性癫痫(symptomatic epilepsy)。临床上将每次癫痫发作的过程称为痫性发作(seizure)。痫性发作是COVID-19患者症状加重的神经系统表现,若COVID-19患者先前存在癫痫和神经系统局灶性病变(如脑炎和脑血管疾病),会导致癫痫发作的可能性增加或癫痫持续状态加重[38],正如美国的三级诊疗医院回顾的7例患者中的3例患者既往有控制良好的癫痫病史,感染SARS-CoV-2后继发症状性癫痫,表明SARSCoV-2通过各种途径入侵CNS可能降低痫性发作的阈值[39]。而剩下的4例新发癫痫发作的患者中有2例既往有卒中史[40],说明成人急性症状性癫痫往往与神经系统损伤与功能紊乱密切相关。痫性发作很少独立存在,有基础疾病的COVID-19 老年患者是痫性发作的高发人群[41],此外多器官衰竭和相关的代谢紊乱等严重并发症也会干扰正常的神经元网络,从而加大诊疗难度,预后不甚理想。Geneslaw 等[42]从哥伦比亚大学欧文医学中心儿科重症监护医学科收入的82 例患儿中有4 例出现痫性发作,其确切发病机制尚不清楚,这是因为儿童神经系统还未发育完全,在疾病过程中跟成人存在很大的差异,但不排除是SARS-CoV-2 入侵CNS 使皮质受累的原因,或者免疫介导的大脑炎症激活谷氨酸受体,导致神经元过度兴奋,引发急性癫痫发作。临床上结合脑电图和影像学检查的早期诊疗显得尤为重要,应及早为COVID-19患者提供抗癫痫药物治疗、免疫疗法或调节血压等干预措施以改善预后。
2.2 外周神经系统疾病损伤及功能紊乱
2.2.1 格林-巴利综合征 格林-巴利综合征(Guillain-Barré syndrome,GBS)是自身免疫介导的周围神经病,主要累及脊神经根、周围神经、脑神经[43],临床表现为急性或亚急性起病,发病前1~3周常有感染史,患者多以肢体对称性弛缓性肌无力为首发症状[44]。Zhao 等[43]报道了首例COVID-19 合并GBS 患者,临床表现为双下肢严重肌无力,肌电图和神经传导检查提示脱髓鞘性疾病。Bhanot 等[45]报道了另一位54 岁的男性可能因感染SARS-CoV-2 引发了GBS,Toscano 等[46]也报道了5 例意大利COVID-19 合并GBS 患者,因此推测出COVID-19 与GBS 之间可能存在关联。此外,从发病机制角度看,GBS 患者体内因免疫应答产生的自身抗体与周围神经结构的成分相似而引发交叉反应(分子模仿),从而导致外周神经损伤[48],确与免疫系统受累相关,进而推测细胞因子风暴影响了机体正常的免疫调节能力,从而引发GBS。
2.2.2 周围神经系统疾病 COVID-19患者的非特异性PNS症状通常包括厌食、嗅觉障碍、味觉障碍、肌痛和疲劳。Mao 等[28]从214例COVID-19患者中总结,嗅觉、味觉减退是有PNS症状的患者的早期症状甚至首发症状。嗅觉减退的主要原因可能是如图2所示,病毒可通过结合嗅上皮ACE2受体感染并破坏鼻黏膜之后以轴突运输的方式进入CNS。临床发现,嗅觉和味觉减退和恢复几乎是同步的,这可能是因为味觉和嗅觉相互关联,也可能是因为SARS-CoV-2 同时识别并结合唾液酸中的受体,所以味觉功能减退[49]。此外,临床数据显示COVID-19 患者嗅觉和味觉的变化与IL-6的水平相关,相关研究发现IL-6参与嗅觉相关的信号通路,因而应关注出现味觉、嗅觉减退的轻度COVID-19患者的神经系统表现,避免疾病进一步加重[49]。
3 总结与展望
病毒嗜神经性作为冠状病毒常见特性之一,可引起急性或慢性感染、留下致残后遗症甚至死亡。SARS-CoV-2 具有嗜神经性,可侵入CNS 并引发症状,重症患者体内细胞因子风暴可加剧急、慢性神经炎症反应。COVID-19 除常见的呼吸系统受累外,还可导致多器官功能障碍,也可致神经系统损伤。本文总结了SARS-CoV-2 嗜神经性可能途径与机制及COVID-19 与相关神经系统疾病的关系,主要关注SARS-CoV-2 侵入神经系统后神经血管单元内的免疫应答机制,为未来寻找有效的防治方法及改善患者神经系统预后提供新思路。随着大量科学研究和临床数据正在全球范围内迅速积累,本课题组也积极参与COVID-19 的研究中,结合本课题组利用组织工程学积极构建类脑损伤修复模型并结合干细胞与微流控芯片方面的优势,探究干细胞在新冠病毒肺炎中的治疗作用,并对体外扩增培养的干细胞的功能有效性与移植安全性进行了评估(数据尚未发表),为探寻干细胞疗法修复COVID-19患者各系统损伤而做出努力。深入认识SARS-CoV-2嗜神经性的机制从而有助于临床对神经系统症状早发现、早诊断,并进行针对性治疗,最大程度地改善患者预后。

