参与调节哺乳动物精子运动的离子通道研究进展
何琪富,高 峰,吴盛辉,张 涌*,权富生*
(1.西北农林科技大学动物医学院,杨凌 712100;2.农业部动物生物技术重点实验室,杨凌 712100;3.陕西省动物胚胎工程技术研究中心,杨凌 712100)
哺乳动物精子通过复杂的精子发生过程,在附睾管运行过程中成熟,期间受到多种基因和激素调控,精子表面结构、细胞内物质数量和种类、生理及代谢状态发生变化[1-2]。精子运动能力受多种翻译后修饰、特定信号通路的激活或失活以及鞭毛摆动等调节[3-4]。动物本交或人工授精时,精子进入雌性生殖道,其功能受到离子通道和激素(如雌激素、孕激素)调节,但是影响哺乳动物精子运动的确切机制尚不清楚[5]。膜片钳、电生理学、药理学和分子技术等应用于该领域研究后发现,离子通道不仅参与调节精子运动、获能和顶体反应[6-9],还参与调节精子对孕酮的趋化性[8]、精子膜极化和能量稳态、在输卵管移动和卵母细胞结合过程[10-12]。其中,离子通道的功能在调节精子活力方面尤为重要,在精子发生的不同阶段将各种离子通道和细胞分布与其功能状态合并研究,有助于理解其参与精子分化和生理功能的分子机制[13-14]。因此总结这些离子通道在调节精子运动和受精能力中的机制,对于认识精子运动功能调控和改善精子运动研究具有重要意义。
1 精子运动调节因素
精子获得运动能力是从附睾开始,在雄性和雌性生殖道的不同部位表现出不同类型的运动[1,15]。在附睾中,鞭毛蛋白磷酸化导致低振幅的对称运动,精子进行基础运动,渐进性向前游动[16]。随后精子获能,进行超激活运动[17-18],头部侧向弯曲,鞭毛摆动增加,使得精子能够穿透黏稠的宫颈黏液,到达卵母细胞所处位置[19]。在精子运动的过程中要受到众多因素的影响,诸如:精子运动结构基础,能量代谢水平,所处环境中Ca2+、K+、Na+、Cl-和 HCO3-浓度,ATP含量,pH和温度等[16]。
1.1 结构基础
成熟精子包括头部和尾部,其中尾部为精子运动提供动力,尾部鞭毛的正常摆动决定精子能够顺利到达受精部位完成受精。尾部中段主要结构是轴丝和外围的线粒体鞘,轴丝是精子的运动器官,由远端中心粒形成,一直伸向精子的末段。精子轴丝的结构基本组成上都是9+2型,即位于中央的两条是单根的微管,四周是9条成双的微管,轴丝双微管弯曲产生的推进力,推进精子的前向运动对于精子运动性能而言极其重要[12]。
1.2 能量代谢
位于精子鞭毛中段的线粒体会通过氧化磷酸化和糖酵解产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP),在激活动力蛋白链中的ATP酶将ATP化学能转换为机械能,为精子鞭毛的摆动提供能量[12,20]。但是线粒体产生的ATP不能运输至整个鞭毛纤维,研究发现,缺失线粒体氧化磷酸化反应的小鼠精子依然具有受精能力,证明糖酵解过程产生ATP也同样用于精子运动调节[21],其中己糖激酶、乳酸脱氢酶和3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPD)是调节精子糖酵解活性的主要蛋白酶[22],综合来看,精子中ATP由线粒体氧化磷酸化和糖酵解过程共同产生。
1.3 精子运动的调节分子
精子运动通过两条重要的代谢途径进行调节:Ca2+途径和蛋白激酶A(protein kinase A,PKA)或环腺苷酸(cyclic adenosine monophosphate,cAMP)依赖性蛋白激酶途径,这两种途径都涉及Ca2+、HCO3-、腺苷酸环化酶(adenylate cyclase,AC)和通道蛋白磷酸化[16]。哺乳动物AC可分为可溶性AC(sAC)和跨膜AC(tmAC),通过在焦磷酸盐存在下催化ATP分子内环化为cAMP来调节细胞cAMP浓度[23-24]。
哺乳动物精子中最常见的AC是sAC,它参与以cAMP为基础的信号传递和鞭毛搏动频率的调节[25],Ca2+浓度增加会激活sAC,导致ATP转化为cAMP,从而使cAMP浓度增加[26]。sAC基因失活会造成精子缺乏向前性运动能力,最终导致雄性不育[25]。sAC活化的主要调节器是HCO3-和Ca2+离子,其中HCO3-直接调节sAC的功能,而不影响tmAC活性[23]。tmAC通过G蛋白偶联受体(G protein-coupled receptors,GPCR)激活,通过cAMP依赖性蛋白磷酸化参与精子基础进行性运动的调节,而sAC导致精子生成高浓度的cAMP,调节超激活运动。sAC在细胞过程中充当ATP、CO2、pH、Ca2+和HCO3-离子的传感器,调节精子细胞内与cAMP相关的大多数信号通路[25,27]。精子处于HCO3-环境会增加进入精子内部的Ca2+,从而使鞭毛搏动频率增加,导致PKA激活,引起蛋白质丝氨酸、苏氨酸残基和酪氨酸磷酸化加强[28]。所以Ca2+、ATP、pH及HCO3-均被认为是精子运动的关键调节分子[16]。
2 参与精子运动调节的离子通道
2.1 调节精子运动的Ca2+通道
精子离子通道主要受胞外的生理环境或生理因子调控,Ca2+是常见的参与细胞信号通路的次级信使,在调节精子运动中的作用已被广泛研究。精子中Ca2+来源有两种主要途径:1)分布在精子头部和线粒体钙库中Ca2+的释放;2)通过特定的Ca2+通道进入精子的Ca2+[29]。引起精子内外Ca2+浓度发生变化的因素如下:1)Ca2+通道(CatSper)第四跨膜区域所带正电荷的氨基酸残基可以感受电压的变化,精子膜发生去极化时通道激活;2)精子胞内碱化激活Ca2+通道;3)CatSper通道受到孕酮、前列腺素、血清白蛋白和环核苷酸等生理性物质激活[30-31]。不同浓度Ca2+对精子影响不同,相对较低的细胞内Ca2+浓度(10~40 nmol·L-1)诱导精子鞭毛的对称和线性跳动,相对较高的细胞内Ca2+浓度(100~300 nmol·L-1)通过诱导蛋白酪氨酸磷酸化诱导精子运动过度激活[32],而当Ca2+浓度过高(5~10 μmol·L-1)时,通过减少蛋白质酪氨酸磷酸化来抑制精子基础运动,例如研究发现,山羊附睾尾精子中Ca2+浓度为10 μmol·L-1时基础运动能力增强,而浓度大于10 μmol·L-1则抑制了运动能力[33],人类精浆中Ca2+浓度达到11 mmol·L-1时精子运动被抑制[34]。
在精子中,钙调节蛋白(calcium-modulated protein,CaM)作为鞭毛轴突中的主要钙受体发挥作用,并调节钙启动的信号转导途径,其与蛋白激酶、磷酸酶和sAC相互作用,调节精子运动[10,35-36]。与Ca2+流入精子细胞有关的离子通道主要有两种类型:精子的阳离子通道(CatSper)和储存囊泡中的Ca2+通道(SOCC)[37]。Ca2+进入精子内也受质膜Ca2+-ATP酶(PMCA)、Na+/Ca2+交换器和K+依赖性Na+/Ca2+交换器活性影响[38]。精子中与Ca2+相关的离子通道详细描述见下文,功能和定位统计见表1。
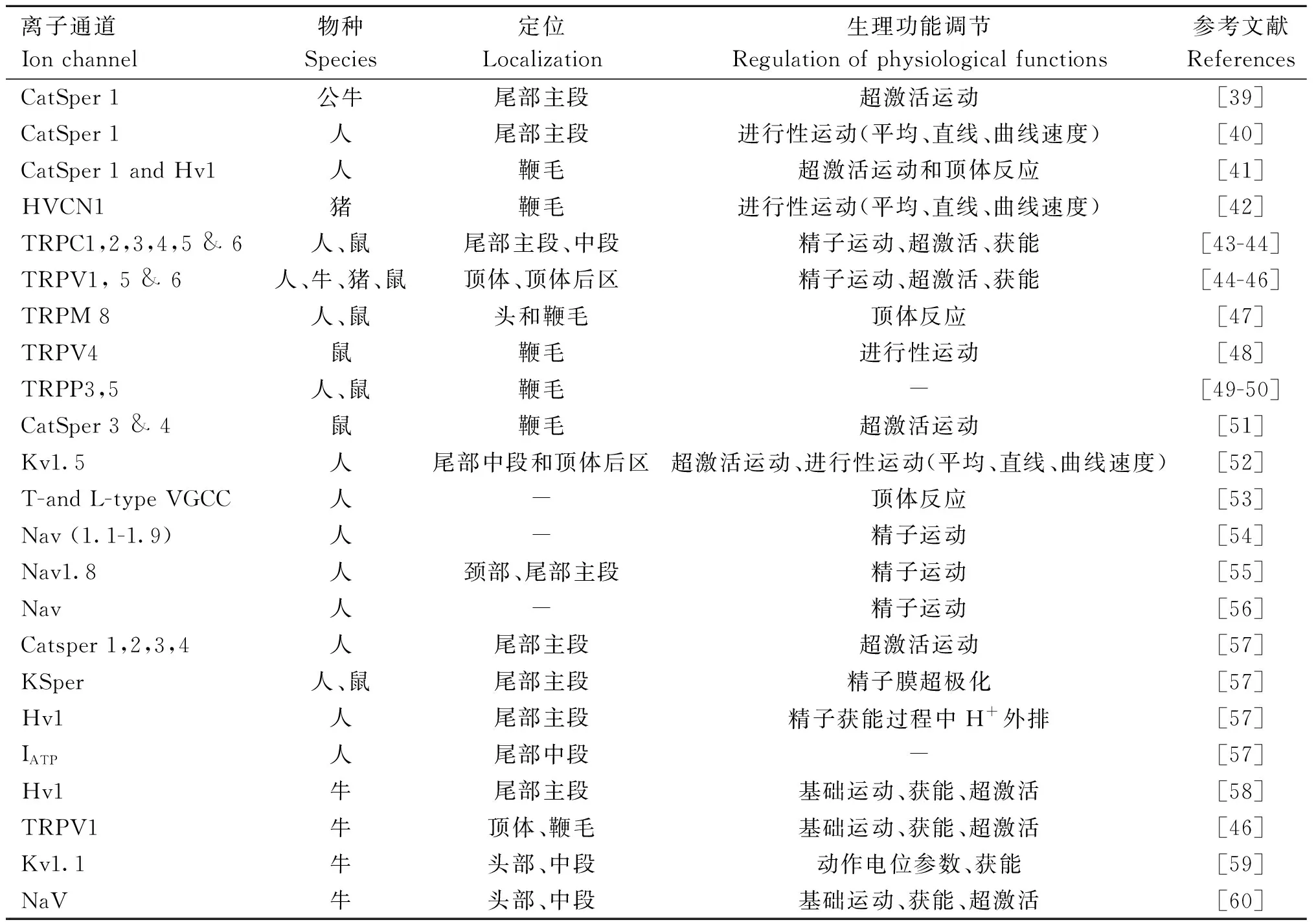
表1 与Ca2+相关的精子离子通道定位及功能Table 1 Localization and function of Ca2+-related sperm ion channels
2.1.1 CatSper通道 CatSper通道是与精子功能相关且研究的最广泛的通道,是指Ca2+进入细胞和细胞内Ca2+通过的特异性钙离子通道,在精子趋热性、趋化性、超激活和顶体反应中具有重要功能[61]。CatSper是质膜钙离子通道,特异性表达于成熟精子,在人和小鼠中,主要定位于精子尾部主段[30]。CatSper在精子发生期间在睾丸中表达,主要负责精子中的钙信号传递[62]。研究表明,在人、小鼠、猪和马等哺乳动物精子中存在CatSper通道[51,63-66],有趣的是,在马精子中,CatSper1亚单位富含组氨酸的pH传感器区域的结构存在物种差异性[66]。CatSper通道对pH[67]、Na+通道(EnaCs)[68]、Ca2+ATP酶、K+、电压门控质子通道(Hv1)[69]和HCO3-转运体诱导的Ca2+变化敏感[70]。该通道介导Ca2+进入精子受到多种生理因素的调节,包括卵母细胞周围卵丘细胞分泌的孕酮、子宫内膜分泌的前列腺素、环核苷酸,如cAMP和环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)、透明带蛋白、输卵管液中的牛血清白蛋白[71]。除Ca2+外,当细胞外Ca2+浓度达到极限时,CatSper通道还可促进单价离子(如Na+和Cs+)和二价离子(如Ba2+)的通过[38,63]。CatSper通道激活导致细胞外液Ca2+进入或内部Ca2+库释放,精子细胞内Ca2+浓度增加,精子鞭毛的形状和搏动方向发生变化,跳动频率增加导致运动活性增加[72-73]。
CatSper通道复合体由4个α亚基(CatSper 1-4)和6个辅助亚基CatSperβ(beta)、CatSperγ(gamma)、CatSperδ(delta)、CatSperε(epsilon)、CatSperζ(zeta)以及EF手钙结合域蛋白9(EF hand calcium-binding domain protein 9,EFCAB9)组成,其中α亚基包含6个跨膜结构域(TM1-TM6),形成两个生理功能上不同的区域,即电压传感结构域(VSD; TM1-4)和孔道形成结构域(TM5-6), TM1-TM4通过短环状结构连接,其中TM4即第4跨膜区段中含有带正电荷的氨基酸残基如赖氨酸/精氨酸作为电压传感器;TM5和TM6通过疏水的短环状结构连接,该区域具有高度保守的同源序列([T]×[D]×[W]),能够选择性地允许Ca2+进入。CatSper1的n端含有一个特定的富含组氨酸的区域,该区域参与pH对CatSper活性的调节(图1a)[74]。研究发现,与下层精子相比,向上游动的精子中CatSper1的丰度更高[75];与野生型小鼠相比,CatSper1和CatSper2缺失小鼠的精子鞭毛弯曲幅度较小[76],证明CatSper1也参与精子游动。靶向敲除小鼠精子CatSper3或CatSper4可阻止精子过度激活,但不影响其基本运动,这表明CatSper在精子运动最后阶段起作用[51]。
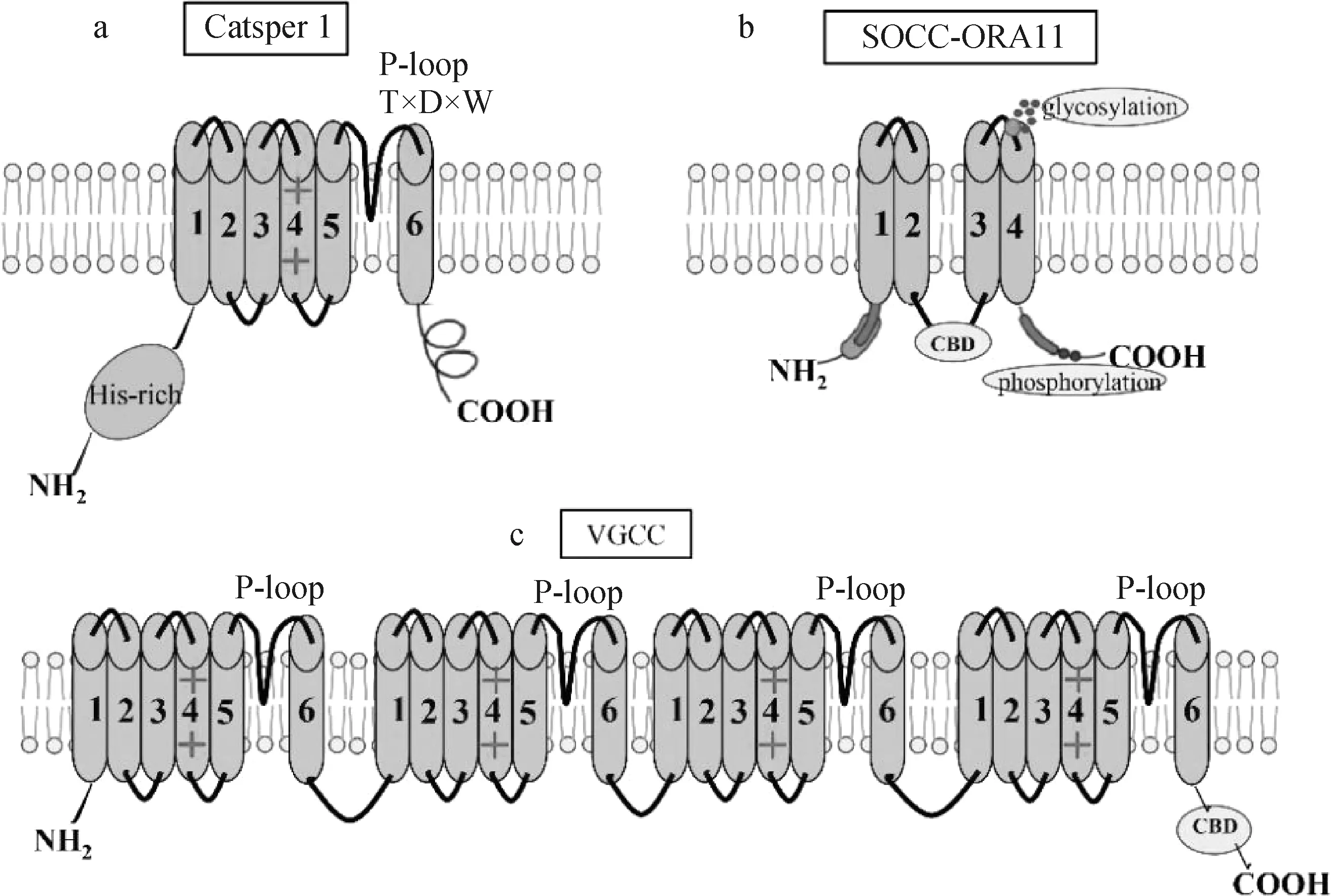
图1 调节精子运动的Ca2+通道拓扑结构(基于文献[74])Fig.1 Topology of Ca2+ channels regulating sperm motility (based on reference [74])
2.1.2 调控钙库的Ca2+通道(SOCC) SOCC是与内质网(endoplasmic reticulum,ER)在拓扑和物理结构上密切关联的质膜通道,当内质网中的Ca2+耗尽时,细胞外Ca2+通过该通道内流[77]。SOCCs是由ORAI1-3基因编码的蛋白质构成,每个ORAI蛋白有4个TMs,TM2和TM3形成一个孔环。基质相互作用分子(STIM1)和ORAI相互作用激活该通道,并从内质网释放Ca2+,Ca2+与其结合域(cell-binding domain,CBD)结合导致通道失活(图1b)[74]。SOCCs参与调节精子运动,信号级联由5′AMP活化蛋白激酶(Adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)磷酸化控制,抑制该通道会引起AMPK磷酸化减少,顶体反应减弱,鞭毛不对称搏动减少,精子活力降低[78]。
2.1.3 电压门控Ca2+通道(VGCC) VGCC是会因膜电位去极化而激活的膜离子通道[74],可以根据动作电位去极化信号介导Ca2+内流。根据该通道的药理和生理调节特性,VGCC可以分为4种,分别为L型、T型、R型和P/Q型通道[79]。VGCC是由α1(由CACNA1基因编码)、α2δ(CACNA2D)、β(CACNB)和γ(CACNG)亚单位组成的异多聚体。α1亚基的拓扑结构由4个同源结构域组成,每个结构域由6个跨膜α螺旋(TM1-6)组成。TM4作为电压传感器,当膜极性发生改变时引起构象变化,打开孔环。TM5、TM6和P-loop形成一个孔环,C端包含一个CBD,当Ca2+与CBD结合或通过CaM时通道失活(图1c)[74]。牛精子鞭毛中存在L型和T型VGCC,VGCC与孕酮诱导的运动性加强有关,选择性阻断这些通道大大降低了精子的运动性,单独或联合阻断两个通道导致基础运动减少[80]。重组ZP3蛋白通过L型和T型钙通道在人类精子中诱导顶体反应[52]。有趣的是,Garza-Lpez等[81]证明,L型VGCC孔隙区域中存在4种天冬氨酸,可确保人类精子细胞通道对Cd2+的敏感性和通透性。
2.1.4 瞬时受体电位通道(TRPV) 精子中的Ca2+流动除了受CatSper通道活性调节外,也受TRPV通道影响。目前,已报道TRP基因型有30种,根据序列分为7组:香草素(TRPV)、褪黑素(TRPM)、经典(TRPC)、锚蛋白(TRPA)、黏蛋白(TRPML)、多囊蛋白(TRPP)和TRP-无机械感受器电位C(TRPN)。TRPV是同源或异源四聚体,每个单体由6个跨膜α螺旋(transmembrane α helix,TM)组成,孔环由5~6个TM组成,孔环作用是选择性通过阳离子和调节温度激活通道。N端包含3~6个锚蛋白重复序列,这些通道可以与磷脂酰肌醇4,5-二磷酸(PIP2)和CaM相互作用,从而调节通道活性。
TRPV通道对Ca2+浓度变化、温度、化学物质、pH、机械压和渗透压敏感,上述通道受体激活介导Ca2+流入细胞,增加细胞内Ca2+含量[82]。TRPV通道的信号级联通过IP3途径介导,TRPVs有6种亚型:TRPV1、TRPV2、TRPV3、TRPV4、TRPV5和TRPV6。TRPV1~TRPV4蛋白对温度敏感,对Ca2+几乎没有通透性,氨基酸序列同源性约40%~50%;TRPV5与TRPV6对温度不敏感,具有很强的钙通透性[83],氨基酸序列同源性为75%。TRPV通道活性随pH降低而增加,并受细胞内PIP2的调节,虽然关于PIP2的作用存在许多争议,但是其结合后确实增加了通道敏感性[84]。有研究报道公牛精子中存在TRPV1通道,阻断或激活TRPV1可调节精子功能运动过度激活和顶体反应[46]。Kumar等[85]证明,在TRPV4的药理调节下,人类精子中存在从头部到鞭毛的Ca2+波传播。Hamano等[48]认为,TRPV4热敏特性在小鼠精子运动中有作用,TRPV4基因敲除小鼠的精子运动活性在高温环境中低于对照组。
2.2 调节精子运动的pH通道
精子细胞内pH调节包括3个离子通道:HCO3-通道、Hv1通道和Na+/H+交换器(sodium/hydrogen exchanger,NHE)。HCO3-是pH调节系统的重要组成部分,是雌性生殖道(尤其在输卵管)中的重要调节离子[86],当HCO3-进入精子细胞质时,伴随着Cl-进入,在获能过程中起重要作用[87]。HCO3-的内流刺激Ca2+流入精子,激活sAC和PKA和蛋白酪氨酸磷酸化,导致超激活运动和顶体反应[88]。同时,HCO3-的流入会导致精子细胞内碱化,导致细胞膜发生超极化反应[89-90]。
HCO3-内流主要通过Na+/HCO3-共转运体从精子中排出Na+来抵消,防止精子细胞内碱化和超极化[91]。在获能期间,HCO3-内流同时受到碳酸酐酶和囊性纤维化跨膜电导调节体(cystic fibrosis transmembrane conductance regulator,CFTR)离子通道的调节[89]。存在于精子鞭毛中的NHE是调节细胞内pH的另一种机制,缺乏NHE的小鼠不育,精子活力显著减弱[91]。外界环境pH影响精子基础运动和超激活运动的调节,在酸性pH条件下,由于Na+/K+-ATP酶活性降低,精子活力减弱;而碱性pH条件时,Ca2+内流增加,导致精子运动活性增强[92]。
参与调节精子细胞内pH的还有Hv1通道(VGHC)[69]。VGHC单体由4个TMs构成,在经典的电压门控通道中包含VSD,VGHCs不存在形成孔环结构的TM5-TM6。Boonamnaj和Sompornpisut[93]认为,VGHC二聚体中C端尾部通过形成卷曲结构相互作用,n端磷酸化位点可增强通道选择性(图2)。Hv1通道主要存在于精子鞭毛中,该通道诱导质子(H+)快速、高效、单向地转移到细胞外[94],导致细胞内碱化[95]。分子和功能的研究表明,该通道位于哺乳动物精子尾部主段,参与精子运动和超运动的调节[69]。由于该通道受到高浓度的锌抑制,也可以通过去除锌而激活,对精子运动产生调节作用[96],如精子在附睾内静止就与高浓度的锌有关,前列腺液中锌的浓度是附睾中锌浓度的300倍,完全抑制了精子的运动[97]。射精后,雌性生殖道中的锌被锌结合蛋白和内源性大麻素清除,导致Hv1通道激活,随后精子运动加强[98]。公牛精子鞭毛中有Hv1通道,特别是在主段部分,在公牛精子中,Hv1通道通过cAMP、蛋白激酶C(protein kinase C,PKC)和CatSper通道之间的复杂相互作用来调节精子获能、超激活运动和顶体反应[58]。
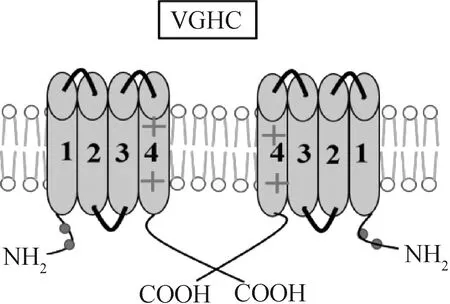
图2 精子电压门控H+通道(VGHC)拓扑结构(基于文献[74])Fig.2 Topology of sperm voltage-gated H+ channel (VGHC) (based on reference [74])
Hv1通道定位于精子尾部主段,与双侧纵线内的CatSper通道共同定位[99]。研究表明Hv1通道和CatSper之间存在功能上互作关系[100],Hv1通道沿精子鞭毛分布模式为CatSper选择性激活和随后的鞭毛旋转提供了结构基础[101]。Hv1通道参与精子进行性运动、获能和顶体反应[102],Hv1通道阻断导致精子运动参数的降低和孕酮诱导的顶体反应减弱[42]。此外,发现Hv1和CatSper通道参与NADPH氧化酶5(NADPH oxidase 5,Nox5)诱导的活性氧(reactive oxygen species,ROS)生成[100]。Ca2+与NOX5的结合激活产生超氧离子(O2-),尽管高浓度的活性氧与精子活力呈负相关,但一定水平的活性氧对于精子的正常功能是必要的[103-104]。
2.3 调节精子运动的电压门控钠通道(VGNCs,NaV)
电压门控Na+通道(VGNCs)存在于精子膜中,在功能上与神经元和肌肉细胞中的通道相似,当质膜从超极化状态转为去极化时,这些通道被激活(-70~-55 mV至0 mV),并向内传导Na+[105]。每个VGNC通道由1个α亚基构成,α亚基包括4个重复结构域(RD1-RD4),每个结构域有6个TMs。TM1-TM4形成一个VSD,TM4充当带正电的传感器。在去极化过程中,TM4向细胞外表面移动,构象改变激活通道。Na+通过TM5和TM6之间形成的P-loop在细胞内运输。RD3和RD4之间的细胞质环包含1个基序(I×F×M序列),其代表疏水氨基酸三联体,即异亮氨酸、苯丙氨酸和甲硫氨酸。IFM基序作为由RD3和RD4之间的孔环形成的疏水锁闩参与VGNC的失活(图3)[74]。Pinto等[54]在2009年首次报道了人类精子中存在VGNCs通道,参与调节未获能精子活动以及精子获能的初始阶段,在初始阶段之后,细胞膜超极化导致VGNCs通道失活,使用藜芦碱激活VGNCs通道,从而导致精子运动活性增加,而细胞内Ca2+没有增加。选择性阻断VGNCs通道导致精子数量减少,精子运动活性减弱[53]。VGNCs通道的激活通过酪氨酸蛋白的磷酸化诱导获能[57],在获能过程中,由于细胞内K+内流和细胞内Na+的短暂减少,精子出现超极化[106]。

图3 精子电压门控Na+通道(VGNC)拓扑结构(基于文献[74])Fig.3 Topology of sperm voltage-gated Na+ channel (VGNC) (based on reference [74])
2.4 调节精子运动的钾离子(K+)通道
精子开始获能以膜超极化为特征,主要是由于K+通道激活引起[107]。在非获能精子中,膜电位范围为-35~-45 mV,在获能期间,精子膜超极化,电位差为-80 mV。分子和功能研究表明,生精细胞和精子细胞含有电压门控K+通道、Ca2+激活的K+通道和向内运输K+通道[108]。获能前,细胞内pH呈酸性,K+通道不活跃,去极化状态保持不变,获能期间,HCO3-内流和H+流出,导致细胞内碱化、pH增加和ATP依赖性K+通道激活,这些反应导致K+离子外流,细胞膜超极化[30,109]。有趣的是,NaV通道和ENaC、Na+内流有关,导致非获能精子膜去极化,当这些通道在获能过程中闭合时,膜发生超极化。总之,K+通道和Na+通道都参与调节获能期间发生的膜极化过程,非获能时,K+通道不活跃,Na+通道活跃,导致膜去极化,获能期间通道活性相反。
公牛精子中存在K+通道,参与基础运动和超激活运动的调节。蛋白免疫印迹试验结果证明,K+通道位于公牛精子的头部、颈部和尾部主段[110]。K+通道的功能依赖于Hv1和CatSper通道的功能,选择性阻断这些通道时会影响K+通道活性[11,59]。SLO1和SLO3通道是Ca2+激活的K+通道,其作用是调节精子细胞内的渗透压和电压(Vm)[111],它们被膜去极化、[Ca2+]i和[Mg2+]i[112]激活,两个通道都是由4个成孔α亚基和辅助亚基形成。α亚基由7个单体组成,每个单体包括6个TMs,其中TM4是典型的VSD,TM5和TM6之间形成孔环。N端尾部处于细胞外,包含K+电导调节因子1 (RCK1)和K+电导调节因子2 (RKC2)。SLO1和SLO3的结构差异在于SLO1的RKC结构域内存在“Ca2+碗”结构,导致通道对[Ca2+]i更敏感(图4a)[74]。SLO3是精子中主要K+通道蛋白,负责K+流出,从而启动细胞膜超极化。SLO3蛋白被细胞内碱性pH激活较弱,与HCO3-的内流相关,并导致精子获能前K+外排[112],被Ca2+激活更强烈,因此Vm受[Ca2+]i的调节比受pHi的调节更强烈。孕酮通过CatSper诱导的Ca2+内流受到SLO3调控的Ca2+超极化的限制,在人类精子所处环境存在孕酮时,细胞外K+离子浓度的增加导致细胞内Ca2+的增加[113]。值得注意的是,有研究表明小鼠SLO3通道对PIP2具有高亲和力,PIP2与SLO3的结合上调了通道的活性,而电压敏感磷酸酶(voltage-sensitive phosphatase,VSP)对PIP2的去磷酸化使SLO3活性降低[114]。由于缺乏膜超极化,SLO3通道缺陷的小鼠精子运动能力降低,导致这些精子在体外条件下无法受精[115]。
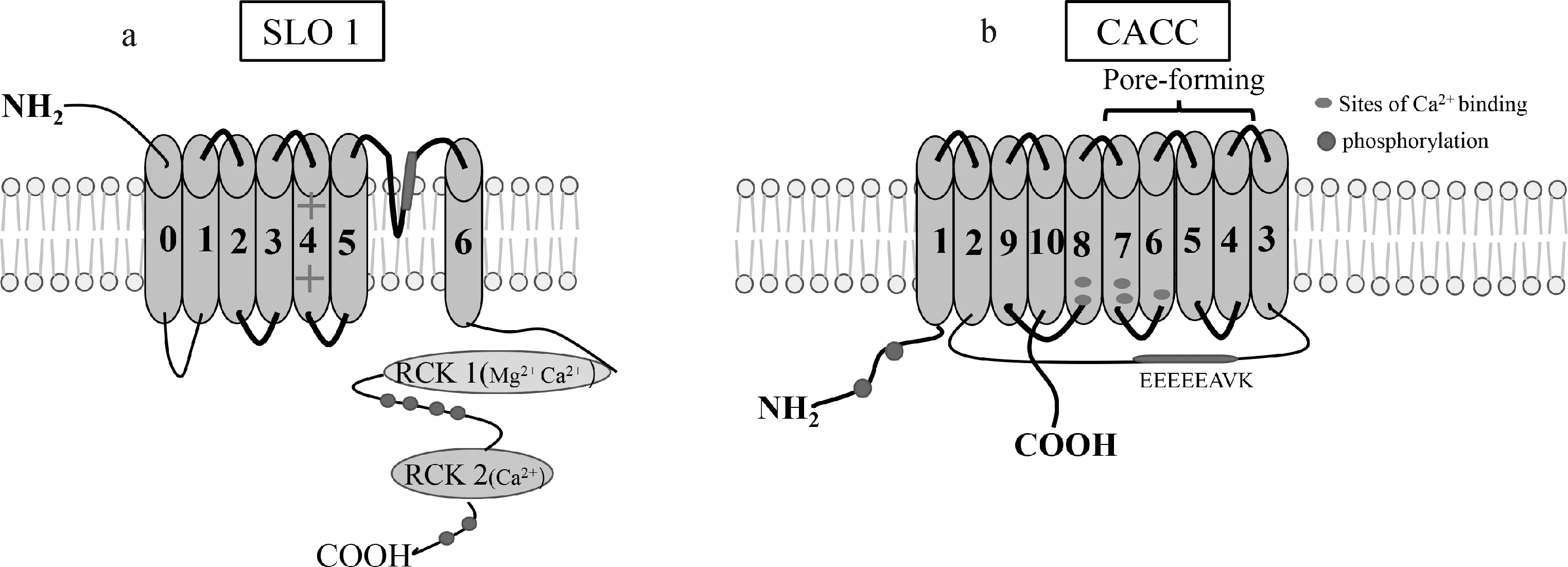
图4 精子SOL1通道和CACC通道拓扑结构(基于文献[74])Fig.4 Topological structure of sperm SOL1 channel and CACC channel (based on reference [74])
2.5 调节精子运动的氯离子(Cl-)通道
Cl-通道通过膜超极化、细胞内碱化和cAMP/PKA诱导的蛋白磷酸化信号机制参与调节精子获能过程[116]。研究表明,存在CFTR离子通道、钙激活氯通道(CACC)和CIC-3通道[76,117]。CFTR通道的功能涉及精子获能和超激活过程中HCO3-转运依赖过程的调节[118]。选择性阻断CFTR通道可减少HCO3-内流,从而抑制cAMP/PKA通路活性,减少精子运动活性,而在人类精子中,CFTR在获能时可以从细胞中排出Cl-[119]。CACC由10个TMs和胞质N端、C端组成,每个亚基中的3~7个TMs形成孔环结构,Vm和低浓度Ca2+(<600 nmol·L-1)通过TM2-TM3环中的EEEEEAVK激活通道(见图4b)[74]。2012年,Orta等[17]使用膜片钳技术证明人类精子头部存在CACC,该离子通道开放受[Ca2+]i浓度增加的刺激,这取决于细胞内Ca2+释放或通过质膜通道的内流。ClC-3通道激活产生向外的Cl-电流,这些电流被PKC激活所抑制[120-121]。氯离子通道在调节精子体积和运动中起着重要作用,与正常精子相比,弱精子(精子运动能力低)动物的精子显示出较小的细胞体积调节能力和运动活性[122]。
3 总结与展望
在精子发生过程的不同阶段,已经研究证明离子通道发挥着重要的生理作用,如SLO3通道是精子特异性性KSper通道,能够调控精子的膜电位,在精子超极化过程中起决定性作用。CatSper是哺乳动物精子细胞膜上实现精子超激活的最重要Ca2+通道,通过维持、调控Ca2+信号对精子运动和受精功能起着关键作用,该通道对弱电压依赖、Ca2+特异、pH敏感,会受到pH、膜电位、类固醇激素等多种生理刺激物的影响。除过上述具有重要功能的KSper和CatSper通道外,精子膜还存在 Na+、K+、H+和Cl-等离子通道,其活性均受到离子泵(如细胞质膜Ca2+-ATPase、Na+/K+-ATPase等)、转运蛋白(如Na+/Ca2+交换器、Na+/H+交换器和碳酸氢盐转运蛋白)的影响,进一步调节精子成熟、获能、顶体反应等一系列生理过程。本文总结了目前报道的全部精子离子通道,其相互作用机制见图5。

图5 参与精子基础运动、获能和顶体反应过程的离子通道[88]Fig.5 Ion channels involved in sperm basal motility, capacitation and acrosome reactions[88]
随着基因组学、蛋白质组学以及代谢组学等学科技术的发展,精子生理学研究也将会快速发展,精子运动离子通道的研究将会更加深入。哺乳动物精子运动是一种自然现象,运动调控是复杂的,离子通道是精子膜发挥功能的直接调控基础,会随精子内代谢和运动快速做出反应。相信随着生命科学的不断发展,尤其是交叉学科的融合发展,新技术和新方法不断出现,精子运动与离子通道调控机制的研究将愈来愈深入,不仅在科学问题研究方面,在生产应用方面将会有更大的突破。未来精子运动和离子通道研究可以从以下几方面着手:1)X精子与Y精子运动差异与离子通道关系研究,利用离子通道技术进行动物性别控制技术开发与应用研究;2)不同物种动物精子离子通道差异与调控研究;3)精子离子通道与精子获能、精子激活与受精机制研究;4)精子离子通道活性物质、干扰物的筛选和生产应用研究;5)精子离子通道对精子糖酵解、能量代谢影响研究;6)雌性动物生殖道环境离子种类和浓度的变化对精子运动影响及调节研究;7)不同动物调节精子pHi的sNHE变体种类及调节机制研究;8)在体外和体内环境条件下,精子运动和受精时参与的离子通道是否相同?如何调控?9)精子离子通道电化学调控与生物学意义研究;10)精子离子泵、转运蛋白与膜蛋白离子通道互作调控研究;11)精子离子通道与参与信号通路的调控研究;12)精子离子通道的激素调控与互作研究等。更深层次研究离子通道在调节精子运动、获能和顶体反应中的作用,挖掘参与精子功能调节的离子通道并了解其作用机制,为后续研究精子膜结构和运动活性调节机制提供重要的理论基础。

