盐度对腐败嗜水气单胞菌YCR17腐败特性的影响
朱耀磊,郑玉茹,张昕昕,孟婷,和朝军,马永杰
洛阳师范学院食品与药品学院(洛阳 471934)
嗜水气单胞菌属是一种常见的条件性致病菌,经常分离于各种水体、水产品及其制品中[1-2]。近年来有关嗜水气单胞菌属的研究,多侧重在其对食品的致腐特性和机理等方面,作为水产品优势腐败菌,能够表达多种腐败特性,如水解蛋白质、在多种介质表面形成生物膜、运动性、产生生物胺等[3-4],且不同来源菌株的致腐特性各有差异。
NaCl能够改变环境渗透压,对分离自淡水黄河鲤鱼的嗜水气单胞菌产生胁迫。群体感应(quorum sensing,QS)系统在微生物抵抗外界环境变化中起着重要作用,同时也是食品腐败微生物的重要致腐调控系统[5]。研究表明QS系统对微生物的腐败特性如生物膜、泳动性、生物胺、TVB-N产生、胞外蛋白酶等具有显著的调控作用[6]。Zhu等[7]和Li等[8]的报道显示,腐败菌的QS系统会受培养条件及环境胁迫的影响而发生变化,进而对细菌的腐败特性产生影响,因此研究盐度对腐败菌QS系统及腐败性状的影响对食品加工条件的选择及其品质控制具有重要意义。
随着我国对黄河流域生态环境的保护和改善,野生及养殖黄河鲤鱼产量将会面临急速增长,以分离自黄河鲤鱼的一株嗜水气单胞菌A.hydrophilaYCR17为研究对象,探究不同NaCl浓度作用下该菌腐败特性的变化,为黄河鲤鱼腐败机理和防腐保鲜研究提供理论基础。
1 材料和方法
1.1 材料与试剂
试验菌株A.hydrophilaYCR17(分离自腐败黄河鲤鱼);紫色杆菌CV026(C.violaceum026,由大连工业大学侯红漫教授惠赠);酵母浸粉、胰蛋白胨、蛋白胨(北京奥博星生物技术有限公司);结晶紫染液(上海生工生物有限公司);无水甲醇、无水乙醇、冰醋酸(均购自天津大茂试剂有限公司);偶氮酪蛋白(上海麦克林生化科技有限公司);三氯乙酸(天津市科密欧化学试剂有限公司)。
1.2 仪器与设备
RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);PE Victor Nivo酶标仪(美国珀金埃尔默公司);Sigma 3-18KS高速冷冻离心机(德国Sigma公司);UV-2600紫外-可见分光光度计(日本岛津公司)。
1.3 方法
1.3.1 盐度对A.hydrophilaYCR17 AHLs产生的影响
采用报告平板法[9]对嗜水气单胞菌AHLs产生进行测定。分别将嗜水气单胞菌接种到不同NaCl浓度(0,0.5%,1%,2%和3%)的LB培养基中,于30 ℃培养至细菌稳定期。取100 mL菌液,用乙酸乙酯萃取法提取AHLs。配制LB固体培养基,当其冷却至50 ℃左右时,按照1︰10的比例加入过夜培养的CV026菌液,混匀后移取20 mL倾注平板。待平板冷却后,在平板中央打孔,加入60 μL的AHLs提取液,置于28 ℃下静置培养24 h。
1.3.2 A.hydrophilaYCR17胞外蛋白酶活性的测定
采用脱脂奶平板法[10],分别配制15%的脱脂奶粉溶液和1.5%琼脂溶液,于115 ℃灭菌30 min,冷却至60 ℃后将脱脂奶琼脂溶液以1︰1的比例混合制备脱脂乳固体平板,凝固后在平板中央打孔备用。分别取1 mL在0,0.5%,1%,2%和3% NaCl条件下培养至稳定期的A.hydrophilaYCR17菌液,按8 000 r/min离心10 min,收集上清液,用孔径0.22 μm的过滤器进行过滤,吸取100 μL添加到脱脂乳固体平板中央小孔中,在30 ℃下培养。观察平板中央的透明酶解区域大小,并测量直径。
以偶氮酪蛋白为底物测定A.hydrophilaYCR17胞外蛋白酶活性[11],分别取150 μL上述无菌滤液添加到250 μL 1%偶氮酪蛋白溶液,在30 ℃下水浴1 h,加入1.2 mL 10%三氯乙酸,混匀后,室温静置30 min;按8 000 r/min离心5 min,吸取500 μL上清液添加到500 μL 1 mol/L NaOH溶液中混匀,测定其吸光度A440nm,以每小时A440nm增加0.001定义为1个酶活力单位(U),每组试验重复3次。
1.3.3 盐度对A.hydrophilaYCR17生物膜形成的影响
将过夜培养至稳定期的A.hydrophilaYCR17菌液分别用含有0,0.5%,1.0%,2.0%和3.0% NaCl的LB培养基1︰100稀释,取200 μL加入到96孔板中,于30 ℃静置培养48 h。按照Ye等[12]的方法测定生物膜的含量。
A.hydrophilaYCR17在玻璃表面生物膜形成的测定[9]。将过夜培养的菌液按1∶100比例分别接种到含有0,0.5%,1.0%,2.0%和3.0% NaCl的LB培养基中,分别取2 mL加入玻璃试管(1 cm×10 cm)中,于30℃静置培养48 h;培养结束后弃去菌液,用10 mmol/L的PBS洗涤3次,加入2.5 mL无水甲醇固定15 min,弃去管中溶液,在60 ℃下干燥15 min。随后加入2.5 mL 0.1%结晶紫溶液染色15 min,结束后用去离子水洗涤3次,于60 ℃干燥。观察管壁A.hydrophilaYCR17生物膜的形成情况。
1.3.4 NaCl对嗜水气单胞菌YCR17泳动性的影响
分别配制NaCl终浓度为0,0.5%,1.0%,2.0%和3.0%的泳动性培养基,灭菌后量取20 mL倾注平板,待平板冷却凝固后,吸取3 μL培养至稳定期的菌液,加到泳动性平板中央,小心移至30 ℃恒温培养箱进行培养[13]。
1.4 数据处理
数据处理结果均以“平均值±标准偏差”表示,使用SPSS Statistics 25软件进行数据统计分析,采用Office Excel 2019和Origin 9软件进行试验数据处理和绘图。
2 结果与分析
2.1 NaCl浓度对A.hydrophila YCR17 AHLs产生的影响
由图1可知,紫色杆菌在AHLs的诱导下可以产生紫色素使其周围呈现紫色区域,紫色素蔓延的范围大小代表AHLs量的多少。图1显示,NaCl浓度为0.5%和1.0%时对AHLs的产生有促进作用,而在高浓度NaCl(2.0%和3.0%)作用时,紫色圈直径减小,AHLs产生受到抑制。

图1 不同浓度NaCl对A.hydrophila YCR17 AHLs产生的影响
2.2 NaCl浓度对A.hydrophila YCR17生物膜的影响
由图2可知,在NaCl浓度为0时,A.hydrophilaYCR17生成的生物膜较0.5%和1%时明显降低(P<0.05),而当浓度增加到2.0%和3.0%时,生物膜的形成显著性减少(P<0.05)。由图3可观察到试管底部区域形成紫色圆环,是A.hydrophilaYCR17菌株在试管底部区域形成的生物膜被结晶紫染液染成紫色。表明该菌能够在玻璃介质表面形成生物膜,在低浓度NaCl作用下,生物膜形成的紫色较深,区域较大,随着NaCl浓度的增高,紫色区域逐渐减少,颜色变浅,表明生物膜的形成受到抑制,结果显示A.hydrophilaYCR17生物膜的形成对高浓度NaCl较为敏感。
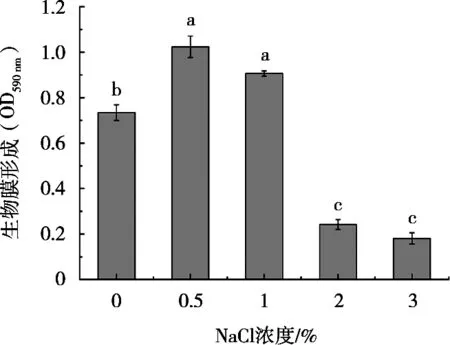
图2 不同浓度NaCl下A.hydrophila YCR17生物膜的形成

图3 不同浓度NaCl下A.hydrophila YCR17生物膜的形成
2.3 NaCl浓度对A.hydrophila YCR17胞外蛋白酶产生的影响
脱脂乳平板检测结果显示,0,0.5%和1% NaCl的作用下,胞外蛋白酶的酶解蛋白区域直径未发生明显变化,随着NaCl浓度的增高,水解透明区域逐渐变小,表明该菌的胞外蛋白酶活性受到NaCl显著抑制作用。
由图4可知,偶氮酪蛋白法的检测结果与脱脂乳平板法的测定结果基本呈现相同趋势,结果显示A.hydrophilaYCR17的胞外蛋白酶活性在0和0.5% NaCl作用下未发生明显的变化,NaCl浓度升高到1%时,蛋白酶活性开始下降(P<0.05),2.0%和3.0%时蛋白酶水解活性明显降低。
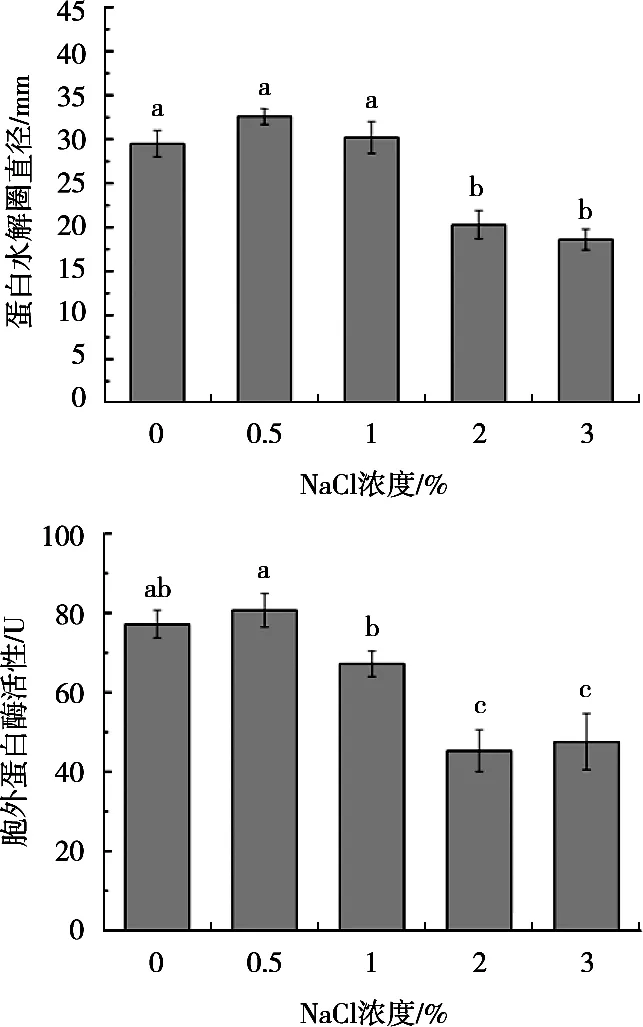
图4 不同浓度NaCl作用下A.hydrophila YCR17胞外蛋白酶的活性
2.4 NaCl浓度对A.hydrophila YCR17泳动性的影响
由图5可知,在NaCl作用下,A.hydrophilaYCR17在泳动性培养基表面的扩散区域发生明显变化,低浓度NaCl下该菌的泳动性较强,随着NaCl浓度的增高该菌的泳动性半径减少,区域变小,表明该菌的泳动性受到高浓度NaCl的抑制作用。
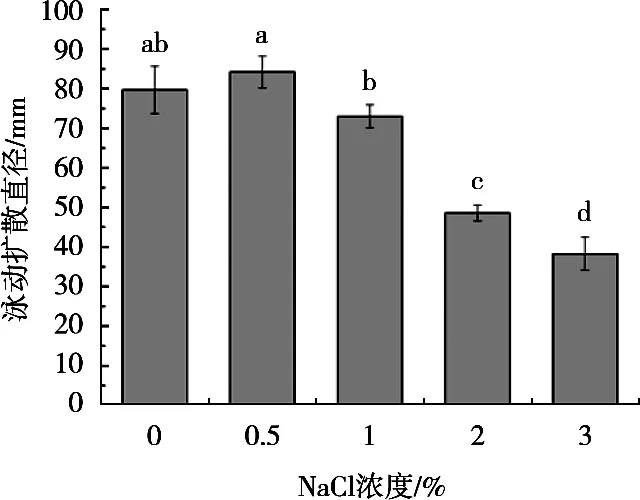
图5 不同NaCl作用下A.hydrophila YCR17的泳动性
3 讨论
A.hydrophilaYCR17是一株分离自腐败黄河鲤鱼的主要致腐菌,该菌能够产生胞外蛋白酶,形成强生物膜,泳动性等腐败特性,含有群体感应AI-1型腐败调控系统[14]。在NaCl的作用下,A.hydrophilaYCR17菌株的上述腐败特性受到明显的抑制作用,与Jahid等[3]和赵丹丹等[15]的研究结果一致。研究表明,嗜水气单胞菌的QS系统对腐败特性具有显著的调控作用,这种调控作用是以AHLs为媒介实现[16]。AHLs的产生受luxR/I系统调控,AHLs的产生随NaCl浓度的增加呈现逐渐减少表明luxR/I调控系统也受到抑制,使得生物膜、泳动性和胞外蛋白酶活性等腐败特性的表达降低[15,17]。并且,NaCl浓度会改变A.hydrophilaYCR17菌株生长环境的渗透压,可能导致AHLs、胞外多糖及胞外蛋白酶的分泌和释放受到抑制,进而影响到各腐败性状的表达[18-19]。同时,NaCl浓度的增加使得微生物的生存环境受到影响,可能导致细菌为了抵抗外界环境而降低新陈代谢、减少代谢产物的分泌[20]。试验结果表明,NaCl胁迫下A.hydrophilaYCR17的AHLs产生受到抑制,影响到该菌的QS系统,进而减少对生物膜、胞外蛋白酶产生、泳动性等腐败特性的调控,造成各腐败特性的变化。
4 结论
在NaCl胁迫下,分离自腐败黄河鲤鱼的优势腐败菌A.hydrophilaYCR17的致腐相关特性、胞外蛋白酶、生物膜、泳动性及群体感应AHLs等均受到明显抑制作用,初步探究了A.hydrophilaYCR17的致腐机理,在黄河鲤鱼的加工和贮藏保鲜的研究中有着重要作用。

