响应ABA的甘草bZIP转录因子的基因表达及调控研究△
王清,武立伟,范潘慧,徐志超,罗红梅,孙伟,王瑀,郑司浩,宋经元,5,姚辉,5*
1.中国医学科学院 北京协和医学院 药用植物研究所/国家中医药管理局中药资源保护重点研究室,北京 100193;2.东北林业大学 生命科学学院,黑龙江 哈尔滨 150040;3.中国中医科学院 中药研究所,北京 100700;4.中国中药有限公司,北京 102600;5.中药资源教育部工程研究中心,北京 100193
甘草为我国大宗药材,具有补脾益气、清热解毒、调和诸药的功效,素有“十方九草”之说。甘草Glycyrrhiza uralensisFisch.是甘草药材的主要来源,其主要成分是黄酮类和三萜类化合物[1]。《中华人民共和国药典》(以下简称《中国药典》)2020年版规定甘草药材含甘草苷不少于0.50%,甘草酸不少于2.0%[2]。甘草酸属于三萜皂苷类化合物,目前学界内认为该类化合物的生物合成是以乙酰辅酶A(acetyl-CoA)为起始物质,经过甲羟戊酸(MVA)途径合成。3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGR)、鲨烯合酶(SQS)、β-香树脂醇合酶(β-AS)被认为是甘草酸合成途径中的3 个关键限速酶。随着甘草酸合成下游途径细胞色素P450 单加氧酶CYP88D6、CYP72A154 及纤维素合成酶超家族衍生的糖基转移酶CSyGT、糖基转移酶UGT73P12 的发现[3-6],甘草酸的主要合成通路已完全解析。甘草苷属于黄酮类化合物,查耳酮合成酶(CHS)是其合成途径上的第1 个关键酶,3 分子的丙二酰辅酶A 和1 分子的香豆酰辅酶A 经过CHS 催化生成查耳酮后,经过查耳酮还原酶(CHR)催化生成异甘草素,再经过查耳酮异构酶(CHI)催化生成甘草素,最后经过糖基转移酶UGT的催化生成甘草苷[7-9]。
植物次生代谢产物的主要功能是为了保护植物免受胁迫的伤害,反之这些胁迫也可用来诱导次生代谢物的产生。脱落酸(ABA)属于倍半萜类激素,在植物生长过程中起到重要的作用,是植物发育和胁迫反应的关键调节因子[10-12]。徐鹏等[13]以甘草为材料,以外源钙叶面喷施浓度、喷施季节与干旱胁迫程度为因素设计正交试验,检测不同处理下的甘草酸与ABA量的变化,发现干旱胁迫对甘草酸和ABA的量均有极显著的影响,且两者量之间具有极显著的正相关关系。此外,多项研究结果表明,适当浓度的ABA 胁迫处理甘草可以显著提高甘草中甘草酸和甘草苷的含量[14-15]。
碱性亮氨酸拉链(bZIP)转录因子作为最大的转录因子调控家族之一,在植物胁迫应答和生长发育等生理过程中发挥重要作用[16-17]。Zhong 等[18]从青蒿中克隆得到1 个bZIP 转录因子AaABF3,采用实时荧光定量聚合酶链式反应(qRT-PCR)分析发现AaABF3 在ABA 诱导下表达量明显增高;特别是在青蒿素合成和积累的腺毛中,AaABF3 通过直接调控青蒿素生物合成基因ALDH1,在ABA调控的青蒿素生物合成中发挥了重要作用。Shi 等[19]从丹参中分离得到一种响应ABA 诱导的WRKY 转录因子SmWRKY34,其对酚酸和丹参酮具有负调控作用;并从SmWRKY34 转录组中筛选得到显著表达的bZIP 转录因子SmbZIP3,发现SmWRKY34 负调控SmbZIP3,而SmbZIP3 在酚酸和丹参酮的生物合成中起正向调控作用,从而得出ABA 信号可以通过WRKY34-bZIP3 转录级联调节酚酸和丹参酮的生物合成。有关bZIP转录因子参与ABA信号转导通路调控植物次生代谢产物生物合成在青蒿、丹参等药用植物中已有较多研究,但在甘草中的研究还不够深入。Han 等[20]鉴定得到了66 个甘草bZIP 转录因子家族基因,并对乌拉尔甘草在ABA、紫外线(UV)、茉莉酸甲酯(MeJA)等非生物胁迫下bZIP 的表达进行了研究,认为GubZIP基因在乌拉尔甘草的各种生物学过程和转录调控网络中发挥着重要作用。本课题组前期基于已发表的甘草全基因组数据共鉴定到69 个甘草bZIP 转录因子[21],利用Illumina 高通量测序技术对不同浓度ABA 处理的甘草进行转录组测序,并结合qRT-PCR 确定筛选出的bZIP 转录因子的表达模式[22],成功克隆到转录因子基因GubZIP1、GubZIP5、GubZIP33、GubZIP56,并通过转基因功能验证证明了候选bZIP 转录因子可以影响甘草活性成分合成关键酶基因的表达,进而影响活性成分的积累[23]。
在此基础上,本研究利用甘草毛状根体系对响应ABA 的GubZIPs 转录因子基因表达模式进行验证,并分析了GubZIPs基因在3年生甘草中的空间表达差异,基于甘草基因组对关键酶基因的启动子进行分析与克隆,通过探讨甘草中GubZIPs 转录因子与关键酶基因的具体结合位点,为进一步解析响应ABA的bZIP转录因子调控甘草活性成分生物合成的分子机制提供参考。
1 材料
1.1 样品
甘草种子、3 年生甘草植株来源于甘肃省武威市民勤县,后将植株移栽于中国医学科学院药用植物研究所实验地中,经药用植物研究所林余霖研究员鉴定为豆科植物甘草Glycyrrhiza uralensisFisch.,凭证标本保存于中国医学科学院药用植物研究所。
1.2 试药
MS培养基(批号:MSP09,北京拜尔迪生物技术有限公司);6,7-V 培养基(批号:DZSL0221,北京欣汇天东方科技有限公司);乙酰丁香酮(批号:MC0624,美 国Novon 公 司);ABA(批 号:A8060)、氯化钠(批号:S8210)、噻孢霉素(Cef,批号:C8240)、氨苄青霉素(Amp,批号:A8180)均购自北京索莱宝科技有限公司;吲哚乙酸(IAA,批号:I2886)、琼脂(批号:A1296)均购自德国Sigma 公司;蛋白胨(批号:LP0042B)、酵母提取物(批号:LP0021B)均购自英国Oxoid公司;多糖多酚植物基因组DNA 提取试剂盒(批号:DP360)、多糖多酚植物总RNA 提取试剂盒(批号:DP441)、DH5α感受态细胞(批号:CB101)均购自天根生化科技(北京)有限公司;PrimeScript™ Ⅱ 1stStrand cDNA Synthesis Kit(批号:6210A)、TB Green®Premix ExTaq™(批号:RR420A)、PrimeSTAR®GXL DNA Polymerase(批号:R050Q)、DNA ATailing Kit(批号:6109)、pMD™ 18-T Vector(批号:6011)均购自宝日医生物技术(北京)有限公司。
2 方法
2.1 发根农杆菌侵染甘草外植体及诱导毛状根
对甘草种子进行破皮等前处理后,接种至MS固体培养基进行发芽试验。2 周后将组培苗转移至无菌培养皿中,用解剖刀将其胚轴和子叶分离出来,作为后续制备外植体的材料。以甘草子叶(切为两半)为外植体,用发根农杆菌 [吸光度(A)600nm=0.5] 浸染30 min,于6,7-V+乙酰丁香酮(200 mg·L-1)固体培养基上25 ℃黑暗中共培养48~72 h。共培养结束后,用Cef 溶液(400 mg·L-1)除菌,移入6,7-V 固体培养基上培养。待毛状根长至3.0 cm 左右后将其切下,转入6,7-V+IAA(0.1 mg·L-1)固体培养基上并标号,刺激毛状根长出侧根,待长出大量侧根后转移至液体6,7-V培养基,于120 r·min-1、25 ℃黑暗中摇床培养。
2.2 甘草毛状根ABA 处理及空间表达甘草材料前处理
分别用含0、25、50、75 mg·L-1ABA 的6,7-V培养液对甘草毛状根进行处理,并在3、6、12 h 后从培养瓶中取出毛状根,用纸巾快速吸干水分后用锡纸包裹,立即放入液氮中冷冻,并将其储存在-80 ℃冰箱备用。
将3 年生甘草从地里取出,除去泥土,用蒸馏水洗过后快速用纸巾擦干,将植株分为茎、叶、芦头、周皮、韧皮部、木质部6 个部分后,用锡纸包裹放进液氮速冻,后保存于-80 ℃冰箱备用。以上每份样品设置3个生物学重复。
2.3 qRT-PCR分析
参照RNA 提取试剂盒说明书对甘草样品进行RNA 提取,后采用PrimeScript™ Ⅱ 1stStrand cDNA Synthesis Kit 试剂盒进行反转录,根据克隆得到的GubZIPs基因的蛋白编码区序列(CDS),以及选取的内参actin序列,使用Primer Premier 5.0 软件设计适合的特异性引物(表1)。反应体系参照TB Green Premix ExTaq试剂盒说明书配制:cDNA 1 μL,TB Green Premix ExTaq10 μL,上下游引物(2 μmol·L-1)各2 μL,ddH2O 补足至20 μL。反应条件为95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,40 个循环;95 ℃,10 s。溶解曲线:以0.5 ℃·s-1从65 ℃线性上升至95 ℃;每个反应重复3 次,在CFX96 Real-time PCR Detection System 中进行。采用2-ΔΔCt方法计算基因的相对表达量,用GraphPad Prism 8.0软件采用单因素方差分析分析GubZIPs 转录因子基因的表达差异并作图。

表1 甘草GubZIPs基因qRT-PCR检测及关键酶基因启动子克隆引物序列
2.4 关键酶基因启动子的克隆及顺式作用元件分析
参考基因组DNA 提取试剂盒说明书方法,提取3 年生甘草根部的总DNA,冻存于-20 ℃备用。从美国国家生物技术信息中心(NCBI)上下载甘草关键酶基因的CDS序列,利用TBtools软件[24]在甘草基因组[21]中比对到对应的基因序列号,提取目的基因的启动子区域(CDS 区前2 kb),通过PlantCARE 网站(http://bioinformatics.psb.ugent.be/webtools/PlantCARE/html)[25]预测GubZIPs与甘草酸、甘草苷合成途径结构酶基因HMGR、SQS、β-AS、CYP88D6、CYP72A154、CSyGT、UGT73P12、CHS、CHI的启动子的结合位点,并根据提取的启动子序列设计引物(表1),扩增甘草关键酶基因的启动子区域。反应程序为98 ℃,5 min;98 ℃,10 s,60 ℃,15 s,68 ℃,2 min,30个循环;68 ℃,10 min。对PCR产物进行胶回收纯化,连A 尾后与pMD-18T 载体连接,16 ℃反应过夜。通过热激法将连接产物转化入大肠埃希氏菌DH5α感受态细胞,在LB(100 mg·L-1Amp)平板上筛选阳性克隆,并进行菌液PCR验证,将阳性克隆的菌液送测。将成功克隆的关键酶基因启动子序列提交PlantCARE 网站进行顺式作用元件预测。
3 结果与分析
3.1 外源ABA 胁迫下候选GubZIPs 基因的表达模式分析
以未用ABA 处理的毛状根为对照组,对4 个GubZIPs 转录因子的基因在不同浓度ABA 处理下的表达模式进行分析。结果表明,在质量浓度为25、50、75 mg·L-1的ABA 处理后3、6、12 hGubZIP1均有响应,且处理组GubZIP1表达量均显著高于对照组,其中在25 mg·L-1ABA 处理12 h 时的表达最高,是对照组的22.7 倍。在25 mg·L-1ABA 处理3、6 h 后GubZIP5的表达量均显著高于对照组,12 h 后下降并恢复至对照组水平;在50 mg·L-1ABA 处理3 h 后GubZIP5的表达量显著高于对照组,6 h 后表达量接近对照组水平,表达模式为先升高再降低;在75 mg·L-1ABA 处理下GubZIP5无显著响应。GubZIP33在所有处理组中的表达量均高于对照组,其中在3 个质量浓度的ABA 处理3、6 h 后的表达量显著高于对照组,但在12 h 时的表达量与对照组比较差异无统计学意义,表达模式为先升高后降低。在25 mg·L-1ABA 处理6 h 时和50 mg·L-1ABA 处理3 h 时GubZIP56的表达量显著上升,其余处理下GubZIP56的表达量与对照组比较差异无统计学意义(图1)。此外,GubZIP5、GubZIP33和GubZIP56基因的表达量均在50 mg·L-1ABA 处理3 h 时达到最高值,分别是对照组的2.5、11.1、4.0 倍。在处理时间为3 h 时,GubZIP1基因的表达量也在50 mg·L-1ABA 处理下达到峰值。综上,GubZIP1、GubZIP5、GubZIP33、GubZIP56均 对ABA 有响应,其中GubZIP1和GubZIP33的响应最为显著。
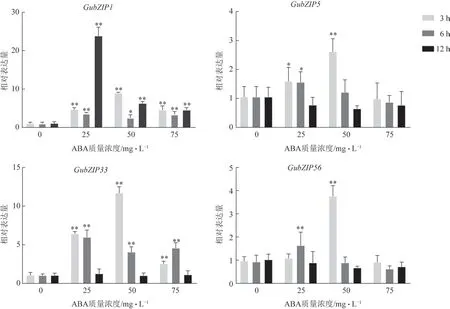
图1 甘草毛状根中GubZIPs响应ABA的表达模式(,n=3)
3.2 GubZIPs基因在甘草不同组织的表达差异分析
为了分析GubZIPs 转录因子基因在甘草不同部位的表达差异,采用qRT-PCR 对3 年生甘草的茎、叶、芦头、周皮、韧皮部、木质部6 个部位的GubZIPs基因表达量进行检测。结果显示(图2),GubZIP1和GubZIP5均在根部高水平表达,其中GubZIP1在芦头处的表达量最高,GubZIP5在韧皮部的表达量最高,与其他部位相比差异有统计学意义(P<0.01)。GubZIP33和GubZIP56均在叶中高水平表达,而在其余部位的表达量显著低于叶片。其中GubZIP33在茎中的表达量最低,但和根部的表达量相比差异无统计学意义,GubZIP56在茎、芦头、周皮、韧皮部的表达量差异无统计学意义,而在木质部的表达量显著低于芦头和韧皮部。
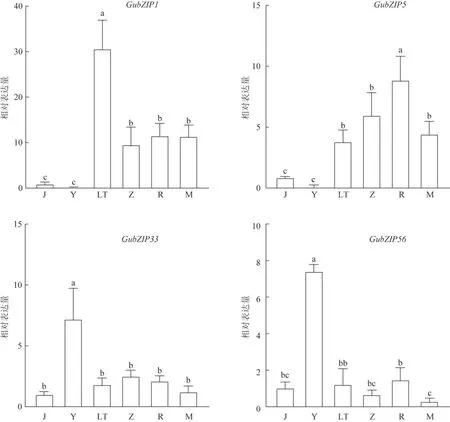
图2 GubZIPs在甘草不同组织中的表达水平(,n=3)
3.3 甘草酸和甘草苷生物合成关键酶基因启动子的克隆及顺式作用元件分析
利用TBtools软件提取甘草基因组中甘草苷合成通路的2个关键酶基因CHS、CHI和甘草酸合成通路的7 个关键酶基因HMGR、SQS、β-AS、CYP88D6、CYP72A154、GuCSyGT、UGT73P12的起始 密码子前2 kb 启动子序列。对这9 个关键酶基因启动子区域的顺式作用元件进行分析整理,其位置信息及响应元件信息见图3。分析结果显示,甘草的9个关键酶基因的启动子上含有大量与环境、生长调节相关的作用元件,特别是响应激素的元件,如ABA、MeJA、水杨酸(SA)、生长素(auxin)、赤霉素(GA)的响应元件;胁迫反应元件,如光胁迫、低温胁迫及低氧诱导响应元件(图3)。
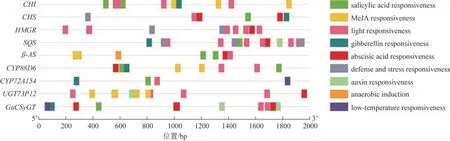
图3 甘草基因组中9个关键酶基因启动子上响应激素或其他胁迫的顺式作用元件位置
利用Primer Premier 5.0 软件设计引物(表1),成功扩增出CHI、CHS、β-AS的启动子片段,大小分别为1604、1540、1406 bp(图4)。
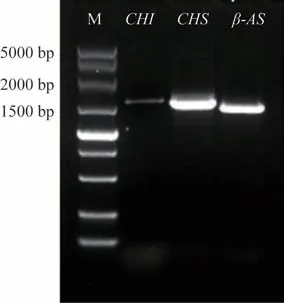
图4 甘草基因组中关键酶基因CHI、CHS、β-AS启动子扩增电泳结果
将测序获得的3个启动子序列提交至PlantCARE网站进行顺式作用元件的预测,结果表明β-AS、CHS、CHI基因的启动子区域除含有基本转录元件TATA-box 和CAAT-box 外,还含有ABA 响应元件ABRE,厌氧诱导顺式作用元件ARE,光响应元件G-box、Box 4、TCT-motif、GT1-motif 等,以及其他激素响应元件CGTCA-motif、TGACG-motif、TCA-element等,具体见表2。
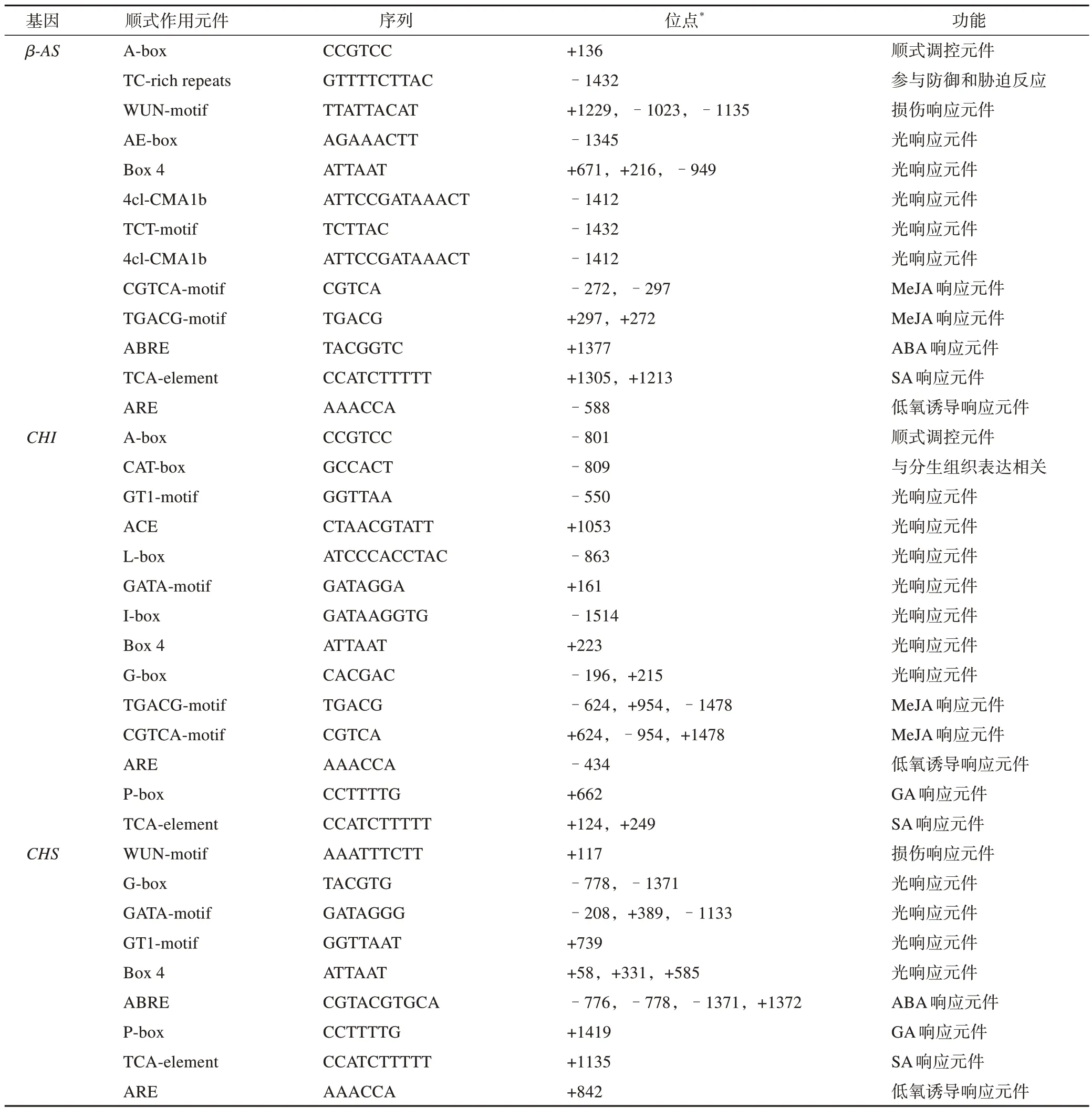
表2 克隆得到的甘草酸和甘草苷生物合成关键酶基因启动子序列的顺式作用元件分析
4 讨论
转录因子能够促进或抑制参与1 条或多条生物合成途径的多个基因的表达,是控制生物合成中基因表达的有力工具[26]。目前,已在甘草中鉴定得到了大量的转录因子。关思静等[27]对盐、低磷及干旱胁迫下乌拉尔甘草根转录组进行分析,发现在3 种胁迫处理下ERF、ARF、bHLH、WRKY 和MYB 等转录因子表达量均发生显著变化。Wang 等[28]通过转录组学分析鉴定了盐胁迫下甘草中的MYB 和bHLH转录因子家族,并在此基础上构建了类黄酮和三萜类化合物的假定生物合成网络。此外,也有研究对光果甘草和胀果甘草中的转录因子进行了筛选和鉴定[29-30]。甘草中次生代谢产物的生物合成途径已较为清晰,多个转录因子也已得到鉴定,但仅停留在基因家族筛选等生信分析层面,相关调控机制的深入研究尚十分匮乏。
bZIP 转录因子在植物生长及逆境胁迫中起着重要作用,能够参与植物组织的分化,提高植物对病害的防御能力,进行能量代谢及信号转导,还能促使内源ABA的合成,从而激活bZIP家族的基因[31-32]。本研究中,在外源ABA 处理下GubZIP1、GubZIP5、GubZIP33和GubZIP56基因均有显著响应,这基于甘草毛状根体系验证了ABA 处理植株的检测结果[22]。外 源ABA 处理3 h 时,GubZIP1、GubZIP5、GubZIP33和GubZIP56基因的表达量均在50 mg·L-1ABA 处理下达到最高值,说明用50 mg·L-1ABA 处理3 h 是研究甘草中ABA 相关通路较为适宜的方案。此外,当ABA 质量浓度提高到75 mg·L-1时,GubZIP5和GubZIP56基因均无显著响应,且表达量有降低趋势;在ABA 处理12 h 时,GubZIP33基因的表达量由显著升高降至初始水平;GubZIP1基因在各质量浓度ABA 处理组中虽然表达水平与对照组相比显著升高,但均在6 h处存在拐点。以上结果说明GubZIPs基因在甘草中的表达变化是不同且复杂的,这可能与甘草中其他转录因子或者基因密切相关。本课题组在前期研究中将鉴定到的69 个甘草bZIP 转录因子家族基因与拟南芥AtbZIPs 序列构建最大似然(ML)系统发育树,将甘草bZIP 转录因子分为A~I 及S 这10 个亚家族[22]。分析表明GubZIP1、GubZIP5、GubZIP33 属于S 亚家族,GubZIP56 属于H 亚家族。S 亚家族功能广泛,受ABA、干旱、低温、无氧和机械损伤处理激活,H亚家族主要参与光信号的感应和传导。这可能也是GubZIP56基因对ABA 的响应没有另外3 个GubZIPs转录因子基因敏感的原因。
甘草作为我国的常用大宗药材,人工栽培甘草的质量并不稳定,多数不符合《中国药典》标准[33]。因此,如何提高甘草活性成分含量、生产高品质的甘草药材是目前的主要问题[34-35]。有关调控甘草酸、甘草苷的机制研究内容已有很多,如从植物激素[36]、功能基因的多态性[37-41]、药材性状[42]出发考察其与甘草活性成分之间的相关性,最终归结到复杂的植物次生代谢合成调控网络[43]。在GubZIPs 转录因子基因的空间表达实验中,GubZIP1和GubZIP5基因均在根部高水平表达,这与甘草活性成分甘草酸、甘草苷的积累一致[44-47],推测是其合成通路上的关键调控因子。另外2个转录因子基因GubZIP33和GubZIP56均在叶片处高水平表达,在其余部位虽有一定的表达量但显著低于叶片。而甘草叶片中含有大量的黄酮类化合物,总黄酮含量高于根中[48],说明GubZIP33和GubZIP56对甘草中黄酮类化合物的合成具有更大的影响。以上表明bZIP 家族中不同的转录因子在甘草中的主要表达部位具有差异性,发挥的功能也不同。
bZIP 转录因子如何调控次生代谢途径是一个复杂的研究体系。鉴定与次生代谢产物生物合成相关的关键酶基因,对于理解bZIP 转录因子的调控机制十分必要。bZIP 蛋白包含1 个参与DNA 结合和核定位的碱性区域,以及1 个亮氨酸拉链二聚结构域[49],被激活后形成同源或异源二聚体,并通过其碱性区域结合特定基因启动子,进而调控下游相关基因的表达[16]。目前已有研究克隆得到甘草酸代谢通路上关键酶基因HMGR、β-AS、CYP88D6、CYP72A154的启动子序列[50-51],本研究成功克隆出甘草苷合成关键酶基因CHI、CHS及甘草酸合成途径中第3个关键限速酶基因β-AS的启动子序列。对克隆获得的启动子序列进行分析,发现CHI基因的启动子区域有2个G-box 和1 个A-box 顺式作用元件,CHS基因的启动子区域有2 个ABRE 和1 个G-box 顺式作用元件,β-AS基因的启动子区域有1 个ABRE 和1 个G-box 顺式作用元件。研究表明,植物bZIP 转录因子家族通常优先结合ACGT 核心的回文或假回文顺式作用元件,如ABRE(CCACGTGG)、G-box(CACGTG)、C-box(GACGTC)及A-box(TACGTA)[16]。因此,GubZIPs 转录因子可能结合甘草苷和甘草酸合成代谢途径上关键酶基因的启动子区的顺式作用元件,进而调控其生物合成。
虽然目前的实验结果显示,GubZIPs 转录因子与甘草活性成分合成的关键酶基因有密切关联,但是甘草酸、甘草苷的合成受多个关键酶基因及转录因子的作用,其是否真正与GubZIP 转录因子有相互作用,这些作用是正向调控还是反向调控,须结合GubZIP 转录因子的功能验证实验结果进行解析。此外,高质量基因组是进一步研究的基础[52-53]。由于目前公开的甘草基因组只是基因组草图[21],本课题组在提取甘草启动子序列时发现其中存在大量的简并碱基。因此,下一步将对甘草基因组进行重测序并组装获得染色体级别的甘草基因组,或者采用染色体步移等技术克隆更多的关键酶基因启动子片段,进一步研究GubZIP 转录因子调控甘草活性成分合成的机制,为构建甘草活性成分生物合成的调控网络提供参考。此外,有关植物bZIP 转录因子的研究仍存在研究物种少、相关通路少、机制研究不够深入等不足之处,已经投入实际生产中的转基因药用植物也鲜有报道,因此还需要后续深入研究。
