丹参SmRopGEF1基因的克隆、亚细胞定位与表达分析△
陈颖,满金辉,石玥,黄钰莹,张晓芹,王馨,刘珊瑚,何高洁,安克露,王晓晖,魏胜利*
1.北京中医药大学 中药学院,北京 102488;2.北京中医药大学 生命科学学院,北京 102488;3.北京中医药大学 北京中医药研究院 中药现代研究中心,北京 102488
ROP(Rho-related GTPases from plants)是一类植物特有的小G 蛋白。ROP 蛋白通过鸟嘌呤三核苷酸磷酸(GTP,激活)/鸟嘌呤二核苷酸磷酸(GDP,失活)状态的改变,与下游信号分子共同调控植物多种生命活动,在植物生长发育、信号转导和抗逆境胁迫响应方面具有重要作用。ROP 鸟苷酸交换因子(ROP guanine nucleotide exchange factor,RopGEF)是其上游活化因子,能够催化ROP 蛋白结合形式的转变(GDP 转化为GTP 结合形式),从而使之发挥相关功能[1-3]。因此对RopGEF 蛋白的功能研究成为近年来植物信号转导方面的热点。研究表明,RopGEF 蛋白参与植物对低温、干旱、高病虫害、激素信号转导等的应答,但是目前关于其在药用植物中的功能研究较少。Shin等[4]克隆了拟南芥中14个RopGEFs基因,研究分析了其在非生物胁迫处理下的不同表达模式,结果表明14个RopGEFs的转录水平受冷、热、旱、盐等非生物胁迫的影响发生显著变化。脱落酸(ABA)处理条件下,拟南芥RopGEF1~RopGEF6、RopGEF11、RopGEF14表 现出了不同的应答模式[5]。拟南芥RopGEF1参与了生长素输入载体AUX1 的极性分布和输出载体PIN7 和PIN2 的差异积累[6]。在茶树叶片中克隆得到的鸟苷酸交换因子CsRopGEF1和CsRopGEF3在ABA 信号转导途径中受到不同的调控作用[7]。
丹参Salvia miltiorrhizaBunge为唇形科鼠尾草属药用植物,其干燥根和根茎是常用的大宗药材,《神农本草经》中位列上品,能够活血祛瘀、清心除烦、凉血消痈及通经止痛[8]。丹参的化学成分主要有二萜类、三萜类、酚酸类、黄酮类及含氮类化合物、内酯类化合物、多糖等,其中二萜类与酚酸类化合物是丹参的主要活性成分[9]。丹参在临床主要用于保护心脑血管系统、保肝、抗炎、抗氧化、抗肿瘤、抗纤维化等[10]。低温、干旱、高盐、病虫害等逆境胁迫会影响丹参的产量和质量[11-13],并且激素信号转导影响丹参的生长发育和体内活性成分的生物合成。RopGEF 蛋白在植物调控对逆境胁迫的应激反应和激素信号转导过程中起到重要作用。因此本研究扩增了丹参中的SmRopGEF1基因,利用生物信息学分析其原核表达与亚细胞定位,探究了其在不同非生物胁迫和外源激素诱导处理下的表达模式,可为研究丹参防御反应机制、选育抗逆优良品种、提高产量和品质提供参考。
1 材料
1.1 样品与试剂
丹参样品于2020 年9 月采自北京市房山区良乡国家现代农业产业园信息中心,经北京中医药大学中药学院魏胜利教授鉴定为唇形科植物丹参Salvia miltiorrhizaBunge。
Trans1-T1、Rosetta(DE3)、DH5ɑ感受态细胞,GoScript Reverse Transcription System 反转录试剂盒均购自北京全式金生物技术股份有限公司;pET28a、pCAMBIA1300-35S-GFP 载体均购自武汉转导生物实验室有限公司;胶回收纯化试剂盒(南京诺唯赞有限公司);载体pMD19-T,内切酶BamHⅠ、XhoⅠ、KPnⅠ均购自TaKaRa 公司;异丙基-β-D-硫代半乳糖苷(IPTG)、2×Phanta Flash Master Mix、琼脂糖、核酸Marker 和染料均购自北京拜尔迪公司;Plant RNA Kit(Omega 公司);引物由北京六合华大基因科技有限公司合成。
1.2 仪器
HH-S4A 型水浴锅(北京科伟永兴仪器有限公司);HWY-1102C 型摇床(上海智诚分析仪器制造有限公司);GL-88B 型涡旋器(海门市其林贝尔仪器制造有限公司);WD-9413B 型凝胶成像仪(北京六一生物科技有限公司);NanoDrop One 型超微量分光光度计(Thermo Fisher 公司);JY300E 型凝胶电泳仪(北京君意东方电泳设备有限公司);PL602E 型电子天平(Mettler-Toledo 公司);T100 型聚合酶链式反应(PCR)仪、CFX96 型实时荧光定量PCR(qRT-PCR)仪(Bio-Rad 公司);HZQ-211C型振荡培养箱(上海一恒科学仪器有限公司);TGL-16型高速冷冻离心机(湘仪离心机仪器有限公司);LSM980 型激光共聚焦显微镜 [卡尔蔡司(上海)管理有限公司]。
2 方法
2.1 样品处理
选取无病害、长势良好的丹参立刻置于液氮中保存,之后储存于-80 ℃冰箱中。取丹参刚采摘的健康叶片,经清洁后置于含激素的培养基上诱导愈伤组织,选择生长良好且长势相同的丹参愈伤组织进行非生物胁迫和激素诱导处理。非生物胁迫为低温(4 ℃)、NaCl(150 mmol·L-1)和甘露醇(400 mmol·L-1);外源激素为ABA(150 µmol·L-1)、茉莉酸甲酯(MeJA,150 µmol·L-1)及生长素(IAA,150 µmol·L-1)3 种,在经过0、12、24、36、48 h处理后分别提取RNA作为检测样品。
2.2 丹参叶片RNA提取及cDNA的合成
RNA 提取参照Plant RNA Kit 产品说明书进行,提取RNA 样品浓度由超微量分光光度计测定,并进行1%琼脂糖凝胶电泳分析,检测RNA 完整性和质量,以确保满足后续分析的需要。反转录方法参照试剂盒说明书进行。
2.3 SmRopGEF1基因克隆
根据丹参转录组测序数据库,筛选与发育相关的基因,依据片段两端使用Primer Premier 5.0 软件设计基因的特异性扩增引物SmRopGEF1-F1、SmRopGEF1-R1(表1)。将丹参叶片RNA 进行反转录,反转录后的cDNA 作为扩增模板,扩增体系:cDNA 1.6 µL、2×Phanta Flash Master Mix 25 µL、10 µmol·L-1正反引物各2 µL,ddH2O 补足使终体积为50 µL。反应程序:98 ℃预变性30 s;98 ℃变性10 s,53.4 ℃退火5 s,72 ℃延伸10 s,28 个循环;72 ℃最终延伸1 min;扩增产物于4 ℃条件保存。扩增产物进行电泳检测及凝胶成像分析,快速切下目的条带,回收后按照纯化试剂盒的操作流程进行。回收后的产物与pMD19-T连接,之后转化进Trans1-T1 感受态细胞中,在平板(氨苄抗性)上进行筛选,经菌落PCR 验证后送北京六合华大基因科技有限公司测序。
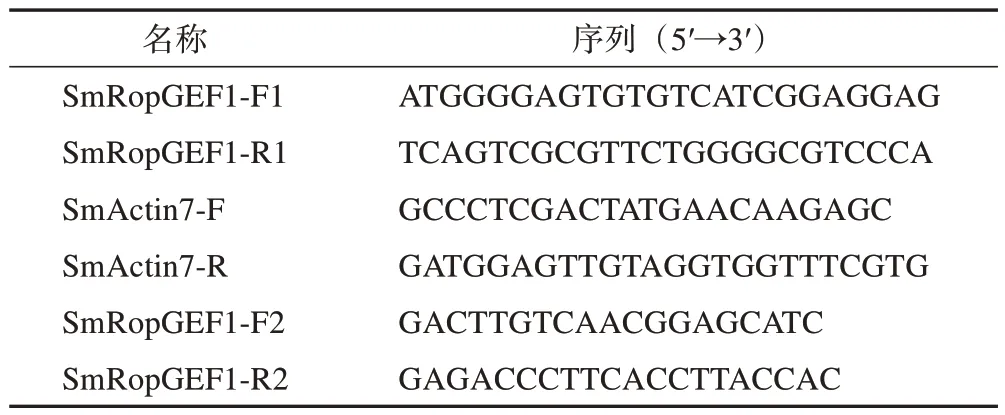
表1 SmRopGEF1基因扩增引物序列信息
2.4 SmRopGEF1基因编码蛋白的生物信息学分析
通过Protparam 在线工具(https://web.expasy.org/protparam/)对SmRopGEF1基因编码的蛋白理化性质进行预测,对SmRopGEF1基因编码蛋白质的氨基酸组成、相对分子质量、理论等电点和稳定性等参数进行分析;利用TMHMM 2.0 软件(https://services.healthtech.dtu.dk/service.php? TMHMM-2.0)进行蛋白序列的跨膜螺旋分析;用ExPASY 中的SOPMA 在线工具(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa%20_sopma.html)预测基因编码蛋白的二级结构。通过SWISS-MODEL工作站构建SmRopGEF1 蛋白的三级结构模型;将SmRopGEF1氨基酸序列输入美国国家生物技术信息中心(NCBI)中CDD 数据库进行结构域预测,应用DNAMAN 将SmRopGEF1 蛋白与其他物种RopGEF1 蛋白的氨基酸序列进行比对分析;从拟南芥数据库(https://www.arabidopsis.org/)和NCBI中下载与SmRopGEF1 相似度较高的氨基酸序列,通过MEGA 6.0软件构建邻接(neighbor-joining)进化树,Bootstrap重复次数为1000次。
2.5 SmRopGEF1 蛋白原核表达载体构建和异源表达
使用BamHⅠ和XhoⅠ双酶切目的基因PCR 产物与pET28a 质粒,回收纯化酶切产物,经T4 连接酶连接,转化Trans1-T1感受态细胞,培养形成单克隆,经菌落PCR、测序正确后进行质粒pET28a-SmRopGEF1提取,之后转化Rosetta(DE3)感受态细胞,选取单克隆接种于LB液体培养基(含卡那霉素),180 r·min-1、37 ℃摇床活化过夜,按1∶100加入到LB 液体培养基(含卡那霉素),180 r·min-1、37 ℃恒温振荡培养至600 nm 处吸光度(A600nm)为0.5 左右,调整温度为16 ℃,加入0.8 mmol·L-1IPTG 振荡培养22 h 后12 000 r·min-1、4 ℃进行离心(离心半径为8.4 cm),收集大肠埃希氏菌,使菌体悬浮于40 mmol·L-1磷酸钾(KPB)缓冲液(含5 mmol·L-1咪唑,100 mmol·L-1NaCl,pH 7.9)中。将含有菌体悬浮液的离心管置于冰上,利用超声破碎仪破碎细胞,之后12 000 r·min-1、4 ℃离心30 min(离心半径为8.4 cm)。镍柱纯化,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分析。
2.6 SmRopGEF1蛋白亚细胞定位
利用KPnⅠ和BamH Ⅰ双酶切目的基因SmRopGEF1PCR 产物与双元载体pCAMBIA1300-35S-GFP,对酶切产物进行纯化,T4 连接酶连接酶切后的产物与载体,连接产物转化DH5ɑ感受态细胞。37 ℃恒温培养,进行菌落PCR 及测序鉴定,对序列正确的单克隆菌斑进行菌液扩繁,提取pCAMBIA1300-35S-GFP-SmRopGEF1 重组质粒,将细胞核标记物和质粒共转化至拟南芥原生质体,弱光下培养10 h,在激光共聚焦显微镜下观察SmRopGEF1蛋白的亚细胞定位。
2.7 SmRopGEF1基因在不同胁迫时间的表达分析
采用qRT-PCR 测定丹参愈伤中SmRopGEF1基因在低温(4 ℃)、NaCl(150 mmol·L-1)、甘露醇(400 mmol·L-1)、ABA(150 µmol·L-1)、MeJA(150 µmol·L-1)及IAA(150 µmol·L-1)不同处理条件下分别经过0、12、24、36、48 h处理时的表达模式,不同处理条件样品有3 个生物学重复。选取SmActin7为内参(GenBank 登录号:HM051058.1),设计qRT-PCR 特异引物(表1),在qRT-PCR 仪上检测表达情况。反应总体系为20 µL;Nuclease-Free H2O 8.2 µL、STBR Premix ExTaq酶10 µL、上下游引物(10 µmol·L-1)各 0.4 µL、cDNA 模板1 µL。反应程序:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,40 个循环(每次循环后采集荧光),循环后95 ℃变性10 s,65~95 ℃做熔解曲线分析,每个温度以0.5 ℃上升,停留5 s。观察熔解曲线,判断qRT-PCR 产物的特异性,采用2-ΔΔCt方法进行定量分析计算。
3 结果与分析
3.1 SmRopGEF1基因cDNA克隆
从丹参叶片转录组数据中筛选叶片发育相关基因SmRopGEF1设计基因特异性引物,以丹参反转录后的cDNA 为模板进行PCR 扩增,经电泳对扩增产物进行检测(图1),胶回收纯化测序序列与转录组测序数据一致,成功克隆出SmRopGEF1,序列长度为1701 bp,编码566个氨基酸。
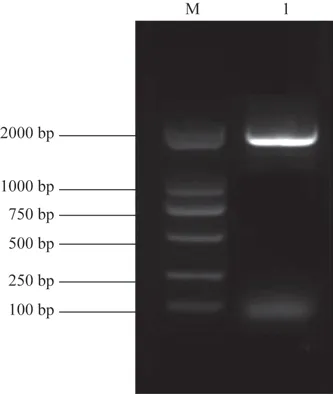
图1 SmRopGEF1基因的扩增
3.2 SmRopGEF1基因编码蛋白的生物信息学分析
3.2.1 SmRopGEF1蛋白理化性质分析和跨膜区域分析 推测SmRopGEF1蛋白总原子数为8706个,分子式为C2748H4332N756O840S30,相对分子质量为62 362.99,不稳定系数和理论等电点分别为56.11、5.86,预测为不稳定蛋白,总的亲水性平均系数为-0.355,属于亲水性蛋白。通过TMHMM 2.0 预测到SmRopGEF1蛋白没有跨膜螺旋结构,序列在膜外。
3.2.2 SmRopGEF1蛋白二级结构预测 结果表明,SmRopGEF1 的二级结构由随机卷曲(random coil)、α-螺旋(α-helices)、延伸链(extended strand)和β-折叠(β-turn)组成,占比分别为41.87%、45.76%、8.13%、4.24%。推测上述4 种中最多的二级结构元件为α-螺旋,而随机卷曲、β-折叠和延伸链分散在整个蛋白中(图2)。
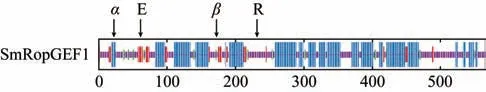
图2 SmRopGEF1蛋白的二级结构预测
3.2.3 SmRopGEF1 蛋白的三级结构分析 以2ntx.1.A 为模板,对SmRopGEF1 的三维结构进行预测,结果表明,SmRopGEF1 与2ntx.1.A 的相似性为54.06%,具有参考价值,具体三维结构见图3。
图3 SmRopGEF1蛋白三级结构预测
3.2.4 SmRopGEF1 蛋白氨基酸序列分析和系统进化树分析 SmRopGEF1具有保守的PRONE结构域。与其他植物中的RopGEF1 氨基酸序列进行比对,结果显示,SmRopGEF1 氨基酸序列与芡欧鼠尾草Salvia hispanicaL.、紫 苏Perilla frutescens(L.)Britt.、一串红Salvia splendensKer Gawl.序列相似度分别为94.58%、93.99%、93.50%(图4)。为进一步了解SmRopGEF1 在植物RopGEF 家族中的进化位置,下载与SmRopGEF1 相似度较高的氨基酸序列构建系统进化树(图5),SmRopGEF1 与芡欧鼠尾草和一串红同源性较高。

图4 SmRopGEF1蛋白与其他物种RopGEF蛋白氨基酸序列对比
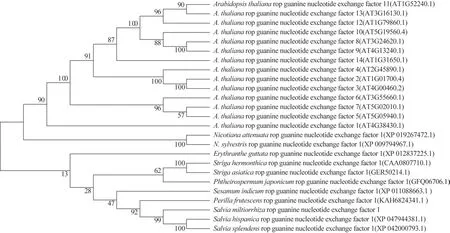
图5 SmRopGEF1基因与其他RopGEF基因的系统进化关系
3.3 SmRopGEF1蛋白原核表达分析
将构建好的原核表达载体pET28a-SmRopGEF1质粒转化至大肠埃希氏菌Rosetta(DE3)中,挑取单克隆菌斑,经菌落PCR 鉴定阳性克隆,成功构建pET28a-SmRopGEF1 原核表达载体。经过纯化,利用10% SDS-PAGE 检测发现在62 000 左右出现SmRopGEF1蛋白条带(图6)。

图6 SmRopGEF1重组蛋白SDS-PAGE凝胶电泳
3.4 SmRopGEF1蛋白的亚细胞定位分析
使用细胞核Marker 作为标记物,将其和红色荧光蛋白序列融合。结果表明融合蛋白pCAMBIA1300-35s-GFP-SmRopGEF1 主要分布在细胞核,可以与细胞核标记物Osghd7 共同定位于细胞核,然而有gfp基因的pCAMBIA1300-35S-GFP 载体注射后荧光在细胞质、细胞核和细胞上都有分布(图7)。以上结果表明,SmRopGEF1 蛋白主要定位在植物细胞的细胞核,在细胞核中发挥作用。
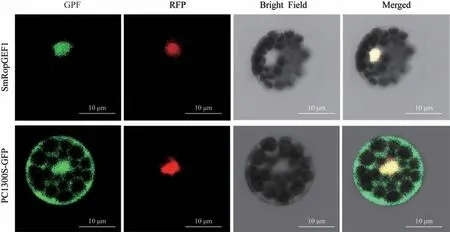
图7 SmRopGEF1蛋白在拟南芥叶片中的亚细胞定位
3.5 SmRopGEF1 基因在非生物胁迫及激素诱导处理下的表达分析
为了验证SmRopGEF1在植物防御反应及激素信号转导中的作用,对丹参长势相同的愈伤组织分别进行非生物胁迫(低温、盐及干旱)和激素诱导(IAA、ABA、MeJA)处理。以0 h 处理的丹参愈伤组织样品为对照,不同处理时间点取样,提取丹参愈伤组织的RNA,之后进行qRT-PCR 检测,分析SmRopGEF1的表达水平。盐胁迫下,SmRopGEF1表达水平先升高,再降低,之后又升高,并在36 h达到最高;冷胁迫下,SmRopGEF1表达水平先升高,后降低,并在24 h 达到最高,为0 h 的5.6 倍;干旱胁迫后丹参愈伤中SmRopGEF1表达量下降,12 h 时表达水平最低(图8A)。丹参愈伤组织经IAA、ABA激素诱导后SmRopGEF1表达量没有显著变化,MeJA 诱导后SmRopGEF1表达量先升高,后降低,之后上升,在48 h时达到峰值(图8B)。
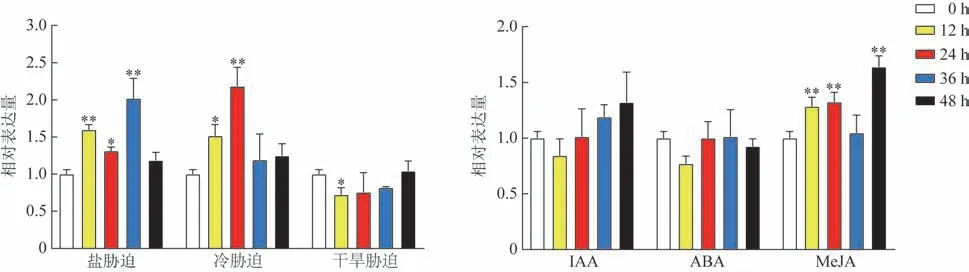
图8 非生物胁迫和激素诱导处理下SmRopGEF1基因的相对表达量(,n=3)
4 讨论
RopGEF 在植物抗逆反应及激素信号转导过程中起到重要作用。本研究扩增了SmRopGEF1基因,并首次在大肠杆菌中异源表达了SmRopGEF1 蛋白,序列分析结果表明SmRopGEF1 蛋白含有1 个保守的PRONE 结构域,与芡欧鼠尾草和一串红具有较高的同源性。已有研究表明,RopGEF 蛋白能够定位于细胞膜、细胞质、细胞核中,如拟南芥RopGEF4 蛋白在细胞膜、细胞质和细胞膜中均有表达[14];拟南芥RopGEF5 蛋白定位在细胞膜及细胞膜周围的细胞质中,并且在膜上不对称定位[15];拟南芥RopGEF2主要分布在近细胞膜处、细胞质和线粒体中[16]。本研究应用拟南芥瞬时表达系统实验证明SmRopGEF1为核蛋白,可能在细胞核中发挥作用。
RopGEF 在植物防御中发挥重要作用。例如,拟南芥在受到低温胁迫、盐胁迫和热胁迫时,GEF7、GEF9、GEF10被显著诱导表达;受到低温胁迫、盐胁迫和渗透胁迫时,GEF8、GEF13被显著诱导表达;在受到盐胁迫和热胁迫时,GEF3和GEF11被显著诱导表达;在受到低温和盐胁迫时,GEF4和GEF12被显著诱导表达;受到热胁迫时,GEF2和GEF6被显著诱导表达[17]。本研究通过qRTPCR实验分析SmRopGEF1基因在不同胁迫下的表达量,实验结果表明盐胁迫和冷胁迫能够显著提高SmRopGEF1的表达,而干旱胁迫显著降低SmRopGEF1的表达,说明SmRopGEF1基因在植物抗逆过程中起到重要作用。RopGEF基因在植物信号转导过程中也起到重要作用。例如,100 μmol·L-1ABA 处理后,拟南芥叶中RopGEF4表达量先升后降,根中呈下降趋势;RopGEF8表达量在叶片和根中均先上升后下降[14]。经外源ABA(100 μmol·L-1)诱导后,茶树CsRopGEF1和CsRopGEF3基因的相对表达量分别显著下调和上调,表明这2 个基因能够对外源ABA 进行响应且响应模式不同[5]。水稻OSRopGEF7A能够响应生长素的诱导,用1 μmol·L-1NAA处理幼苗,随着处理时间的延长,OSRopGEF7A的表达量也增加,并在处理12 h 时达到最高水平[18]。本研究表明,SmRopGEF1基因在生长素和ABA 的诱导下表达量变化不明显,但是MeJA 诱导下能够显著升高,表明SmRopGEF1基因可能参与MeJA 信号转导。本研究通过对SmRopGEF1基因的亚细胞定位和不同胁迫、激素诱导下的表达分析,为丹参中RopGEF 蛋白功能的进一步研究和抗逆品种的选育提供了参考。

