老鹳草化学成分及抗肿瘤活性研究△
孔楚楚,柳志诚,叶丹阳,张园园,刘永刚
北京中医药大学 中药学院,北京 100029
牻牛儿苗科植物老鹳草Geranium wilfordiiMaxim.是我国传统中草药,有祛风活血、清热解毒等作用,还有止泻痢的功效。根据《中华人民共和国药典》2020 年版,将其干燥地上部分作为中药老鹳草的来源之一。现代药理研究表明,老鹳草煎剂及提取物具有抗菌[1]、抗病毒[2-3]、抗氧化[4-5]、保护肝肾[6]、抗炎镇痛[7]、抗肿瘤[8]、降低血糖等生物活性。本研究对老鹳草75%乙醇提取物进行分离和鉴定,共得到了17 个化合物,分别鉴定为水杨酸(1)、没食子酸甲酯(2)、没食子酸乙酯(3)、1,2,4-苯三酚(4)、原儿茶酸(5)、(6S,9R)-6,9-二羟基-3-酮基-α-香堇醇(6)、短叶苏木酚酸乙酯(7)、没食子酸(8)、euphorhirtin G(9)、异柯里拉京(10)、金丝桃苷(11)、槲皮素(12)、烟酰胺(13)、山柰酚(14)、短叶苏木酚(15)、莽草酸(16)、槲皮素-3-O-(6″-没食子酰基)-β-D-半乳糖苷(17)。包括2个有机酸类(化合物1、5)、6 个鞣质类(化合物2、3、7~9、10)、4 个黄酮类(化合物11、12、14、17)和5 个其他化合物(化合物4、6、13、15、16)。化合物2、4、6、9、10、13、16、17 均为首次从老鹳草中分离出。化合物10、14 在体外实验中对人肝癌细胞HepG2增殖具有较好的抑制活性。
1 材料
1.1 细胞
HepG2细胞购自中国科学院细胞库。
1.2 试药
老鹳草样品采自云南省,由北京中医药大学刘勇教授鉴定为老鹳草属牻牛儿苗科植物老鹳草Geranium wilfordiiMaxim.的干燥地上部分。
5-氟尿嘧啶(纯度>99%,批号:C13964617,上海麦克林生化科技股份有限公司);分析纯乙酸乙酯、石油醚、二氯甲烷、甲醇、甲酸、二甲基亚砜(北京化工厂);CCK-8 试剂盒、磷酸缓冲盐溶液、胎牛血清(FBS)、链霉素-青霉素双抗(PS)、高糖DMEM培养基(美国Corning Incorporated公司);胰蛋白酶(美国Sigma公司);氘代试剂(美国Cambridge Isotope Lab)。
1.3 仪器与耗材
BT224S 型十万分之一电子天平(德国Sartorius公司);AVANCE NEO 400型核磁共振波谱仪(德国Bruker公司);YXQ-LS-100SⅡ型立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);SpectraMax i3x 型酶标仪(美国BioTek 公司);SW-CJ-2FD(标准型)双人单面净化工作台(苏州博莱尔净化设备有限公司);CK型光学显微镜(美国Olympus公司);Series Ⅱ型二氧化碳培养箱、Revco PLUS 型-80 ℃低温冰箱(美国Thermo 公司);FC5515R 型高速低温离心机(美国Ohaus公司);柱色谱硅胶、GF254硅胶薄层色谱板(青岛海洋化工厂);96 孔板(美国Corning Incorporated公司)。
2 方法
2.1 提取与分离
取干燥的老鹳草全草10 kg,用10 倍量70%工业乙醇加热回流提取3 次(每次2 h),减压抽滤后,合并提取液,用旋转蒸发仪减压蒸馏除去乙醇,浓缩得到老鹳草粗提物浸膏。将浸膏混悬于蒸馏水(4 L)中,用乙酸乙酯萃取(萃取试剂与水悬浮液比例为1∶1),萃取5 次,合并萃取液,减压回收溶剂,得到乙酸乙酯萃取部位约300 g。
乙酸乙酯萃取部位经乙酸乙酯及甲醇溶解后,用硅胶300 g 拌样,通过硅胶柱色谱分离,用石油醚-乙酸乙酯(100∶0→0∶100)系统及乙酸乙酯-甲醇(100∶0→0∶100)系统梯度洗脱,共得到8个组分(A~H)。
将组分A 进行二次硅胶柱色谱分离,以石油醚-乙酸乙酯(100∶0→0∶100)梯度洗脱,根据GF254硅胶薄层色谱检识分成3 个组分(A1~A3),经过反复硅胶柱色谱分离并结合多次重结晶后,从A3组分中分离得到了化合物1(20 mg)。对组分D 进行了二次硅胶柱色谱分离,用二氯甲烷-甲醇(100∶1→0∶100)梯度洗脱,得到6 个组分(D1~D6),经过反复硅胶柱色谱分离及多次重结晶后从组分D2中分离得到化合物2(15 mg),从组分D3 中分离得到了化合物3(20 mg)和4(7 mg),从组分D4 中分离得到化合物5(100 mg)和6(7 mg)。将组分E用二氯甲烷-甲醇(100∶3→0∶100)梯度洗脱,得到7 个组分(E1~E7),用石油醚-乙酸乙酯系统及二氯甲烷-甲醇系统多次硅胶柱色谱分离,经薄层色谱检识和多次重结晶后,从组分E1 中分离得到了化合物7(200 mg)和8(1 g),从组分E4 中分离得到化合物9(9 mg),从组分E7 中分离得到化合物10(200 mg)。同样对组分F 进行二次硅胶柱色谱分离,以二氯甲烷-甲醇(100:10→0∶100)梯度洗脱,得到7 个组分(F1~F7)。再反复多次用硅胶柱色谱进行进一步的分离,同时用GF254硅胶薄层色谱检识和多次重结晶,从组分F1 中分离得到了化合物11(1 g),从组分F3 中分离得到化合物12(30 mg),从组分F5 中分离得到化合物13(10 mg),从组分F6 中分离得到化合物14(10 mg)、15(30 mg)和16(9 mg),从组分F7 中分离得到化合物17(200 mg)。
2.2 化合物体外抗肿瘤活性评价
2.2.1 细胞培养 从液氮罐内将装于冻存管的HepG2细胞拿出,转移到37 ℃水浴锅内,使细胞迅速解冻,直至冻存管内细胞悬液不存在固体。将细胞悬液转移至2 mL 离心管中,配平后于离心机内离心(800 r·min-1,5 min,离心半径为10 cm),离心结束后吸出离心管内的上清液,管内沉淀加入高糖DMEM 完全培养基(含10% FBS 和1% PS)1 mL,吹打3~4 次,使细胞重新混悬。将混悬好的细胞转移至细胞培养瓶内,加入完全培养基5 mL,慢慢左右摇晃培养皿,吹打均匀使细胞散布其中,于37 ℃、饱和湿度和5% CO2下培养。
2.2.2 CCK-8 实验检测细胞生长抑制率 观察HepG2 细胞的生长状态,当细胞生长至占培养瓶底部面积70%~80%时,吸出培养基,用PBS 润洗2次,消化完全后加入完全培养基1 mL 吹打均匀,制备细胞悬液。取细胞悬液计数后以4×103个/mL 的密度接种于96 孔板中,每孔100 μL,对照组根据给药浓度加入含一定量DMSO(体积分数<0.3%)的培养基,空白组不加入细胞只加完全培养基。在37 ℃、5% CO2细胞培养箱培养24 h,细胞贴壁后,将培养瓶中的完全培养基更换为基础培养基,将细胞饥饿24 h,调整细胞状态,24 h 后吸出基础培养基,加入含相应浓度药物的完全培养基200 μL 继续培养72 h。72 h 后吸出加药培养基,用基础培养基将CCK-8 试剂稀释10 倍,在96 孔板每孔中加入稀释后的CCK-8 试剂100 μL。在37 ℃、5%CO2细胞培养箱孵育1~2 h,用全波长酶标仪检测各孔在450 nm 波长下的吸光度(A),每组设置3~6 个复孔。按照公式(1)计算抑制率。
将各化合物的母液用完全培养基稀释至50、100、150、200 μmol·L-1给药进行初筛。根据每组给药组的细胞抑制率,对每个化合物的给药浓度进行调整,再次进行CCK-8 实验,并用GraphPad Prism 软件构建曲线计算每个化合物的半数抑制浓度(IC50)。
2.2.3 数据处理 采用SPSS Statistics 20 软件进行统计分析,结果用()表示。多组间比较如符合正态分布且方差齐则用方差分析,不符合正态分布的采用Wilcoxon秩和检验,P<0.05表示差异有统计学意义。
3 结果
3.1 化合物结构鉴定
化合物1:无色针状结晶(甲醇),分子式为C7H6O3。1H-NMR (400 MHz,DMSO-d6)δ: 7.80 (1H,dd,J=7.9,1.8 Hz,H-6),7.47 (1H,ddd,J=8.3,7.2,1.8 Hz,H-3),6.91 (2H,m,H-3,4);13C-NMR (100 MHz,DMSO-d6)δ: 172.5 (-COOH),161.7 (C-2),136.0 (C-1),117.5 (C-3),130.7 (C-4),113.3 (C-5),119.5 (C-6)。以上数据与文献[9]报道基本一致,故鉴定化合物1为水杨酸。
化合物2:白色无定型粉末,分子式为C8H8O5。1H-NMR (400 MHz,DMSO-d6)δ: 9.13 (3H,s,3,4,5-OH),6.94 (2H,s,H-2,6),3.75 (3H,s,-OCH3);13CNMR (100 MHz,DMSO-d6)δ: 119.7 (C-1),109.0 (C-2,6),146.0 (C-3,5),138.9 (C-4),166.8 (C-7),52.1 (-OCH3)。以上数据与文献[10-11]报道基本一致,故鉴定化合物2为没食子酸甲酯。
化合物3:白色无定型粉末,分子式为C9H10O5。1H-NMR (400 MHz,CD3OD)δ: 7.06 (2H,s,H-2,6),4.29 (2H,q,J=7.1 Hz,-OCH2CH3),1.36 (3H,t,J=7.1 Hz,-OCH2CH3);13C-NMR (100 MHz,CD3OD)δ: 167.2 (-CO-),146.1 (C-3,5),138.3 (C-4),120.3 (C-1),108.6 (C-2,6),60.3 (-OCH2CH3),13.2 (-OCH2CH3)。以上数据与文献[12]报道基本一致,故鉴定化合物3为没食子酸乙酯。
化合物4:淡黄色粉末,分子式为C6H6O3。1HNMR (400 MHz,DMSO-d6)δ: 7.28 (2H,m,H-3,5),6.70 (1H,d,J=8.0 Hz,H-6);13C-NMR (100 MHz,DMSO-d6)δ: 150.4 (C-4),145.2 (C-2),122.0 (C-1),117.6 (C-6),115.4 (C-3,5)。以上数据与文献[13]报道基本一致,故鉴定化合物4为1,2,4-苯三酚。
化合物5:白色无定型粉末,分子式为C7H6O4。1H-NMR (400 MHz,CD3OD)δ: 7.44 (2H,m,H-2,6),6.91 (1H,d,J=8.0 Hz,H-5);13C-NMR (100 MHz,CD3OD)δ: 168.9 (-COOH),150.2 (C-4),144.7 (C-3),122.5 (C-6),121.7 (C-1),116.3 (C-5),114.4 (C-2)。以上数据与文献[14]报道基本一致,故鉴定化合物5为原儿茶酸。
化合物6:白色无定型粉末,分子式为C13H20O3。1H-NMR (400 MHz,DMSO-d6)δ: 5.78 (1H,brs,H-4),5.68 (1H,overlap,H-8),5.66 (1H,overlap,H-7),4.18 (1H,m,H-9),2.36 (1H,d,J=16.8 Hz,H-2a),2.06 (1H,d,J=16.6 Hz,H-2b),1.81 (3H,s,H-13),1.11 (3H,d,J=9.5 Hz,Me-10),0.93 (3H,s,Me-12),0.91 (3H,s,Me-11);13C-NMR (100 MHz,DMSO-d6)δ: 41.4 (C-1),49.9 (C-2),197.8 (C-3),128.4 (C-4),164.9 (C-5),78.3 (C-6),125.9 (C-7),136.3 (C-8),66.5 (C-9),23.5 (C-10),24.6,24.4 (1-CH3),19.5 (5-CH3)。以上数据与文献[15]报道基本一致,故鉴定化合物6为 (6S,9R)-6,9-二羟基-3-酮基-α-香堇醇。
化合物7:黄色粉末,分子式为C15H12O8。1HNMR (400 MHz,DMSO-d6)δ: 7.29 (1H,s,H-7),4.40 (1H,dd,J=7.5 Hz,H-9),2.98 (1H,dd,J=18.7,7.9 Hz,H-10),2.44 (1H,d,J=18.9 Hz,H-10),4.08 (2H,q,J=8.0 Hz,H-2′),1.17 (3H,t,J=8.0 Hz,H-3);13C-NMR (100 MHz,DMSO-d6)δ: 192.5 (C-11),159.6 (C-8),149.0 (C-6),145.2 (C-2),143.1 (C-4),139.7 (C-5),137.9 (C-3),114.3 (C-3a),112.4 (C-7a),107.4 (C-7),40.1 (C-9),36.4 (C-10),171.5 (C-1′),60.0 (C-2′),13.3 (C-3′)。以上数据与文献[16]报道基本一致,故鉴定化合物7为短叶苏木酚酸乙酯。
化合物8:白色无定型粉末,分子式为C7H6O5。1H-NMR (400 MHz,DMSO-d6)δ: 12.23 (1H,brs,-COOH),9.19 (2H,brs,3,5-OH),8.85 (1H,brs,4-OH),6.96 (2H,s,H-2,6);13C-NMR (100 MHz,DMSO-d6)δ: 167.9 (-COOH),146.1 (C-3,5),138.9 (C-4),121.2 (C-1),109.4 (C-2,6)。以上数据与文献[9]报道基本一致,故鉴定化合物8为3,4,5-三羟基苯甲酸,即没食子酸。
化合物9:浅黄色无定形粉末,分子式C15H13O8。1H-NMR (400 MHz,CD3OD)δ: 7.49 (1H,s,H-8),5.65 (2H,s,H2-3),4.18 (2H,q,J=7.2 Hz,14-OCH2CH3),3.59 (2H,s,H2-13),1.27 (3H,t,J=7.2 Hz,14-OCH2CH3);13C-NMR(100 MHz,CD3OD)δ: 170.0 (C-14),162.4 (C-1),160.9 (C-12),149.7 (C-7),142.4 (C-4),139.5 (C-5),138.4 (C-6),113.1 (C-11),112.8 (C-8),111.3 (C-9),110.7 (C-10),67.4 (C-3),61.1 (14-OCH2CH3),31.1 (C-13),13.0 (14-OCH2CH3)。以上数据与文献[17-18]报道基本一致,故鉴定化合物9为euphorhirtin G。
化合物10:白色无定形粉末,分子式为C27H22O18。1H-NMR (400 MHz,CD3OD)δ: 7.07 (2H,s,Gal H-2,6),6.71 (1H,s,HHDP H-2),6.68 (1H,s,HHDP H-2′),6.38 (1H,d,J=2.2 Hz,Glc H-1),4.51 (2H,m,Glc H-4,5),4.18 (1H,dd,J=11.0,8.0 Hz,Glc H-6b),4.00 (1H,d,J=2.0 Hz,Glc H-2);13CNMR (100 MHz,CD3OD)δ: 168.8 (HHDP C′=O),167.2 (HHDP C=O),165.3 (Gal C=O),145.0 (Gal C-3,5),144.7,144.3 (HHDP C-3,5),143.8 (HHDP C-3′),143.9 (HHDP C-5′),139.0 (Gal C-4),136.8 (HHDP C-4′),136.3 (HHDP C-4),124.1 (HHDP C-1),124.1 (HHDP C-1′),119.2 (Gal C-1),115.8 (HHDP C-6′),115.3 (HHDP C-6),109.6 (Gal C-2,6),108.9 (HHDP C-2),107.0 (HHDP C-2′),93.7 (Glc C-1),74.8 (Glc C-5),70.2 (Glc C-3),68.0 (Glc C-2),63.6 (Glc C-4),61.0 (Glc C-6)。根据6.38 (1H,d,J=2.2 Hz,Glc H-1),J=2.2 Hz 可知应为α-苷键,且与文献[19-20]报道基本一致,故鉴定化合物10 为异柯里拉京。
化合物11:黄绿色粉末,分子式为C21H20O12。1H-NMR (400 MHz,DMSO-d6)δ: 12.64 (1H,s,OH-5),7.68 (1H,dd,J=1.5,8.4 Hz,H-6′),7.53 (1H,d,J=1.5 Hz,H-2′),6.82 (1H,d,J=8.4 Hz,H-5′),6.41 (1H,d,J=1.4 Hz,H-8),6.21 (1H,d,J=1.4 Hz,H-6),5.38 (1H,d,J=8.0 Hz,H-1″),4.29~5.47 (5H,d,糖环上质子);13C-NMR (100 MHz,DMSO-d6)δ: 178.0 (C-4),164.7 (C-7),161.7 (C-5),156.8 (C-9),156.7 (C-2),149.0 (C-4′),145.3 (C-3′),134.0 (C-3),122.5 (C-1′),121.6 (C-6′),116.4 (C-5′),115.7 (C-2′),104.4 (C-10),102.3 (C-1″),99.2 (C-6),94.0 (C-8),76.3 (C-5″),73.7 (C-3″),71.7 (C-2″),68.4 (C-4″),60.6 (C-6″)。以上数据与文献[21]报道基本一致,故鉴定化合物11为金丝桃苷。
化合物12:黄色无定形粉末,分子式为C15H10O7。1H-NMR (400 MHz,DMSO-d6)δ: 12.49 (1H,s,5-OH),10.78 (1H,s,4′-OH),9.36 (1H,s,3′-OH),7.68 (1H,d,J=2.0 Hz,H-2′),7.54 (1H,dd,J=6.4,2.0 Hz,H-6′),6.88 (1H,d,J=8.4 Hz,H-5′),6.41 (1H,d,J=2.0 Hz,H-8),6.19 (1H,d,J=2.0 Hz,H-6);13C-NMR (100 MHz,DMSO-d6)δ: 176.3 (C-4),164.4 (C-7),161.2 (C-5),156.6 (C-9),148.2 (C-4′),147.3 (C-2),145.5 (C-3′),136.2 (C-3),122.2 (C-1′),120.4 (C-6′),116.1 (C-5′),115.4 (C-2′),103.5 (C-10),98.6 (C-6),93.8 (C-8)。以上数据与文献[22]报道基本一致,故鉴定化合物12为槲皮素。
化合物13:白色粉末,分子式为C6H5NO2。1HNMR (400 MHz,CD3OD)δ: 9.03 (1H,d,J=2.2 Hz,H-6),8.69 (1H,dd,J=5.0,1.6 Hz,H-2),8.29 (1H,dt,J=8.0,1.9 Hz,H-4),7.54 (1H,dd,J=8.0,4.9 Hz,H-3);13C-NMR (100 MHz,CD3OD)δ: 168.5 (-COOH),151.5 (C-2),148.1 (C-6),135.9 (C-4),130.0 (C-5),123.7 (C-3)。以上数据与文献[23]报道基本一致,故鉴定化合物13为烟酰胺。
化合物14:黄色无定形粉末,分子式为C15H10O6。1H-NMR (400 MHz,DMSO-d6)δ: 12.49 (1H,s,5-OH),10.78 (1H,s,3-OH),10.11 (1H,s,4′-OH),9.37 (1H,s,7-OH),8.05 (2H,m,H-2′,6′),6.93 (2H,d,J=8.7 Hz,H-3′,5′),6.45 (1H,d,J=2.1 Hz,H-8),6.20 (1H,d,J=2.1 Hz,H-6);13C-NMR (100 MHz,DMSO-d6)δ: 176.4 (C-4),164.4 (C-7),161.2 (C-5),159.7 (C-9),156.7 (C-4′),147.3 (C-2),136.1 (C-3),130.0 (C-2′,6′),122.2 (C-1′),115.9 (C-3′,5′),103.5 (C-10),98.7 (C-6),94.0 (C-8)。以上数据与文献[9]报道基本一致,故鉴定化合物14为山柰酚。
化合物15:黄色无定型粉末,分子式为C15H10O6。1H-NMR (400 MHz,DMSO-d6)δ: 7.27 (1H,s,H-7),3.17 (2H,t,J=3.8 Hz,H-10);13C-NMR (100 MHz,DMSO-d6)δ: 145.4 (C-2),140.8 (C-3),115.9 (C-3a),144.7 (C-4),141.9 (C-5),149.8 (C-6),108.4 (C-7),113.6 (C-7a),161.1 (C-8),24.3 (C-9),33.5 (C-10),196.0 (C-11)。以上数据与文献[24-25]报道基本一致,故鉴定化合物15为短叶苏木酚。
化合物16:白色无定型粉末,分子式为C7H10O5。1H-NMR (400 MHz,DMSO-d6)δ: 6.57 (1H,d,J=2.6 Hz,H-2),4.20 (1H,brs,H-3),3.83 (1H,dd,J=6.3,4.3 Hz,H-4),3.55 (1H,dd,J=6.2,3.9 Hz,H-5),2.40 (1H,dd,J6e-H,Je,a=18.0 Hz,J5,6e=4.5 Hz),2.02 (1H,dd,J6aHa,e=18.1 Hz,J5,6a=3.7 Hz);13C-NMR (100 MHz,DMSO-d6)δ: 168.5 (CO),139.3 (C-2),128.8 (C-1),70.8 (C-3),67.3 (C-4),66.0 (C-5),30.4 (C-6)。以上数据与文献[26]报道基本一致,故鉴定化合物16为莽草酸。
化合物17:化合物色粉末,分子式为C28H24O16。1H-NMR (400 MHz,DMSO-d6)δ: 7.65 (1H,dd,J=8.4,2.4 Hz,H-6′),7.52 (1H,d,J=1.8 Hz,H-2′),6.87 (2H,br s,H-2‴,6‴),6.82 (1H,d,J=9.0 Hz,H-5′),6.40 (1H,d,J=1.8 Hz,H-8),6.19 (1H,d,J=1.8 Hz,H-6),5.36 (1H,d,J=7.8 Hz,H-1″),4.12 (1H,dd,J=10.8,7.2 Hz,H-6″),4.04 (1H,dd,J=10.2,5.4 Hz,H-6″),3.73 (2H,dd,J=7.2,5.4 Hz,H-4″,5″),3.61 (1H,dd,J=9.6,7.8 Hz,H-2″),3.45 (1H,dd,J=6.0,3.0 Hz,H-3″);13C-NMR (100 MHz,DMSO-d6)δ: 177.8 (C-4),165.9 (C-7‴),164.6 (C-7),161.7 (C-5),156.9 (C-2),156.8 (C-9),149.0 (C-4′),146.0 (C-3‴,5‴),145.3 (C-3′),139.0 (C-4‴),134.0 (C-3),122.4 (C-1′),121.5 (C-6′),119.5 (C-1‴),116.4 (C-2′),115.6 (C-5′),109.0 (C-2‴,6‴),104.3 (C-10),102.5 (C-1″),99.2 (C-6),94.0 (C-8),73.3 (C-5″),72.8 (C-3″),71.5 (C-2″),68.2 (C-4″),62.5 (C-6″)。以上数据与文献[27-28]报道基本一致,故鉴定化合物17 为槲皮素-3-O-(6″-没食子酰基)-β-D-半乳糖苷。
3.2 化合物对HepG2细胞的体外增殖抑制作用
从老鹳草中分离出的化合物对HepG2 细胞的体外增殖抑制作用见表1,以5-氟尿嘧啶为阳性对照药,结果表明,化合物2~4、7、8、10、14、15、17具有明显的体外抗肿瘤活性(IC50<300 μmol·L-1),其中化合物10 和14 体外抗HepG2 细胞增殖活性较好,IC50分别为27.95、18.24 μmol·L-1。
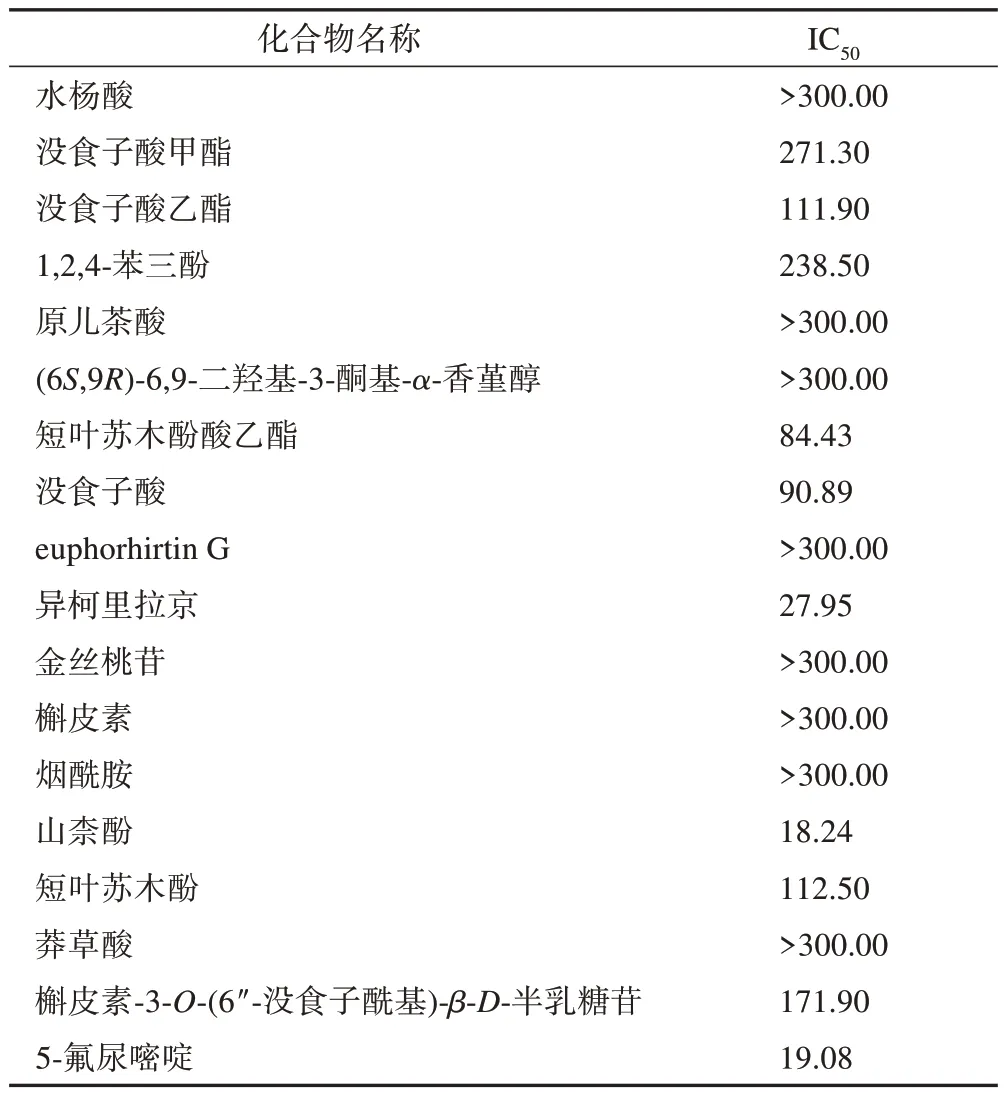
表1 老鹳草中分离化合物抗HepG2细胞增殖的IC50 μmol·L-1
4 讨论
本研究从老鹳草的75%乙醇提取物中分离出17个化合物,主要为酚酸类和黄酮类化合物,与文献[29-31]的研究结果一致。化合物2、4、6、9、10、13、16、17 均为首次从老鹳草中分离得到,化合物4、6、9、10、13 为首次从老鹳草属植物中分离得到。化合物13 也是首次从老鹳草中分离出生物碱类成分,丰富了老鹳草的化学成分研究。并对这些化合物进行了体外抗HepG2 细胞增殖活性研究,筛选出8 个具有明显抗肿瘤活性的化合物,为鞣质和黄酮类化合物,其中化合物10、14 体外抗HepG2 细胞增殖活性良好。有文献报道老鹳草中的鞣质可以抑制致癌物苯并芘-7,8-二醇-9,10-环氧化物(BPDE)的诱变活性,防止细胞癌变[32]。也有研究发现,老鹳草中的黄酮类化合物具有明显的抗肿瘤活性,能够显著抑制多种癌细胞的生长[33],因此也有必要对此进行更系统和深入的研究。本研究为后续药理活性研究及此类药用植物资源的开发提供了参考。
