强化硫胺素途径能增强工业酵母线粒体稳态
付嘉琦,董曙馨,李 珺 ,李 春 ,2
(1. 北京理工大学 化学与化工学院 生物化工研究所 医药分子科学与制剂工程工信部重点实验室,北京 100081;2. 清华大学 化学工程系,北京 100084)
燃料乙醇作为一种新型能源已逐渐进入人们的日常生活,更成为国内外学者的研究热点[1-2]。通过提高乙醇转化率和浓度,并且降低生产成本,能极大地提高乙醇总产值,带来巨大的经济效益和社会效益。由于工业发酵条件复杂,酿酒酵母(Saccharomycescerevisiae)需要面对高温、高乙醇浓度、高渗透压、毒性副产物(如乙酸)和底物毒性等苛刻环境[3],这些不利因素影响细胞的多种代谢过程,造成有毒物质在胞内的积累,进而使细胞稳态失衡[4-5],最终导致目标产物产量下降和生产成本升高。为了给发酵菌株提供适宜的生长条件,需要严格控制发酵过程,这极大地增加了生产成本和能耗。因此,可直接对耐受相关途径进行工程化设计以增强工业酵母的耐受性,以期获得能适应工业生产复杂胁迫环境的、稳定可遗传的优良工业菌株。
工业菌株抵御胁迫环境一般涉及碳、脂质、氨基酸等代谢途径的重塑,以修复由胁迫因子引起的细胞损伤,同时增加菌株清除对自身有害因子的能力。维持细胞稳态对工业菌株高产目标产物有重要作用[6-7]。酿酒酵母基因组测序的完成为利用转录组分析其基因特征及全面解读奠定基础[8],转录组分析包含细胞过程、细胞组分及分子生物学功能等方面。特别是深度分析转录组获得的数据,对挖掘能够提高菌株耐受能力的潜在关键基因、潜在代谢通路、了解工业酵母的复杂代谢机制至关重要。Baeza等[9]对8种适应低温但生长特性各不相同的酵母的转录组分析后发现,差异表达基因的总数与每个酵母面临的温度变化有关。Kocaefe-Özen等[10]对酵母的转录组和基因组分析后发现,实验室进化的抗氧化胁迫酿酒酵母对其他类型的胁迫具有交叉抗性,同时产生更高水平的海藻糖和糖原,这两种产物对维持细胞器膜结构有着积极作用。内质网、线粒体等膜结合的细胞器是许多关键代谢途径的场所,它们通过调节胞内的氧化还原平衡、维持线粒体膜上的电子传递链与输入机制等方式参与调节细胞在胁迫环境下的稳态[11-12],但关于细胞器调控细胞稳态的机制研究尚不深入。
有研究证明,硫胺素途径对菌株耐受性的贡献除了其在糖酵解、磷酸戊糖途径(PPP)和三羧酸循环(TCA)等中央细胞代谢中的作用外,硫胺素及其磷酸化衍生物依赖的应激保护功能也是利于酵母存活的关键[13-14]。硫胺素(thiamine)又称维生素 B1,是一种维持酵母正常生长代谢的水溶性 B 族维生素,通常以能量代谢关键酶辅酶的形式参与物质代谢与能量代谢。Wolak等[15]研究发现,在发酵过程中,硫胺素的缺乏不仅会引起胞内氧化还原失衡以及活性氧(ROS)的产生,而且进一步引发细胞生长抑制、细胞死亡和发酵停滞,可见硫胺素在酿酒酵母中的应激保护作用与它在细胞中的从头合成途径密切相关。在人体中,硫胺素缺乏会触发介导细胞死亡的线粒体通透孔开放[16]。一般线粒体产生的能量通常以电化学势能储存在线粒体内膜,形成相对稳定的线粒体膜电位,当菌株出现不同程度稳态失衡甚至衰老时,就会出现不同程度线粒体膜电位下降的趋势。如,硫胺素反应性巨幼细胞贫血的成因涉及线粒体氧化磷酸化和硫胺素代谢途径[17],这不仅证实细胞器线粒体是硫胺素作用的场所,而且硫胺素途径与细胞稳态有着密切的关系。如果缺失硫胺素合成途径的基因则会影响菌株的生长,如THI5缺失的菌株在缺乏硫胺素的培养基上生长严重受阻,而缺失THI4的菌株对DNA 损伤敏感[18-19];尤其是THI80所编码的硫胺素二磷酸(TDP),以辅因子的形式不仅调控着丙酮酸代谢途径和磷酸戊糖途径中的关键酶及线粒体转运蛋白,还通过促进乙酰辅酶A和NADPH的生成间接影响着蛋白质、脂类、DNA、RNA的合成和胞内氧化还原稳态的维持,同时THI80以负反馈的形式调节着硫胺素途径中的THI调节子,保证硫胺素途径的基因在转录水平的动态平衡[20-22]。因此,硫胺素途径与维持细胞稳态和响应胁迫存在必然联系,值得深入研究。
笔者针对所在课题组前期获得的工业菌株酿酒酵母A223热胁迫相关的转录组数据进行深度分析,对差异基因进行功能富集,建立关键代谢途径与细胞稳态调节的相关性,同时挖掘确定了与酵母菌株耐热性相关的硫胺素代谢途径。因此,本研究对得到的硫胺素代谢途径相关基因PDX3、SNZ1、BUD16、THI80和PHO3进行进一步基因敲除、过表达及硫胺素回补实验验证及分析,以期揭示乙醇代谢途径利用硫胺素途径来应对高温胁迫的细胞器调节机制,为丰富酵母细胞抗逆机制的动态变化提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌种
酿酒酵母BY4742 菌株,笔者所在实验室保藏;工业酿酒酵母菌株 CY,中粮集团营养与健康研究所生物技术中心;工业酿酒酵母菌株 A223,实验室前期对工业酿酒酵母CY进行筛选及适应性改良所得到的具有多层次防御系统的耐受菌株,具体的改造包括将多个耐受线路的随机整合到基因组多拷贝位点、常压室温等离子体(ARTP)诱变、自适应进化,再经高通量筛选所得[23]。用于质粒构建的DH5α 大肠杆菌感受态细胞,New England BioLabs公司。用于载体构建的质粒HcKan-P 和HcKan-T ,深圳市高等技术研究院戴俊彪教授惠赠。本研究中用到的菌株和质粒如表1 所示。

表1 本研究所用菌株与质粒
1.1.2 引物设计
本研究所用引物如表 2 所示。
1.1.3 试剂及仪器
酵母提取物、胰蛋白胨、D-葡萄糖、琼脂粉,北京东旭灵美生物科技有限公司;30% H2O2溶液、乙酸溶液,北京化学试剂公司;罗丹明 123 、 D-山梨醇、20 ×磷酸盐缓冲溶液(PBS),索莱宝生物科技有限公司;活性氧检测探针,南京碧云天生物科技公司。
压力蒸汽灭菌器,日本株式会社;PCR 仪,杭州博日公司;紫外酶标仪、全自动凝胶成像系统,美国 Syngene公司;恒温振荡培养箱,德国 Martin Christ公司;紫外可见分光光度计,上海知楚仪器有限公司;Waters 1515型高效液相色谱(配Waters 2414型示差检测器和Aminex HPX-87H色谱柱),Bio-Rad公司。
1.1.4 培养基及其他溶液
YPD培养基(g/L):胰蛋白胨20、无氨基酸酵母氮源10、葡萄糖20;灭菌条件为115 ℃、20 min。若需配制固体培养基,则在灭菌前在液体YPD培养基的基础上加入琼脂粉20 g/L。
1 mol/L山梨醇(g/L):D-山梨醇182.2;灭菌条件为 121 ℃、20 min。
1 mg/L罗丹明123溶液:准确称取1 mg罗丹明123于1.5 mL离心管中,在超净台中加入1 mL二甲基亚砜(DMSO)溶解。
1.2 方法
1.2.1 转录组分析
对在高温、高糖双重胁迫条件下(37 ℃、200 g/L葡萄糖)培养的菌株 A223选取10和24 h这2个时间点进行 RNA-Seq测序分析。本次测序使用华大公司DNBSEQ平台,将所测数据进行质控,去除低质量、接头污染以及未知碱基N含量过高的reads后得到clean reads,再分别利用序列比对软件HISAT和Bowtie2将参考基因组序列与参考基因序列进行比对。最后,通过检测平台一共得到5 897个基因,对这些基因进行定量分析、基于基因表达水平的各项分析,再对筛选出的样品间差异表达基因(DEGs)进行pathway显著性富集分析。使用软件RSEM计算各个样品的基因表达水平,筛选DEGs条件为校正后的Q值<0.05且|log2(差异倍数)|>1。
1.2.2 菌株构建
基因片段的构建使用表2所列的相关引物,以BY4742基因组DNA为模板分别扩增长度为600 bp左右目标敲除基因的上下游片段(用作同源重组左右臂)SNZ1L(L-left)、SNZ1R(R-right),PDX3L、PDX3R,BUD16L、BUD16R,THI80L和THI80R,以T 载体为模板,分别扩增相应的G418表达盒。

表2 本研究所用引物
将纯化后的目标敲除基因的上下游片段分别与G418表达盒进行OE PCR连接扩增,最后得到SNZ1L-G418-SNZ1R、PDX3L-G418-PDX3R、BUD16L-G418-BUD16R和THI80L-G418-THI80R。以SNZ1L/R、PDX3L/R、BUD16L/R和THI80L/R部分作为同源融合片段,用电转化的方法将所构建基因片段导入BY4742 菌株进行同源重组,在添加 3 g/L G418 抗生素的YPD 平板上培养后,利用验证引物筛选阳性克隆。
过表达菌株的构建以BY4742基因组DNA为模板,用表2所列引物分别扩增目标基因片段PHO3、PDX3、BUD16和THI80,启动子TDH3p,终止子CYC1t以及同源整合位点的左右臂HOL/R,将纯化后的基因片段进行 OE PCR 连接扩增,得到表达盒TDH3p-PHO3-CYC1t、TDH3p-PDX3-CYC1t、TDH3p-BUD16-CYC1t和TDH3p-THI80-CYC1t。将上述基因表达盒分别与整合位点的左右臂、G418 表达盒进行OE PCR连接扩增,最后得到HOL-TDH3p-PHO3-CYC1t-G418-HOR、HOL-TDH3p-PDX3-CYC1t-G418-HOR、HOL-TDH3p-BUD16-CYC1t-G418-HOR和HOL-TDH3p-THI80-CYC1t-G418-HOR。HOL/R部分作为同源融合片段,利用电转化的方法将所构建基因片段导入BY4742菌株进行同源重组,在添加3 g/L G418抗生素的YPD平板上培养后,利用验证引物筛选阳性克隆。
1.2.3 摇瓶发酵
将活化后的一级酿酒酵母种子液按10%(体积分数)接种量转接到含有YPD液体培养基的试管中,在30 ℃、200 r/min条件下培养12~16 h,使大部分酵母细胞处于对数生长期,然后以初始OD600为0.1接种到细口锥形瓶中,使用硅胶塞封闭瓶口以维持微氧发酵条件,前12 h每隔4 h取样检测生物量(OD600),最后在24和36 h时分别取样测OD600。
1.2.4 细胞发酵产物检测
用高效液相色谱(HPLC)法检测葡萄糖、乙醇和副产物甘油的浓度。取1 mL培养36 h的发酵液,12 000 r/min离心1 min后,准确吸取100 μL上层清液转移至装有900 μL蒸馏水的离心管中进行稀释,振荡混匀。将混匀后的溶液通过0.22 μm水系滤膜转移至HPLC进样小瓶。HPLC分析条件:柱温65 ℃、检测器温度50 ℃、流动相5 mmol/L H2SO4、流速0.6 mL/min。
1.2.5 酿酒酵母ROS检测
酵母的ROS含量用2′,7′-二氯荧光黄双乙酸盐(DCFH-HA)法测定。取1 mL培养24 h的发酵液, 5 000 r/min 离心2 min,弃上层培养基。然后吸取1 mL 1×PBS(pH 7.4)重悬细胞,5 000 r/min 离心2 min后弃上清,同样操作步骤重复1次。再准确吸取900 μL 1× PBS重悬酵母细胞并在避光条件下添加已经稀释好的100 μL DCFH-HA 探针,充分混合均匀后,避光染色45 min,将染色后的菌液5 000 r/min离心2 min后弃上清。再吸取1 mL 1×PBS重悬菌体后,5 000 r/min离心 2 min,并重复1次,将重悬后的酿酒酵母菌液取适量体积加入96孔黑色酶标板内,每个样品进行3次平行实验,测其OD600,并以488 nm 的激发和 525 nm 的发射波长测定其荧光强度。
1.2.6 酿酒酵母线粒体膜电位检测
酵母线粒体膜电位变化情况用罗丹明123(Rh123)来检测,荧光强度与细胞膜电位成反比。取1 mL培养24 h发酵液,5 000 r/min离心2 min,弃上层培养基,然后吸取1 mL 1×PBS重悬细胞,5 000 r/min离心2 min,弃上清,同样操作步骤重复1次。再准确吸取950 μL 1×PBS重悬酵母细胞并在避光添加已经稀释好的50 μL 1 mg/L Rh123溶液,充分混合均匀后避光条件下染色20 min,将染色后的菌液,5 000 r/min、离心2min后弃上清。再吸取1 mL 1×PBS重悬菌体,5 000 r/min、离心2 min,并重复1次,将重悬后的酿酒酵母菌液取适量体积加入96孔黑色酶标板内,每个样品进行3次平行实验,测其OD600,并以488 nm的激发和525 nm的发射波长测定其荧光强度。
1.2.7 统计学分析
采用SPSS 19.0软件进行统计学分析,实验数据以Means±SD表示。组间比较使用了最小显著差异(LSD)多重比较方法,P<0.05时,差异有统计学意义,并且用字母法来标注差异显著的有统计学意义的组别。
2 结果与分析
2.1 硫胺素途径的转录组深度分析
笔者所在实验室前期对耐受工业酿酒酵母CY进行了筛选及适应性改良,获得了一株具有多层防御系统的工业菌株 A223[23]。该菌株在中试发酵中表现出较高的细胞活性及乙醇产量。与亲本菌株相比,工程菌株具有明显提高的ROS清除效率、质膜及线粒体膜的完整性,丙二醛含量、细胞凋亡及坏死的比例也大大降低。本研究先对工业菌株 A223培养10和24 h的转录组进行深度分析,总结得到A223 菌株为抵御37 ℃高温胁迫所进行的代谢重塑改变,再比较30和37 ℃条件下相同菌株和相同胁迫条件下不同菌株(A223 和CY)的转录组,构建3个比较组:CY_37 ℃与CY_30 ℃、A_37 ℃与A_30 ℃、A_37 ℃与 CY_37 ℃,其中CY是出发菌株CY,A是A223菌株。在3 个比较组中共鉴定出5 447个DEGs,这些DEGs 经过压力响应基因相关分析,进一步选定了183 个耐受型压力响应基因的DEGs,使用GO 数据库进行生物通路分类和分析,结果见图1(a)和(b)。

图1 硫胺素合成途径相关基因转录水平分析Fig.1 Transcription level analysis of thiamine synthesis pathway related genes
由图1(a)和(b)可知:在37 ℃的胁迫条件下,酵母细胞为降低胁迫环境对细胞器、细胞膜的破坏以及细胞正常生长和代谢的影响,胞内相关代谢基因的转录水平发生了显著变化,有20 个DEGs参与了硫胺素代谢过程(图1(a)),其中 13个基因上调(THI20、THI4、THI5、THI12、BUD16、PDC1、PDC5、THI21、PHO3、THI80、THI3、THI7和THI6),7个基因下调(SNO1、SNO3、PDX3、SNZ1、SNZ2、SNZ3和PDC2)。可见,在胁迫条件下,硫胺素的合成与代谢可能有助于酵母细胞应对不利环境的影响。由图1(b)可以发现,正常生长条件下,硫胺素合成相关基因在A223 和CY 菌株的表达量都不高。除编码吡哆醇磷酸氧化酶PDX3基因外,催化吡哆醛磷酸盐(PLP)到硫胺素焦磷酸(TDP)的相关基因(THI11、THI12、THI13、THI4、THI6和BUD16 等)FPKM 值均小于400,而催化生成PLP 的相关基因(SNZ1、SNZ2和SNZ3)相对于前者表达水平较高,这可能是为了增加硫胺素前体PLP所导致的。PLP 是多种酶促反应必不可少的辅因子,它能参与氨基酸代谢、维生素的代谢、能量代谢、碳水化合物代谢和脂质代谢[24-25]。当菌株受到胁迫压力时,CY和A223的硫胺素合成相关基因在转录水平上的调整是相似的,参与硫胺素前体PLP 生成的部分基因转录上调(如编码吡哆醛激酶的BUD16),这可能会为硫胺素途径上游提供丰富的前体PLP,也会导致多种酶促反应的上调。催化PLP到TDP的大部分基因转录都上调,特别是编码三功能酶(羟甲基嘧啶、磷酸甲基嘧啶激酶、硫胺素酶)的THI20基因[25]。同时,当CY菌株遭受胁迫压力时,调控硫胺素基因表达的转录因子THI3以及催化TDP、硫胺素相互转化的PHO3、THI80基因转录都上调。可见,硫胺素途径在胁迫条件下发生重塑,体现了菌株调动所有资源对硫胺素进行富集,也进一步验证了关于硫胺素的合成与代谢有助于酵母应对胁迫环境的猜想。
在37 ℃条件下,CY和A223菌株生长的前期,丙酮酸代谢途径中的PDC1、PDC5和戊糖磷酸途径中的TKL1都在转录水平发生了上调(图1(b)),因为这些重要代谢作用与升高的 TDP共同参与酵母应激反应,构成了一个复杂且微妙的细胞防御系统[26]。因为丙酮酸途径和戊糖磷酸途径都是受到TDP辅因子调控的糖酵解的下游途径,其中戊糖磷酸途径的产物海藻糖对膜完整性维持有着积极作用,所以内质网和线粒体等膜细胞器的稳态对提高酵母菌株耐受性是至关重要的[13]。同时,具有缓解菌株内稳态作用的氨基酸合成途径基因ILV2的转录水平也显著上调。在工业上广泛应用的耐受性强的酵母中,多达20个硫胺素基因的转录水平发生显著变化,由此可见,硫胺素途径与菌株的耐热性存在潜在联系。
2.2 硫胺素合成相关基因缺失菌株在高温下的调控机制
2.2.1 在高温胁迫下基因缺失菌株的细胞性能
温度是影响微生物正常生长代谢的重要参数之一。提高的菌株耐热性不仅可以使细胞保持较好的生长代谢状态,还可为工业生产节省更多成本。为了表征菌株应对高温胁迫对硫胺素合成关键基因的影响,详细分析缺乏编码硫胺素合成基因的酵母菌株ΔSNZ1、ΔPDX3、ΔBUD16和 ΔTHI80在30和37 ℃下的生长情况,结果见图2(a)和(b)。由图2(a)和(b)可知:在发酵后期缺失菌株的细胞生长均受到抑制,其中ΔTHI80生长抑制效果最明显。因为THI80 编码硫胺素焦磷酸激酶,负责将硫胺素磷酸化形成辅酶TDP,TDP是硫胺素发挥作用的主要活性形式[26],如果TDP缺乏会降低 NADPH,从而影响细胞合成代谢并导致葡萄糖消耗停止[27]。这解释了敲除THI80后菌株的生长受到抑制,可见,这种酶对于细胞的一般代谢功能很重要。同时发现,硫胺素途径中单个基因的敲除对菌株在30和37 ℃条件下的生长无显著影响。

图2 在高温胁迫下硫胺素途径基因缺失菌株的生长曲线与细胞损伤测定Fig.2 Growth curves and cell damage of thiamine gene deletion strains under heat stress
为了探讨硫胺素途径基因的缺失对酵母细胞生长的影响机制,因此对缺失菌株胞内的线粒体膜电位情况、ROS水平进行检测。将突变株ΔTHI80、ΔSNZ1、ΔPDX3、ΔBUD16以初始OD600为0.1分别转接至20 mL YPD培养基中,在30和37 ℃条件下摇瓶发酵24 h 后,利用ROS 检测探针、罗丹明123 荧光染料进行表征,结果见图2(c)和(d)。
事实上,硫胺素参与催化细胞质中的酶促反应,而且线粒体等细胞器是硫胺素作用的场所,所以线粒体参与细胞响应胁迫的代谢网络[22]。当菌株出现不同程度稳态失衡甚至衰老时,就会出现不同程度线粒体膜电位下降的趋势。由图2(c)可知:在30 ℃条件下,菌株ΔTHI80、ΔPDX3的线粒体膜电位分别降低了24.5%和18.2%;当温度为37 ℃时,ΔBUD16菌株的线粒体膜电位极显著降低,检测到的Rh123探针的荧光强度比对照升高1.66倍,ΔSNZ1菌株的线粒体膜电位升高25%,这是因为在37 ℃时,BUD16、SNZ1的敲除会导致酵母细胞线粒体膜完整性受到不同程度的损伤。
SNZ1编码5′-磷酸吡哆醛合酶[24]、PDX3编码吡哆醇磷酸氧化酶[28]、BUD16编码吡哆醛激酶[29],这3个酶都参与催化硫胺素合成途径主要中间产物 PLP的合成。因此,高温条件下的细胞生长抑制可能是无法正常合成硫胺素所导致的。由图2(d)可知:ΔPDX3在37 ℃高温胁迫下的生长活性下降19%,同时菌株在30及37 ℃下对胞内ROS清除能力都显著减弱,导致ROS累积水平分别升高80%和286%。编码吡哆醇磷酸氧化酶的PDX3缺失会导致拟南芥对温度变得敏感,同时还积累大量的5′-磷酸吡哆醇胺(PMP),导致氮代谢受损[30]。在酿酒酵母中,PDX3的缺失导致菌株在含有2 mmol/L H2O2的YPD液体培养基中出现明显的生长缺陷[31]。在本研究中,PDX3的缺失菌株表现为生长迟缓以及ROS清除能力严重受损。对菌株ΔBUD16、ΔSNZ1来说,在30 ℃时胞内ROS累积量分别上升60%、50%,在37 ℃时胞内ROS累积量分别上升277%、217%;特别在37 ℃条件下,菌株线粒体稳态失衡,Rh123含量分别提高167%、26%。PLP缺失会导致DNA 损伤,进而威胁基因组完整性[29],本研究中ΔPDX3、ΔSNZ1和ΔBUD16 菌株的胞内ROS 含量显著增长亦证实该结果。ΔTHI80菌株的细胞损伤可能是TDP的合成受阻造成营养缺乏所导致的。由此可见,硫胺素途径中的PLP和TDP对维持酵母细胞平衡活性氧水平以及调控线粒体稳态的能力十分重要。
2.2.2 回补硫胺素的基因缺失菌株在高温胁迫下的细胞性能分析
为了考察敲除硫胺素途径的基因造成的细胞受损是否由硫胺素缺乏所导致,因此在YPD 培养基中加入400 μg/L硫胺素[14],将ΔTHI80、ΔSNZ1、ΔPDX3和ΔBUD16 菌株在30 和37 ℃摇瓶中发酵并检测细胞生长性能,结果见图3。由图3可知:在正常温度条件下,添加400 μg/L 的硫胺素可以缓解THI80、PDX和BUD16基因缺失造成的细胞生长缺陷,不过ΔSNZ1菌株的生长却受到了抑制;当温度升至 37 ℃时,外源添加硫胺素无法缓解这4株菌的细胞生长缺陷。

图3 添加400 μg/L硫胺素的缺失菌株在高温胁迫下的生长曲线和细胞损伤测定Fig.3 Growth curves and cell damage of thiamine gene deletion strains added 400 μg/L thiamine solution under heat stress
同时发现,在30 ℃条件下,外源添加硫胺素可以缓解ΔTHI80和ΔBUD16菌株的线粒体损伤和维持氧化还原能力,线粒体膜电位水平、胞内ROS含量与相同条件下的对照菌株相比没有显著差别。在相同温度下添加硫胺素,ΔSNZ1菌株的OD600降低了19%,生长被抑制,ROS累积量也提高了123%。SNZ2/3作为SNZ1的旁系同源物,可以满足细胞对5′-磷酸吡哆醛和硫胺素的需求[24],所以可以推测SNZ1基因的缺失所带来的负面影响不仅是缺乏硫胺素所导致的,外源添加的硫胺素也给细胞造成了毒效应,导致菌株生长受阻。当温度升至37 ℃时,外源添加硫胺素无法弥补高温对菌株代谢产生的影响,添加硫胺素后,ΔPDX3和ΔBUD16菌株的线粒体膜电位比相同条件下的BY4742菌株受损严重,Rh123含量分别提高86%和80%,同时胞内ROS含量比BY4742菌株的分别升高81%、130%。由此可见,SNZ1、PDX3和BUD16基因缺失对细胞造成损伤是多种机制共同作用的结果。虽然外源添加硫胺素能缓解30 ℃条件下THI80缺失对菌株造成的损伤,但是不能补偿37 ℃高温胁迫给所有基因敲除菌株带来的影响,说明硫胺素途径的基因THI80缺失通过减少硫胺素合成对细胞生长产生影响。
2.3 过表达硫胺素合成基因菌株在高温胁迫下的调控机制
2.3.1 过表达基因菌株在高温胁迫下的细胞生长及发酵性能
为了考察硫胺素途径的单基因过表达是否能提升细胞生长性能与稳态,因此,对过表达菌株BYTDH3p-PHO3、BYTDH3p-PDX3、BYTDH3p-BUD16和BYTDH3p-THI80分别在 30和37 ℃条件下摇瓶发酵36 h,结果见图4。由图4可知:在正常温度条件下,过表达菌株的生长状态与对照菌株相比没有明显差异;当发酵温度为37 ℃时,过表达菌株的生长活性和乙醇产量也未表现出显著优势。值得关注的是,在37 ℃胁迫下,THI80的缺失没有造成菌株生长活性的显著抑制,但过表达该基因却造成菌株生长进入对数生长期的速度变慢、乙醇的缓慢累积及残糖的缓慢消耗。这可能是由于生物合成硫胺需要磷酸化的步骤较多,且THI80的底物游离硫胺素的合成需要经历两个蛋白质的合成和降解[13],这些都是耗能的过程。由此推断,高温胁迫条件下,过表达THI80过多地占用酵母菌株的能量资源,造成菌株的生长和代谢受损。

图4 过表达基因菌株在高温胁迫下的细胞生长曲线及发酵性能Fig.4 Cell curves and fermentation performance of the thiamine gene overexpression strains under heat stress
2.3.2 过表达基因菌株在高温胁迫下的细胞损伤测定
菌株衰老的标志是线粒体功能下降[32-33],细胞凋亡也伴随着线粒体膜的去极化,因此考察过表达基因菌株在高温胁迫下的细胞损伤情况,结果见图5。由图5可知:在 30 ℃时,过表达PDX3、PHO3、BUD16和THI80的菌株线粒体膜电位分别上升了20%、21%、51%和48%;在 37 ℃时,相应菌株的线粒体膜电位分别上升33%、39%、41%和16%。在 30 ℃条件下,对照菌株与过表达菌株的胞内 ROS 含量没有显著区别;当温度升高为37 ℃后,除过表达PDX3的菌株外,其余菌株的胞内ROS含量都有不同幅度的增加,其中过表达THI80使菌株的胞内ROS含量比对照菌株的提高了101%。
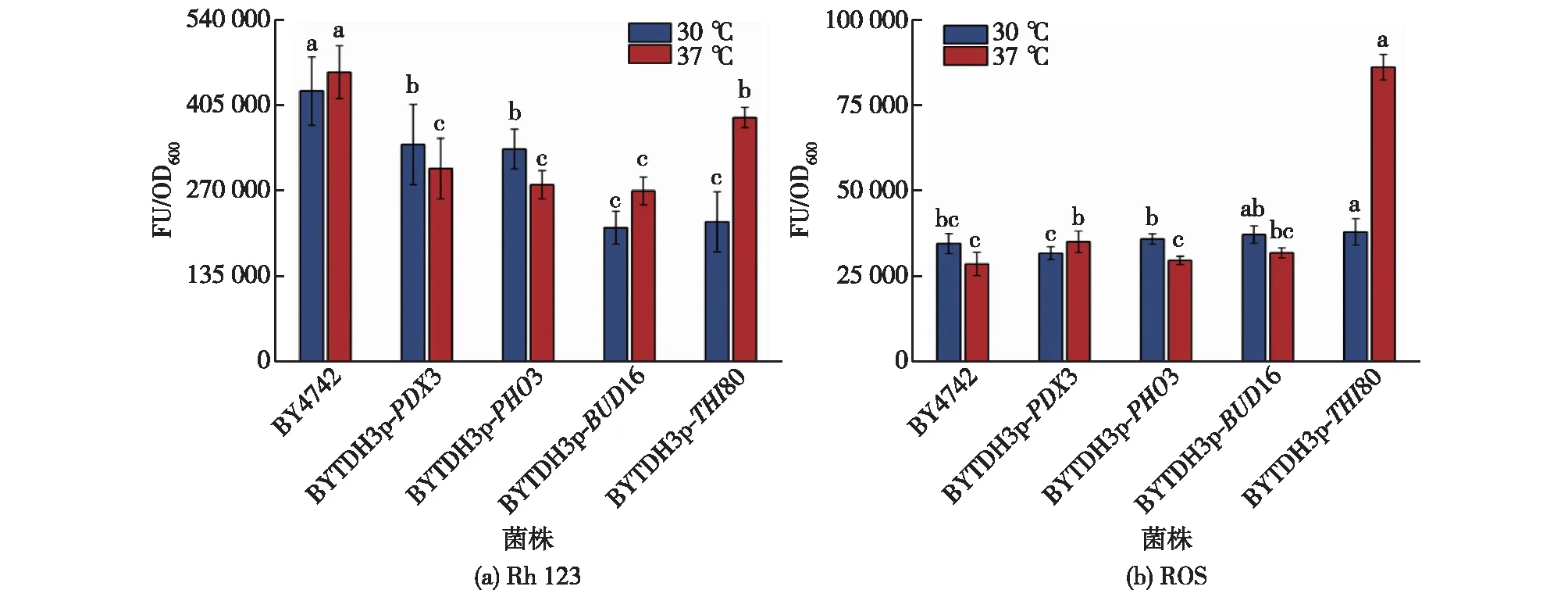
图5 过表达基因菌株在高温胁迫下的细胞损伤Fig.5 Cell damage of thiamine gene overexpression strains under heat stress
在缺乏维生素的情况下,PHO3编码的酸性磷酸酶,在周质空间水解硫胺素磷酸盐,增加细胞对硫胺素的吸收[34]。因为过表达PHO3能加快胞外游离硫胺素进入胞内,而过表达PDX3、BUD16则可提高硫胺素前体PLP的合成,所以过表达这3个基因可通过富集硫胺素途径的上下游关键化合物,有助维持菌株线粒体稳态。THI80编码的硫胺素焦磷酸激酶催化生成的TDP会被转运到线粒体中发挥功能[26],所以过表达THI80 能增强硫胺素与线粒体活性之间的联系,使线粒体稳态有所增强。但是在高温胁迫下,过表达参与硫胺素负反馈机制[35]的THI80则可能会扰乱整个硫胺素途径的动态平衡,使菌株生长活性受到较大影响,导致氧化还原能力下降。总的来说,过表达硫胺素途径的基因PHO3、PDX3、BUD16和THI80对酵母细胞在正常及高温条件下的线粒体的稳态都有显著的增强作用。
2.4 讨论
在乙醇工业发酵过程中,酿酒酵母面临着高温、高乙醇浓度、高渗透压、高黏度及底物毒性等环境胁迫。这些胞外胁迫可以通过不同的方式扰乱蛋白质的活性、细胞膜和代谢途径,并诱发更深层的胞内胁迫,从而导致蛋白质的变性、活性氧的产生、细胞器的损伤和代谢紊乱。近年来,研究人员通过各种非理性和理性手段来提高酿酒酵母的耐受性,如基因组重排、驯化、诱变和CRISPR编辑,在系统水平上人为构建抗胁迫系统等[36-38],但是对耐受性酵母菌株的转录组进行分析并关注差异代谢途径与菌株在胁迫下稳态的联系的研究成果甚少。
本研究基于转录组学和系统生物学对改造后具有多重耐受性的 A223 菌株进行深度分析,发现有20 个DEGs参与了硫胺素代谢过程,其中上调了13个基因(THI20、THI4、THI5、THI12、BUD16、PDC1、PDC5、THI21、PHO3、THI80、THI3、THI7和THI6),下调了7个基因(SNO1、SNO3、PDX3、SNZ1、SNZ2、SNZ3和PDC2)。Nosaka等[39]发现,在酿酒酵母中,硫胺素的合成受到严格控制。从整体上看,菌株在胁迫条件下催化PLP合成TDP 的大部分基因转录上调,这可能是为了增加硫胺素水平,从而帮助酵母细胞应对不利环境的影响。硫胺素途径中众多基因的转录水平发生显著波动,说明该途径与菌株耐受性存在密切联系。
由于线粒体在呼吸作用和氨基酸代谢中起核心作用,且线粒体内部进行的区室特异性代谢反应能帮助酵母适应高温胁迫[40],可见线粒体稳态所介导的细胞器调节对于胁迫环境下的菌株生长是至关重要的。由于SNZ1、BUD16等基因还可能参与调控其他代谢途径,所以敲除硫胺素途径中单个基因使菌株中的代谢平衡受到了扰动,导致菌株的ROS平衡能力显著降低,这无法通过回补硫胺素来缓解。有趣的是,THI80基因的缺失和过表达都会对菌株的性能产生一定的负面影响。同时,Szappanos等[41]发现,THI80催化产生的TDP在野生型菌株中受胞内硫胺素含量动态调控,当硫胺素途径中的前体物质及硫胺素分子累积时,TDP暂时被抑制;当胞内硫胺素含量达到一定程度时,TDP正常分泌,它不仅能与参加氧化应激信号传导的基因相互作用,帮助菌株抵御外界胁迫[41],而且还能以辅因子的形式调控中心碳代谢途径[26],使菌株的生长更好。所以THI80的敲除或过表达都会扰动硫胺素途径的动态调控,造成菌株无法达到最佳生长状态,这个发现尚未见报道。
3 结论
硫胺素途径中单个基因PDX3、SNZ1、BUD16、THI80和PHO3的缺失和过表达,对菌株的生长活性和乙醇产量的整体趋势没有显著影响,但在37 ℃高温胁迫下,基因缺失菌株的线粒体稳态严重失衡,而且过表达这些基因对菌株在30和37 ℃的线粒体稳态则具有显著增强作用,表明硫胺素途径对酵母细胞维持线粒体膜完整性有着直接的影响。特别是催化生成TDP的相关基因THI80的敲除与过表达分别会造成菌株在30与37 ℃条件下的生长抑制与平衡活性氧的能力降低,但THI80缺失对菌株造成的负面影响可以通过外源添加硫胺素来缓解,表明实现硫胺素对菌株胁迫的调控需要对途径基因进行整体的组合调动。
本研究利用生物信息学和系统生物学更加深入地解析了细胞响应胁迫的变化,在转录水平上确定了酵母细胞利用硫胺素途径来应对高温胁迫,并以实验验证硫胺素途径在高温胁迫下对维持线粒体膜稳态有积极作用,为硫胺素途径调控酵母细胞应对高温胁迫的细胞器调节机制提供理论支持。

