基于凋亡小体的药物递送系统研究进展
刘 渝,孙敏捷
(中国药科大学 药剂系,江苏 南京 210009)
细胞外囊泡是细胞释放的一系列具有膜结构的囊泡,包括外泌体、微囊泡以及凋亡小体(apoptotic body)[1]。细胞外囊泡由各种脂质和膜蛋白组成,其中一部分特殊的膜蛋白有助于靶向特定的组织和细胞,而另一部分蛋白则确保将非特异性相互作用降到最低[2-3],这些生理特性赋予了其优异的生物相容性和靶向病灶的能力,使细胞外囊泡能够广泛用于药物递送领域的研究[4-6]。
与活细胞产生的外泌体和微囊泡相比,来源于凋亡细胞的凋亡小体具有更高的产生效率[7]。细胞凋亡是细胞主动将生物分子包装成囊泡的自然过程,基于此,药物可通过此过程高效地装载到凋亡小体中[8-9],所以完整的凋亡小体可作为一种具有潜力的药物递送载体。一些凋亡小体衍生物(如重组凋亡小体[10]、凋亡小体膜修饰的纳米颗粒[11]等)既保留了凋亡小体优异的生理特性,又具有药物递送所需的合适尺寸以及更高的载药效率,这可进一步推动基于凋亡小体的药物递送系统的应用。基于此,本文在概述凋亡小体的形成机制基础上,对近年来基于凋亡小体的药物递送系统的相关研究进行综述,以期为凋亡小体药物递送系统的开发和临床转化提供参考。
1 凋亡小体的形成机制
细胞凋亡是一种保守的程序性细胞死亡方式,通常出现在多细胞生物体中[12],以此维持生物体中正常细胞群体的动态平衡,因此在发育和衰老过程中起着至关重要的作用[13]。这种程序性细胞死亡过程是由多种因素(包括细胞应激、DNA损伤和免疫监视)触发的相关信号通路介导的[14]。在整个凋亡过程中,细胞经历了一系列形态变化,并最终导致凋亡细胞的分解。凋亡细胞的解体分为三个不同的形态学过程,即质膜起泡、形成凋亡膜突起以及最终分解为凋亡小体(图1)[15-16]。
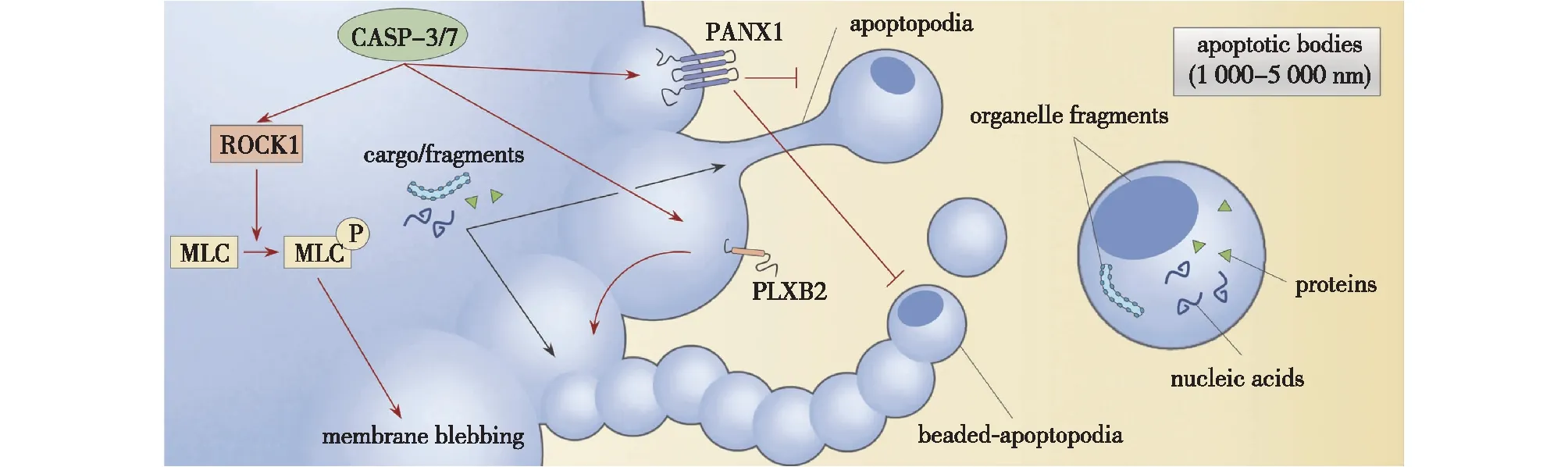
图1 凋亡小体的形成机制[16]Fig.1 Formation mechanism of apoptotic body[16]
1.1 质膜起泡
质膜起泡是凋亡细胞分解的第一步,即在凋亡细胞表面形成大的圆形凸起,这一过程由细胞骨架塌陷和静水压力增加驱动,而肌动球蛋白收缩过程中产生的压缩应力会增加细胞内的静水压力,使细胞溶质从膜附着较弱的区域挤出,最终导致质膜起泡[17]。此过程使得最终形成的凋亡小体保留了丰富的细胞内容物和相关蛋白分子。在分子水平上,质膜起泡过程受多种激酶的调节,包括p21激活激酶2(PAK2)、Lim结构域激酶1(LIMK1)和Rho相关激酶1(ROCK1),其中,ROCK1被认为是质膜起泡过程的关键正调节因子[18-19]。
1.2 凋亡膜突起形成
在质膜起泡后,一些细胞可以继续产生长的凋亡膜突起,称为凋亡足(apoptopodia)和珠状凋亡足(beaded apoptopodia)[20]。凋亡足在质膜起泡后从质膜中被挤出并具有长串状外观,沿这些突起能观察到凋亡小体样结构,可见凋亡足是通过分离膜泡来促进凋亡小体的形成。相比之下,珠状凋亡足由几个连续的凋亡小体连接而成,其长度可以达到亲代细胞的数倍,单个珠状凋亡足的断裂可导致10~20个大小一致的凋亡小体释放,其中每个凋亡小体的直径为1~3 μm[15]。泛连接蛋白-1(PANX1)通道[21]、Plexin B2(PlexB2)受体[22]、细胞骨架网络结构以及囊泡运输过程等[20]参与调节凋亡膜突起的形成。PANX1是凋亡细胞分解过程的关键负调节因子,因为阻断PANX1通道可以促进凋亡小体的形成,进而提高巨噬细胞对于凋亡细胞的吞噬和清除效率,这有利于治疗与凋亡细胞清除缺陷相关的炎症和自身免疫疾病,如系统性红斑狼疮、原发性胆汁性肝硬化等[18,23]。
1.3 凋亡小体形成
凋亡膜突起断裂形成分散的凋亡小体是凋亡细胞分解的最后一步,通常这一过程需要在外部因素(如剪切力、细胞间物理相互作用)和内部因素(如脱落样过程)的协同来完成[13]。调节细胞分解上游步骤的许多因素都会影响凋亡小体的产量。如,通过抑制ROCK1、肌动蛋白聚合以及囊泡运输不仅能抑制质膜起泡或凋亡膜突起形成,而且还能导致凋亡小体的总体产量减少。与之相反,抑制PANX1活性可增强凋亡膜突起的形成,导致随后的凋亡小体数量增加。另外,缺乏LIMK1的细胞在诱导凋亡后产生了更多的凋亡小体[9,18]。
基于目前对凋亡细胞分解过程的机制解析,凋亡小体的形成被认为是一个可干预的生物发展过程,通过抑制或者促进凋亡小体的形成可以获得针对不同疾病的理想治疗结果[16,23]。如,使用抗精神病药物氟哌啶醇抑制凋亡单核细胞分解产生凋亡小体,可以有效减少甲型流感病毒在细胞间的传播,并减轻小鼠模型中流感的严重程度[24]。而PANX1抑制剂,如丙磺舒和羧甲氧苄啶,可以促进凋亡小体的形成,因此可被用于动脉粥样硬化、唐氏综合征等疾病的治疗[23]。
2 凋亡小体在药物递送方面的应用
凋亡小体可以装载一系列细胞内容物(如DNA、RNA和蛋白质等),并将这些物质转移到其他可以吞噬凋亡小体的细胞中,促进细胞间的物质和信息交流,这表明凋亡小体具有作为药物递送载体的巨大潜力。目前,基于凋亡小体的药物递送系统主要分为四类:①完整凋亡小体直接作为药物载体;②重组凋亡小体药物递送系统;③基于凋亡小体原位生成的药物递送系统;④类凋亡小体仿生递送系统。
2.1 完整凋亡小体直接作为药物载体
由于凋亡小体的尺寸效应以及独特的生物学性质,研究者们曾认为其不适合作为药物递送载体,然而最近的研究[25-27]正逐渐推翻这一论断。研究者们利用各种方法(包括紫外照射、药物处理以及饥饿乏氧处理等)诱导细胞凋亡[28-30],并收集产生的凋亡小体来构建载药凋亡小体,这些载药凋亡小体保留了亲代细胞的相关生物学特性,表现出优异的靶向病灶部位的能力。Wang等[31]通过紫外照射联合H2O2刺激诱导预先摄取抗TNF-α反义寡核苷酸(ASO)的B16F10肿瘤细胞产生凋亡小体,构建载有ASO的凋亡小体(sCABs),经研究发现:这些肿瘤细胞来源的凋亡小体表面可高表达细胞黏附分子CD44v6,在CD44v6的介导下,凋亡小体可以高效跨越血脑屏障(BBB);在帕金森症(PD)小鼠模型中,sCABs能有效跨越BBB并通过ASO介导的抗炎作用显著改善PD症状(图2)。同样,载药凋亡小体在肿瘤的靶向治疗中也取得了优异的治疗效果。Zuo等[32]利用X线照射肿瘤细胞产生凋亡微粒,然后通过电穿孔使凋亡微粒负载5-氨基乙酰丙酸己酯盐酸盐(HAL)和3-溴丙酮酸(3BP),成功构建凋亡微粒复合物HAL/3BP@X-MP,结果发现:经尾静脉给药后,HAL/3BP@X-MP可特异性靶向肿瘤细胞,并在HAL和3BP的协同作用下产生优异的光动力治疗效果。
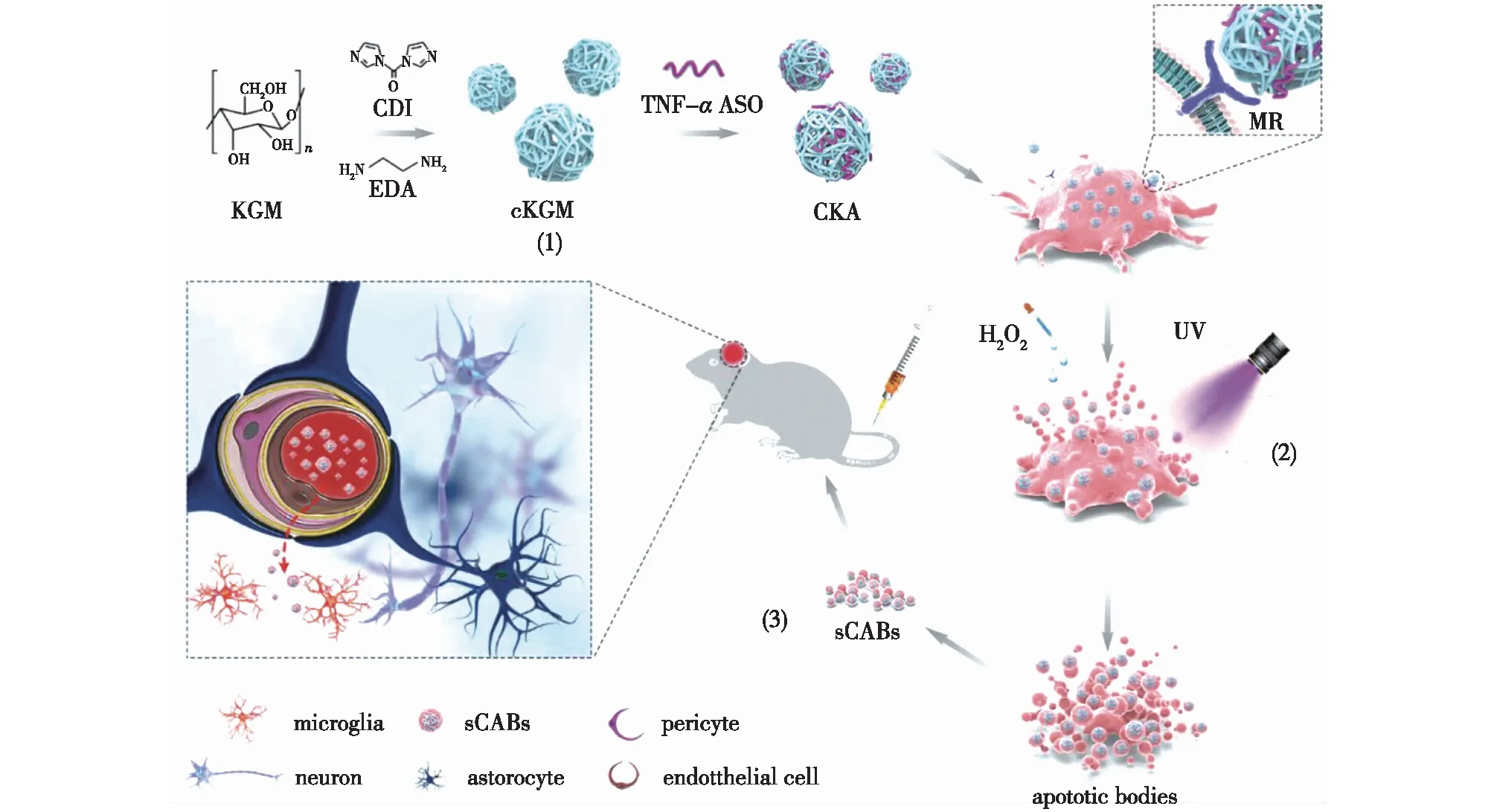
图2 通过肿瘤细胞衍生的小凋亡小体跨血脑屏障递送反义寡核苷酸[31]Fig.2 Delivering antisense oligonucleotides across the blood-brain barrier by tumor cell-derived small apoptotic bodies[31]
一般认为,微米级的凋亡小体很难通过增强渗透滞留(EPR)效应聚集于肿瘤区域,但是可以通过体内“搭便车”效应实现药物的靶向递送。“搭便车”效应是指利用合成的药物载体对体内细胞进行靶向,这些药物载体被内源性细胞吞噬或吸附在细胞表面之后,利用内源性细胞天然的归巢能力,可将药物靶向递送到病灶部位[33-34]。由于凋亡小体表面暴露了大量磷脂酰丝氨酸(PS),这种特殊的磷脂可以作为“吃我”信号被体内专职吞噬细胞(如单核细胞、巨噬细胞等)识别从而促进吞噬细胞对凋亡小体的吞噬[35],然后利用单核/巨噬细胞的肿瘤归巢能力实现负载药物的靶向肿瘤递送。Zheng等[36]开发了一种载有金纳米棒和CpG免疫佐剂的凋亡小体递药平台AuNR-CpG/AB,其尺寸为1~5 μm,经研究发现:AuNR-CpG/AB可被炎性Ly-6C+单核细胞特异性吞噬,然后通过单核细胞天然的肿瘤归巢效应被主动运送至肿瘤部位,这种细胞介导的递送系统能有效将药物靶向递送到肿瘤部位,然后在近红外光照射下高效消融原发肿瘤,并且可以诱发免疫激活效应来抑制肿瘤转移和复发。
不同尺寸的凋亡小体可通过不同的转运途径实现药物的靶向递送,纳米级的凋亡小体可以与传统的纳米药物一样通过EPR效应及同源靶向作用来实现肿瘤或其他疾病的靶向治疗[31,37],而微米级的凋亡小体则可以通过体内“搭便车”的方式将药物递送到靶向部位[36]。可以肯定的是,无论通过哪种转运途径,利用凋亡小体进行药物递送是一种非常有潜力的递药策略。
2.2 重组凋亡小体药物递送系统
为了保留凋亡小体的生物相容性及靶向能力,同时提高载药的效率和稳定性,研究者先将制备的凋亡小体与药物进行混合,然后通过各种力学作用重组凋亡小体并高效负载药物。Bose等[10]通过简单的饥饿策略来诱导肿瘤细胞产生凋亡小体,再将收集的凋亡小体与抗生素万古霉素(vancomycin)混合后并进行超声和冻融处理,最后通过滤膜过滤挤压形成大小均一的负载万古霉素的重组凋亡小体ReApoBds,经研究发现:重组过程显著降低了凋亡小体的尺寸并提高了万古霉素的封装效率;体内外实验结果表明,与游离万古霉素相比,加载万古霉素的ReApoBds能更好地靶向巨噬细胞及肿瘤细胞并有效杀死细胞内的金黄色葡萄球菌(S.aureus)。因此,该策略可用于抗肿瘤治疗引起的细菌感染的治疗(图3)。Zhang等[7]通过化学诱导膜起泡和挤压相结合的方法诱导4T1细胞凋亡产生凋亡小体,并将凋亡小体优化为药物递送所需的合适尺寸,最后通过电穿孔负载皂草素蛋白和抗twist siRNA得到凋亡小体类似物ABA,经研究发现:由于继承了亲代细胞的膜蛋白成分(如CD47和细胞黏附分子),ABA同时具备抗免疫细胞吞噬和同源靶向能力;在4T1肿瘤原位转移模型中,ABA在肿瘤部位显示出较强靶向蓄积能力,并且能够防止肿瘤细胞的增殖和肺转移。
通过不同的诱导方法[38-39]与力学作用[40-42]组合可以制备各种符合需求的重组凋亡小体药物递送系统。这些重组凋亡小体既保留了凋亡小体的生物学特性,又具有高效的药物装载效率和合适的尺寸。更重要的是,通过合理设计制备方法可以快速大规模地生产所需要的重组凋亡小体,这将有助于其进一步临床转化。
2.3 基于凋亡小体原位生成的递送系统
细胞凋亡产生凋亡小体后,不仅可以被专职吞噬细胞吞噬,还可以被邻近细胞吞噬并处理。基于这种邻近效应(neighboring effect),凋亡小体可以在细胞凋亡后将剩余的药物携带至邻近肿瘤细胞中实现药物在肿瘤内的深层渗透[43-44]。Zhao等[45]制备了一种由喜树碱(CPT)和乏氧(hypoxia)激活型前药PR104A组成的前药纳米粒CSSP,结果发现:CPT杀死外部常氧(normoxia)肿瘤细胞以产生凋亡小体,而PR104A保持非活性;剩余药物被凋亡小体有效地输送到内部的深层肿瘤细胞中,在肿瘤深部乏氧环境中PR104A被激活,发挥较强的细胞毒性作用,进一步促进剩余药物的深度渗透(图4)。这种方法增强了凋亡小体的邻近效应,从而放大肿瘤治疗效果。同样,利用凋亡小体的邻位效应也可以实现肿瘤的光动力治疗,Zheng等[46]设计了一种载有光敏剂PpIX前体的淋巴细胞,结果发现:这种淋巴细胞能特异性地积聚在肿瘤组织中,在630 nm激光照射下,淋巴细胞产生含有PpIX的凋亡小体,随即被邻近的肿瘤细胞吞噬,并在第二次激光照射下实现肿瘤的光动力治疗。

图4 凋亡小体介导的细胞间递送以增强药物渗透和整个肿瘤破坏[45]Fig.4 Apoptotic body-mediated intercellular delivery for enhanced drug penetration and whole tumor destruction[45]
因此,通过凋亡小体的邻近效应来实现药物在肿瘤部位的深层渗透,再联用放射治疗、光治疗等方法,是一种非常有前景的肿瘤治疗策略。然而,为了更好地增强纳米药物的肿瘤渗透性,仍需要进一步明确基于邻近效应的细胞间药物传递的具体作用机制,这样有助于我们设计和制备具有针对性的药物递送系统以放大邻近效应,进而提高纳米药物治疗肿瘤的效率并促进其临床应用。
2.4 类凋亡小体仿生递送系统
受吞噬细胞能特异性吞噬凋亡小体的启发,研究者们设计出一系列类凋亡小体仿生纳米药物载体来实现药物靶向巨噬细胞的递送[47-48]。这些仿生纳米药物载体既保留了凋亡小体优异的靶向能力,又具有纳米药物载体易于制备和修饰的优点[49-50]。Dou等[11]利用T细胞来源的凋亡小体膜修饰载药介孔硅纳米粒(MSN),构建了用于按需调节炎症的嵌合凋亡小体CAB,结果发现:MSN预装载抗炎剂(microRNA-21或姜黄素),并用刺激响应分子进行修饰,实现药物的定点释放;CAB能主动靶向炎症区域的巨噬细胞并促进这些巨噬细胞由M1表型向M2表型极化以调节炎症(图5)。通过这种策略,他们已经在动物层面成功实现了包括结肠炎[11]和心肌梗死[51]等在内的多种炎症的有效治疗。然而,在制备凋亡小体膜修饰的纳米粒过程中,很可能会引起部分膜蛋白损失或原本位于凋亡小体膜外侧的靶向分子未展示在颗粒外表面从而降低靶向效率。因此,需要在后续研究过程中对关键靶向分子进行定量分析并不断优化制备过程以最大程度保留凋亡小体膜的靶向能力。

图5 具有天然膜和模块化递送系统功能的嵌合凋亡小体用于炎症调节[11]Fig.5 Chimeric apoptotic bodies functionalized with natural membrane and modular delivery system for inflammation modulation[11]
另一种有效的基于凋亡小体的仿生递送策略是利用PS修饰纳米药物载体[10]。Wu等[52]将PS修饰到载有PPARγ激动剂吡格列酮的脂质体表面,构建了凋亡小体仿生脂质体(AP-Lipo)以实现将吡格列酮靶向递送到动脉粥样硬化区域的巨噬细胞中,结果发现:与未修饰的脂质体相比,AP-Lipo能更有效地识别和穿透活化的血管内皮细胞,靶向动脉粥样硬化斑块,通过上调抗炎巨噬细胞数量,稳定动脉粥样硬化斑块,从而抑制动脉粥样硬化的进程。同样,通过这种策略可将药物递送至肿瘤相关巨噬细胞(TAMs)以实现抗肿瘤治疗。Liu等[53]设计了一种PS修饰的达沙替尼脂质体,靶向并耗竭TAMs,从而提高抗肿瘤疗效。因此,无论是基于凋亡小体膜修饰还是PS修饰的仿生纳米粒,均可以实现针对巨噬细胞的靶向递送,这为炎症以及肿瘤治疗提供了一种新思路。
3 总结与展望
近年来,基于凋亡小体的药物递送系统受到了越来越多研究者的关注,并取得了一系列瞩目的研究成果,为药物的靶向递送提供了新的思路和理念。然而,由于凋亡小体的体内转运机制尚未完全明确以及缺乏统一规范的生产及提纯工艺标准,因此将其广泛应用于药物递送仍需进一步研究。未来我们需要更加深入地研究凋亡小体的生物学特性,阐述凋亡小体的体内转运机制,并开发新的制备方法以提高凋亡小体的稳定性及病灶靶向能力,从而进一步推动基于凋亡小体的药物递送系统的临床转化,使其更好地应用于各种疾病的有效治疗。

