CO2和DIP对浒苔幼苗生长及光合特性的影响
王津果,盛杨杰,4,王续昆,倪嘉璇,武 卉,刘卫国,周 伟*,
(1.江苏海洋大学,江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005; 2.自然资源部滨海盐沼湿地生态与资源重点实验室,江苏 连云港 222005; 3.江苏海洋大学,江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005; 4.汕头大学 理学院,广东 汕头515000; 5. 乳山市牡蛎协会,山东 威海 264500)
0 引言
大型海藻在近海海洋生态系统中发挥着关键作用,例如:为海洋生物提供了多样化的栖息地和繁殖场所;通过光合作用固定CO2,降低大气中CO2的累积[1];大量吸收海水中氮、磷等营养物质,降低海水富营养化程度和有害赤潮的发生几率[2]。然而,有一些广温、广盐性的海藻,因其强大的营养盐吸收能力和高耐受性,会在特定环境下暴发性生长、聚集,引发绿潮[3-4]。绿潮在我国已持续发生15年,为黄海海域常态化的自然灾害之一,对江苏和山东沿海等地的生产、生活产生了诸多不良影响。
浒苔(Ulvaprolifera)是黄海绿潮的常见种,其生活史包括孢子(2n)、配子(n)、合子(2n)、微观繁殖体和藻体等阶段[5]。微观繁殖体泛指只进行营养繁殖的细胞团、单细胞或组织块等,它具有强大的繁殖和抗逆能力,会在条件适宜时出现暴发性生长[5]。浒苔微观繁殖体是绿潮“种子库”,在绿潮暴发的早期阶段发挥着关键作用[5]。

近岸海水中氮、磷等物质的增加会引起海水富营养化,也会对大型海藻生长、光合生理和生化组成产生影响[20-23]。氮、磷浓度的增加能显著提高成体浒苔的相对生长速率、叶绿素荧光参数和净光合速率[22],提高日本糖海带(Saccharinajaponica)的相对生长速率,促进其Chla和可溶性蛋白的合成[23]。有研究发现,相较于氮,磷对温带近岸海域石莼属海藻的生长更为重要[24],并且海水中无机磷酸盐(dissolved inorganic phoshphate, DIP)会与温度、光强等环境因子产生交互作用[20,25]。目前有关磷对绿潮藻生长以及生理生化的研究多针对藻的成体阶段[22-23],针对早期阶段,如微观繁殖体、幼苗的相关研究较少。
选取CO2和DIP两个因子,探索单因子及交互作用对浒苔幼苗生长和光合生理特性的影响,为进一步揭示浒苔绿潮早期暴发原因和绿潮的预警防控提供基础数据和科学支撑。
1 材料与方法
1.1 幼苗来源及培养条件
含浒苔微观繁殖体的海水于2021年3月29日采自江苏省南通市小洋口附近海水养殖场(121°09′73.45″E,32°33′50.06″N)。用孔径200 μm筛绢过滤,去除海水中的藻丝体和大型浮游植物,低温避光带回实验室。取过滤水样50 mL置于灭菌烧杯中,加Provasoli培养基[26]和GeO2以抑制硅藻的生长,置于培养箱(GXZ-500C,宁波江南)中,通空气培养3周,控制温度为15 ℃、光合有效辐射为100 μmol·m-2·s-1、光周期为12 L∶12 D。实验开始时,幼苗高度为0.8~1.0 cm。
1.2 实验设计
实验设置CO2和DIP 2个因子,其中CO2分别为400 μatm(LC)和1 000 μatm(HC)2个水平,3个DIP梯度:0.32 μmol·L-1(LP)、3.62 μmol·L-1(MP)和36.2 μmol·L-1(HP)。实验共设6个不同的CO2和DIP组合(LCLP: CO2400 μatm和DIP 0.32 μmol·L-1; LCMP: CO2400 μatm和DIP 3.62 μmol·L-1; LCHP: CO2400 μatm和DIP 36.2 μmol·L-1; HCLP: CO21 000 μatm和DIP 0.32 μmol·L-1; HCMP: CO21 000 μatm和DIP 3.62 μmol·L-1; HCHP: CO21 000 μatm和DIP 36.2 μmol·L-1),每个组合设3个平行,以LCMP 处理组(CO2400 μatm和DIP 3.62 μmol·L-1)为对照组。
LC为正常大气CO2水平,通过直接向光照培养箱泵入空气实现,HC通过CO2植物培养箱(HP1000 G-D,武汉瑞华)来控制。DIP浓度通过NaH2PO4来调节。取(0.20±0.01)g幼苗置于550 mL通气培养瓶中,瓶中装500 mL灭菌海水(用0.45 μm滤膜过滤),按 1∶100 的比例添加Provasoli培养基[26]。培养瓶置于相应植物培养箱培养14 d,培养箱温度为15 ℃、光合有效辐射为100 μmol·m-2·s-1,每2天添加1次培养基。
1.3 海水碳酸盐系统参数的测定
采用pH计(Seven Easy,Mettler Toledo)测定pH值,总碱度(total alkalinity,TA)根据Barakat滴定法测定[12],其他海水碳酸盐系统参数根据TA和pH值计算得到[23]。
1.4 相对生长速率的测定和计算
每2天测定一次藻体质量。用镊子取出藻体,吸水纸轻轻吸干表面水分,快速称重。相对生长速率(relative growth rate,RGR,%·d-1)计算公式如下:
RGR=100%×[ln(mt/m0)]/t
(1)
式中:mt为第t天藻体的质量,m0为实验开始时(第0天)藻体的质量,t为培养天数。
1.5 叶绿素荧光参数的测定和计算
采用手持式PAM叶绿素荧光仪(AquaPen AP-P 100 Chech,捷克)测定不同光合有效辐射(photosynthetically active radiation,PAR)下的有效光合量子产率[effective quantum yield,Y(II)]。根据PAR和Y(II) 计算相对光合电子传递速率(relative electron transfer rate,rETR),公式如下:
rETR=Y(II)×0.5×PAR
(2)
式中:Y(II)指光系统II的有效光合量子产率;0.5为光系统II吸收的光量子占总光量子的比例;PAR分别为0,10,20,30,100,300,500和1 000 μmol·m-2·s-1。
对PAR和rETR值进行拟合,获得快速光响应曲线[27],计算最大相对光合电子传递速率(maximum rETR,rETRmax)、光能利用效率(light utilization efficiency,α)及饱和光强(saturation light intensity,Ek),公式如下:
rETR=PAR/(a×PAR2+b×PAR+c)
(3)
式中:a、b、c为拟合参数。
rETRmax=1/[b+2×(a×c)1/2]
(4)
α=1/c
(5)
Ek=rETRmax/α
(6)
1.6 呼吸速率和净光合速率的测定和计算
将藻体剪成1 cm左右的小段,在培养条件下适应1 h以上,减小机械损伤造成的误差。在反应槽中加入8 mL纯水,充分搅拌20 min,使其达到氧饱和,温度控制在20 ℃。称取约0.01 g藻体,在黑暗环境中适应20 min,置于含8 mL培养基的反应槽中待测。反应槽避光,采用液相氧电极(YSI 5300A,美国)测定溶解氧百分比值,每间隔1 min测定一次并记录数值,当连续3次测定数值变化幅度在0.1%~0.2%时,停止测定。根据GAO et al[28]的方法计算呼吸速率(Rd,μmol·g-1·h-1),公式如下:
Rd=(0.284×60×△d×8)/m
(7)
式中:0.284为 20 ℃时水中氧气的饱和溶解度,60为时间单位转换进率,△d代表稳定后每隔1 min溶解氧百分比差值的平均值,8为反应槽中的培养基体积,m为藻体的质量。
同样采用液相氧电极测定培养条件下(PAR为100 μmol·m-2·s-1)反应槽中溶解氧百分比值,每隔1 min测定一次并记录数值,当连续3次数值变化幅度在0.1%~0.2%时,停止测定。根据GAO et al[28]方法计算净光合速率(Pn,μmol·g-1·h-1):
Pn=(0.284×60×△d×8)/m
(8)
1.7 色素的测定和计算
称取0.05 g藻体置于离心管中,加入5 mL无水甲醇,于冰箱(4 ℃)中放置12 h,离心,取上清液,用分光光度计分别测定666 nm、653 nm、470 nm波长下的吸光度值。根据各波长下的吸光度值计算叶绿素a(chlorophylla,Chla)、叶绿素b(chlorophyllb,Chlb)、类胡萝卜素(cartenoids,Car)的含量[29],公式如下:
wChl a=15.65A666-7.34A653
(9)
wChl b=27.05A653-11.21A666
(10)
wCar=(1 000A470-2.86wChl a-129.2wChl b)/221
(11)
式中:wChl a为Chla的含量;wChl b为Chlb的含量;wCar为Car的含量;A666、A653、A470分别为666 nm、653 nm、470 nm波长处的吸光度值。
1.8 数据统计及分析
采用Origin 9.1软件进行作图和统计分析。分别用K-S检验和Levene检验数据的正态性和方差齐性。利用单因素方差分析和Turkey’s多重比较检验CO2和DIP处理组间的差异显著性,利用双因素方差分析检验CO2和DIP的交互作用对浒苔幼苗生长、生理的影响,以p<0.05作为差异显著性水平。
2 结果与分析
2.1 CO2和DIP对海水碳酸盐系统的影响


表1 不同处理组的海水碳酸盐系统参数
2.2 CO2和DIP对相对生长速率的影响
CO2和DIP对浒苔幼苗RGR均有显著影响(p<0.05),但二者交互作用不显著(p>0.05)。如图1所示,在同一CO2水平下,RGR随着DIP升高增加;相同DIP培养条件下,HC处理组RGR高于LC处理组,随着DIP浓度增加,组间的差异增大。其中,在LP、MP培养条件下,不同CO2处理组间差异不显著(p>0.05),在HP培养条件下,HC处理组RGR显著高于LC处理组(p<0.05),增幅为11.75%。

图1 不同处理下浒苔幼苗的相对生长速率
2.3 CO2和DIP对荧光参数的影响
双因素方差分析显示,CO2对浒苔幼苗Y(II)没有显著影响(p>0.05),DIP对其存在显著影响(p<0.05),二者交互作用显著(p<0.05)。如图2所示,Y(II)随着DIP增加而升高,在HP培养条件下达到高值0.76±0.01(LC)、0.74±0.02(HC),比在LP条件下分别提高了22.58%、15.63%。

图2 不同处理下浒苔幼苗的有效光合量子产率
通过快速光响应曲线(图3)可以看出,各处理组的rETR均表现为先随PAR的增加而升高,后逐渐趋于平稳的趋势,其中,LCHP和HCHP组的rETR值较高。由该曲线计算得出的rETRmax、α和Ek,如表2所示。CO2和DIP对rETRmax存在显著交互作用(p<0.05),对α、Ek的交互作用不显著(p>0.05)。在同一CO2水平下,rETRmax、α、Ek均随着DIP浓度的增加而升高,CO2水平显著影响rETRmax与Ek(p<0.05),但对α影响不显著(p>0.05)。在LP培养条件下,HC处理组的rETRmax、Ek水平显著低于LC处理组(p<0.05),降幅分别为21.81%、27.52%;在MP、HP培养条件下,CO2对二者的影响均不显著(p>0.05)。

图3 不同PAR下浒苔幼苗的相对光合电子传递速率

表2 不同处理下浒苔幼苗的最大相对光合电子传递速率(rETRmax)、光能利用效率(α)与饱和光强(Ek)
2.4 CO2和DIP对净光合速率和呼吸速率的影响
CO2和DIP单因子对Pn的影响显著(p<0.05),但二者交互作用对其影响不显著(p>0.05)。如 图4a 所示,Pn随着DIP浓度的增加而升高;同一DIP浓度下,HC处理组的Pn值均高于LC处理组,其中,高DIP浓度(HP)下的两CO2处理组间的差异显著(p<0.05)。
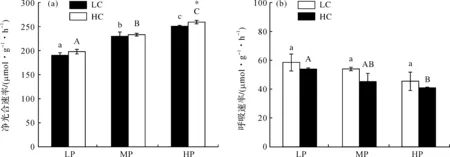
图4 不同处理下浒苔幼苗的净光合速率(a)和呼吸速率(b)
DIP对Rd存在显著影响(p<0.05),但CO2以及交互作用对其影响不显著(p>0.05)。图4b显示,同一CO2水平下,Rd随DIP浓度的增加而降低。LC条件下,不同DIP处理组间的Rd差异不显著(p>0.05);HC条件下,LP处理组的Rd值最高,为53.82±0.66 μmol·g-1·h-1,与MP处理组无显著性差异(p>0.05),但显著高于HP处理组(p<0.05),增幅为32.04%。
2.5 CO2和DIP对色素的影响
CO2、DIP单因子和二者交互作用均显著影响浒苔幼苗的Chla、Chlb和Car的含量(p<0.05)。如图5a所示,同一CO2水平下,Chla含量随着DIP浓度的增加而升高,其中,在HP条件下,LC和HC处理组Chla含量均达到高值(0.98±0.05 mg·g-1,0.61±0.06 mg·g-1),二者间存在显著差异(p<0.05);在MP条件下,HC处理组的Chla含量比LC处理组下降26.19%;在LP条件下,LC和HC处理组间的Chla含量没有显著差异(p>0.05),分别为0.10±0.04 mg·g-1和0.07±0.01 mg·g-1。

图5 不同处理下浒苔幼苗的叶绿素a(a)、叶绿素b(b)与类胡萝卜素(c)含量
Chlb、Car呈现出与Chla相同的变化趋势(图5b,5c)。同一CO2水平下,随着DIP浓度的增加,色素含量升高;在MP、HP条件下,HC处理组的Chlb和Car含量显著低于LC处理组(p<0.05);在LP条件下,LC和HC处理组间差异不显著(p>0.05)。
3 讨论

磷是大型海藻生长所需的关键因子,它既是遗传物质核酸的重要组分,也是光合磷酸化过程中三磷酸腺苷(ATP)形成的关键元素[34-35]。XU et al[21]研究发现,当DIP浓度由0.5 μmol·L-1增加到40.5 μmol·L-1时,钝马尾藻的净光合速率增加近1倍。在本研究中,高浓度DIP(HP)使浒苔幼苗的净光合速率较对照组(MP)增加了10%左右(图4a),同时,有效光合量子产率(图2)、最大相对光合电子传递速率和光能利用效率(表2)也均有提高,表明DIP升高促进了浒苔幼苗的光合作用,对其生长有利。并且,本研究中DIP浓度增加促进了幼苗色素的合成(图5),与其他藻类如石莼属[9,36]、钝马尾藻[21]、日本糖海带[23]等的研究结果一致,这些研究认为高浓度DIP可能刺激一些与色素合成相关酶的生成[21]。
CO2和DIP的交互作用对生长和光合生理特性的影响在其他大型海藻中也有研究,如二者协同影响龙须菜、缘管浒苔的相对生长速率、净光合速率、光合色素和蛋白质含量[9,13]。本研究结果显示,CO2和DIP对相对生长速率、净光合速率、呼吸速率等指标的交互作用不显著,但CO2或DIP单因子对3个指标的影响均显著。高CO2水平和DIP在抑制幼苗的呼吸速率的同时提高其光合速率,从而对生长起到促进作用。另外,幼苗的饱和光强随DIP的增加而升高,随CO2的升高而降低,这与南方石莼(U.australis)[37]、条斑紫菜(Pyropiayezoensis)的结果不同[38],表明CO2和DIP对大型海藻的交互作用存在种属特异性。
4 结论
本文研究了CO2和DIP对浒苔微观繁殖体发育而来的幼苗的生长和光合生理特性的影响,结果表明,高CO2水平提高了幼苗的相对生长速率、净光合速率和光能利用效率等指标,抑制Chla、Chlb和类胡萝卜素合成;高DIP浓度显著提高了相对生长速率、净光合速率、最大相对光合电子传递速率、光能利用效率、饱和光强及色素含量等指标,抑制其呼吸速率。综上所述,高CO2水平和DIP浓度会促进浒苔幼苗的生长,为浒苔绿潮的暴发提供有利条件。未来海洋酸化和富营养化的环境可能会使浒苔绿潮暴发的可能性增加。

