CpG-ODN DSP30联合IL-2刺激在慢性B淋巴细胞增殖性疾病细胞遗传学检测中的临床价值
贾晓冬,李建伟,毛 翠
1.天津金域医学检验实验室有限公司细胞遗传室,天津 300392;2.广州金域医学检验集团股份有限公司实验室管理中心,广东广州 510005
慢性B淋巴细胞增殖性疾病(B-CLPD)是一组可累及骨髓和外周血的成熟B淋巴细胞克隆增殖性疾病,其中慢性淋巴细胞白血病(CLL)是临床最为常见的一类B-CLPD。细胞遗传学分析对B-CLPD的诊断、危险分层、预后判断及诊疗方案选择均具有重要意义,但由于常规细胞遗传学(CC)获取的成熟B淋巴细胞有丝分裂指数低,进而导致疾病检出率低,且荧光原位杂交(FISH)只能检测特异位点的异常,不能全面分析染色体异常,因此,B-CLPD的诊断与鉴别诊断一直是国内临床工作的难点[1-2]。有研究发现,未甲基化胞嘧啶鸟嘌呤二核苷酸寡脱氧核苷酸(CpG-ODN)刺激CLL细胞增殖,可明显提高染色体核型培养成功率和染色体核型异常检出率[2-5],但未对非CLL的其他B-CLPD进行相关研究。因此,为提高CLL及其他B-CLPD患者的疾病检出率,本研究进一步探讨了CpG-ODN DSP30联合IL-2作为刺激剂对CLL和非CLL的其他B-CLPD的染色体核型培养成功率和染色体核型异常检出率的影响,现报道如下。
1 资料与方法
1.1一般资料 选取2020年1月至2021年6月天津金域医学检验实验室初诊的491例B-CLPD患者作为研究对象,将240例CLL患者作为CLL组,男168例,女72例;中位年龄67岁。将251例非CLL的其他B-CLPD患者作为non-CLL组,男149例,女102例;中位年龄66岁。CLL及非CLL的其他B-CLPD患者诊断符合《血液病诊断及疗效标准(第4版)》[6],患者均通过流式细胞术检测到单克隆成熟B淋巴细胞,根据英国马斯登皇家医院免疫标志积分系统[7]进行分类,CLL患者积分为4~5分,非CLL的其他B-CLPD患者积分低于3分,积分为3分时进行FISH 检测并参考其他相关检测以排除套细胞淋巴瘤(MCL)等。
1.2仪器与试剂 光学显微镜BX41购自奥林巴斯株式会社;二氧化碳培养箱MCO-18AC购自日本松下电器产业株式会社;BSL-2生物安全柜BSC-1500ⅡB2-X购自济南鑫贝西生物技术有限公司;医用离心机JW-1048购自安徽嘉文仪器装备有限公司;数显恒温水箱HH-W21-600购自常州澳华仪器有限公司;电热鼓风干燥箱DHG-9140A购自上海一恒科学仪器有限公司;Metasystem染色体自动扫描分析系统购自卡尔蔡司光学(中国)有限公司。冰醋酸购自国药集团化学试剂有限公司;Gibco培养基和胰酶均购自美国赛默飞世尔科技有限公司;CpG-ODN DSP30、IL-2和秋水仙素均购自上海乐辰生物科技有限公司;DSP30碱基序列为TCGTCGCTGTCTCCGCTFCTTCTTGCC;低渗液为0.075 mmol/L氯化钾溶液,均购自国药集团化学试剂有限公司;固定液为冰醋酸和甲醇,按照1∶3进行配制,均购自国药集团化学试剂有限公司;Giemsa染色液购自珠海贝索生物技术有限公司。
1.3方法
1.3.1染色体培养与制备 采用牛鲍氏计数板对骨髓细胞进行细胞计数,将每例患者标本分为2份,分别为实验组和对照组,按照1×106/mL细胞密度种入含8 mL Gibco培养液的培养瓶中,同步进行培养。实验组加入100 μL CpG-ODN DSP30和IL-2刺激剂(浓度为2 μmol/L),对照组不加刺激剂。实验组和对照组均放入37 ℃、5% CO2培养箱,对照组培养48 h,实验组培养72 h。完成培养后加入20 μg/mL秋水仙素0.05 mL孵育2 h,收集细胞,进行制片、染色。
1.3.2染色体核型分析 采用Metasystem染色体自动扫描分析系统分析,每份标本分析20个以上染色体处于中期分裂相的培养细胞。核型异常根据文献[8]进行详细描述。1个异常克隆需满足以下条件之一:(1)≥2个细胞有同样的染色体数目增加或结构重排;(2)≥3个细胞有同样的染色体数目减少。在CLL中,3个或4个不相关的染色体畸变定义为复杂核型(CK),5个或5个以上的异常(+ 12、+19和其他与预后良好相关的异常除外)定义为高水平复杂核型(high-CK)。
1.4统计学处理 采用SPSS22.0统计软件进行数据分析处理。计数资料以例数或百分率表示,组间比较采用χ2检验,当单组n<5时采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1染色体核型培养成功率和异常检出率比较 在240例CLL患者和251例非CLL的其他B-CLPD患者中,实验组染色体核型培养成功率及异常检出率均明显高于对照组,差异均有统计学意义(P<0.05)。见表1、图1。进一步分析发现,在采用CpG-ODN DSP30联合IL-2刺激后,CLL患者与non-CLL患者染色体核型培养成功率及异常检出率比较,差异均无统计学意义(P>0.05)。
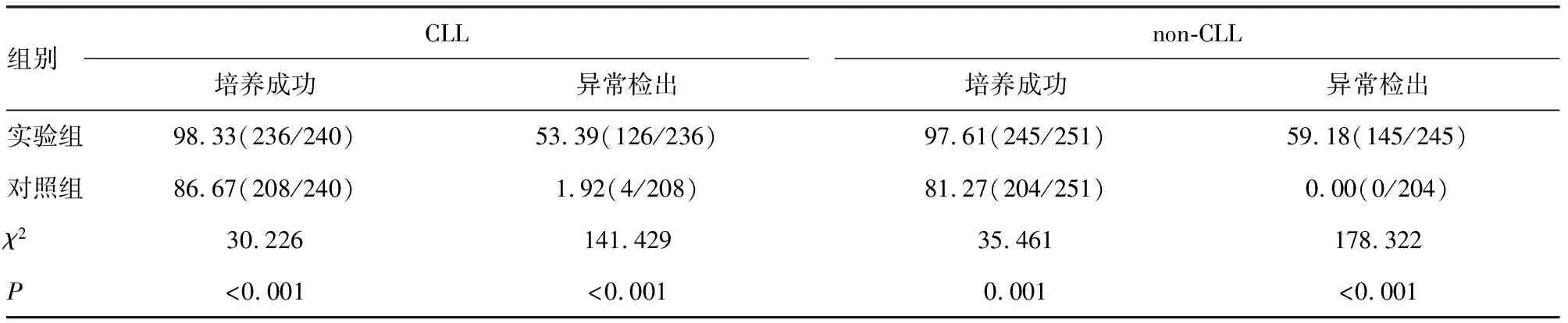
表1 实验组和对照组CLL和non-CLL患者染色体核型培养成功率和异常检出率比较[%(n/n)]
2.2CLL组和non-CLL组采用CpG-ODN DSP30联合IL-2刺激后染色体核型异常检出情况比较 进一步比较CLL组和non-CLL组采用CpG-ODN DSP30联合IL-2刺激后染色体核型异常检出情况,包括染色体数目异常和结构异常。结果显示,non-CLL组high-CK及CK比例均明显高于CLL组,差异均有统计学意义(P<0.05)。见表2。CLL组常见的染色体核型异常由高至低依次为+12、13q-、abn(17p)、14q32(IGH)重排、11q-、6q-等,而non-CLL组常见的染色体核型异常由高至低依次为IGH重排、6q-、+12、7q-、13q-、abn(17p)、+3、+18等。与CLL组比较,non-CLL组更易出现IGH重排、6q-、7q-、+3及+18,见图2。
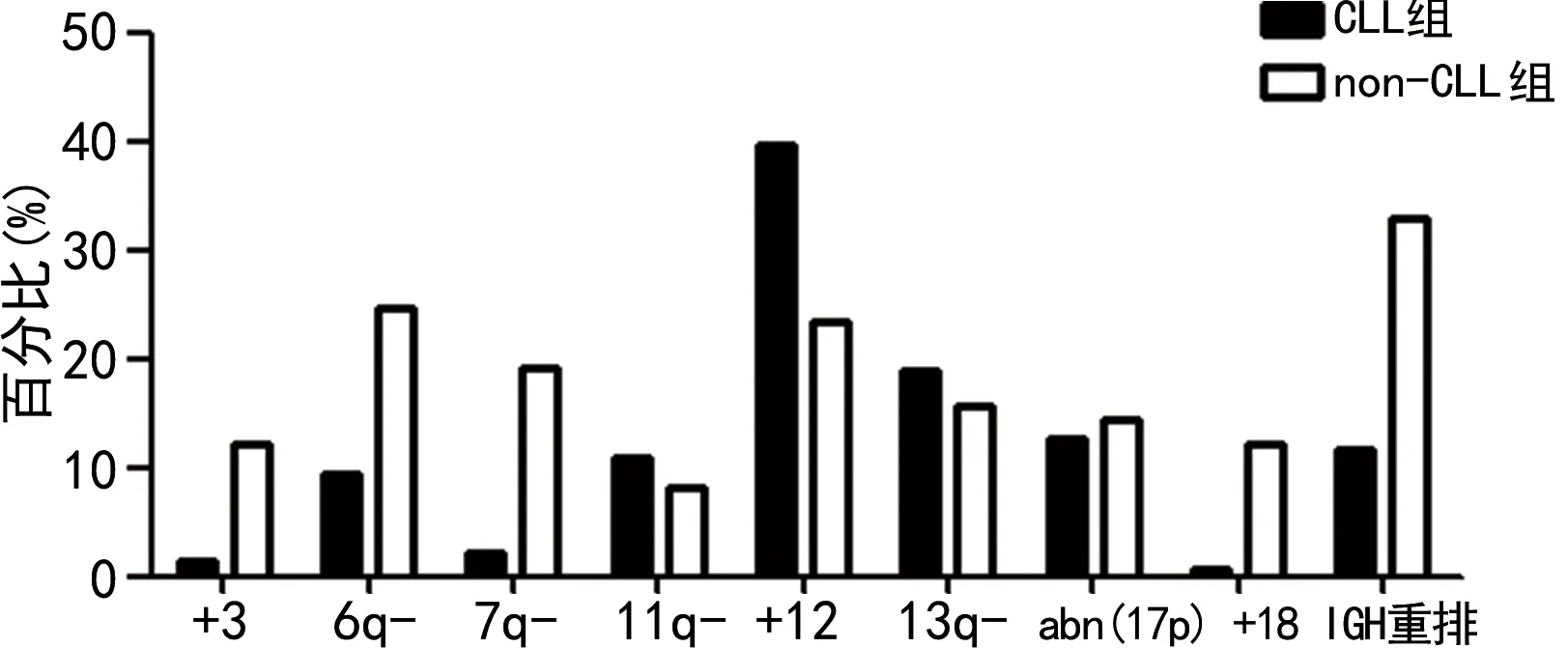
图2 CLL组和non-CLL组常见的染色体核型异常检出情况比较

表2 CLL组和non-CLL组使用CpG-ODN DSP30联合IL-2刺激后染色体核型异常检出率比较[%(n/n)]
3 讨 论
B-CLPD的细胞遗传学异常对于判断疾病进展、评价临床预后及制订治疗方案等均具有重要临床意义。细胞遗传学分析是检测细胞遗传学异常的常用方法,但由于成熟B淋巴细胞属于终末分化期B细胞,增殖分化能力差,大多数处于分裂间期,常规培养不易获得中期分裂相。目前,已有研究探讨了各类刺激剂对提高常规培养中B淋巴细胞中期分裂相获得率的不同影响,包括脂多糖、美洲商陆有丝分裂原及植物血凝素(PHA)等,但这些刺激剂对染色体核型异常检出率的提升效果不佳[8-10]。因此,寻找合适的刺激剂对提升染色体核型培养成功率及异常检出率均具有重要临床意义。
现有研究表明,人工合成的CpG-ODN DSP30能够直接激活B淋巴细胞,提高其增殖能力和细胞因子的分泌速率[9-10]。有研究发现,IL-2具有抗凋亡作用,可促进成熟B淋巴细胞增殖、分化,从而提高中期细胞培养成功率[11]。因此,CpG-ODN DSP30联合IL-2可以刺激成熟B淋巴细胞有丝分裂,从而可以提高B淋巴细胞染色体核型培养成功率及异常检出率。多项研究发现,CpG-ODN联合IL-2共同刺激B淋巴细胞可将染色体核型异常检出率提高至64%~83%[4-5,10-13]。王冬梅[14]等应用CpG-ODN DSP30及IL-2刺激对115例CLL患者的骨髓标本培养后进行R显带分析,其染色体核型培养成功率为74.8%,异常检出率为58.1%。买地娜·艾尔肯等[15]应用PHA、CpG-ODN DSP30联合IL-2刺激剂对82例CLL患者的骨髓标本进行培养制片,其染色体核型培养成功率分别为90.2%和68.3%,异常检出率分别为13.5%和46.4%。有研究发现,CpG-ODN DSP30和IL-2联合刺激对于CLL的细胞遗传学分析效果极佳,但对于非CLL的其他B-CLPD研究仍涉及较少[10-13]。本研究进一步探讨在CLL及非CLL的其他B-CLPD的细胞遗传学分析诊断中使用CpG-ODN DSP30联合IL-2刺激对疾病染色体核型检测的影响发现,CLL和非CLL的其他B-CLPD患者骨髓细胞经CpG-ODN DSP30和IL-2联合刺激培养的染色体核型培养成功率分别为98.33%和97.61%,异常检出率分别为53.39%和59.18%。本研究与国内之前报道比较,新增了对非CLL的其他B-CLPD的对照研究,且增加了病例数,染色体核型培养成功率及异常检出率均明显提高,染色体核型培养成功率接近或高于部分国外数据,但异常检出率相比国外数据稍低,考虑是因为种族差异及地域差异因素影响[10-13]。
B-CLPD是一组异质性很强的疾病,已有研究表明,染色体核型分析对B-CLPD患者诊断、准确危险分层、评估预后及制订治疗方案等方面均具有重要临床意义[9]。本研究发现,CLL组常见的染色体核型异常为+12、13q-、abn(17p)、IGH重排、11q-、6q-等;non-CLL组常见的染色体核型异常为IGH重排、6q-、+12、7q-、13q-、abn(17p)、+3、+18。既往有文献报道,+12是CLL中最频繁的染色体畸变[16],与本研究结果一致,常与不典型CLL细胞形态和免疫表型有关,但出现+12的CLL患者生存期与正常核型患者无差异。单纯13q缺失预后较好,生存期长,不需要过多治疗[17]。abn(17p)往往提示存在p53基因缺失,在疾病复发或恶性进展时其水平较高,疾病进展较快,患者预后差,生存期短[15]。本研究发现,CLL组检出CK患者占9.52%,high-CK占12.70%,而non-CLL组检出CK占21.38%,high-CK占33.79%。既往研究发现,CK与CLL患者不良预后相关,特别是high-CK与CLL中不良预后和对治疗(包括新药物)的不良反应有关[18]。而在B-CLPD患者中,多由特定和常见的染色体易位来解除对已知致癌基因的控制,如滤泡性淋巴瘤的t(14;18)(q32;q21)(涉及IGH::BCL2融合基因),伯基特淋巴瘤的t(8;14)(q24;q32)(涉及IGH::MYC),以及MCL的t(11;14)(q13;q32)(涉及IGH::CCND1融合基因),平衡易位在CLL中很少见[19]。
综上所述,CpG-ODN DSP30联合IL2刺激可成为成熟B淋巴细胞染色体培养的首选刺激剂,可明显提高B-CLPD的染色体核型培养成功率及异常检出率,有助于更加全面地检出B-CLPD的遗传学异常,并且在非CLL的B-CLPD患者细胞遗传学检测中同样具有重要价值。与CLL患者比较,非CLL的B-CLPD患者更易出现复杂核型,预后更差,应进一步加强对B-CLPD遗传学复杂性及多样性的认识。
——访欧洲生物刺激剂行业委员会(EBIC)前任主席Giuseppe Natale

