血清SP、MT、HSP70水平与口腔扁平苔藓病损程度及细胞免疫-炎症反应的关系*
汪 静,王 婷,付芳岐△
宝鸡市中心医院:1.口腔科;2.检验科,陕西宝鸡 721000
口腔扁平苔藓(OLP)属于一类慢性炎症疾病,好发于中年女性人群[1]。OLP的发病机制较为复杂,有研究表明,T淋巴细胞介导的细胞免疫功能紊乱及炎症反应在OLP的发病过程中起重要作用[1-2]。有报道显示,血清P物质(SP)、褪黑素(MT)、热休克蛋白70(HSP70)3种物质均参与了多种炎症性和免疫性疾病的进程[3-4]。例如在类风湿关节炎患者中血清HSP70水平较健康人群明显升高,游离HSP70和抗HSP70抗体呈高表达,说明HSP70介导的免疫反应参与了类风湿关节炎的炎症因子激活过程[5]。致炎因子SP可刺激细胞因子、白细胞介素(IL)-1、IL-6的分泌,加重气道炎症反应,从而导致疾病进展[6]。有学者切除小鼠松果体后发现,小鼠胸腺体积和质量均明显减少,而切除松果体并注射MT的小鼠却无明显变化,证实MT参与了胸腺的分化、发育而影响免疫调节[7]。本研究通过检测MT、SP及HSP70在OLP中的表达水平,探讨3项指标与OLP患者病损程度及细胞免疫-炎症反应的关系,旨在为OLP的诊疗和病情评估提供更多选择,现报道如下。
1 资料与方法
1.1一般资料 选取2020年7月至2021年7月本院收治的45例OLP患者作为OLP组,45例健康体检者作为对照组。OLP组男15例,女30例;平均年龄(46.15±5.08)岁。对照组男20例,女25例;平均年龄(46.08±4.89)岁。将45例OLP患者根据OLP临床分型诊断标准分为糜烂型(糜烂组,n=22)、非糜烂型(非糜烂组,n=23)。糜烂组男8例,女14例;平均年龄(46.02±5.03)岁。非糜烂组男7例,女16例;平均年龄(46.28±5.14)岁。OLP组纳入标准:(1)就诊前未接受任何治疗;(2)病变局限于口腔黏膜;(3)3周内未接受抗菌药物治疗;(4)病历资料完整;(5)经组织病理学检查诊断为OLP[8]。OLP组排除标准:(1)患有糖尿病、高血脂等疾病;(2)患有其他免疫系统疾病;(3)患有良、恶性肿瘤;(4)患有感染性疾病;(5)3个月内接受过免疫抑制剂治疗;(6)存在皮肤损害;(7)妊娠期妇女。对照组纳入标准:(1)就诊前未服用任何药物;(2)经诊断未患OLP;(3)年龄和性别与OLP组相仿;(4)病历资料完整;(5)进行血生化检测。对照组排除标准:(1)患有其他系统疾病;(2)有扁平苔藓家族史;(3)妊娠期妇女;(4)口腔溃疡、牙周炎患者。糜烂型诊断依据:假膜覆盖,边缘不规则,可见充血糜烂[6];非糜烂型诊断依据:病灶未见明显充血糜烂[8]。所有研究对象均知情同意并签署知情同意书。本研究经本院伦理委员会审核通过。
1.2方法
1.2.1血清SP、MT、HSP70水平检测 OLP组于入院次日、对照组于体检当日采集空腹静脉血6 mL。将OLP组采集的血液分为2份,一份以3 000 r/min离心10 min得到血清,放置于-20 ℃恒温箱中保存待检,所有血液标本状态均无黄疸、溶血。采用MT酶联免疫吸附试验(ELISA)试剂盒(上海晶抗生物工程有限公司)、SP ELISA试剂盒(上海信裕生物科技有限公司)、HSP70 ELISA试剂盒(上海江莱生物科技有限公司)检测MT、SP、HSP70水平。首先离心标本悬浮液,确保血液标本无其余杂质,而后制备洗涤液,用蒸馏水1∶20稀释,再进行标准品配置,采用蒸馏水或去离子水将标准品浓度依次稀释为480、240、120、60、30、15 pmol/L 6种梯度,设置标准品孔和样本孔,每一标准品孔各放入稀释倍数不等的标准品50 μL。设置标准品孔、待检样品孔和空白孔,将波长设置在固定450 nm测定吸光度值。所有操作严格按照试剂盒说明书执行。
1.2.2外周血淋巴细胞亚群水平检测 于OLP组血液中吸取100 μL置于流式检测管,再向其加入20 μL单克隆抗体,于恒温箱内37 ℃孵育15 min向其加入2 mL红细胞裂解液,混匀后以3 000 r/min离心10 min得到血清放置于-20 ℃恒温箱中保存待检。除去上清液后洗涤,加入500 μL磷酸盐缓冲液混匀,采用MACSQuant Analyzer 10流式分析仪(德国美天旎生物技术有限公司)检测CD3+、CD4+、CD8+、CD19+、CD16+56水平,计算CD4+/CD8+。
1.2.3炎症因子指标水平检测 将OLP组另一份血液混匀后以3 000 r/min离心10 min得到血清,放置于-80 ℃冰箱中保存待检。选取酶标仪(BK-EL10C,济南好来宝医疗器材有限公司)检测肿瘤坏死因子-α(TNF-α)、IL-6及IL-8水平。

2 结 果
2.1OLP组和对照组血清SP、MT、HSP70水平比较 OLP组血清MT水平明显低于对照组,SP和HSP70水平均明显高于对照组,差异均有统计学意义(P<0.05)。见表1。
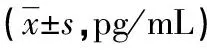
表1 OLP组和对照组血清SP、MT、HSP70水平比较
2.2OLP组和对照组血清TNF-α、IL-6、IL-8水平比较 OLP组血清TNF-α、IL-6、IL-8水平均明显高于对照组,差异均有统计学意义(P<0.05)。见表2。
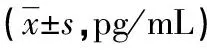
表2 OLP组和对照组血清TNF-α、IL-6、IL-8水平比较
2.3OLP组和对照组外周血淋巴细胞亚群水平比较 OLP组CD3+、CD4+、CD8+水平均明显低于对照组,CD19+、CD4+/CD8+均明显高于对照组,差异均有统计学意义(P<0.05);OLP组和对照组CD16+56水平比较,差异无统计学意义(P>0.05)。见表3。

表3 OLP组和对照组外周血淋巴细胞亚群水平比较
2.4糜烂组和非糜烂组血清SP、MT、HSP70水平比较 糜烂组血清MT水平明显低于非糜烂组,SP和HSP70水平均明显高于非糜烂组,差异均有统计学意义(P<0.05)。见表4。
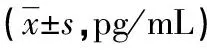
表4 糜烂组和非糜烂组血清SP、MT、HSP70水平比较
2.5OLP组SP、MT、HSP70水平与外周血淋巴细胞亚群、血清炎症因子水平的相关性 SP、HSP70水平与CD3+、CD4+、CD8+水平均呈负相关(P<0.05),与CD4+/CD8+、TNF-α、IL-6、IL-8水平均呈正相关(P<0.05);MT水平与TNF-α水平呈负相关(P<0.05),与CD3+、CD4+、CD8+水平均呈正相关(P<0.05)。见表5。
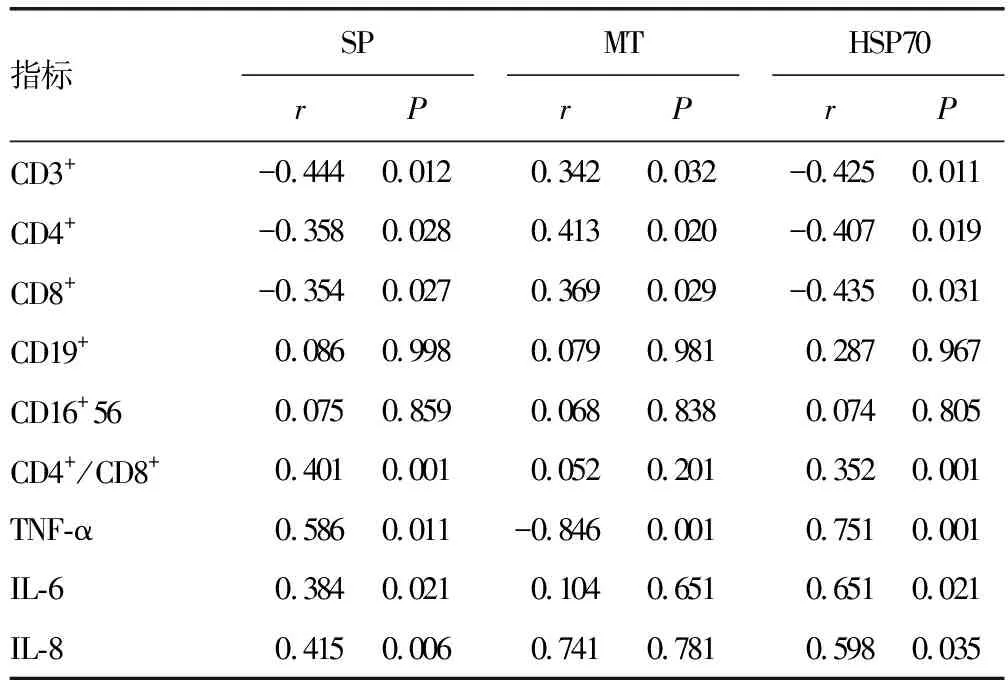
表5 OLP组SP、MT、HSP70水平与外周血淋巴细胞亚群、血清炎性因子水平的相关性
3 讨 论
OLP是一种常见的慢性口腔黏膜皮肤疾病,一般不具有传染性[1]。OLP发病机制尚未完全明确,有研究表明,T淋巴细胞介导的细胞免疫及炎症反应是OLP发病的中心环节[2]。口腔角质形成细胞在形成初始状态时被抗原攻击,刺激CD4+等T淋巴细胞分泌细胞因子,继而促进角质细胞凋亡及T淋巴细胞增殖,造成炎症反应进一步进展,导致OLP发生[9]。因此,寻找可对OLP病损程度进行评估的血清学指标,对临床诊断和寻找辅助治疗方法至关重要。
本研究结果显示,OLP组血清MT水平明显低于对照组,SP和HSP70水平均明显高于对照组,提示MT、SP和HSP70水平变化可能在病情发生和发展中起促进作用。究其原因,MT具有抗炎作用,主要与预防硝基氧化应激及减少炎症细胞浸润有关[10]。MT可减少炎症细胞增殖引起组织损伤,在正常组织中水平较高,而在OLP中因细胞免疫功能紊乱,在过度炎症反应刺激下,MT水平逐渐下降,使黏膜组织修复细胞数量减少,导致病情进一步加重,因此,OLP患者MT水平低于对照组[11]。SP是神经源性炎症反应的一种重要介质,调节人体炎症反应和免疫反应。SP在健康人群中表达程度较低,炎症反应发生后SP合成和释放增多,导致口腔角质形成细胞大量凋亡,口腔黏膜屏障打破,促进淋巴细胞浸润和纤维化,进一步加重局部炎症反应和外周增敏[6]。HSP70是一类非常保守的蛋白质分子家族,在细胞保护、免疫应答、信号传导及调节凋亡等方面具有重要作用。健康成人血清HSP70水平较低,OLP患者机体因淋巴细胞的活化和浸润产生了大量细胞因子,刺激HSP70表达,从而导致其水平高于对照组[12]。本研究结果显示,糜烂组血清MT水平明显低于非糜烂组,SP和HSP70水平均明显高于非糜烂组,差异均有统计学意义(P<0.05)。进一步说明SP、MT、HSP70与病损程度存在一定联系,SP和HSP70水平越高,MT水平越低,其病损程度越重。究其原因,可能是SP、MT、HSP70等致炎因子导致上皮细胞抗原性质发生改变,而巨噬细胞摄取此类变性抗原传递至T淋巴细胞,促使T淋巴细胞释放各种细胞因子,进而加重细胞免疫-炎症反应。
OLP的发生和发展常伴随炎症反应,病情进展至一定程度可导致糜烂[13]。炎症反应伴随着多种促炎介质的释放,如TNF-α、IL-6和IL-8,引起OLP炎症反应进而导致机体损伤[14-15]。本研究结果显示,OLP组血清TNF-α、IL-6及IL-8水平均明显高于对照组,提示促炎介质与OLP的发生存在一定联系,是由于促炎因子的活跃,病变上皮内淋巴细胞数目增多、迁移,进而引起患者口腔组织糜烂和炎症反应。本研究结果显示,OLP组CD3+、CD4+、CD8+水平均明显低于对照组,CD19+和CD4+/CD8+均明显高于对照组,提示OLP组机体细胞免疫功能较对照组更加紊乱。考虑可能与炎症细胞因子迁移至病损组织有关,且能够通过改变T淋巴细胞功能而引起OLP特异性免疫应答。本研究还发现,SP、HSP70水平与CD3+、CD4+、CD8+水平均呈负相关(P<0.05),与CD4+/CD8+、TNF-α、IL-6、IL-8水平均呈正相关(P<0.05),MT水平与TNF-α水平呈负相关(P<0.05),与CD3+、CD4+、CD8+水平均呈正相关(P<0.05),提示OLP患者处于免疫功能紊乱状态。MT可能改善机体免疫状态,维持内环境相对稳定,在正常机体内抑制过度的先天性免疫反应,降低炎症因子产生,同时,促进获得性免疫反应,加快特异性抗体产生[16]。SP、HSP70通过促进B淋巴细胞和免疫球蛋白增殖,使体液免疫亢进,导致机体产生大量抗体[17-18]。相关研究证实,MT可抑制TNF-α水平从而减轻炎症反应,同时,MT还可降低IL-1β水平从而调节炎症反应[19]。此外,SP、HSP70可通过影响细胞免疫功能,提高外周炎症因子水平,进而加重炎症反应状态[20]。
综上所述,OLP患者随着病损程度加重,SP和HSP70水平升高,MT水平降低。血清SP、HSP70与MT水平异常变化可能与细胞免疫和炎症反应有关。

