一石二鸟:单分子双波长荧光定量和手性识别氨基酸
韩 苗,曹明磊,2,段文增,龚树文
(1. 聊城大学 化学化工学院 聊城 252059; 2. 山东信发瑞捷新材料科技有限公司 聊城 252000)
1 引言
氨基酸是自然界中普遍存在的重要有机分子,在化学、生物工业和实验室中也随处可见[1,2]。其两种构型中L-氨基酸是构成生物体蛋白质的基本单位,与生物体的生命活动有着密切关系;非天然的D-氨基酸虽然不是构成蛋白质的基本结构单元,但广泛存在于真核肽、细菌和动物(包括人类)中[3-5]。游离氨基酸不仅可用于营养补充和食品加工,在生物系统中发挥多种功能,它们还是制备结构多样的有机化合物的起始材料。如在不对称合成中,光学活性氨基酸通常被用作手性源。因此,由于氨基酸的重要作用,许多分析工具被开发用来研究氨基酸,特别是对其对映体的鉴别[6,7]。
近几年,利用分子探针对手性氨基酸的对映选择性荧光识别已经成为化学家们研究的热点,很多探针被设计合成出来并展现出优异的不对称识别效果[8-17]。这些探针可以用于快速分析不对称反应或生物过程产生的氨基酸的对映体组成。与用荧光分子探针分析非手性底物不同,荧光分子探针分析非手性底物通常只需要获得一个参数,即底物的浓度,而手性氨基酸的分析需要确定两个参数,包括浓度和对映体组成。因为浓度和对映体组成都会影响荧光响应,所以通常需要有两种独立的方法来确定这两个参数。如果在不分离氨基酸对映体的情况下只使用一个荧光探针同时获得氨基酸的浓度和对映体组成,这将是一个重大的挑战。使用一种荧光分子探针同时进行浓度和对映体组成测定,这种“一石二鸟”的策略存在很多优点:(1) 检测方法简单,成本较低;(2) 不需要分离手性底物;(3) 高灵敏度、高选择性;(4) 具有安全性和很强的复用能力。因此,本文在前期研究的基础上[18],结合近几年手性荧光分子探针手性识别氨基酸进展,重点综述了四种可同时检测氨基酸的浓度和对映体的组成的荧光化合物,并对其设计合成理念和双响应识别机制进行了详细研究。第一种双响应荧光分子探针(R)-4,当(R)-4在Zn(OAc)2的存在下被各种手性胺处理时,会与2-萘胺发生换位反应,由于2-萘胺恢复发射,其在λ3=427 nm(I3)处显示出较大的荧光增强。剩余的手性二萘基单元与手性底物结合,在λ4>500 nm(I4)处产生高度对映选择性的荧光增强。由于I3只依赖于浓度,不依赖于手性构型,因此它可以测定底物浓度。而I4依赖于手性构型,所以它可以测定对映体的组成。因此,可以使用一个荧光探针和一次荧光测量,同时确定底物浓度和对映体组成[19]。第二种双响应荧光分子探针(R)-9,它是一种由1,1′-联二萘酚(BINOL)和香豆素制成的新型荧光探针,其在中性缓冲溶液中,以λ5=365 nm激发时,与氨基酸作用,在465 nm处显示荧光增强,但两种对映体之间的差异非常小。当在λ6=467 nm激发时,在534 nm处表现出高度的对映选择性荧光增强。这样通过调整不同的激发波长就可以同时测定氨基酸的浓度和对映体组成[20]。第三种双响应荧光分子探针(S)-12,当(S)-12被组氨酸和Zn2+处理时,可以产生一种六配位的Zn(II)配合物,限制BINOL单元的旋转,从而显示荧光增强。同时由于组氨酸的L-和D-对映体可能导致六配位的Zn(II)配合物的稳定性或结构刚性不同,从而进行不同的对映体选择性反应。其他氨基酸没有组氨酸的咪唑取代基,不能产生六配位的配体结构,从而在不同激发波长下,组氨酸的浓度和对映选择性可以被(S)-12同时检测到[21]。第四种双响应分子探针(S)-17是一种具有多个活性检测位点的BINOL荧光探针。当(S)-17被精氨酸处理时,两个醛基与精氨酸的氨基进行缩合,丙烯酸酯提供一个额外的反应位点,只与特定的精氨酸对映体进行Michael加成形成环状化合物,虽然未反应完全,但经历了强烈的ICT(分子内电荷转移)发出强烈的荧光,从而可以同时检测精氨酸浓度和对映体组成[22]。
2 第一个双响应荧光探针的发现
2012年有文章报道了1,1′-联二萘酚(BINOL)基三氟甲基酮(S)-1(表1)在手性二胺的荧光识别中的应用[23]。发现非荧光化合物(S)-1在与反式-1,2-环己二胺的两个对映体相互作用时,在λ1=370 nm和λ2=438 nm处显示双重荧光增强,在λ1处,(S)-1对两种对映体都有较大的荧光增强作用,但对映选择性很小;在λ2处,(R,R)-反式-1,2-环己二胺对荧光的增强作用远大于(S,S)对映体。因此,在λ1处的荧光响应可测定环己二胺的浓度,而在λ2处的荧光响应可测定手性二胺的对映体组成。自此,可同时测定浓度和对映体组成的单分子荧光传感器开始迅速发展。
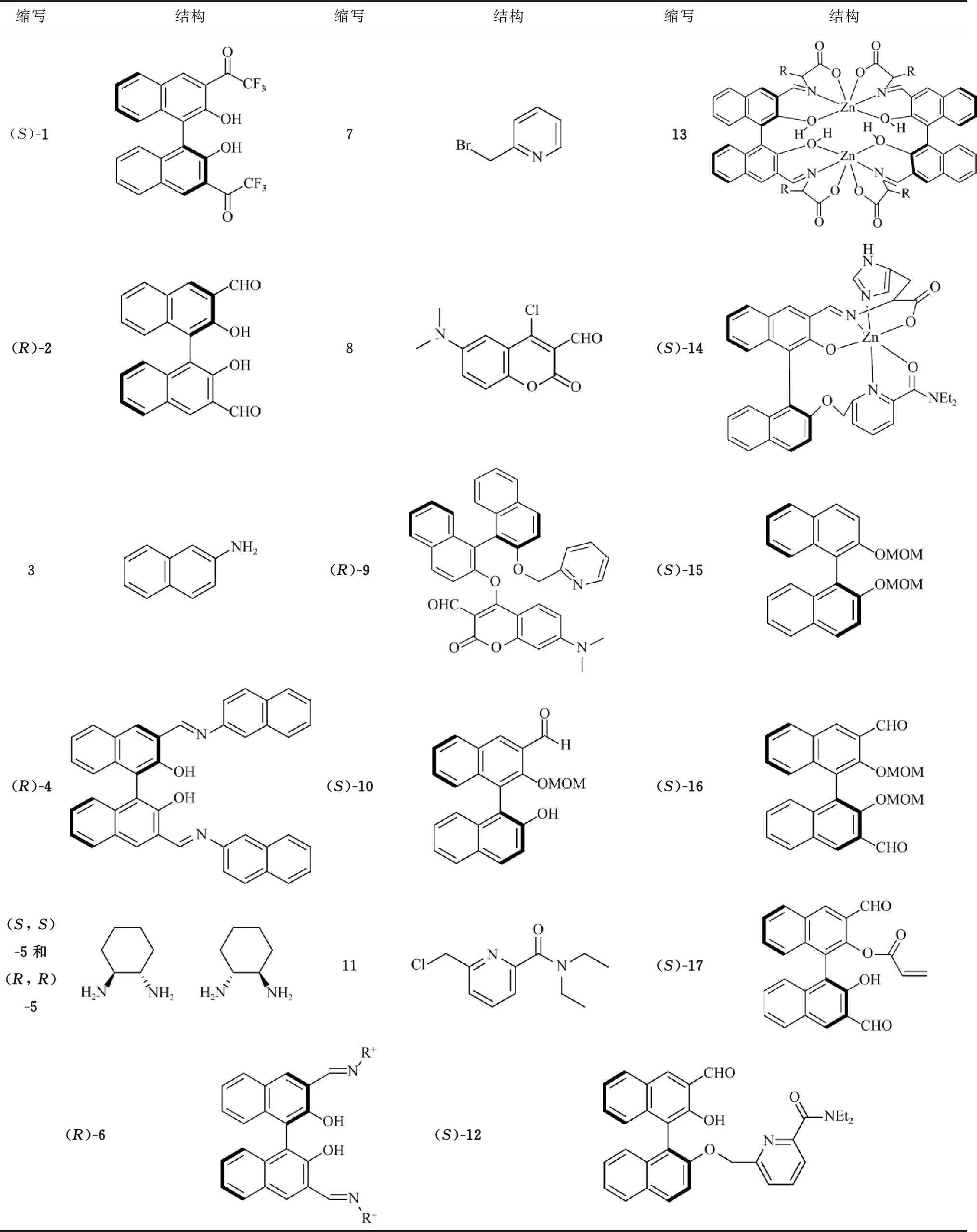
表1 文中化合物名称缩写及结构
尽管(S)-1可用于手性二胺的浓度和对映选择性识别,但其不适用于检测手性氨基酸,不过其双重响应检测机制是相通的。这一发现促使Pu实验室提出了一种潜在的通用策略,将对映选择性荧光传感器转化为同时测定手性化合物浓度和对映体组成的双响应荧光传感器[19]。如图1所示,将发射波长为λ1的非手性荧光团A连接到对映选择性荧光传感器B上。选择B的标准是该传感器与手性底物在不同波长λ2的相互作用下显示对映选择性荧光增强。将A和B之间引入适当的键,以使A的荧光在[A +B]双单元中猝灭。再结合一种连锁裂解机制,以允许添加手性底物时释放出A在λ1处恢复其发射。因此,在λ1处的荧光增强与底物浓度密切相关,其受对映体组成的影响可以忽略。键断裂后,得到的B与底物的对映体结合后,在λ2处应表现出对映选择性荧光增强。因此,[A + B]双单元可用于测定λ1处的底物浓度和λ2处的对映体组成,即一次荧光测量可以给出两个参数结果。
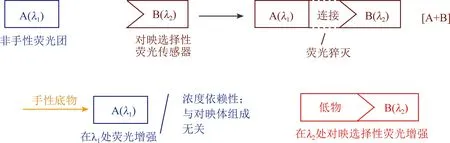
图1 将对映选择性荧光传感器转换为双重响应传感器的拟议一般策略[19]

图2 双响应荧光分子探针(R)-4的合成路线
3 双响应荧光分子探针(R)-4研究进展
3.1 双响应荧光分子探针(R)-4的设计与合成
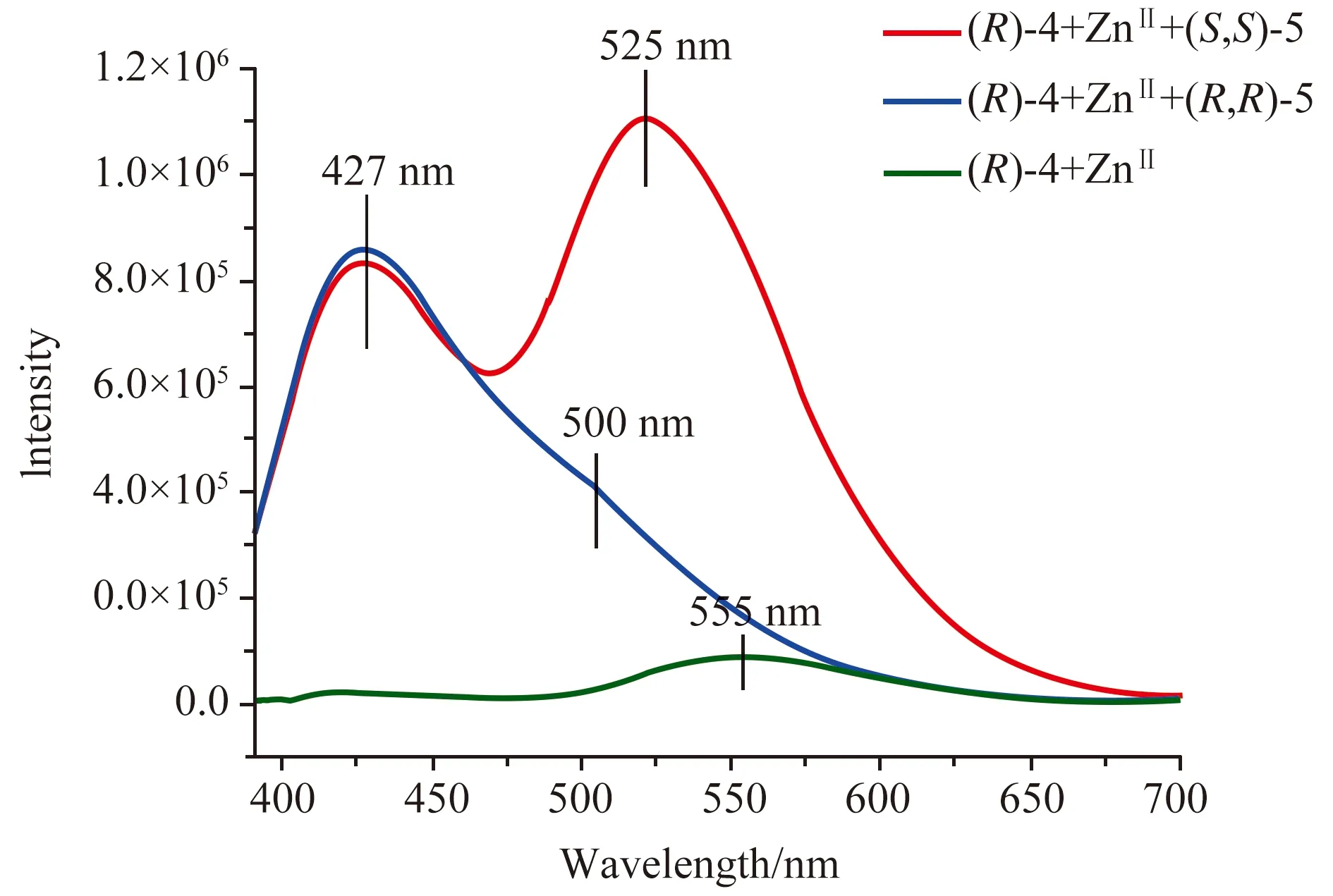
图3 在(S, S)-5和(R, R)-5存在的条件下,(R)-4 + ZnII的荧光光谱[18]
2014年研究报道了(R)-2与Zn2+结合得到的对映选择性荧光传感器[24],其可广泛应用于二胺、氨基醇和氨基酸等手性功能胺的识别研究。在Zn2+存在下,(R)-2与手性功能胺反应,在λ>500 nm(λ4)处表现出高度的对映选择性荧光增强。根据图1中提出的同时测定浓度和对映体组成的策略可将该化合物设计为双响应荧光传感器。将(R)-2与化合物3缩合生成相应的席夫碱(R)-4(图2)[19],产率为33%。该反应为亲核加成反应,由于(R)-2有两个醛基,会与3形成单取代的席夫碱,所以产率不高,但是该反应产物易分离提纯,实验操作较简单。在(R)-4生成过程中,化合物3在427 nm(λ3)处的强发射被猝灭,这可能是由于该化合物中双酚羟基氢与亚胺氮之间的分子内氢键作用,这表明化合物(R)-4可作为图1中所示的双单元[A + B]传感器。同时,在Zn2+存在下用氨基酸处理时,(R)-4的2-萘胺单元可被更碱性的脂肪胺取代恢复427 nm(λ3)的发射,由此形成的新的亚胺-锌配合物在λ>500 nm(λ4)时应显示对映选择性荧光增强峰,可直接用于(R)-4 + ZnII对氨基酸的对映选择性荧光识别。
3.2 双响应荧光分子探针(R)-4的响应机制
Pu等人首先研究了在Zn2+的存在下,(R)-4对反式-1,2-环己二胺(S,S)-5和(R,R)-5对映体的荧光响应[19]。当(R)-4(在CH3OH / 2 % CH2Cl2中2.0 × 10-5mol·L-1)用Zn(OAc)2(4.0 × 10-5mol·L-1)处理时,由于Zn2+与亚胺单元的相互作用,它在555 nm处发出一个微弱的发射信号。当用(S,S)-5(1.5 × 10-2mol·L-1)处理(R)-4 + Zn(II)溶液时,在λ3=427 nm和λ4=525 nm的双发射下观察到较大的荧光增强。当使用对映体(R,R)-5与(R)-4相互作用时,在λ3=427 nm处观察到相同的荧光增强,但在λ4处的荧光增强峰要小得多。因此,在λ3处的发射与手性构型无关,而λ4处的发射具有高度的对映选择性识别(图3),这样就得到了一种用于识别手性胺的双响应荧光传感器。
图4解释了观察到的双响应荧光识别的机制。(R)-4 + Zn(II)配合物与手性胺的亚胺发生换位反应释放化合物3,以恢复其在λ3=427 nm处的发射,而且Zn2+的存在并没有改变化合物3的荧光。与手性胺反应形成的新的BINOL-亚胺-ZnII配合物(R)-6在λ>500 nm处产生对映选择性发射,该发射与之前报道的在Zn2+存在下直接使用(R)-2荧光识别的情况几乎一致,但是引入2-萘胺基后,可以产生双重响应荧光测试。
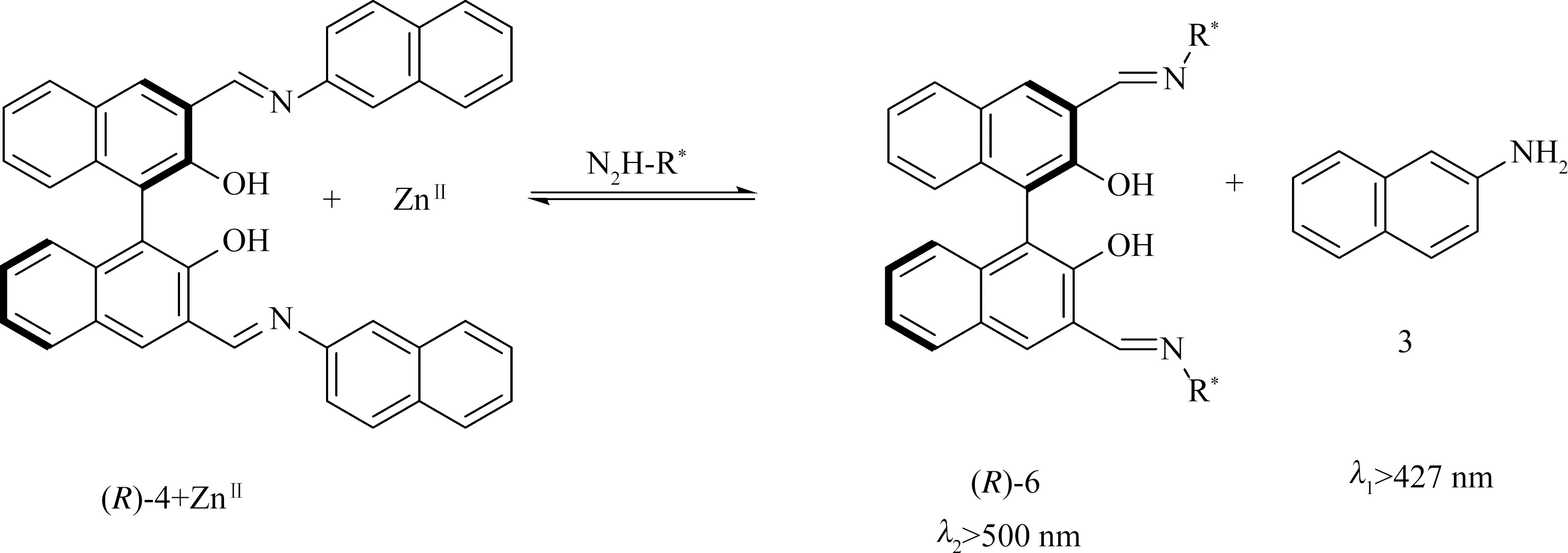
图4 (R)-4 + ZnII与手性胺的亚胺换位反应
在Zn2+存在下,(R)-4还可以对手性氨基酸进行双荧光响应识别,这些氨基醇包括丙氨酸、谷氨酸、组氨酸、丝氨酸和苯丙氨酸。以(R)-4对苯丙氨酸的手性识别为例,如图5a, b所示,在(R)-4(2.0 × 10-5mol·L-1/2 % CH2Cl2)的混合溶液中加入L-苯丙氨酸和四丁基铵后,在λ1=427 nm和λ2=509 nm下均产生荧光增强,但是短波长下荧光增强的幅度小于长波长荧光增强。图5c绘制了(R)-4 + ZnII在λ=427 nm下对不同浓度的L-和D-苯丙氨酸的荧光强度I427。结果表明,氨基酸的手性构型对I427几乎没有影响,可用于检测氨基酸浓度。图5d绘制了I509与L-和D-苯丙氨浓度的对比图,该图说明在波长为509 nm下,(R)-4对苯丙氨酸显示了优异的对映选择性识别效果。
同时,该文章还研究了(R)-4(2.0 × 10-5mol·L-1在CH3OH / 2 %二氯甲烷)+ZnII(2当量)传感溶液与苯丙氨酸和氢氧化四丁基铵在不同浓度和对映体组成下的荧光响应。考虑到仅氨基酸的浓度影响I427,作者得到了I427、I509和L-苯丙氨酸的三维图(图6),其中I509与底物的手性构型有很强的相关性。因此,通过对映体组成的可以确定苯丙氨酸的不同对映体组成和浓度。因此,三维图一次荧光测试同时得到氨基酸浓度和对映体组成。
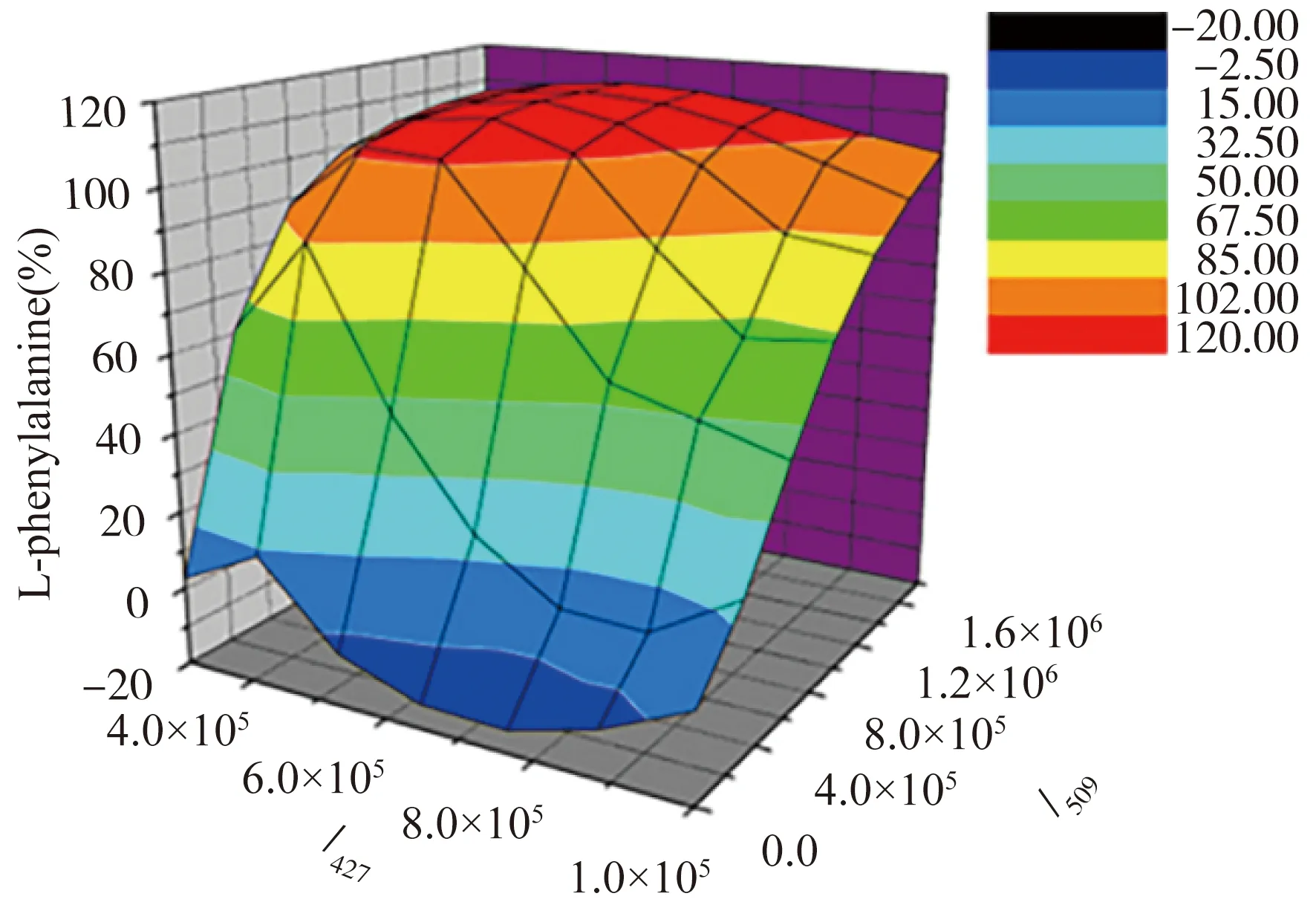
图6 (R)-4 +ZnII对不同浓度和不同对映体组成的苯丙氨酸在I427和I527处的荧光响应[19]。
4 双响应荧光分子探针(R)-9研究进展
4.1 双响应荧光分子探针(R)-9的设计与合成
由BINOL衍生的手性醛与Zn2+结合,对手性氨基酸具有对映选择性荧光增强[24,25]。据报道,一种非手性香豆素醛在氨基酸中不需要添加Zn2+即可增强荧光,但没有对映选择性[26]。因此,Pu课题组将BINOL的手性结构与香豆素醛结构[27-29]结合,在没有Zn2+的情况下对手性氨基酸进行对映选择性荧光识别。9含有两个亲电位点,分别可以与氨基酸的氨基进行1,2-亲核加成[14]和1,4-亲核加成[30,31]。这两种反应途径产生不同的荧光。其中手性联二萘结构可以为亲核加成提供立体控制,与联二萘基连接的吡啶基可为氨基酸提供额外的结合位点,以增强手性偏倚。
将香豆素氯化物(8)[32,33]与(R)-联二萘酚和2-溴甲基吡啶的氢溴酸盐(7)在乙腈中,K2CO3的存在下混合反应,回流,制备得到(R)-9(图7)
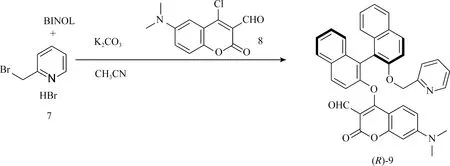
图7 双响应荧光分子探针(R)-9的合成路线
4.2 双响应荧光分子探针(R)-9的响应机制
以(R)-9在HEPES缓冲溶液(pH=7.4)中对D/L-缬氨酸的荧光响应为例(图8)。在HEPES溶液中,(R)-9在λ5=365 nm处激发后在λ=554 nm处显示出一个宽发射,表明由于λ<500 nm的发射减少,联二萘单元对萘酚-香豆素偶联物的有效能量转移减少。当用缬氨酸(50.0当量)处理,在365 nm处激发时,在λ=465 nm处出现较大的荧光增强。结果发现,D-缬氨酸和L-缬氨酸在这种激发下都引起了类似的荧光增强。长波长(λ=554 nm)的发射减少,而短波长(λ=465 nm)的发射大大增强,表明1,4-加成会破坏萘酚单元与香豆素环的结合[30,31]。
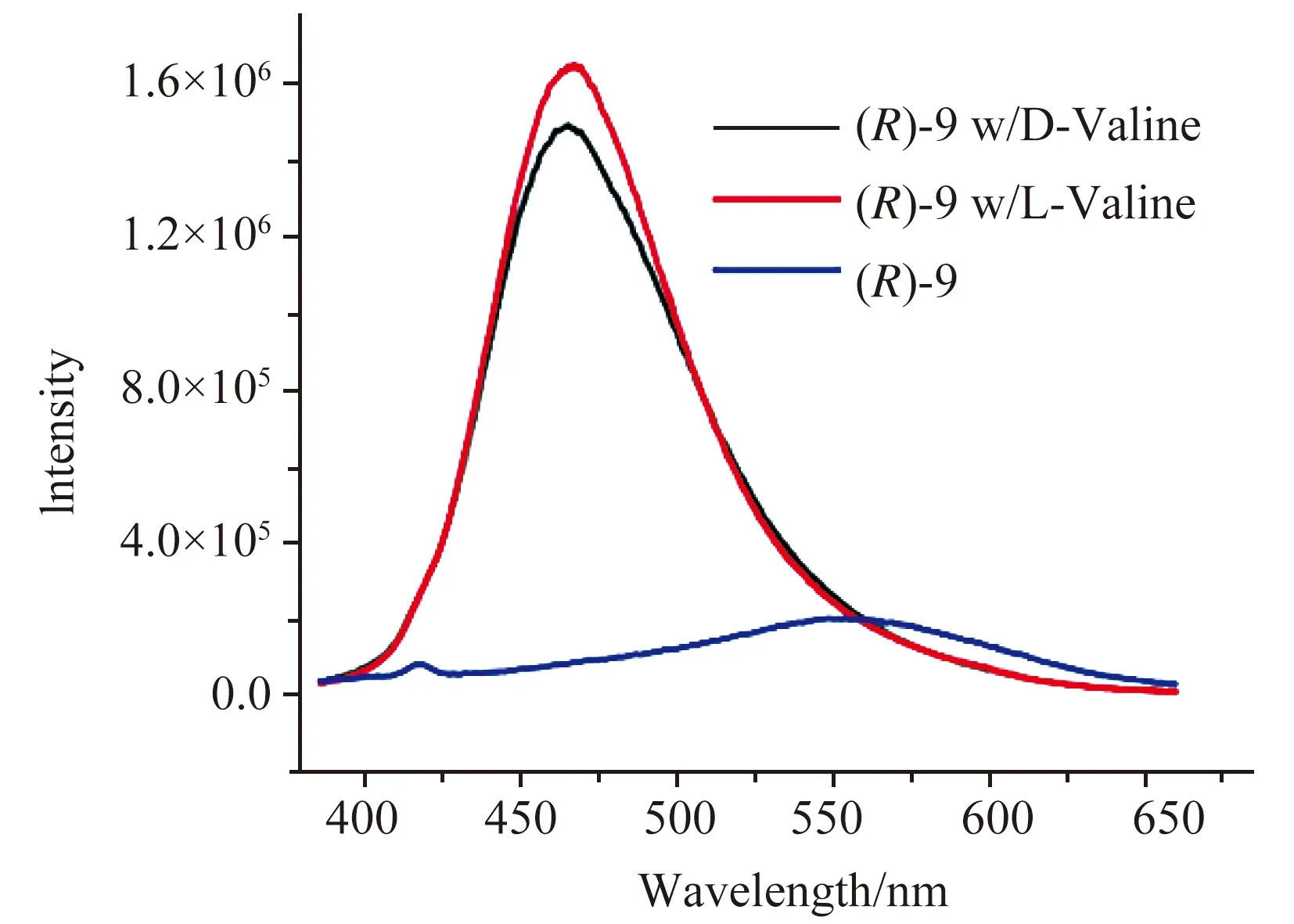
图8 (R)-9与D/L-Val作用的荧光谱图[20]
当(S)-9的HEPES缓冲溶液在λ6=467 nm处被激发时,在λ=558 nm处出现了宽发射。结果表明,该发射带在与缬氨酸反应时表现出高度的对映选择性响应。如图9(a,b)所示,L-Val的加入增强了(S)-9的荧光,而D-Val的加入则导致了558 nm处的荧光猝灭,而且在氨基酸存在的情况下,发射峰最大值出现了轻微的蓝移。图9(c)比较了(S)-9与100当量D-Val和L-Val反应后的荧光光谱,得到了在λ=534 nm时的荧光比IL/ID为12.5。从图9d可以看出,IL/ID所代表的对映选择性随着氨基酸浓度的增加而增加,在氨基酸为100当量时达到最大值。具体反应过程是:(S)-9(1.0 mmol/L在DMSO中,1.0当量)与L-Val和D-Val(5.0~100.0当量)在HEPES缓冲液中反应2 h,然后用HEPES稀释至1.0 × 10-5mol·L-1。将得到的溶液放置1小时后,观察并记录了相对稳定的荧光响应。这种增强的长波长发射[λ=467(激发) / 534(发射) nm]与短波长的荧光响应[λ=365(激发)/465(发射) nm]对比表明,这两种荧光响应于(S)-9与氨基酸的不同反应。也就是说,在萘酚单位和香豆素环之间的结合保留过程中,加入的氨基酸促进了在探针上的1,2-加成反应形成了亚胺。
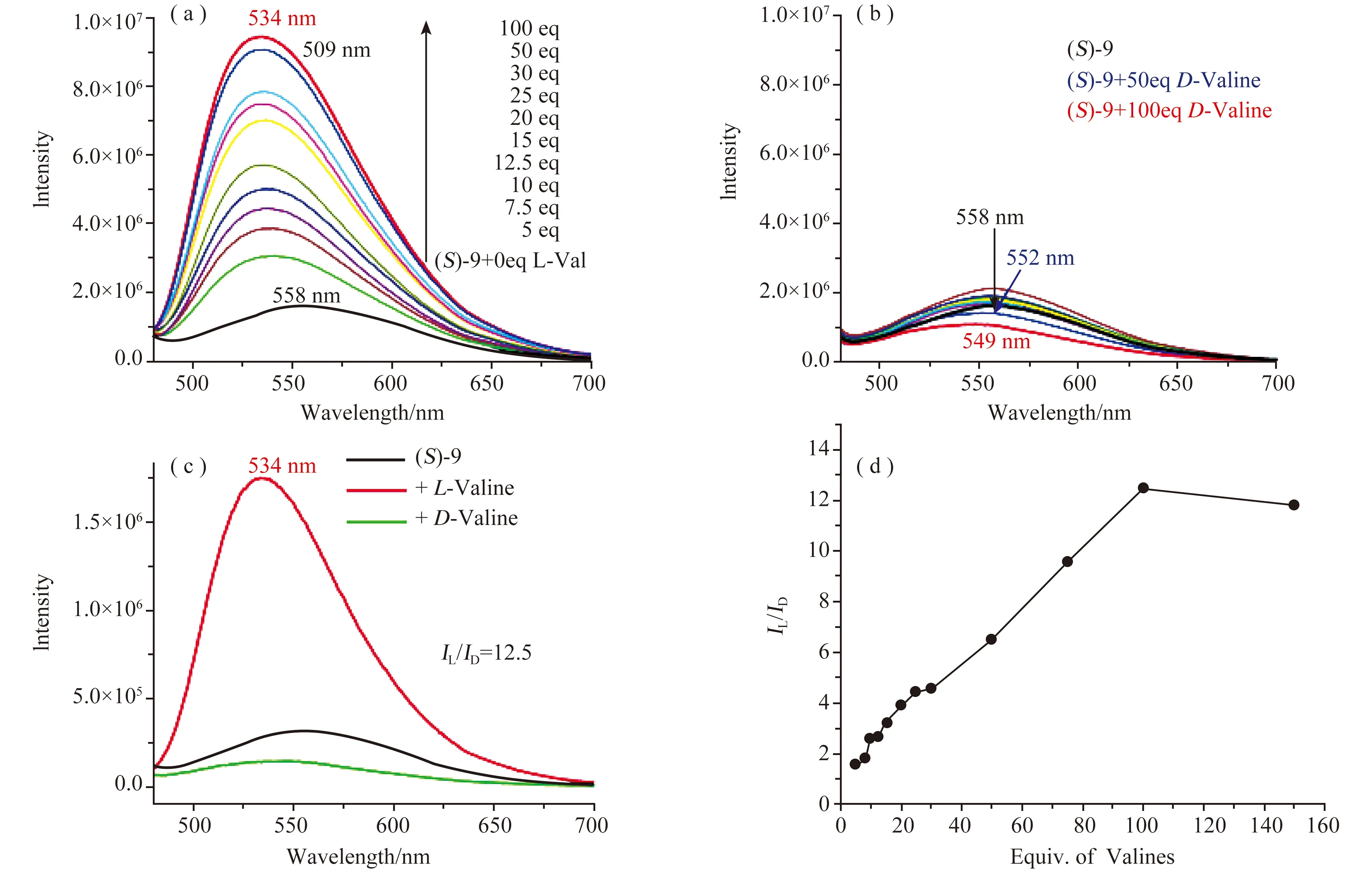
图9 (S)-9与(a)L-Val,(b)D-Val,(c)L-和D-Val及(d)534 nm时的荧光强度比IL/ID与缬氨酸浓度的荧光谱图[20]
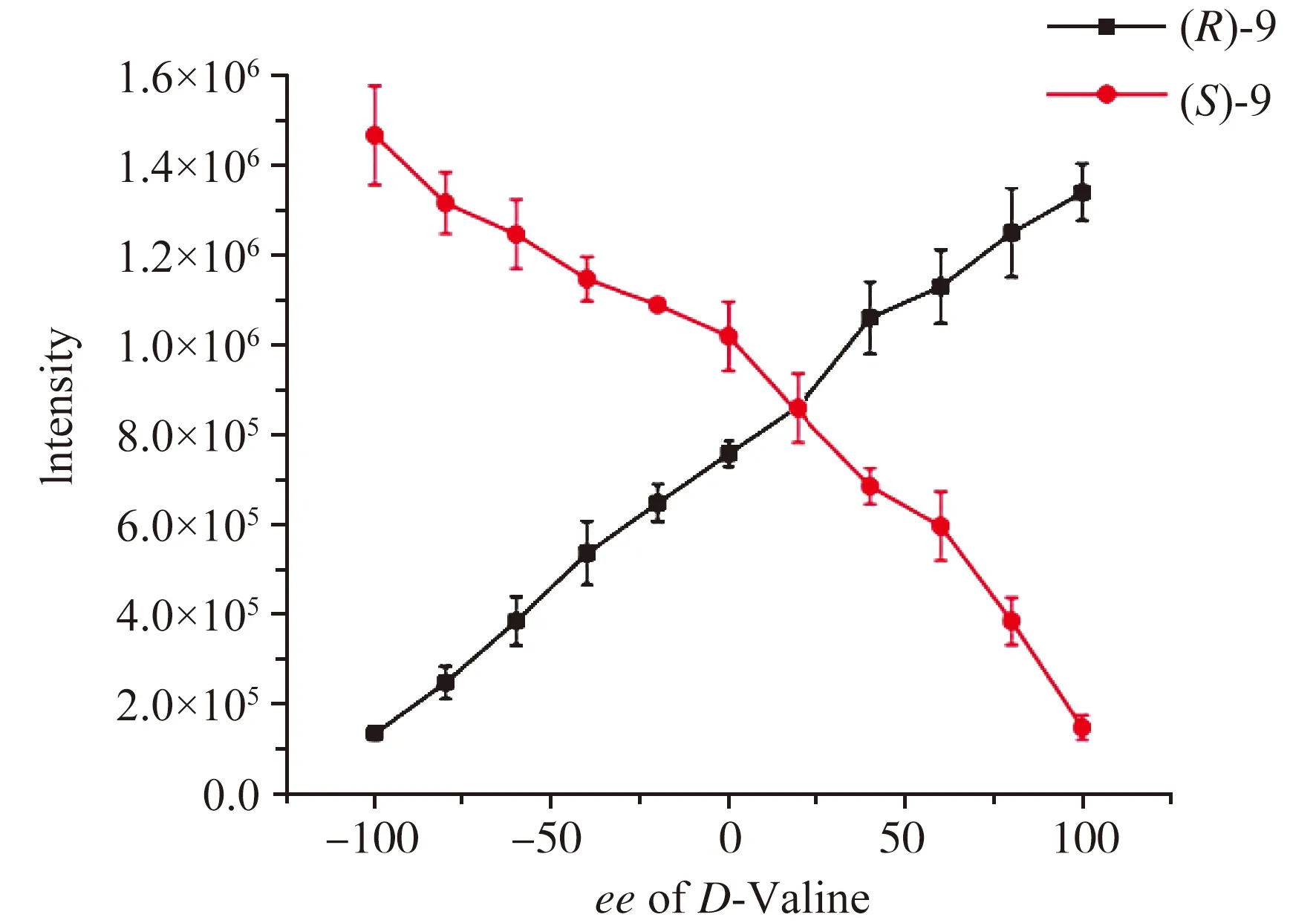
图10 (R)-9和(S)-9在534 nm处的荧光强度与缬氨酸对映体组成的对应关系[20]
图10研究了在不同对映体组成下(S)-9和(R)-9对缬氨酸的荧光响应。图中绘制了该对映体探针在534 nm处的荧光强度与缬氨酸的对映体过量值[ee=([L]-[D])/([L]+[D])]的关系,结果显示了该对映体探针与对映体过量值间的镜像关系,可用于确定氨基酸的对映体组成。
当激发波长为365 nm时,氨基酸的两个对映体与探针作用;然而,当激发波长为467 nm时,氨基酸的一个对映体增强了探针的荧光,而另一个对映体则。因此,对于该荧光探针,当在365 nm处激发时可以测定氨基酸的浓度,在467 nm处激发可以测定对映体的组成。
5 双响应荧光分子探(S)-12研究进展
5.1 双响应荧光分子探针(S)-12的设计与合成
此前,研究发现当BINOL的二醛(R)-2与Zn(II)结合后通过胺-醛缩合反应,Zn(II)离子配位和分子间结合,产生了像配合物13这样的二聚体配合物产生了对映选择性荧光增强[23]。针对这一过程,作者提出了一种两步骤的荧光增强机制:(1) Zn(II)与亚胺的配位限制了激发态C=N键的异构化;(2) 大环二聚体产物13的形成使结构僵化,并限制了BINOL单元围绕其1,1-键的旋转[22,32]。(R)-2可以对几种氨基酸表现出对映选择性的荧光识别,但它对特定的氨基酸底物却不能进行化学选择性识别。为了对组氨酸等特定氨基酸进行同时具有化学选择性和对映选择性的荧光识别,该文章对BINOL-醛基探针的结构进行了系统的修饰(图11)。
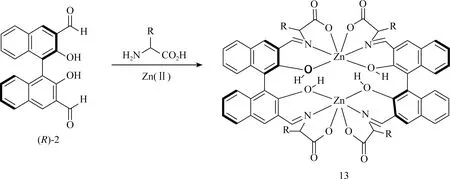
图11 荧光探针(R)-2与氨基酸和Zn(II)的反应
该文章设计制备了单醛探针(S)-12,用于在Zn(II)存在下对组氨酸进行选择性识别。当(S)-12与组氨酸和Zn2+反应后,可以产生一个像13这样的六配位的Zn(II)配合物14,以限制BINOL单元的旋转,从而增强荧光信号。同时因为组氨酸的L-和D-对映体会导致14的稳定性或结构刚性不同,从而产生不同的对映体选择性响应。其他的氨基酸因为没有组氨酸的咪唑取代基不能产生类似配合物14的结构,从而使得组氨酸可以被(S)-12化学选择性地检测。因此,(S)-12和Zn(II)可以作为一种高化学选择性和高对映选择性识别组氨酸的荧光探针(图12)。
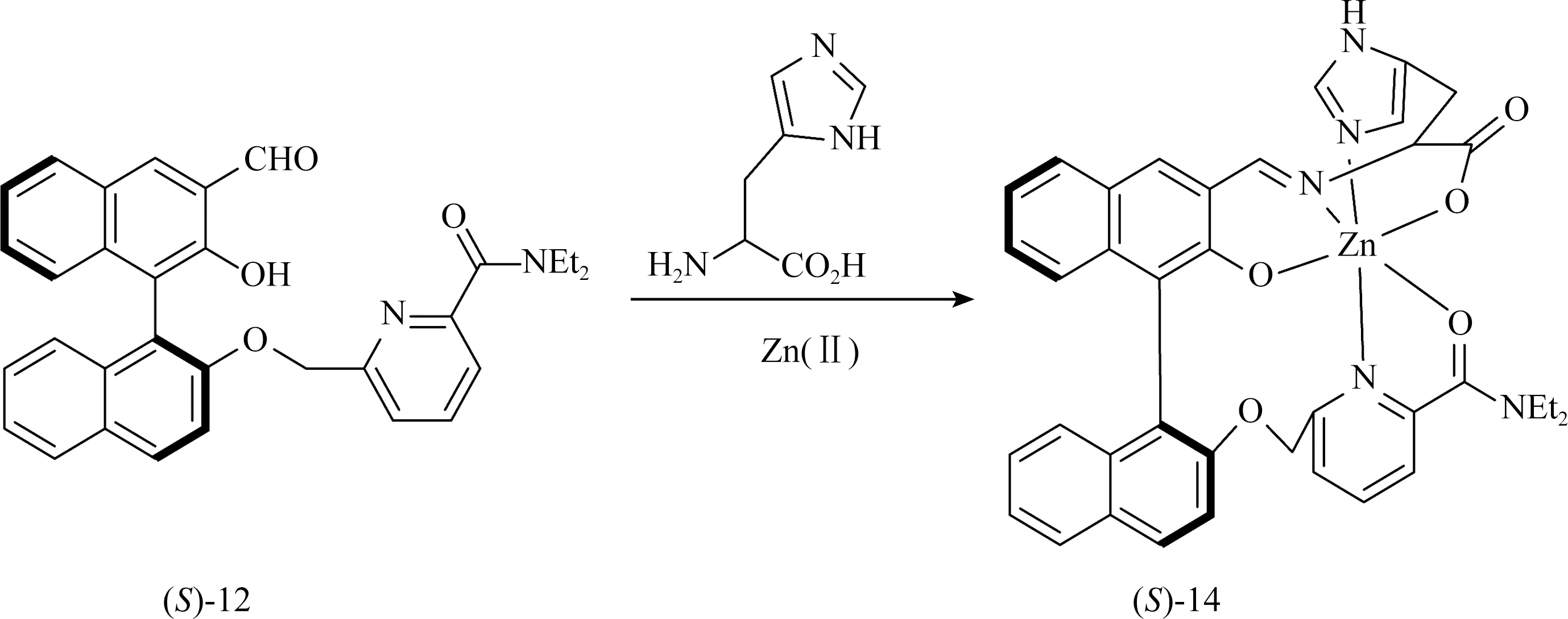
图12 (S)-12与组氨酸和Zn(II)反应形成(S)-14的反应。
探针(S)-12是在80 ℃碱存在条件下,由(S)-10[25]与11[35]反应先得到MOM保护的中间体,再用无水乙醚的氯化氢溶液去除该MOM保护基团得到的(图13)

图13 双响应荧光分子探针(S)-12的合成路线
5.2 双响应荧光分子探针(S)-12的响应机制
化合物(S)-12在378 nm激发时在470 nm处显示发射峰〔图14(a)〕。对于该发射峰,Zn(II)离子的加入对荧光强度没有显著影响。但是,当D-或L-组氨酸逐渐加入后均降低了(S)-12 + Zn(II)溶液在λ7=470 nm处的荧光强度〔图14(a~d)〕。也就是说,在这个波长下的荧光猝灭过程与氨基酸的手性结构无关,可用于检测不同组氨酸的浓度变化。
同时,当(S)-12 + Zn2+被组氨酸处理时,在λ8=560 nm(λexc=450 nm)处出现了一个新的发射峰。如图15所示,加入D-组氨酸后该波长下荧光急剧增强,但加入L-组氨酸后荧光变化不大。因此,荧光探针(S)-12 + Zn(II)在λ8波长对组氨酸表现出较高的对映选择性识别。当加入10当量组氨酸后,对映选择性荧光增强比值[ef=(ID-I0) /(IL-I0),I0:未加D-和L-组氨酸的的荧光强度]为24.3〔图15(a)〕0 。
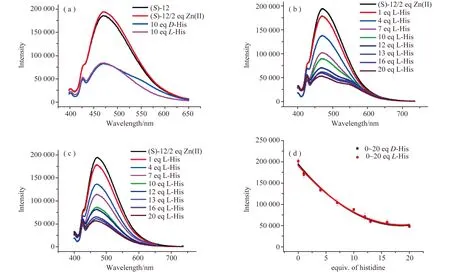
图14 (S)-12 + Zn(OAc)2与(a)D-和L-组氨酸,(b)不同浓度的D-组氨酸,(c)不同浓度的L-组氨酸的荧光谱图,(d)在470 nm处的荧光强度与逐渐加入的D-和L-组氨酸当量之比[21]
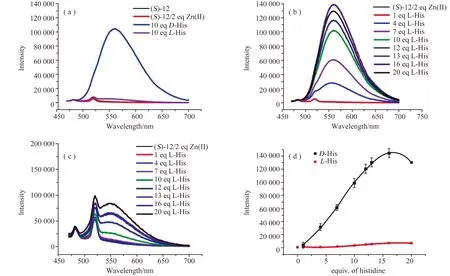
图15 (S)-12 + Zn(OAc)2与(a)D-和L-组氨酸,(b)不同当量的D-组氨酸,(c)不同当量的L-组氨酸的荧光谱图,(d)在560 nm处的荧光强度与D-和L-组氨酸的当量之比[21]
当(S)-12 + Zn(II)对17对常见氨基酸(包括组氨酸)的进行荧光响应研究时,在相同的条件下,所有17个氨基酸都降低了探针在λ7=470 nm(λexc=378 nm)处的荧光强度,没有对映选择性响应。然而,在λ8=560 nm(λexc=450 nm)时,只有L-组氨酸显示出显著荧光增强(图16)。因此,该探针(S)-12 + Zn(II)对组氨酸的荧光识别具有高度的化学选择性。
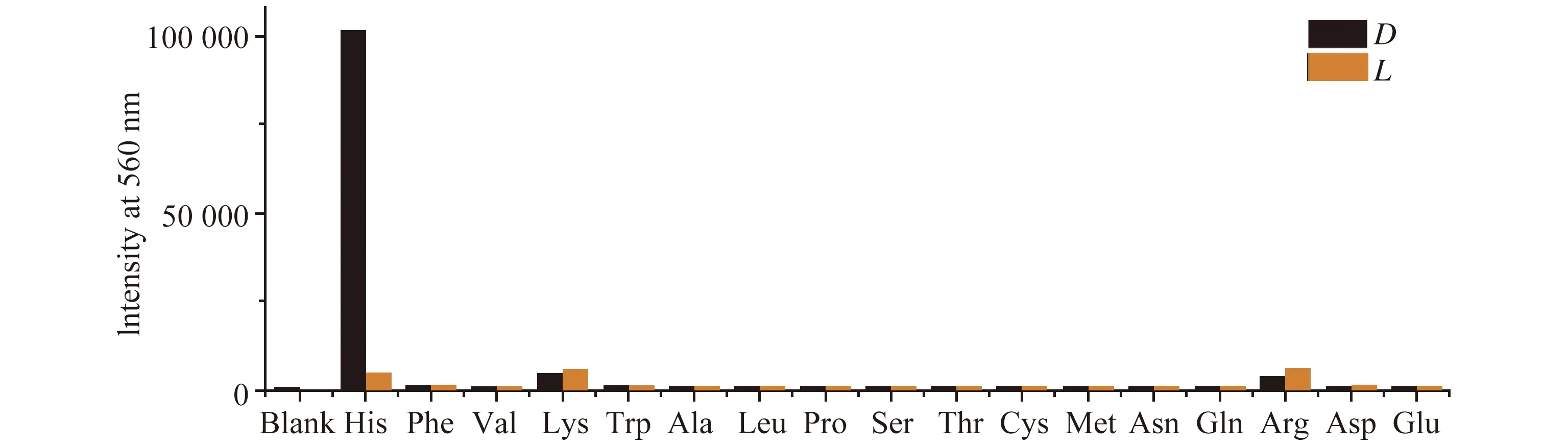
图16 (S)-12 + Zn(OAc)2对17种氨基酸的荧光响应[21]
6 双响应荧光分子探(S)-17研究进展
6.1 双响应荧光分子探针(S)-17的设计与合成
2022年,研究报道了一种基于双BINOL的荧光传感器,它可以化学选择性地识别精氨酸(Arg),但它没有表现出良好的对映选择性识别效果。作者推测当加入一个活性更高的反应位点时,可以获得一种新的、更简化的荧光识别机制。作为候选基团,丙烯酸酯因在迈克尔加成反应中作为良好的亲电试剂,广泛应用于聚合物合成中[37,38],因此其也可用作荧光识别基团。
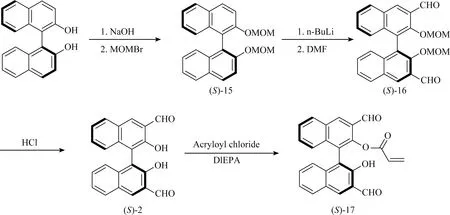
图17 双响应荧光分子探针(S)-17的合成路线
图17提出了一种基于BINOL的荧光探针(S)-17的高效合成方法。该方法为先在氢化钠存在的情况下,用过量的MOMBr处理(S)-BINOL,得到了双MOM保护的BINOL(S)-15。随后用过量的正丁基锂脱质子化和DMF甲酰化,得到中间体(S)-16。后在酸性条件下去除MOM保护基团,得到(S)-2,最后在弱有机碱二异丙基乙胺的存在下,(S)-2与丙烯酰氯反应,在BINOL环的一侧得到一个丙烯酸酯,反应产率为39%。
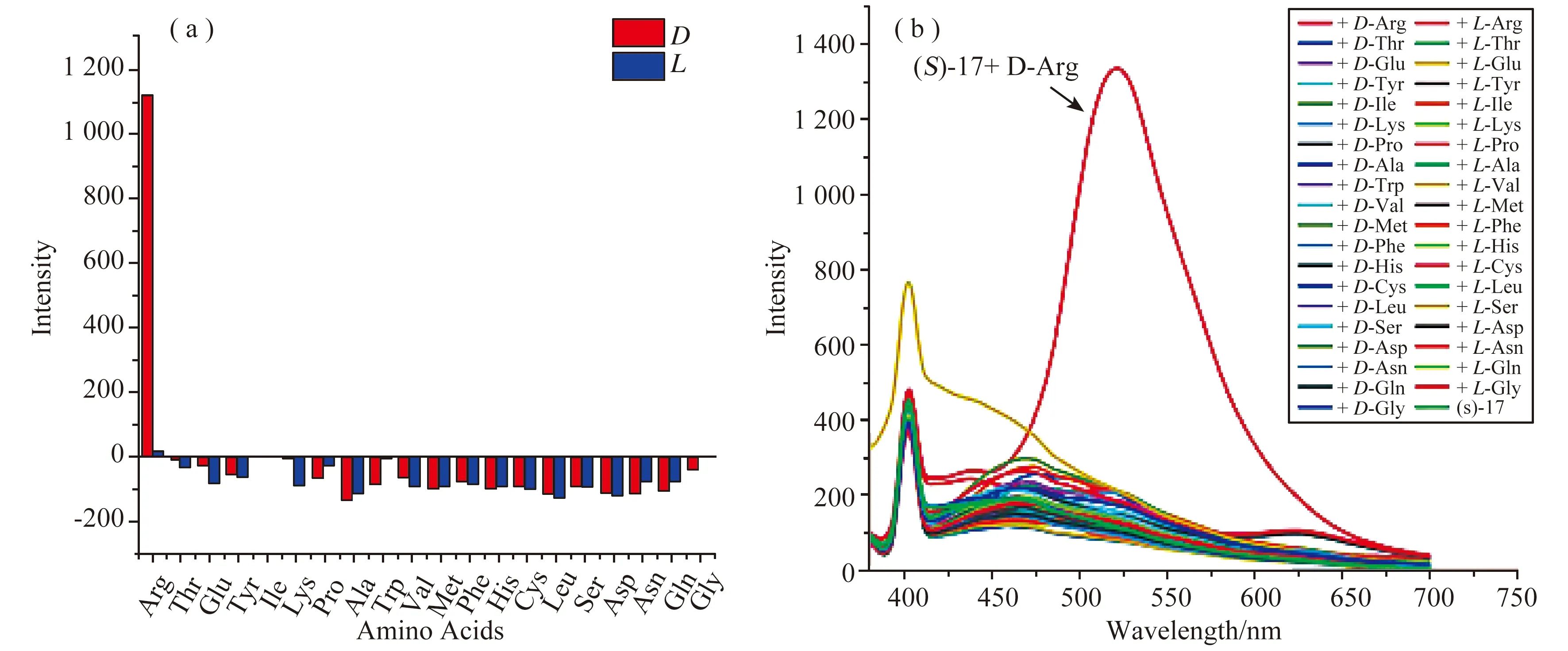
图18 (S)-17对20种氨基酸对映体的荧光响应[21]
6.2 双响应荧光分子探针(S)-17的响应机制
在图18中,发射波长为525 nm时,(S)-17与大多数常见氨基酸的D-或L-对映体作用时,只产生了非常小的荧光增强。然而,D-Arg在λ=525 nm处的荧光却显著增强,其强度比L-Arg高出528%。对映体选择性比值为487。除此之外,(S)-17还具有化学选择性,其对D-Arg的荧光响应远远高于其他任何一种氨基酸。因此,(S)-17仅对Arg不仅有对映选择性识别还有化学选择性识别。
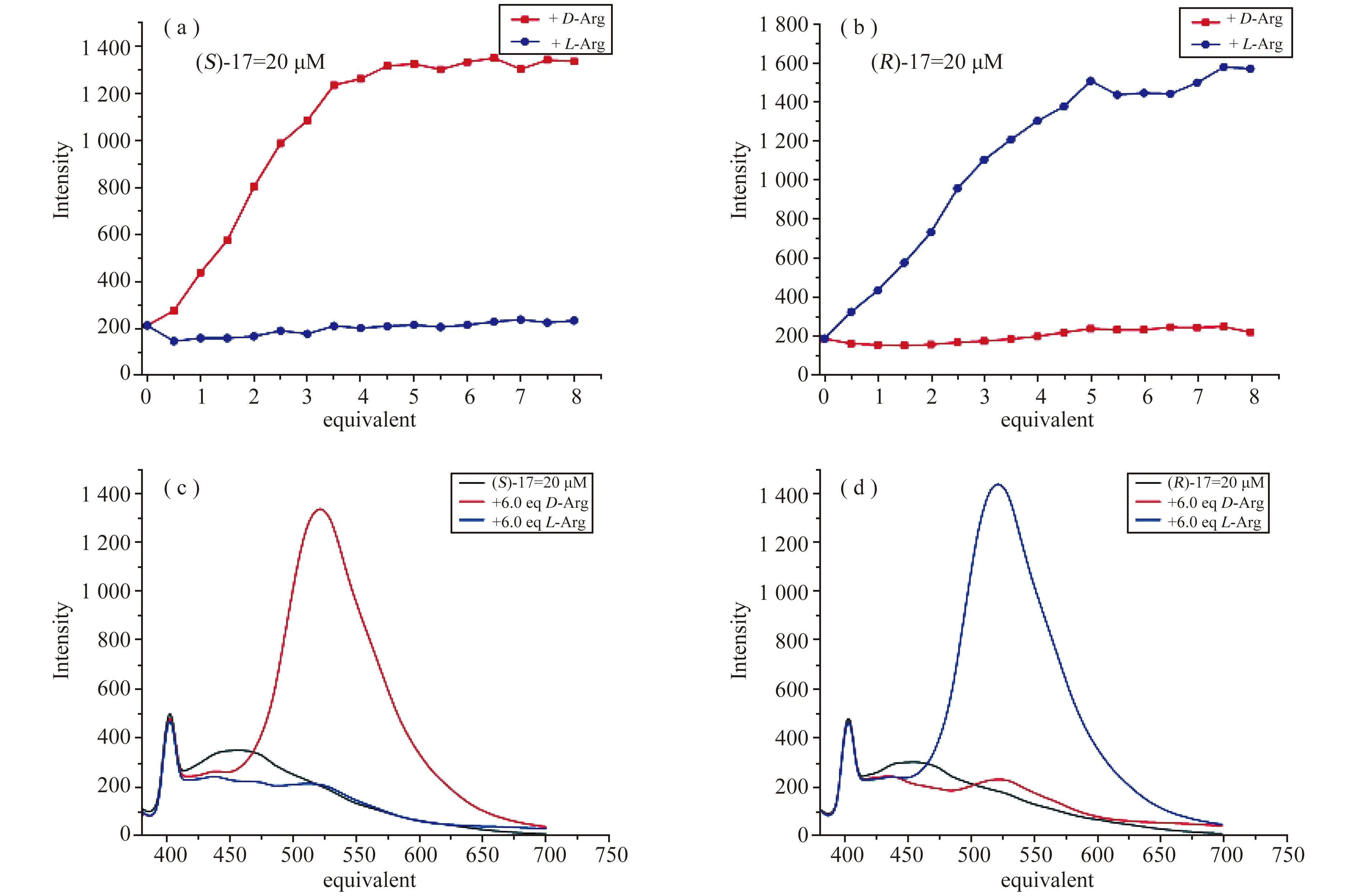
图19 传感器的手性导致对精氨酸对映体的不同荧光响应[22]
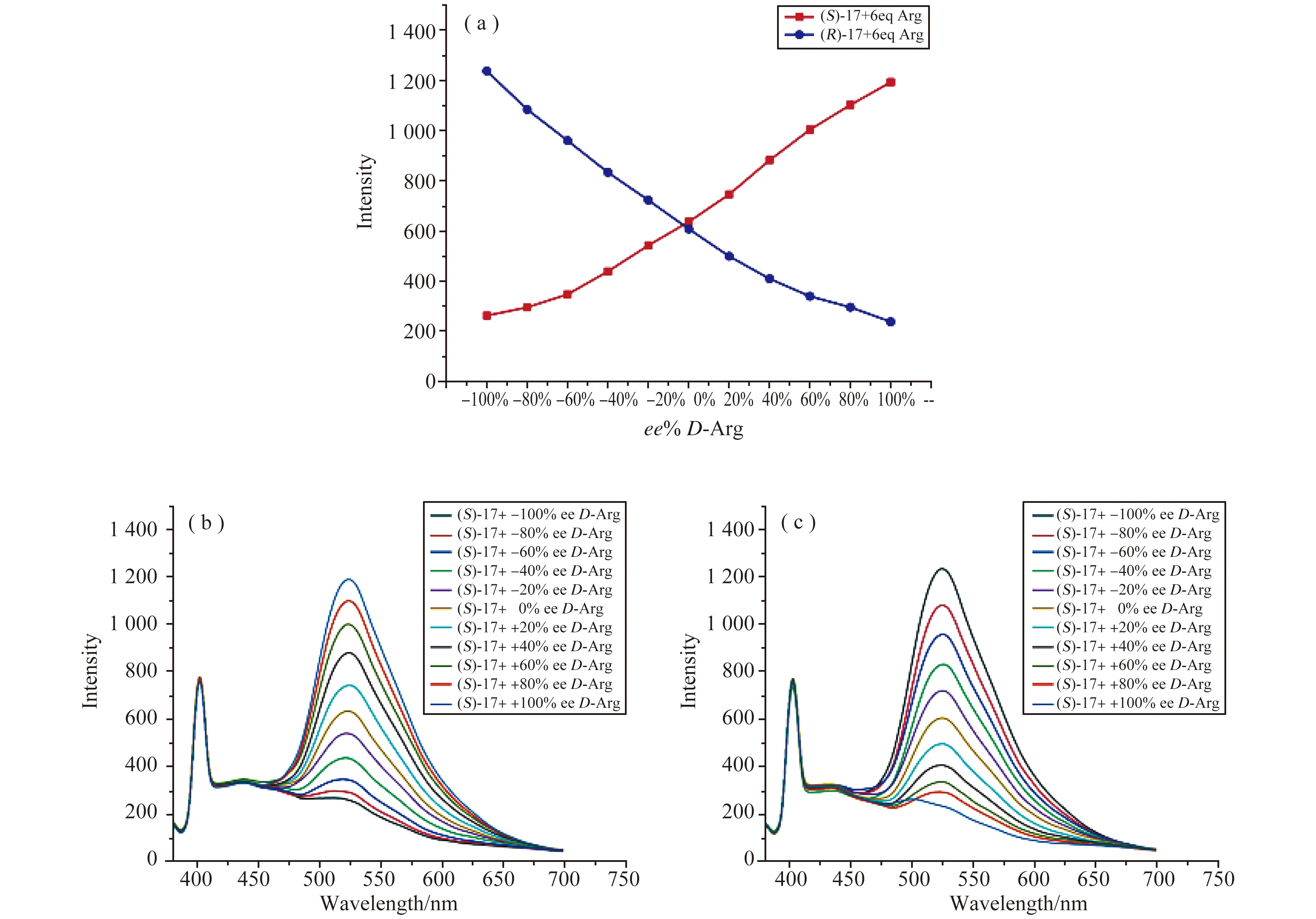
图20 手性传感器对精氨酸对映体的对映选择性荧光增强图[22]
当用已知浓度的(S)-17溶液测定其对L-和D-Arg的响应,如图19(a)所示,荧光强度随着Arg浓度的增加而增加,当加入到5当量D-Arg,此时荧光增强峰值达到饱和。在对映体0~5当量范围内,线性回归系数R2>0.99。因此,确定D-Arg的检测限(LOD)为50 nmol/L(LOD=3×SD/k,其中SD为空白标准偏差,k为校准曲线的斜率)。在相同的条件下使用(R)-17进行类似的实验,如图19(b)和图19(d)所示,与L-Arg作用时下荧光显著增强。这证实了所观察到的对精氨酸对映体的差异荧光响应来源于手性识别过程。
同时,如图20所示,还研究了精氨酸溶液在不同对映体过量值情况下的荧光响应(ee=[D-L]/[D+L])。不同对映体过量值下的(S)-17和(R)-17的荧光响应呈现出近似镜像的关系。因此,与图19中所示的结果一致,不同ee的荧光响应研究进一步证实了所观察到的对映体选择性识别来源于手性匹配关系。
令人惊奇的是该Arg的对映选择性识别可以通过肉眼来区分。当加入D-Arg后,探针溶液呈现深棕色(图21),而L-Arg的加入使溶液变为浅棕色,其他氨基酸都没有显著地颜色变化。这一现象表明,探针(S)-17与Arg的反应机理是完全不同的。

图21 (S)-17的比色检测实验[22]
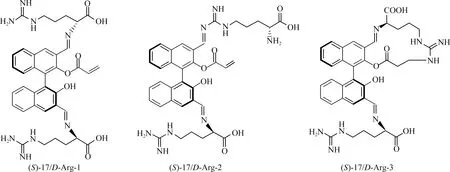
图21 传感反应可能的产物[22]
认为形成了图21所示的产物,并通过量化计算研究了其发光机制,认为是传感反应产物中的分子内电子转移(ICT)导致了荧光增强现象。
7 结论与展望
(R)-4的设计合成及手性荧光识别应用证实了对映选择性荧光传感器可以作为双响应荧光传感器,同时确定手性底物的浓度和对映体组成,极大地促进手性氨基酸化合物的快速测定。该探针的设计原理逐渐成为开发双响应荧光传感器的一种通用策略。该策略为:化合物(R)-4在Zn2+存在下识别手性功能胺,如二胺、氨基醇和氨基酸时,(R)-4中的2-萘胺单元可以与各种手性胺底物进行换位反应,从而呈现两个波长的荧光增强效应,一个波长可用于底物浓度识别,另一个波长用于底物对映体选择性识别。因此,在这两个发射波长上的荧光响应的一次测量可以测定浓度和对映体组成。
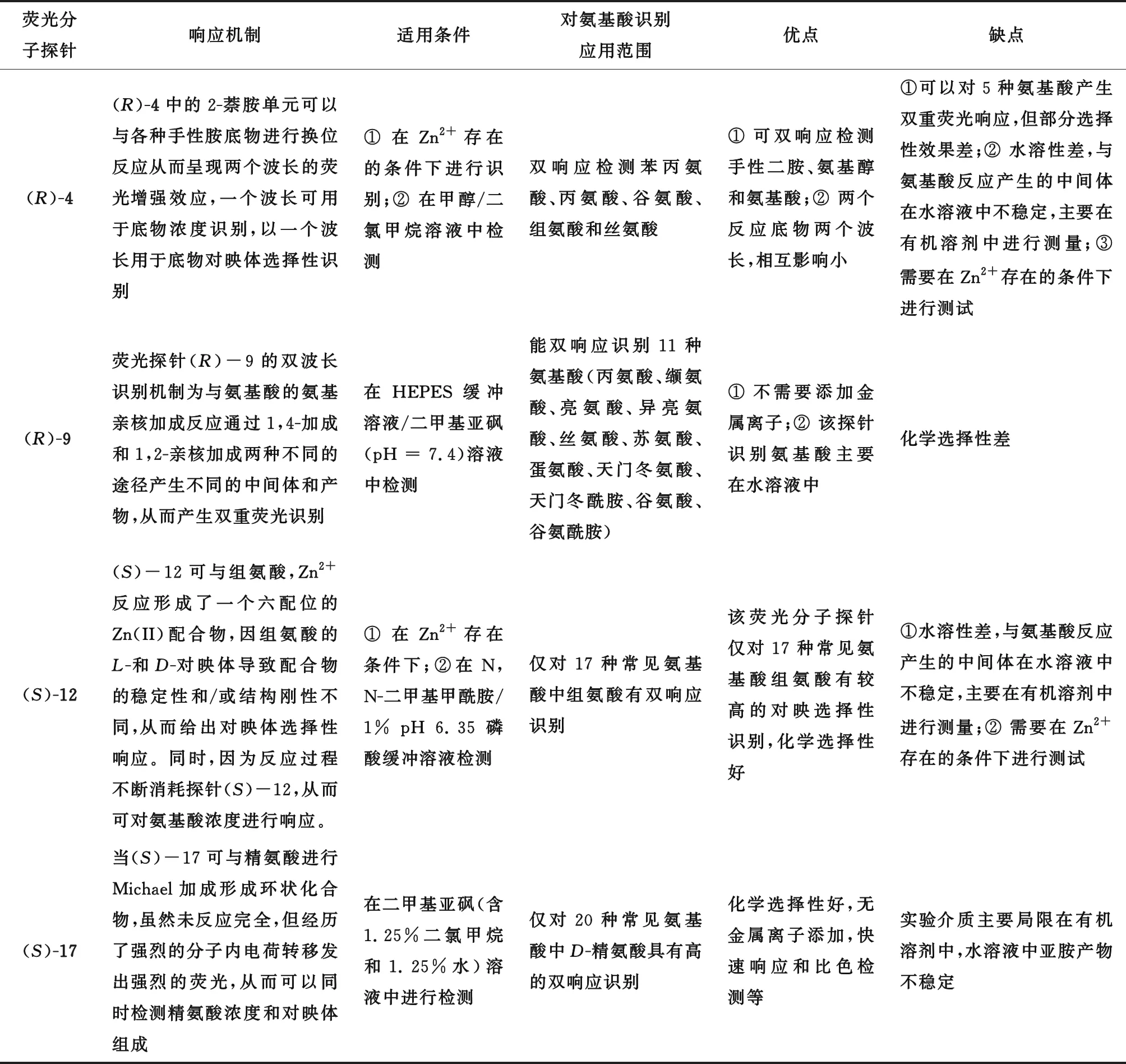
表2 四类不同探针分子应用特点总结
但该传感器的应用也存在一些问题,该传感器可以对种氨基酸产生双重荧光响应,化学选择性效果差。而且其与苯丙氨酸相互作用时,对映选择性比值ef高达13,但对其他氨基酸的对映选择性比值要低得多(ef=1~4),针对这一现象的机理解释有待进一步研究。此外,由于该探针水溶性差,且与氨基酸形成的席夫碱配合物在水溶液中不稳定,测量主要在甲醇溶液中进行,不利于后期生物应用研究。荧光探针(R)-9的双波长识别机制为与氨基酸的氨基亲核反应通过两种途径进行,一种是通过1,4-加成反应脱掉香豆素单元8,8再与氨基酸反应;另一种是与氨基酸的氨基进行1,2-亲核加成反应形成亚胺。两种不同的途径产生不同的中间体和产物,从而产生不同的荧光。与之前报道的基于BINOL的氨基酸荧光探针需要添加Zn2+配位产生对映选择性荧光增强相比,该探针不需要添加金属阳离子,而且该探针识别氨基酸主要在水溶液中进行,这使得它更便于实际应用。对于探针(S)-12,其与组氨酸和Zn2+反应,形成了一个六配位的Zn(II)配合物,限制了BINOL单元的旋转,从而显示荧光增强。同时因组氨酸的L-和D-对映体可能导致14的稳定性和/或结构刚性不同,从而给出对映体选择性响应。该荧光分子探针仅对组氨酸有较高的对映选择性识别,对其他D-和L-氨基酸均没有荧光响应,原因是其他氨基酸没有组氨酸的咪唑取代基不能产生配合物14这样的结构,使得仅组氨酸可以被(S)-12选择性地检测到。但是探针(S)-12对组氨酸的检测是在DMF溶剂中进行的,这导致在生物细胞领域当中的应用受到限制。探针(S)-17具有多个反应位点,可以特异性识别常见20种氨基酸中的精氨酸,具有化学选择性识别;同时其对精氨酸的对映选择性识别效果也很好,ef值可达到487。该荧光探针对手性精氨酸的特异性识别来源于探针结构引入的丙烯酸酯基团,该基团产生了一个额外的反应位点,只与某种精氨酸对映体形成环状化合物。量化计算研究支持了这样的假设,因形成的迈克尔加成产物,具有强烈的分子内电子转移,从而发出强烈的荧光,产生了化学选择性和对映选择性识别。与其他用于检测手性氨基酸的荧光探针相比,该探针具有特异性检测精氨酸,无金属离子添加,快速响应和比色检测等优点。
目前,很多仪器识别方法发展起来用于识别氨基酸的对映异构体,这些光学纯度分析方法有CD[39]、HPLC[40]和电化学方法[41]等,但是这些分析方法需要较高的仪器成本,精密和仔细的操作,费时费力,无法适用于痕量氨基酸分析,特别是对一些先导药物筛选及细胞内涉及手性物质代谢的原位分析等方面难以达到预期效果。而通过对细胞代谢的一些重要产物或中间体氨基酸进行细胞内原位分析,可阐明此类化合物的代谢过程,手性药物的作用机制等。在诸多对手性氨基酸的检测方法中,荧光检测借助其高灵敏度、高选择性、响应时间短、可原位检测、多种检测模式、高吞吐量分析潜能和无创性实时成像等优点在手性识别分析中备受关注。特别是用单一荧光探针双波长同时测定手性底物浓度和对映体组成,可以极大地促进手性化合物的快速分析。因此对近几年所发表的在手性识别氨基酸方面的双响应荧光传感器进行总结整理,窥一斑而知全豹,以此为起点,知晓这一测定思路,可以指导并开发其他类手性双响应荧光传感器。同时,该领域仍有一些问题存在,需要在未来加以解决。第一,由于特定氨基酸的结构相似,对其单个对映体的特异性检测仍然是一个巨大的挑战。第二,荧光分子探针对氨基酸检测由于金属的加入以及反应条件的影响,在细胞领域应用受限。第三,荧光分子探针识别氨基酸,为什么对某一种氨基酸存在荧光响应,而对其他结构相似的氨基酸没有荧光响应或荧光响应较弱,其中的机制仍需进一步研究。相信在未来的诸多学者的不懈努力下,一定会有更多简单而又高效的双响应传感器产生,并在生物细胞领域得到广泛的应用。

