CaSR在大鼠骨骼肌挫伤后的表达与时序变化*
彭 雪,邵洪江,候春梅,赵 永,陈 鹤
哈尔滨医科大学基础医学院法医学教研室,黑龙江 哈尔滨 150081
损伤时间推断是法医病理检验过程中需要解决的一个关键问题,准确的损伤时间不仅能够重建案件过程,并且有助于判断损伤与死因之间的关系。在很多刑事案件中,骨骼肌挫伤出现的频率非常高。然而,目前大多数关于法医损伤时间推断的研究都集中在人和小鼠皮肤损伤愈合过程中,有关骨骼肌挫伤时间的推断研究相对较少[1]。
钙敏感受体(calcium sensing receptor,CaSR)作为G蛋白偶联受体家族成员,已证实其能够通过感应细胞外Ca2+浓度变化来调控胞浆内Ca2+浓度,从而影响细胞增殖、凋亡等。CaSR最主要的生理功能是参与体内Ca2+及其他金属离子稳态的调控,同时还参与细胞增殖、分化、凋亡、离子通道活化、基因表达以及炎症反应等过程[2]。当前,CaSR 的研究主要集中在肿瘤、心血管系统疾病、肺动脉高压、缺血性脑卒中以及甲状旁腺功能亢进等,很少有研究涉及CaSR 与骨骼肌挫伤修复。已有研究[3]证实,骨骼肌再生与Ca2+关系密切。据此,研究者推测CaSR可能参与了骨骼肌挫伤修复。
因此,本实验建立大鼠骨骼肌挫伤修复模型,采用HE 染色方法观察大鼠骨骼肌损伤后的形态学变化,检测骨骼肌挫伤后钙离子浓度变化,并应用免疫组织化学染色和实时荧光定量PCR 技术检测各组CaSR 的表达变化,为法医学损伤时间的推断提供新的思路和证据。
1 材料与方法
1.1 动物分组
取SD 大鼠(180~220 g)50 只,动物等级:SPF 级,购自哈尔滨医科大学实验动物中心,SYXK (黑)2019-001。随机分为10组:对照组1组、实验组9组,每组又分为3 h、6 h、12 h、1 d、3 d、5 d、7 d、10 d、14 d时间段,每个时间段使用5只大鼠。每个时间段的大鼠以消毒饲料及蒸馏水分笼饲养,保持垫料清洁及空气通畅。
1.2 大鼠骨骼肌挫伤模型的制作
用10%水合氯醛(25 mL/kg)腹腔注射麻醉后,将大鼠后肢置于伸膝、踝背屈90°位置,用重500 g的自制打击器,从54 cm高处自由垂直落下打击动物右侧腓肠肌,重力为4.9 N,动能为2.646 J,打击面积约0.785 cm2。按时在损伤后不同时间将大鼠脱颈椎致死,取损伤处骨骼肌,迅速放入4%多聚甲醛/PBS 中固定12 h 后用石蜡包埋,切片。余下骨骼肌4 ℃蒸馏水中洗净,液氮冻干,-80 ℃保存用于实时荧光定量PCR检测。
1.3 HE染色
二甲苯、梯度酒精对组织切片脱蜡至水;苏木素染色、盐酸酒精分化、自来水返蓝、伊红染色、梯度酒精脱水、二甲苯透明、中性树脂封片,显微镜下观察。
1.4 免疫组织化学染色
组织切片后,脱蜡,透明。切片分别加入兔抗大鼠CaSR 多克隆抗体(1∶100,PB9924,武汉博士德公司),4 ℃过夜孵育后,冲洗。滴加生物素化羊抗兔二抗,室温孵育,冲洗;滴加链霉菌抗生物素蛋白-碱性磷酸酶,室温,冲洗。DAB显色。在×400倍镜下,每张切片分别于挫伤中心区及周边区各随机选择10个视野进行CaSR阳性细胞计数。挫伤周边区限定范围为挫伤中心区边界至其外200 μm 内。应用Image-Pro Plus 6.0 软件进行形态学观察和分析,计算各挫伤组阳性细胞数平均值。
1.5 实时荧光定量PCR检测
肌肉组织低温充分匀浆后,按照PrimeScriptTM RT 试剂盒[DRR037S,宝生物工程(大连)有限公司]操作说明书,抽提总RNA,取总RNA 5 μL,在20 μL 逆转录体系中合成cDNA,以5 μL cDNA 为模板加入靶基因上下游引物,引物由上海生工生物工程有限公司合成。使用ABI 7500 Real-Time PCR System PCR 仪进行扩增。最后,用2-ΔΔCT统计学方法分析结果。
1.6 统计学方法
采用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠骨骼肌挫伤后形态学变化
骨骼肌经HE 染色后在100 倍光镜下观察,评估肌肉损伤后的形态变化。对照组大鼠骨骼肌细胞胞质呈粉红色,肌细胞核呈卵圆形、蓝色,多个细胞核位于骨骼肌细胞边缘。骨骼肌挫伤后6 h 可见骨骼肌肌纤维间大量出血;12 h 可见出血伴炎细胞浸润;挫伤后1 d 炎细胞继续增多;挫伤3 d 可见坏死肌纤维伴逐渐增多的炎性细胞浸润;挫伤后5 d,少量新生肌细胞出现,肌细胞核位于细胞中央;挫伤后第7~10 d,新生肌细胞增多,炎性细胞逐渐减少;挫伤后第14 d,肌细胞大都位于肌纤维的边缘,肌细胞境界分明,排列规则,中央成核肌细胞几乎消失,见图1。
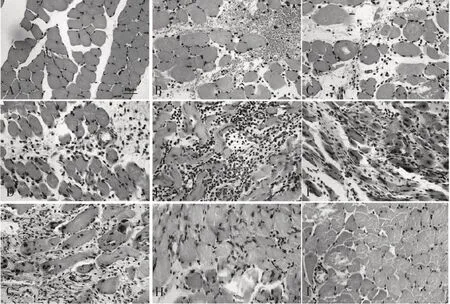
图1 各组大鼠骨骼肌HE染色结果(×400,标尺=50 μm)
2.2 正常对照组与挫伤组大鼠骨骼肌CaSR 的免疫组织化学染色结果
CaSR 在骨骼肌挫伤后1 d 表达增加,挫伤后3 d 表达进一步增加,挫伤后5 d 表达至顶峰,差异有统计学意义(P<0.01)。随后CaSR表达开始减少,挫伤后14 d恢复至正常对照组水平(图2、图3)。
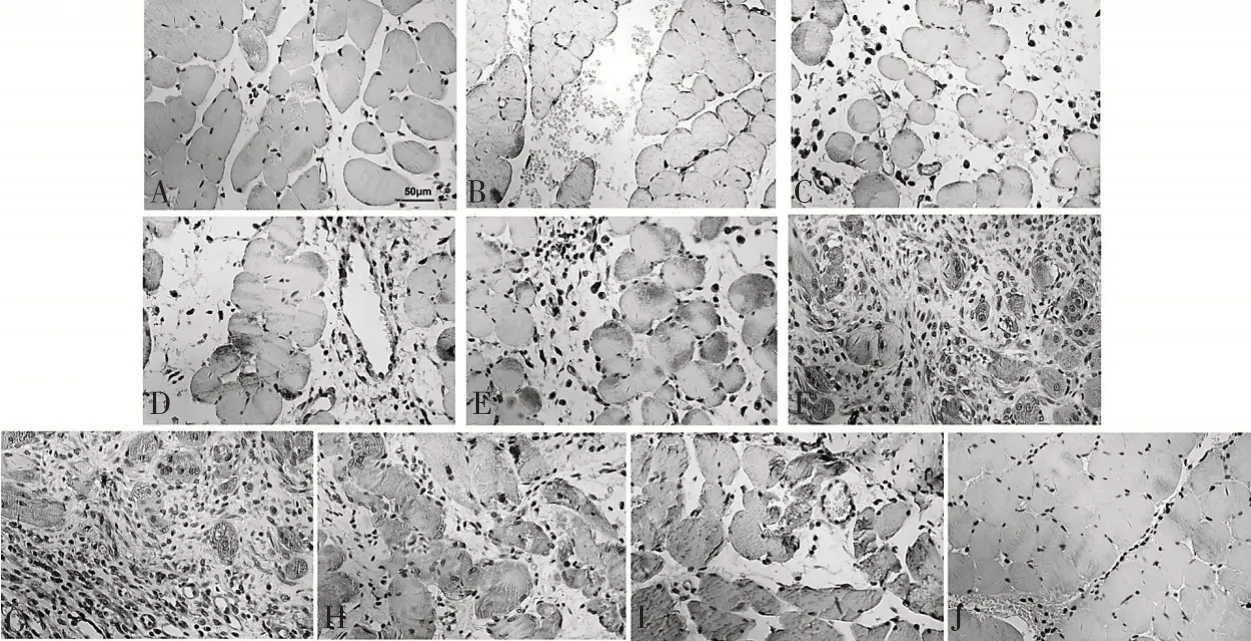
图2 各组大鼠骨骼肌不同时间点CaSR的表达(×400,标尺=50 μm)
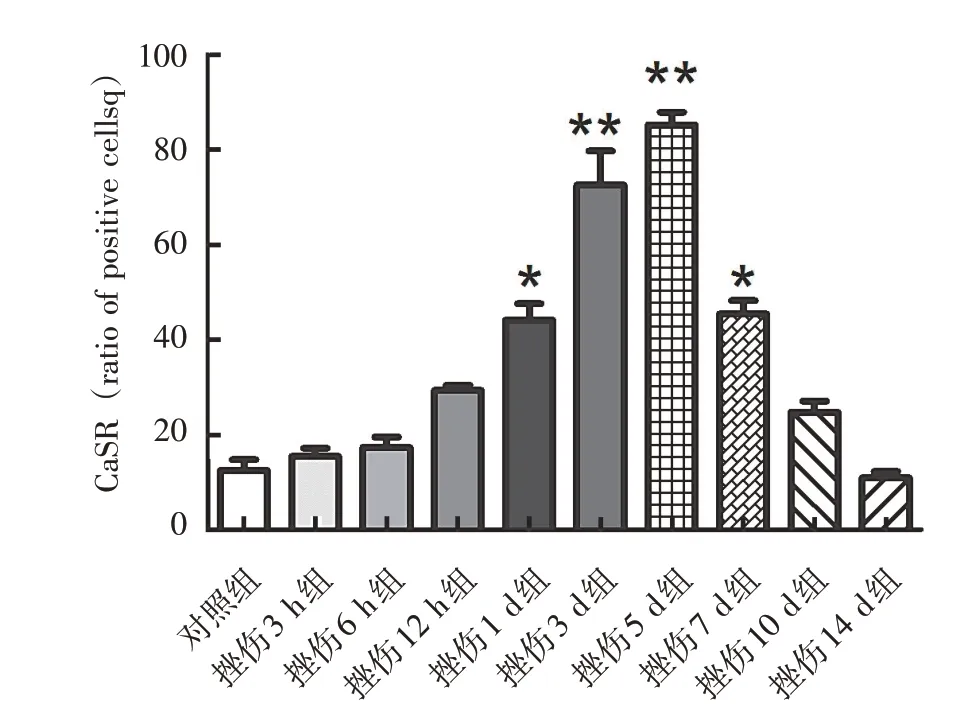
图3 挫伤骨骼肌CaSR蛋白水平检测
2.3 正常对照组与挫伤组大鼠骨骼肌CaSR mRNA的表达
CaSR mRNA 在骨骼肌挫伤后6 h 开始呈规律性增加,挫伤后5 d 至高峰,差异有统计学意义(P<0.01)。随后表达减少,挫伤后14 d恢复至正常对照组水平,见表1。
表1 肌肉挫伤后不同时间点CaSR mRNA表达量(±s)

表1 肌肉挫伤后不同时间点CaSR mRNA表达量(±s)
组别对照组挫伤后3 h组挫伤后6 h组挫伤后12 h组挫伤后24 h组挫伤后3 d组挫伤后5 d组挫伤后7 d组挫伤后10 d组挫伤后14 d组CaSR mRNA 1.000±0.235 1.211±0.145 2.402±0.423 3.766±0.045 4.523±0.409 6.298±0.321 9.586±0.576 7.020±0.214 3.562±0.478 1.298±0.607
3 讨论
损伤时间推断是法医病理工作者实践中重要的工作内容之一。在法医学实践中,损伤时间推断涉及不同器官组织,但现有研究主要集中在皮肤和脑,其他器官组织的研究较少,部分器官组织甚至为空白。由于不同器官组织结构不同,损伤修复机制存在显著差别,不能将某种器官组织损伤时间推断的研究成果用于其他器官组织[1]。而本研究报道了大鼠骨骼肌挫伤后不同时间点的形态学变化以及骨骼肌中CaSR 蛋白和mRNA 水平动态变化趋势,为法医学损伤时间推断的研究提供了全新的依据。
骨骼肌挫伤后肌肉纤维因为受损,处于静止的卫星细胞被激活并形成新的成肌细胞。随后,成肌细胞与现有的损伤肌纤维融合,最终形成新的肌管或者修复受损肌纤维。HE 染色结果显示:骨骼肌挫伤后的早期可见明显出血及以中性粒细胞、单核细胞等为主的炎细胞浸润;挫伤后3 d,可见明显坏死肌纤维伴逐渐增多的炎性细胞浸润;挫伤后5 d,少量新生肌细胞出现,肌细胞核位于细胞中央;挫伤后第7~10 d,新生肌细胞增多,炎性细胞逐渐减少;挫伤后第14 d,肌细胞大都位于肌纤维的边缘,肌细胞境界分明,排列规则,中央成核肌细胞几乎消失。该结果与相关文献报道具有一致性[4-5],且规律呈现骨骼肌损伤后修复的3 个病理进程,即急性损伤炎症期、修复期和组织塑形期[6-7]。
钙敏感受体是钙稳态的关键系统调节剂[8],作为细胞外Ca2+浓度的调节剂,已被证明是生理学和病理学中的重要分子[9]。它属于G蛋白偶联受体,可感知细胞外的分子并激活内部信号转导通路,并最终激活细胞反应[10]。
CaSR 主要在甲状旁腺内表达,并调节甲状旁腺激素的分泌,从而通过作用于肾脏、骨骼和肠道来将Ca2+浓度维持在生理范围内,进而控制钙稳态[8]。最初,CaSR 的研究集中在促钙组织,如甲状旁腺、肾脏和骨骼,这些组织在维持钙稳态方面具有明显的作用。随后的研究发现,CaSR 在许多其他细胞和器官(如神经元、肺、皮肤、胎盘、乳房和血管)中表达,在维持钙稳态方面没有任何明显作用[2]。此外,最近的一些研究[11-14]已经观察到CaSR在细胞(如角质形成细胞、心肌细胞和神经元)的生理分化以及平滑肌收缩和增殖中发挥重要作用。
最近,在一项探索健康人类骨骼肌中CaSR 的研究中,有学者发现CaSR不参与肌纤维的生成[15]。然而,本研究免疫组织化学染色结果以及实时荧光定量PCR检测结果均证实,挫伤后CaSR呈规律性表达。挫伤早期CaSR表达开始增加,挫伤修复期CaSR 表达达到顶峰,随后开始下降至正常水平。还有一项最近的研究报道,运动所致的局部肌肉损伤会激活一种不依赖于肌肉干细胞的肌纤维自我修复机制,小鼠的肌肉损伤触发了涉及钙离子和磷酸激酶C的信号级联反应[16]。
同时,通过免疫组化染色结果,研究者还发现在挫伤后的炎症期内,CaSR 主要定位于中性粒细胞和单核细胞。挫伤进入修复期后,在成纤维细胞以及新形成的成肌细胞中均可见CaSR 蛋白大量表达。同时,诸多研究已证实,CaSR 能够参与炎症细胞的调控[17]。而骨骼肌挫伤修复与炎症细胞关系密切,因此,CaSR 参与的骨骼肌挫伤修复,很可能有多条途径,可能通过调控炎症细胞进而促进肌纤维再生,或者直接作用于肌纤维,这需要进一步的研究证实。
综上所述,研究者认为CaSR 参与了骨骼肌挫伤后修复愈合的过程,并在挫伤后的不同阶段发挥了不同作用。同时,CaSR 的表达与骨骼肌损伤时间具有一定的相关性,可以为骨骼肌损伤时间推断提供参考依据。

